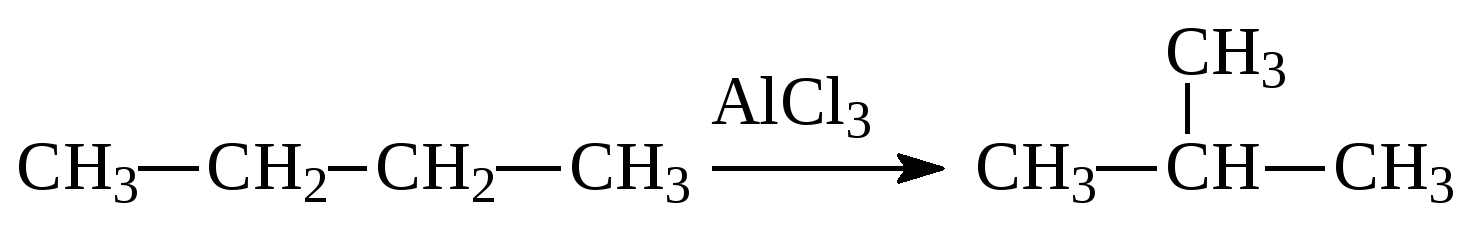«Химические реакции» (11 класс)
Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
Тема курса «Методическая разработка урока по химии
в 11 классе в контексте подготовки к ЕГЭ»
Семинар по теме «Химические реакции».
Цели: систематизация, обобщение и контроль по теме «Химические реакции»
Форма обучения: семинар ( коллоквиум )
1. Развитие аналитических способностей, умения обобщения и формулирования выводов;
2. Приобретение навыков использования научных знаний в практической деятельности;
3. Развитие навыков оперирования формулировками, понятиями, определениями.
Для проведения обобщающего урока по теме «Химические реакции» использовалась форма обучения — семинар. Семинар — это такая форма организации обучения, при которой на этапе подготовки доминирует самостоятельная работа учащихся с учебной литературой и другими дидактическими средствами над серией вопросов, проблем и задач, а в процессе семинара идут активное обсуждение, дискуссии и выступления учащихся, где они под руководством учителя делают обобщающие выводы и заключения[2].
Среди всех методов обучения, используемых при обучении химии, я выбрала частично – поисковый метод . При использовании частично-поискового метода знания учащихся более осознанные, развивается умение лучше наблюдать, пользоваться большим числом умственных операций, среди которых видную роль играют мыслительные действия высокого уровня [3].
Этапы занятия (80 мин)
1.Организационный момент- 2 мин.
(Подготовить учащихся к уроку, объявить цели и задачи урока). одготовить учащихся к уроку, объявить цели и 3) мультимедийный проектор.
2. Теоретическая часть — 20 мин.
3. Обсуждение основных вопросов — 8 мин.
4. Практическая часть (решение задач и упражнений) — 25 мин.
5. Контроль знаний -15 мин.
6. Заключительная часть.- 5 мин.
7. Подведение итогов -5 мин.
1. Теоретическая часть. Вопросы были заданы за две недели до проведения семинарского занятия.
1. Классификация химических реакций.
2. Скорость химических реакций.
3. Химическое равновесие и его смещение.
4. Электролитическая диссоциация
1. Организационный момент. (Подготовить учащихся к уроку, объявить цели и задачи урока). одготовить учащихся к уроку, объявить цели и 3) мультимедийный проектор.
Класс распределяется на группы по количеству вопросов, обсуждаемых на семинаре.
2. Теоретическая часть. [1].
1 группа готовит и выступает по теме «Классификация химических реакций».
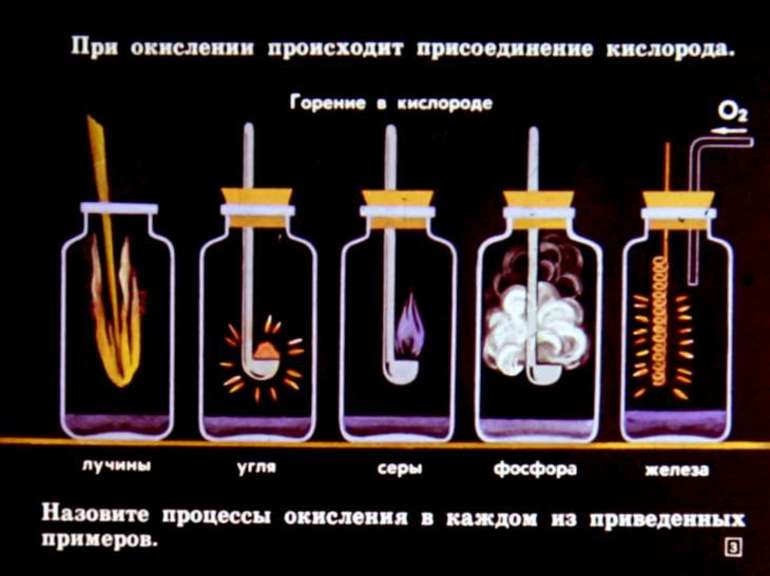
Химические реакции – это явления, при которых из одних веществ получаются другие. В процессе изучения химии приходилось встречаться с классификациями химических реакций по различным признакам.
По тепловому эффекту
Экзотермические – протекают с выделением энергии
Эндотермические – протекают с поглощением энергии
Cu(OH) 2 

По числу и составу исходных и образовавшихся веществ
Реакции разложения – из одного сложного вещества образуется несколько более простых:
СаСО 3 
Реакции соединения – из нескольких простых или сложных веществ образуется одно сложное: 2 H 2 + О 2 → 2 H 2 O ; C 2 H 4 + H 2 → C 2 H 6
Реакции замещения – атомы простого вещества замещают атомы одного из элементов в сложном веществе:
Zn + 2 HCl = ZnCl 2 + H 2 ↑ CH 4 + Cl 2 → CH 3 Cl + HCl
Реакции обмена – два сложных вещества обмениваются составными частями:
AgNO 3 + HCl = AgCl ↓ + HNO 3;
По агрегатному состоянию реагирующих веществ
Гетерогенные – исходные вещества и продукты реакции находятся в разных агрегатных состояниях:
Гомогенные – исходные вещества и продукты реакции находятся в одном агрегатном состоянии:
По наличию катализатора
Каталитические 2 H 2 O 2 
C 2 H 4 + H 2 
Некаталитические S + О 2 
Необратимые – протекают в данных условиях только в одном направлении:
Обратимые – протекают в данных условиях одновременно в двух противоположных направлениях:
По изменению степени окисления атомов элементов
Окислительно-восстановительные – реакции, идущие с изменением степени окисления:
Fe 0 + 2H +1 Cl -1 → Fe 2+ Cl 2 -1 + H 2 0 H +1 C 0 O -2 H +1 + H 2 → C -2 H 3 +1 O -2
Неокислительно-восстановительные – реакции, идущие без изменения степени окисления:
2группа готовит и выступает по теме «Скорость химических реакций».
Химические реакции протекают с разными скоростями. Очень быстро проходят реакции в водных растворах практически мгновенно. Смешаем растворы хлориды бария и сульфата натрия — сульфат бария в виде осадка образуется немедленно. Быстро, но не мгновенно горят сера, магний растворяется в соляной кислоте, этилен обесцвечивает бромную воду. Медленно образуется ржавчина на железных предметах, налет на медных и бронзовых изделиях, гниет листва, разрушаются зубы.
Предсказание скорости химической реакции, а также выяснение ее зависимости от условий проведения процесса — задача химической кинетики
науки о закономерностях протекания химических реакций во времени.
Скорость химической реакции зависит от многих факторов. Основными из них являются: природа н концентрация реагирующих веществ, давление (в реакциях с участием газов), температура, действие катализаторов и поверхность реагирующих веществ в гетерогенных реакций.
3 группа рассказывает про химическое равновесие и способах его смещения.
В обратимых процессах скорость прямой реакции вначале максимальна, а затем уменьшается из-за того, что уменьшаются концентрации исходных веществ, расходуемых ив образование продуктов реакции. Наоборот, скорость обратной реакции, минимальная в начале, увеличивается, но мере увеличения концентрации продуктов реакции. Наконец, наступает такой момент, когда скорости прямой и обратной реакции становятся равными.
Состояние химического обратимого процесса называется химическим равновесием, если при этом скорость прямой реакции равна скорости обратной реакции.
Химическое равновесие является динамичным (подвижным), так как при его наступлении реакция не прекращается, неизменными остаются лишь концентрации компонентов, то есть ля единицу времени образуется такое же количество продуктов реакции, какое превращается в исходные вещества. При постоянных температуре и давлении равновесие обратимое реакции может сохраняться неопределенно долгое время.
Французский химикЛеШателье в 1885 г. вывел, a немецкий физик Фердинанд Браун в 1887 г. обосновал общий закон смещения химического равновесия в зависимости ОТ внешних факторов, который известен пол названием принципа ЛеШателье.
Если изменить одно из условий — температуру, давление или концентрацию веществ — при которых данная система находится в состоянии химического равновесия, то равновесие сместится в направлении, которое препятствует этому изменению.
Этот принцип можно было бы назвать принципом «делай наоборот и добьешься своего».
4 группа выступает по теме «Электролитическая диссоциация».
В первой половине XIX в. М. Фарадей ввел понятие об электролитах и неэлектролиты. Электролитами он назвал вещества, водные растворы которых проводят электрический ток), а неэлектролитами — вещества, водные растворы которых не проводят электрический ток.
Для объяснения свойств водных растворов электролитов шведский ученый С. Аррениус (1859—1927) в 1887 г. предложил теорию электролитической диссоциации.
Согласно этой теории, при растворении в воде электролиты распадаются на свободные ионы. Этот процесс назвали электролитической диссоциацией. Растворы веществ тогда становятся проводниками электрического тока, когда они содержат ионы (положительно или отрицательно заряженные частицы), которые в электрическом поле приходят в направленное движение.
Сильные электролиты — это такие электролиты, которые в водных растворах (даже концентрированных) практически полностью диссоциируют на ноны. К сильным электролитам относятся почти все соли, неорганические кислоты, щелочи.
Слабые электролиты — это такие электролиты, которые в водных растворах не полностью диссоциируют на ионы. К слабым электролитам относятся: многие неорганические кислоты , органические кислоты, основания (за исключением щелочей), гидрат аммиака , некоторые соли.
5группа готовит и выступает по теме «Гидролиз».
Гидролиз — это реакция обменного разложения веществ водой.
Реакции гидролиза могут протекать обратимо и необратимо. Рассмотрим разные случаи этого процесса и его значение.
Сущность гидролиза сводится к обменному химическому взаимодействию катионов или анионов соли с молекулами воды. В результате этого взаимодействия образуется малодиссоциирующее соединение (слабый электролит). А в водном растворе соли появляется избыток свободных ионов Н- или ОН+ и распор соли становится кислотным или щелочным соответственно.
Любую соль можно представить как продукт взаимодействия основания с кислотой.
В зависимости от силы основания и кислоты можно выделить 4 типа солей .
I. Соли, образованные сильным основанием и слабой кислотой
2. Соли, образованные сильной кислотой и слабым основанием.
3. Соли, образованные слабым основанием и слабой кислотой.
4. Соли, образованные сильным основанием и сильной кислотой, не подвергаются гидролизу. К этому выводу вы пришли, очевидно, сами.
3. Обсуждение основных вопросов.Вгруппах происходит обсуждение и обобщение изученного материала. Ребята отвечают на вопросы по каждому разделу темы «Химические реакции» (вопросы также заранее были приведены).
4. Практическая часть. Данная часть включает в себя упражнения и задачи в форме тестов.
П р и м е р 1. Взаимодействие растворов сульфата калия и хлорида бария относится к реакциям:
1) замещения; 2) нейтрализации;
3) ионного обмена; 4) соединения.
Поскольку исходные вещества являются электролитами, определить верный ответ несложно. Правильный ответ – 3.
П р и м е р 2. Взаимодействие между глицерином и высшимикарбоновыми кислотами относится к реакциям:
1) изомеризации; 2) дегидрирования;
3) нейтрализации; 4) этерификации.
Сразу исключается ответ 1, т.к. в условии даны два исходных вещества. Реакция дегидрирования (отщепления водорода) по этой жепричине не удовлетворяет требованиям задания. Реакция нейтрализации – реакция между сильной кислотой и щелочью, но ни первое, ни второе исходные вещества не являются таковыми. Правильныйответ – 4.
П р и м е р 3. К экзотермическим реакциям не относится взаимодействие:
1) оксида натрия с водой;
2) фосфора с кислородом;
3) оксида фосфора с водой;
4) азота с кислородом.
Все указанные в условии задания относятся к реакциям соединения, которые, как правило, являются экзотермическими реакциями, т.е. протекают с выделением теплоты. Одно из немногих
исключений – взаимодействие азота с кислородом. Правильныйответ – 4.
П р и м е р 4. Верны ли следующие суждения применительно к реакции синтеза аммиака?
А) Это реакция соединения, гомогенная, каталитическая.
Б) Это реакция окислительно-восстановительная, обратимая,
1) Верно только А; 2) верно только Б;
3) верны оба суждения; 4) оба суждения неверны.
Верный ответ – 3. К такому выводу позволяет прийти запись уравнения реакции:
N2 + 3H2 ←.→кат 2NH3 + Q .
П р и м е р 5. К реакциям замещения и соединения относятся
1) оксид алюминия + соляная кислота и оксид железа(III) + алюминий;
2) алюминий + хлорид меди(II) и алюминий + хлор;
3) гидроксид алюминия + серная кислота и алюминий + кислород;
4) сульфат алюминия + хлорид бария и алюминий + йод.
Поскольку по условию задания первой в верном ответе должнабыть реакция замещения (взаимодействие простого и сложного веществ), то определить верный ответ не составит труда. Это – ответ 2.
Остальные варианты ответов можно не анализировать.
П р и м е р 6. К реакциям обмена и замещения соответственно
1) азотной кислоты с оксидом меди(II) и гидроксида кальция с оксидом углерода(IV);
2) этина с бромом и серной кислоты с оксидом магния;
3) соляной кислоты с гидроксидом железа(III) и метана с хлором;
4) фенола с натрием и фенола с гидроксидом натрия.
Достаточно сложное задание, т.к. требует знаний не только классификации химических реакций, но и номенклатуры органическихи неорганических соединений. Однако его можно выполнить бы-
стро на основании логики и знания о том, что реакция замещения –это, как правило, взаимодействие простого и сложного веществ. По условию задания эта реакция должна быть предложена вусловиях ответа второй. Правильный ответ – 3.
П р и м е р 7. Верны ли следующие суждения?
А) При сливании растворов карбоната натрия и хлорида алюминия выделяется газ и выпадает осадок.
Б) При сливании растворов карбоната натрия и хлорида бария
выделяется газ и выпадает осадок.
1) Верно только А; 2) верно только Б;
3) верны оба суждения; 4) оба суждения неверны.
В результате обменной реакции между карбонатом натрия и хлоридом алюминия образуется карбонат алюминия, который в присутствии воды сразу необратимо гидролизуется с образованием нерастворимого в воде гидроксида алюминия и выделением углекислого газа, т.е. первое суждениеправильное. Реакция обмена между растворами хлорида бария и карбоната натрия приводит к образованию труднорастворимого карбоната бария, не подвергающегося гидролизу. Никакого газа при этом не выделяется, т.е. второе суждение неверно. Правильный ответ – 1.
П р и м е р 8. Установите соответствие между формулами двух солей и способностью к гидролизу соответственно.
Формулы солей Способность к гидролизу
А) Na2CO3, NaCl; 1) Гидролиз по катиону, гидролиз по аниону;
Б) CuSO4, K2S; 2) гидролиз по аниону, не гидролизуется;
В) LiNO3, Na2SiO3; 3) гидролиз по катиону, не гидролизуется;
Г) KCN, AlCl3. 4) гидролиз по аниону, гидролиз по катиону;
5) не гидролизуется, гидролиз по катиону;
6) не гидролизуется, гидролиз по аниону.
Выполнять задание рекомендуется, разбив левый столбик на дваподстолбика. Зная, по какому иону гидролизуются соли различноготипа, по формуле первого вещества из пáры отбирают возможные
варианты ответов из правого столбика, по формуле второй соли выбирают единственно верный из этих вариантов. Например, для первойпары: гидролиз карбоната натрия протекает по аниону (соответствияА–2, А–4), хлорид натрия не гидролизуется (остается соответствиеА–2). Правильный ответ – 2164.
П р и м е р 9. Установите соответствие между формулами двух
солей и реакцией среды их растворов соответственно.
Формулы солей Реакция среды
А) K2SO4, Na2SO3; 1) Кислая, щелочная;
Б) CH3COONa, KNO2; 2) нейтральная, кислая;
В) LiNO3, ZnCl2; 3) нейтральная, щелочная;
Г) (NH4)2SO4, C17H35COOK. 4) щелочная, щелочная;
5) кислая, кислая;
6) щелочная, кислая.
Выполнять задание рекомендуется, разбив левый столбик надва подстолбика. На основании анализа состава первой соли изпáры и реакции среды в ее растворе отбирают возможные варианты
ответов из правого столбика, по формуле второй соли выбираютединственно верный из этих вариантов. Например, для первойпары: сульфат калия образован сильной кислотой и сильным
основанием, реакция среды – нейтральная (соответствия А–2,А–3), сульфит натрия образован сильным основанием и кислотойсредней силы, среда раствора – щелочная (остается соответствие
А–3).Правильный ответ – 3421.
П р и м е р 10. Для пропана возможны реакции:
Пропан – предельный углеводород, следовательно, реакции присоединения (варианты 1, 2) и полимеризации (вариант 4) для негонехарактерны. Правильный ответ – 356.
5. Контроль знаний. ( Можно предложить взять подобные задания из сборников по подготовке к ЕГЭ).
6. Заключительная часть.
Успех всего семинара и особенно на этапе его подготовки во многом зависит от эффективности самостоятельной работы учащихся.
Для более глубокого изучения темы были заранее подготовлены теоретические вопросы и практические задания. На уроке был рассмотрен достаточно большой объем материала, который в ходе обсуждения был систематизирован и обобщен.Для подготовки точного и полного ответа на семинарском занятии ребятам пришлось серьезно и основательно подготовится. Учащиеся серьезно подошли к подготовке и проведению семинара. Именно такая форма работы способствовала созданию условийдля организации дискуссий, индивидуальной и коллективной работы учащихся, повышению уровня их осмысления и обобщения изученного материала.
7. Подведение итогов (рефлексия). Ребята обсудили итоги семинара (что получилось, а что нет) и самостоятельно оценили свои выступления в группах. Учитель проанализировал ответы всех участников, уровень их подготовки и участия в семинаре и подвел общий итог.
Список используемой литературы
1.Габриелян О.С. Химия. 11 класс. Пособие для общеобразовательныхучреждений — 2-е изд. – М.: Дрофа,2002. – 375 с.
2. Громов Е.В. Методика организации реферативного обучения на семинарских занятиях. — М.: 2001. – 325 с.
3. Педагогический словарь./ под ред. Каирова И.А. – М.: АПН РСФСР, 1960. – Т. 1 – 774 с., Т. 2 – 766с.
Анализ проведенного занятия.
— Мне удалось достичь поставленных целей и задач.
— При проведении занятия у учащихся возникли проблемы в усвоении содержания учебного материала. Причиной возникших трудностей и проблем оказалось, что не все учащиеся хорошо разобрались в изучаемой темеи мне как, учителю пришлось немного корректировать ход проведения семинара.
— Основную концепцию занятия я бы оставила, но добавила задания на творческое развитие учащихся, так например, дала бы им попробовать самостоятельно составить подобные тесты и упражнения и прорешать их всем вместе.
Как решать химические уравнения — схемы и примеры решения для разных реакций
Основные термины и понятия
Составление уравнений химических реакций невозможно без знания определённых обозначений, показывающих, как проходит реакция. Объединение атомов, имеющих одинаковый ядерный заряд, называют химическим элементом. Ядро атома состоит из протонов и нейтронов. Первые совпадают с числом атомного номера элемента, а значение вторых может варьироваться. Простейшими веществами называют элементы, состоящие из однотипных атомов.
Любой химический элемент описывается с помощью символов, условно обозначающих структуру веществ. Формулы являются неотъемлемой частью языка науки. Именно на их основе составляют уравнения и схемы. По своей сути они отражают количественный и качественный состав элементов. Например, запись HNO3 сообщает, что в соединении содержится одна молекула азотной кислоты, а оно само состоит из водорода, азота и кислорода. При этом в состав одного моля азотной кислоты входит по одному атому водорода и азота и 3 кислорода.
Символика элементов, условное обозначение, представляет собой химический язык. В значке содержится информация о названии, массовом числе и порядковом номере. Международное обозначение принято, согласно периодической таблице Менделеева, разработанной в начале 1870 года.
Взаимодействующие между собой вещества называются реагентами, а образующиеся в процессе реакции — продуктами. Составление и решение химических уравнений фактически сводится к определению результатов реакций, поэтому просто знать формулы веществ мало, нужно ещё уметь подбирать коэффициенты. Располагаются они перед формулой и указывают на количество молекул или атомов, принимающих участие в процессе. С правой стороны от химического вещества ставится индекс, указывающий место элемента в системе.
Записывают уравнения в виде цепочки, в которой указываются все стадии превращения вещества начиная с левой части. Вначале пишут формулы элементов в исходном состоянии, а затем последовательно их преобразование.
Виды химических реакций
Химические явления характеризуются тем, что из двух и более элементов образуются новые вещества. Уравнения описывают эти процессы. Впервые с объяснениями протекания реакций знакомят в восьмом классе средней образовательной школы на уроках неорганической химии. Ученикам демонстрируют опыты, в которых явно наблюдаются различия в протекании реакций.
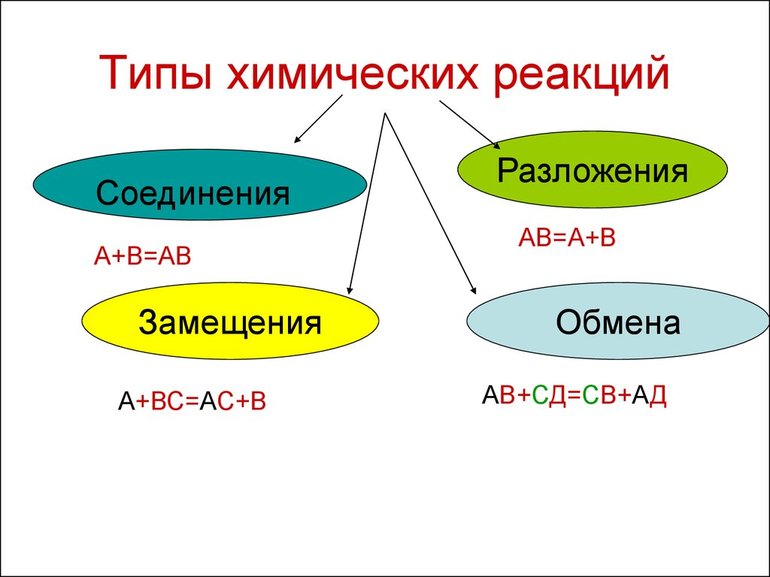
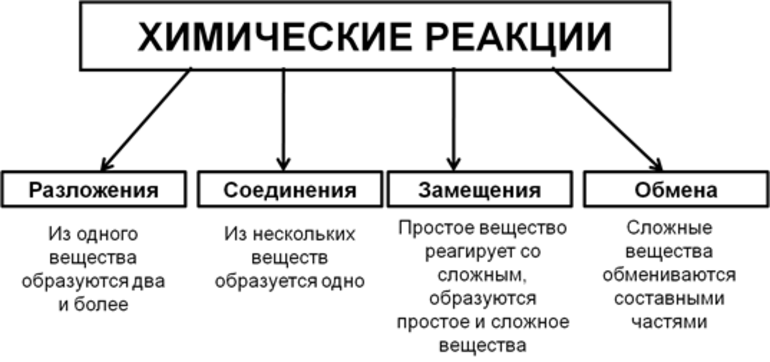
Всего существует 4 типа химического взаимодействия веществ:
- Соединение. В реакцию могут вступать 2 простых вещества: металл и неметалл или неметалл и неметалл. Например, алюминий с серой образуют сульфид алюминия. Кислород, взаимодействуя с водородом, превращается в воду. Объединятся могут 2 оксида с растворимым основанием, как оксид кальция с водой: CaO + H2O = Ca (OH)2 или основной оксид с кислотным: CaO + SO3 = CaSO4.
- Разложение. Это процесс обратный реакции соединения: было одно вещество, а стало несколько. Например, при пропускании электрического тока через воду получается водород и кислород, а при нагревании известняка 2 оксида: CaCO3 = CaO + CO2.
- Замещение. В реакцию вступают 2 элемента. Один из них простой, а второй сложный. В итоге образуются 2 новых соединения, при котором атом простого вещества заменяет сложный, как бы вытесняя его. Условие протекания процесса: простое вещество должно быть более активным, чем сложное. Например, Zn + 2HCl = ZnCl2 + H2. Величину активности можно узнать из таблицы ряда электрохимических напряжений.
- Обмен. В этом случае между собой реагируют 2 сложных элемента, обменивающиеся своими составными частями. Условием осуществления такого типа реакции является обязательное образование воды, газа или осадка. Например, CuO + 2HCl = CuCl2 + H2O. Чтобы узнать, смогут ли вещества прореагировать, используют таблицу растворимости.
Основными признаками химических реакций является изменение цвета, выделение газа или образование осадка. Различают их по числу веществ, вступивших в реакцию и образовавшихся продуктов. Правильное определение типа реакции особо важно при составлении химических уравнений, а также определения свойств и возможностей веществ.
Окислительно-восстановительный процесс
Составление большинства реакций сводится к подбору коэффициентов. Но при этом могут возникнуть трудности с установлением равновесия, согласно закону сохранения массы веществ. Чаще всего такая ситуация возникает при решении заданий, связанных с расстановкой количества атомов в уравнениях окислительно-восстановительных процессов.
Под ними принято понимать превращения, протекающие с изменением степени окисления элементов. При окислении происходит процесс передачи атомом электронов, сопровождающийся приобретением им положительного заряда или ионом, после чего он становится нейтральным. При этом также происходит процесс восстановления, связанный с присоединением элементарных частиц атомом.
Для составления уравнений необходимо определить восстановитель, окислитель и число участвующих в реакции электронов. Коэффициенты же подбирают с помощью метода электронно-ионного баланса (полуреакций). Его суть состоит в установлении равенства путём уравнивания количества электронов, отдаваемых одним элементом и принимаемым другим.
Классический алгоритм
В основе решения задач этим методом — закон сохранения массы. Согласно ему, совокупная масса элементов до реакции и после остаётся неизменной. Другими словами, происходит перегруппировка частиц. Если рассматривать решение химического уравнения поэтапно, оно будет состоять из трёх шагов:
- Написания формул элементов, вступающих в реакцию с левой стороны.
- Указания справа формулы образующихся веществ.
- Уравнивания числа атомов с добавлением коэффициентов.
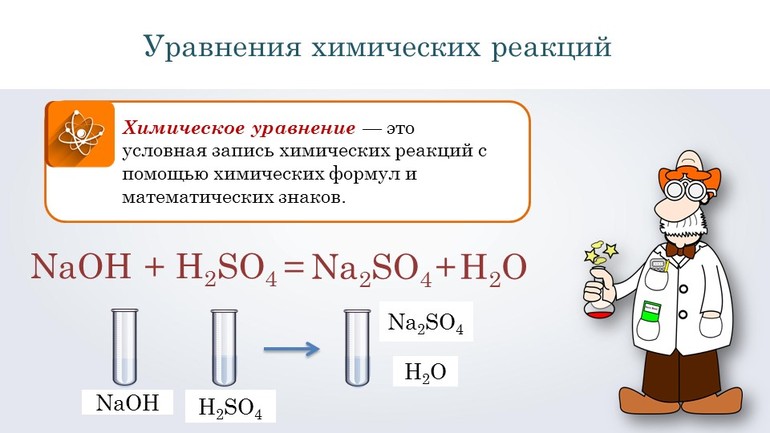
Перед тем как переходить к сложным соединениям, лучше всего потренироваться на простых. Например, нужно составить уравнение, описывающее взаимодействие двух сложных веществ: гидроксида натрия и серной кислоты. При таком соединении образуется сульфат натрия и вода.
Согласно алгоритму, в левой части уравнения необходимо записать реагенты, а в правой продукты реакции: NaOH + H2SO 4 → Na 2SO4 + H2O. Теперь следует уравнять коэффициенты. Начинают с первого элемента. В примере это натрий. В правой части содержится 2 его атома, а в левой один, поэтому необходимо возле реагента поставить цифру 2. Затем нужно уровнять водород. В результате получится выражение: 2 NaOH + H2SO 4 → Na2 SO4 +2H2O.
Ещё одним наглядным примером является процесс реакции тринитротолуола с кислородом. При их взаимодействии образуется: C7H5N3O6 + O2 → CO2 + H2O + N2. Исходя из того, что слева находится нечётное число атомов H и N, а справа чётное, нужно их уравнять: 2C7H5N3O6 + O2 → CO2 + H2O + N2.
Теперь становится понятным, что 14 и 10 атомов углерода и водорода должны образовать 14 долей диоксида и 5 молекул воды. При этом 6 атомов азота превратятся в 3. Итоговое уравнение будет выглядеть как 2C7H5N3O6 + 10,5O2 → 14CO2 + 5H2O + 3N2.
Перед тем как начинать тренировку по составлению уравнений, следует научиться расставлять валентность. Это параметр, равный числу соединившихся атомов каждого элемента. Фактически это способность к соединению. Например, в формуле NH3 валентность атома азота равна 3, а водорода 1.
Решение методом полуреакций
Алгоритм для решения примеров химических уравнений проще рассмотреть на конкретном задании. Пускай необходимо описать процесс окисления пирита азотной кислоты с малой концентрацией: FeS2 + HNO3. Решать этот пример необходимо в следующей последовательности:
- Определить продукты реакции. Так как кислота является сильным окислителем, сера получит максимальную степень оксидации S6+, а железо Fe3+. HNO3 может восстановиться до одного из двух состояний NO2 или NO.
- Исходя из состава ионов и правила, что вещества, переходящие в газовую форму или плохо растворимые, записываются в молекулярном виде, верным будет записать: FeS2 — Fe3+ + 2SO2−4. Гидролизом можно пренебречь.
- В записи уравнивают кислород. Для этого в левую часть добавляют 8 молекул воды, а в правую 16 ионов водорода: FeS2 + 8H20 — Fe3+ + 2SO2−4 + 16H+. Так как заряда в левой части нет, а в правой он равный +15, то серное железо должно будет отдать 15 электронов. Значит, уравнение примет вид: FeS2 + 8H20 — 15e → Fe3+ + 2SO2−4 + 16H+.
- Теперь переходят к реакции восстановления нитрата иона: NO-3 →NO. Для её составления нужно отнять у оксида азота 2 атома кислорода. Делают это путём прибавления к левой части 4 ионов водорода, а правой — 2 молекул воды. В итоге получится: NO-3 + 4H+ → NO + 2H2O.
- Полученную формулу уравнивают добавлением к левой части 3 электронов: NO-3 + 4H+ 3e → NO + 2H2O.
- Объединяют найденные выражения и записывают результат: FeS2 + 8H20 + 5NO-3 + 20H+ → Fe3+ + 2SO2−4 + 16H+ + 5NO + 10H2O.
Уравнение можно сократить на 16H + и 8H2O. В итоге получится сокращённое выражение окислительно-восстановительной реакции: FeS2 + 5NO — 3 + 4 H + = Fe3 + + 2SO 2- 4 + 5NO + 2H2O.
Такой алгоритм считается классическим, но для упрощения понимания лучше использовать способ электронного баланса. Процесс восстановления переписывают как N5+ + 3e → N2+. Степень же окисления составить сложнее. Сере нужно приписать степень 2+ и учесть, что на 1 атом железа приходится 2 атома серы: FeS2 → Fe3++ 2S6+. Запись общего баланса будет выглядеть: FeS2 + 5N5+ = Fe3+ + 2S6+ + 5N2+.
Пять молекул потратятся на окисление серного железа, а ещё 3 на образование Fe (NO3)3. После уравнения двух сторон запись реакции примет вид, аналогичный полученному с использованием предыдущего метода.
Использование онлайн-расчёта
Простые уравнения решать самостоятельно довольно просто. Но состоящие из сложных веществ могут вызвать трудности даже у опытных химиков. Чтобы получить точную формулу и не подбирать вручную коэффициенты, можно воспользоваться онлайн-калькуляторами. При этом их использовать сможет даже пользователь, не особо разбирающийся в науке.
Чтобы расстановка коэффициентов в химических уравнениях онлайн происходила автоматически, нужно лишь подключение к интернету и исходные данные. Система самостоятельно вычислит продукты реакции и уравняет обе стороны формулы. Интересной особенностью таких сайтов является не только быстрый и правильный расчёт, но и описание правил с алгоритмами, по которому выполняются действия.
После загрузки калькулятора в веб-обозревателе единственное, что требуется от пользователя — правильно ввести реагенты в специальные формы латинскими буквами и нажать кнопку «Уравнять». Иногда возникает ситуация, когда запись сделана верно, но коэффициенты не расставляются. Это происходит, если суммы в уравнении могут быть подсчитаны разными способами. Характерно это для реакций окисления. В таком случае нужно заменить фрагменты молекул на любой произвольный символ. Таким способом можно не только рассчитать непонятное уравнение, но и выполнить проверку своих вычислений.
Химические реакции
Контрольная работа по химии для 11 класса по теме «Химические реакции»
Просмотр содержимого документа
«Химические реакции»
Контрольная работа №2 «Химические реакции»
1) Соединения, ОВР 2) Замещения ОВР 3) Обмена не ОВР 4) Разложения ОВР
А2. Какая масса угля вступает в реакцию, термохимическое уравнение которой С+О2 = СО2 + 402 кДж, если при этом выделилось 1608 кДж теплоты?
1) 4,8 г 2) 48 г 3) 120 г 4) 240 г
А3. Химическая реакция, уравнение которой:
1) Дегидрирования 2) Изомеризации 3) Полимеризации 3) Присоединения
1) N 0 2) H 0 3) H +1 4) N –3
А5. При повышении температуры на 30 °С (температурный коэффициент равен 3) скорость увеличится
1) в 3 раза 2) в 9 раз 3) в 27 раз 4) в 81 раз
А6. Факторы, позволяющие сместить химическое равновесие, для реакции CaO(т)+CO2(г)↔CaCO3(т)+Q, в сторону продуктов реакции:
1) Повышение температуры и понижение давления 2) Понижение температуры и давления
3) Понижение температуры и повышение давления 4) Повышение температуры и давления
А7. Щелочную среду имеет водный раствор соли, формула которой:
А8. Наиболее сильной кислотой из перечисленных является:
А9. Осадок образуется при взаимодействии хлорида калия с:
А10. Гидролизу не подвергается:
В1. Установите соответствие между схемой ОВР и коэффициентом перед формулой восстановителя:
http://nauka.club/khimiya/khimicheskie-uravneniya.html
http://multiurok.ru/files/khimicheskie-reaktsii-1.html