Пурины распадаются с образованием мочевой кислоты
Наиболее активно катаболизм пуринов идет в печени, тонком кишечнике (пищевые пурины) и почках.
Реакции катаболизма пуринов
Реакции распада пуринов можно условно разделить на 5 стадий:
1. Дефосфорилирование АМФ и ГМФ – фермент 5′-нуклеотидаза .
2. Гидролитическое отщепление аминогрупы от С6 в аденозине – фермент дезаминаза. Образуется инозин.
3. Удаление рибозы от инозина (с образованием гипоксантина) и гуанозина (с образованием гуанина) с ее одновременным фосфорилированием – фермент нуклеозидфосфорилаза .
4. Окисление С2 пуринового кольца: гипоксантин при этом окисляется до ксантина (фермент ксантиноксидаза), гуанин дезаминируется до ксантина – фермент дезаминаза .
5. Окисление С8 в ксантине с образованием мочевой кислоты – фермент ксантиноксидаза (описание фермента см здесь). Около 20% мочевой кислоты удаляется с желчью через кишечник, где она разрушается микрофлорой до CO2 и воды. Остальная часть удаляется через почки.
Распад пуриновых и пиримидиновых нуклеотидов до конечных продуктов в тканях
Распад пуриновых нуклеотидов.
Аденозин и гуанозин, которые образуются при гидролизе пуриновых нуклеотидов, подвергаются ферментативному распаду с образованием конечного продукта – мочевой кислоты, которая выводится с мочой из организма.
Распад пиримидиновых нуклеотидов.
Начальные этапы этого процесса катализируются специфическими ферментами. Конечные продукты: СО2, NН3, мочевина, β-аланин, β-аминоизомасляная кислота. β-аланин используется для синтеза дипептидов мышц – карнозина и ансерина или выделяется с мочой.
21. Коферменты: Большинство ферментов для проявления ферментативной активности нуждается в низкомолекулярных органических соединениях небелковой природы (коферментах) и/или в ионах металлов (кофакторах). Термин. «кофермент» был введён в начале XX века и обозначал часть некоторых ферментов, которая легко отделялась от белковой молекулы фермента и удалялась через полупроницаемую мембрану при диализе. Несколько позже было выяснено, что большинство ферментов состоит из термолабильной белковой части и термостабильного небелкового фактора — кофермента. Белковая часть получила название «апофермент», который в отсутствие кофермента не обладает каталитической активностью. Кофермент с белковой молекулой (апоферментом) формируют молекулу холофермента, обладающую каталитической активностью.
Более 25% всех ферментов для проявления полной каталитической активности нуждается в ионах металлов. Рассмотрим роль кофакторов в ферментативном катализе.
1. Роль металлов в присоединении субстрата
в активном центре фермента
Ионы металла выполняют функцию стабилизаторов молекулы субстрата, активного центра фермента и конформации белковой молекулы фермента, а именно третичной и четвертичной структур.
Ионы металлов — стабилизаторы молекулы субстрата
Для некоторых ферментов субстратом служит комплекс превращаемого вещества с ионом металла. Например, для большинства киназ в качестве одного из субстратов выступает не молекула АТФ, а комплекс Mg2+-ATФ. В этом случае ион Mg2+ не взаимодействует непосредственно с ферментом, а участвует в стабилизации молекулы АТФ и нейтрализации отрицательного заряда субстрата, что облегчает его присоединение к активному центру фермента
Схематично роль кофактора при взаимодействии фермента и субстрата можно представить как комплекс E-S-Me, где Е — фермент, S — субстрат, Me — ион металла.
В качестве примера можно привести расположение субстратов в активном центре гексокиназы
Гексокиназа катализирует перенос концевого, γ-фосфатного остатка молекулы АТФ на глюкозу с образованием глюкозо-6-фосфата:
Участие ионов магния в присоединении субстрата в активном центре гексокиназы. В активном центре гексокиназы есть участки связывания для молекулы глюкозы и комплекса Мд2+-АТФ. В результате ферментативной реакции происходит перенос концевого, γ-фосфатного остатка молекулы АТФ на глюкозу с образованием глюкозо-6-фосфата.
Ион Mg2+ участвует в присоединении и «правильной» ориентации молекулы АТФ в активном центре фермента, ослабляя фосфоэфирную связь и облегчая перенос фосфата на глюкозу.
Ионы металла — стабилизаторы активного центра фермента
В некоторых случаях ионы металла служат «мостиком» между ферментом и субстратом. Они выполняют функцию стабилизаторов активного центра, облегчая присоединение к нему субстрата и протекание химической реакции. В ряде случаев ион металла может способствовать присоединению кофермента. Перечисленные выше функции выполняют такие металлы, как Mg2+, Mn2+, Zn2+, Co2+, Мо2+. В отсутствие металла эти ферменты активностью не обладают. Такие ферменты получили название «металлоэнзимы». Схематично данный процесс взаимодействия фермента, субстрата и металла можно представить следующим образом:
К металлоэнзимам относят, например, фермент пируват киназу (рис. 2-4), катализирующий реакцию:
Пищеварительные ферменты:Ферме́нты пищеваре́ния, пищеварительные ферменты — ферменты, расщепляющие сложные компоненты пищи до более простых веществ, которые затем всасываются в организм. В более широком смысле пищеварительными ферментами также называют все ферменты, расщепляющие крупные (обычно полимерные) молекулы на мономеры или более мелкие части. Пищеварительные ферменты находятся в пищеварительной системе человека и животных. Кроме этого, к таким ферментам можно отнести внутриклеточные ферменты лизосом. Основные места действия пищеварительных ферментов в организме человека и животных — это ротовая полость, желудок, тонкая кишка. Эти ферменты вырабатываются такими железами, как слюнные железы, железы желудка, поджелудочная железа и железы тонкой кишки. Часть ферментативных функций выполняется облигатной кишечной микрофлорой. По субстратной специфичности пищеварительные ферменты делятся на несколько основных групп:
протеазы (пептидазы) расщепляют белки до коротких пептидов или аминокислот
липазы расщепляют липиды до жирных кислот и глицерина
карбогидразы гидролизуют углеводы, такие как крахмал или сахара, до простых сахаров, таких как глюкоза
нуклеазы расщепляют нуклеиновые кислоты до нуклеотидов.
1.Ротовая полость — Слюнные железы секретируют в полость рта альфа-амилазу (птиалин), которая расщепляет высокомолекулярный крахмал до более коротких фрагментов и до отдельных растворимых сахаров (декстрины, мальтоза, мальтриоза).
Ферменты, секретирующиеся желудком называются желудочными ферментами.
Пепсин — основной желудочный фермент. Расщепляет белки до пептидов.
Желатиназа расщепляет желатин и коллаген, основные протеогликаны мяса.
-Ферменты поджелудочной железы
Поджелудочная железа является основной железой в системе пищеварения. Она секретирует ферменты в просвет двенадцатиперстной кишки.
Трипсин является протеазой, аналогичной пепсину желудка.
Химотрипсин — также протеаза, расщепляющая белки пищи.
Несколько различных эластаз, расщепляющих эластин и некоторые другие белки.
Нуклеазы, расщепляющие нуклеиновые кислоты ДНК и РНК.
Стеапсин, расщепляющий жиры.
Амилазу, расщепляющую крахмал и гликоген, а также другие углеводы.
Липаза поджелудочной железы является важнейшим ферментом в переваривании жиров. Она действует на жиры (триглицериды), предварительно эмульгированные желчью, секретируемой в просвет кишечника печенью.
-Ферменты тонкой кишки
Несколько пептидаз, в том числе:
энтеропептидаза — превращает трипсиноген в трипсин;
аланинаминопептидаза — расщепляет пептиды, образовавшиеся из белков после действия протеаз желудка и поджелудочной железы.
Ферменты, расщепляющие дисахариды до моносахаридов:
сахараза расщепляет сахарозу до глюкозы и фруктозы;
мальтаза расщепляет мальтозу до глюкозы;
изомальтаза расщепляет мальтозу и изомальтозу до глюкозы;
лактаза расщепляет лактозу до глюкозы и галактозы.
Липаза кишечника расщепляет жирные кислоты.
Эрепсин, фермент, расщепляющий белки.
22. Полиферментная сиситема:Каждая клетка организма имеет свой специфический набор ферментов. Некоторые из них содержатся во всех клетках, другие присутствуют только в некоторых. В клетке работа каждого фермента, как правило, не индивидуальная, а тесно связана с другими ферментами, т.е. из отдельных ферментов формируются полиферментные системы, или конвейеры. Субстрат иногда во время своего превращения проходит длинную цепь реакций, в которых участвует много ферментов. Продукт реакции, катализируемой первый фермент, служит субстратом для второго фермента и т.д. Примером может служить процесс гликолиза. Все ферменты гликолиза имеющиеся в растворимом состоянии. В процессах превращения глюкозы до молочной кислоты участвует целый ряд ферментов. Положение каждого фермента в цепи устанавливается по родством с субстратами (начиная с глюкозы), каждый из которых соответственно являются продуктом реакции, катализованои предыдущим ферментом. Это увеличивает скорость ферментативных реакций, и в такой цепи промежуточные продукты не накапливаются.
Многие полиферментные ансамблей структурно связаны с какой-либо органеллы (митохондрии, рибосомы, ядро) или биомембран-ми и составляют высокоорганизованные системы, обеспечивающие жизне-воважливи функции, например, тканевое дыхание, т.е. перенос электронов и протонов от субстратов к кислорода через систему дыхательных ферментов, закрепленных на внутренней мембране митохондрий. Некоторые ферменты, участвующие в реакции одной цепи метаболизма, объединяются в мультиэнзимных комплексы с определенной функцией. Типичным примером подобных надмолекулярных комплексов является пируватдегидрогеназный комплекс, состоящий из нескольких ферментов, участвующих в окислении пировиноградной кислоты до ацетил-КоА, или синтетаза жирных кислот, состоящий из семи структурно связанных ферментов, которые выполняют функцию синтеза жирных кислот.
23. Пищеварение в метоболизме:Метаболи́зм (от греч. μεταβολή — «превращение, изменение»), или обмен веществ — набор химических реакций, которые возникают в живом организме для поддержания жизни. Эти процессы позволяют организмам расти и размножаться, сохранять свои структуры и отвечать на воздействия окружающей среды.
Пищеварение: Такие макромолекулы, как крахмал, целлюлоза или белки, должны расщепляться до более мелких единиц прежде, чем они могут быть использованы клетками. Несколько классов ферментов принимают участие в деградации: протеазы, которые расщепляют белки до пептидов и аминокислот, гликозидазы, которые расщепляют полисахариды до олиго- и моносахаридов.
Микроорганизмы выделяют гидролитические ферменты в пространство вокруг себя,[29][30] чем отличаются от животных, которые выделяют такие ферменты только из специализированных железистых клеток.[31] Аминокислоты и моносахариды, образующиеся в результате активности внеклеточных ферментов, затем поступают в клетки с помощью активного транспорта
Пищеварительные ферменты:Ферме́нты пищеваре́ния, пищеварительные ферменты — ферменты, расщепляющие сложные компоненты пищи до более простых веществ, которые затем всасываются в организм. В более широком смысле пищеварительными ферментами также называют все ферменты, расщепляющие крупные (обычно полимерные) молекулы на мономеры или более мелкие части. Пищеварительные ферменты находятся в пищеварительной системе человека и животных. Кроме этого, к таким ферментам можно отнести внутриклеточные ферменты лизосом. Основные места действия пищеварительных ферментов в организме человека и животных — это ротовая полость, желудок, тонкая кишка. Эти ферменты вырабатываются такими железами, как слюнные железы, железы желудка, поджелудочная железа и железы тонкой кишки. Часть ферментативных функций выполняется облигатной кишечной микрофлорой. По субстратной специфичности пищеварительные ферменты делятся на несколько основных групп:
протеазы (пептидазы) расщепляют белки до коротких пептидов или аминокислот
липазы расщепляют липиды до жирных кислот и глицерина
карбогидразы гидролизуют углеводы, такие как крахмал или сахара, до простых сахаров, таких как глюкоза
нуклеазы расщепляют нуклеиновые кислоты до нуклеотидов.
1.Ротовая полость — Слюнные железы секретируют в полость рта альфа-амилазу (птиалин), которая расщепляет высокомолекулярный крахмал до более коротких фрагментов и до отдельных растворимых сахаров (декстрины, мальтоза, мальтриоза).
Ферменты, секретирующиеся желудком называются желудочными ферментами.
Пепсин — основной желудочный фермент. Расщепляет белки до пептидов.
Желатиназа расщепляет желатин и коллаген, основные протеогликаны мяса.
-Ферменты поджелудочной железы
Поджелудочная железа является основной железой в системе пищеварения. Она секретирует ферменты в просвет двенадцатиперстной кишки.
Трипсин является протеазой, аналогичной пепсину желудка.
Химотрипсин — также протеаза, расщепляющая белки пищи.
Несколько различных эластаз, расщепляющих эластин и некоторые другие белки.
Нуклеазы, расщепляющие нуклеиновые кислоты ДНК и РНК.
Стеапсин, расщепляющий жиры.
Амилазу, расщепляющую крахмал и гликоген, а также другие углеводы.
Липаза поджелудочной железы является важнейшим ферментом в переваривании жиров. Она действует на жиры (триглицериды), предварительно эмульгированные желчью, секретируемой в просвет кишечника печенью.
-Ферменты тонкой кишки
Несколько пептидаз, в том числе:
энтеропептидаза — превращает трипсиноген в трипсин;
аланинаминопептидаза — расщепляет пептиды, образовавшиеся из белков после действия протеаз желудка и поджелудочной железы.
Ферменты, расщепляющие дисахариды до моносахаридов:
сахараза расщепляет сахарозу до глюкозы и фруктозы;
мальтаза расщепляет мальтозу до глюкозы;
изомальтаза расщепляет мальтозу и изомальтозу до глюкозы;
лактаза расщепляет лактозу до глюкозы и галактозы.
Липаза кишечника расщепляет жирные кислоты.
Эрепсин, фермент, расщепляющий белки.
24. Тканевое дыхание.Клеточное или тканевое дыхание — совокупность биохимических реакций, протекающих в клетках живых организмов, в ходе которых происходит окисление углеводов, липидов и аминокислот до углекислого газа и воды. Высвобожденная энергия запасается в химических связях макроэргических соединений (АТФ и др.) и может быть использована по мере необходимости. Входит в группу процессов катаболизма. О физиологических процессах транспортировки к клеткам многоклеточных организмов кислорода и удалению от них углекислого газа см. статью Дыхание.
Впервые сущность дыхания объяснил А.-Л. Лавуазье (1743-1794), обративший внимание на сходство между горением органических веществ вне организма и дыханием животных. Постепенно становились ясными принципиальные различия между этими двумя процессами: в организме окисление протекает при относительно низкой температуре в присутствии воды, и его скорость регулируется обменом веществ. В настоящее время биологическое окисление определяется как совокупность реакций окисления субстратов в живых клетках, основная функция которых — энергетическое обеспечение метаболизма. В развитие концепций биологического окисления в XX в. важнейший вклад внесли А.Н. Бах, О. Варбург, Г. Крепс, В.А. Энгель-гардт, В.И. Палладин, В.А. Белицер, С.Е. Северин, В.П. Скулачев.
БИОЛОГИЧЕСКОЕ ОКИСЛЕНИЕ — совокупность ферментативных окислительно-восстановительных реакций, протекающих в живых клетках. В процессе биологического окисления происходит расщепление питательных веществ, и освобождаемая при этом энергия запасается в удобной для использования клетками форме т. н. богатых энергией соединений — аденозинтрифосфатов и др. Эти соединения затем расходуются на обеспечение всех процессов жизнедеятельности; часть энергии рассеивается в виде тепла. Значительная часть реакций биологического окисления осуществляется в митохондриях
Анаэробное окисление аммония, anammox — биохимический процесс окисления иона аммония нитрит-анионом в анаэробных условиях. Служит источником энергии для фиксации углекислого газа. Описан у следующих родов бактерий: Brocadia, Kuenenia, Anammoxoglobus, Jettenia, Scalindua. Все они относятся к планктомицетам.
Процесс был открыт в 1986 году. Сейчас создана новая технология очистки сточных вод от соединений азота с помощью осуществляющих анаэробное окисление аммония бактерий. В Роттердаме (Нидерланды) построена и запущена первая очистная станция на её основе. Важными достоинствами данной технологии являются уменьшение выбросов CO2 в атмосферу на 85-90% по сравнению с традиционными методами, а также относительная дешевизна.
Общее уравнение реакций анаэробного окисления аммония:
NH4+ + NO2− → N2 + 2H2O.
Анаэробное окисление метана — процесс окисления метана до углекислого газа, производимый некультивируемыми (англ. VBNC) археями групп ANME-1, ANME-2 и ANME-3, близкими к Methanosarcinales, в ассоциации с сульфатредуцирующими и денитрифицирующими бактериями при отсутствии в среде молекулярного кислорода. Биохимия и распространённость процесса в природе изучены пока недостаточно.
26. Пируват, образовавшийся в реакциях гликолиза (в цитоплазме), должен быть транспортирован в митохондрии. Транспорт осуществляется специальной «челночной» системой. В матриксе митохондрии, прикрепившись к ее внутренней мембране, находится сложный полиферментный комплекс – пируватдегидрогеназа.
Пируватдегидрогеназа состоит из 60 полипептидных цепей, которые можно разделить на 3 основных фермента: Е1 – собственно пируватдегидрогеназа (состоит из 24 субъединиц); Е2 – дигидролипоилтрансацетилаза (также 24 субъединицы); Е3 – дигидролипоилдегидрогеназа (12 субъединиц).
Последовательность реакций представлена на рис.5.12. Е1 катализирует декарбоксилирование ПВК с участием кофермента тиаминпирофосфата (ТПФ). Образовавшийся продукт реакции (гидроксиэтильное производное ТПФ) при участии Е2 реагирует с окисленной липоевой кислотой(ЛК). Липоевая кислота – низкомолекулярное азотсодержащее соединение – является коферментом Е2.
СН2 СН – (СН2)4 – СООН
Дисульфидная группа ЛК способна восстанавливаться и ацетилироваться. В реакции, катализируемой дигидролипоилтрансацетилазой (Е2 ), образуется ацетиллипоевая кислота. Далее это соединение реагирует с коэнзимом А (КоА-SH не является собственным коферментом Е2) – при этом образуется восстановленная форма ЛК (дигидролипоевая кислота) и ацетил-КоА.
Наконец, начинает функционировать Е3 , коферментом которого является ФАД: кофермент окисляет дигидролипоевую кислоту и сам при этом восстанавливается (ФАДН2) . Восстановленный флавиновый кофермент реагирует с митохондриальным НАД+, в свою очередь, восстанавливая его (НАДН ·Н+).
Таким образом, в окислительном декарбоксилировании ПВК участвует фактически три фермента, составляющих единый пируватдегидрогеназный комплекс, и 5 коферментов: ТПФ, ЛК и ФАД – собственные коферменты комплекса, КоА-SH и НАД+ – внешние, приходящие “извне”. Образующийся ацетил-КоА затем окисляется в цикле Кребса, а водород с НАДН ·Н+ поступает в дыхательную цепь митохондрий.
Механизм функционирования пируватдегидрогеназного комплекса
Пируватдегидрогеназа отличается большим отрицательным редокс-потенциалом, который способен обеспечить не только восстановление НАД+, но и способствовать образованию высокоэнергетической тиоэфирной связи в ацетил-КоА (СН3-СО
При недостаточном содержании в диете входящих в состав пируватдегидрогеназы витаминов, в первую очередь тиамина, активность фермента снижается. Это приводит к накоплению в крови и тканях пирувата и лактата и развитию метаболического ацидоза. При выраженном дефиците тиамина развивается некомпенсированный ацидоз, который без лечения приводит к летальному исходу.
^ Регуляция активности пируватдегидрогеназы
Пируватдегидрогеназный комплекс может существовать в активной и неактивной формах. Переход одной формы в другую осуществляется путем обратимого фосфорилирования с участием киназы и дефосфорилирования с участием фосфатазы. При этом фосфорилированная форма является неактивной, а дефосфорилированная – активной .
При низкой концентрации инсулина и высоком уровне энергообеспеченности клетки (↑АТФ, ↑ ацетил-КоА и ↑ НАДН·Н+) этот комплекс находится в неактивном состоянии. Активирование пируватдегидрогеназного комплекса индуцируется инсулином, КоА-SН, пируватом, АДФ и ионами магния.
28.Тканевое дыхание и биологическое окисление. Распад органических соединений в живых тканях, сопровождающийся потреблением молекулярного кислорода и приводящий к выделению углекислого газа и воды и образованию биологических видов энергии, называется тканевым дыханием. Тканевое дыхание представляют как конечный этап пути превращений моносахаров (в основном глюкозы) до указанных конечных продуктов, в который на разных стадиях включаются другие сахара и их производные, а также промежуточные продукты распада липидов (жирные кислоты), белков (аминокислоты) и нуклеиновых оснований. Итоговая реакция тканевого дыхания будет выглядеть следующим образом:
С6Н12О6 + 6O2 = 6СO2+ 6Н2O + 2780 кДж/моль. (1)
Потребление кислорода тканями зависит от интенсивности реакций тканевого дыхания. Наибольшей скоростью тканевого дыхания характеризуются почки, мозг, печень, наименьшей – кожа, мышечная ткань (в покое). Уравнение (2) описывает суммарный результат многоступенчатого процесса, приводящего к образованию молочной кислоты (см. главу 10) и протекающего без участия кислорода:
С6Н12Об = 2С3Н6О3 + 65 кДж/моль. (2)
Этот путь отражает, по-видимому, энергетическое обеспечение простейших форм жизни, функционировавших в бескислородных условиях. Современные анаэробные микроорганизмы (осуществляющие молочнокислое, спиртовое и уксуснокислое брожение) получают для жизнедеятельности энергию, производимую в процессе гликолиза или его модификаций.
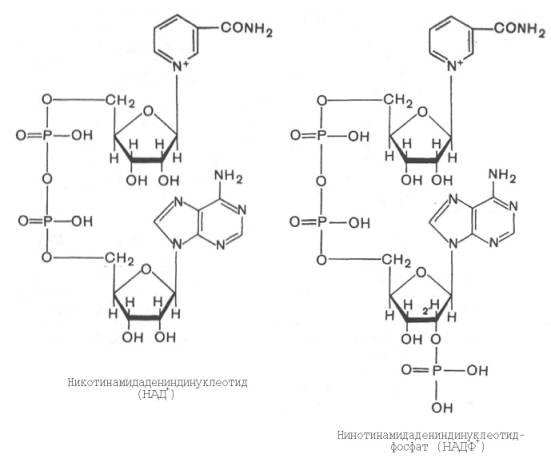
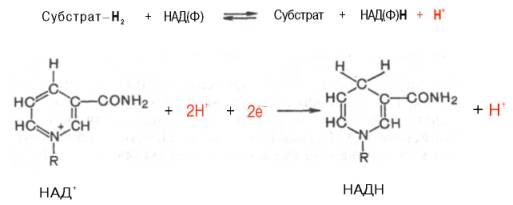
Использование клетками кислорода открывает возможности для более полного окисления субстратов. В аэробных условиях продукты бескислородного окисления становятся субстратами цикла трикарбоновых кислот (см. главу 10), в ходе которого образуются восстановленные дыхательные переносчики НАДФН, НАДН и флавиновые коферменты. Способность НАД+ и НАДФ+ играть роль промежуточного переносчика водорода связана с наличием в их структуре амида никотиновой кислоты. При взаимодействии этих кофакторов с атомами водорода имеет место обратимое гидрирование (присоединение атомов водорода):
При этом в молекулу НАД+ (НАДФ+) включаются 2 электрона и один протон, а второй протон остается в среде.
Во флавиновых коферментах (ФАД или ФМН), активной частью молекул которых является изоаллоксазиновое кольцо, в результате восстановления чаще всего наблюдается присоединение 2 протонов и 2 электронов одновременно:
Восстановленные формы этих кофакторов способны транспортировать водород и электроны к дыхательной цепи митохондрий или иных энерго-сопрягающих мембран
Распад пуриновых нуклеозидов
Образовавшиеся при гидролизе пуриновые нуклеозиды – аденозин и гуано-зин – подвергаются ферментативному распаду в организме животных вплоть до образования конечного продукта – мочевой кислоты, которая выводится с мочой из организма. У человека, приматов, большинства животных, птиц и некоторых рептилий мочевая кислота является конечным продуктом пуринового обмена. У других рептилий и некоторых млекопитающих мочевая кислота расщепляется до аллантоина и у рыб – до аллантоиновой кислоты и мочевины. Последовательность всех этих превращений, катализируемых специфическими ферментами, можно представить в виде следующей схемы:
http://allrefrs.ru/4-15097.html
http://xumuk.ru/biologhim/214.html