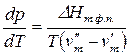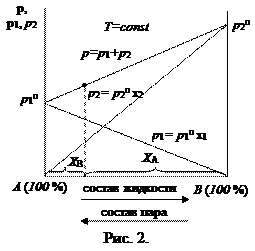Химическая кинетика. Скорость химических реакций
Темы кодификатора ЕГЭ: Скорость реакции. Ее зависимость от разных факторов.
Скорость химической реакции показывает, как быстро происходит та или иная реакция. Взаимодействие происходит при столкновении частиц в пространстве. При этом реакция происходит не при каждом столкновении, а только когда частица обладают соответствующей энергией.
Скорость реакции – количество элементарных соударений взаимодействующих частиц, заканчивающихся химическим превращением, за единицу времени.
Определение скорости химической реакции связано с условиями ее проведения. Если реакция гомогенная – т.е. продукты и реагенты находятся в одной фазе – то скорость химической реакции определяется, как изменение концентрации вещества в единицу времени:
υ = ΔC / Δt
Если реагенты, или продукты находятся в разных фазах, и столкновение частиц происходит только на границе раздела фаз, то реакция называется гетерогенной, и скорость ее определяется изменением количества вещества в единицу времени на единицу реакционной поверхности:
υ = Δν / (S·Δt)
Факторы, влияющие на скорость химической реакции
1. Температура
Самый простой способ изменить скорость реакции – изменить температуру . Как вам, должно быть, известно из курса физики, температура – это мера средней кинетической энергии движения частиц вещества. Если мы повышаем температуру, то частицы любого вещества начинают двигаться быстрее, а следовательно, сталкиваться чаще.
Однако при повышении температуры скорость химических реакций увеличивается в основном благодаря тому, что увеличивается число эффективных соударений. При повышении температуры резко увеличивается число активных частиц, которые могут преодолеть энергетический барьер реакции. Если понижаем температуру – частицы начинают двигаться медленнее, число активных частиц уменьшается, и количество эффективных соударений в секунду уменьшается. Таким образом, при повышении температуры скорость химической реакции повышается, а при понижении температуры — уменьшается .
Обратите внимание! Это правило работает одинаково для всех химических реакций (в том числе для экзотермических и эндотермических). Скорость реакции не зависит от теплового эффекта. Скорость экзотермических реакций при повышении температуры возрастает, а при понижении температуры – уменьшается. Скорость эндотермических реакций также возрастает при повышении температуры, и уменьшается при понижении температуры.
Более того, еще в XIX веке голландский физик Вант-Гофф экспериментально установил, что скорость большинства реакций примерно одинаково изменяется (примерно в 2-4 раза) при изменении температуры на 10 о С.
Правило Вант-Гоффа звучит так: повышение температуры на 10 о С приводит к увеличению скорости химической реакции в 2-4 раза (эту величину называют температурный коэффициент скорости химической реакции γ).
Точное значение температурного коэффициента определяется для каждой реакции.
здесь v2 — скорость реакции при температуре T2,
v1 — скорость реакции при температуре T1,
γ — температурный коэффициент скорости реакции, коэффициент Вант-Гоффа.
В некоторых ситуациях повысить скорость реакции с помощью температуры не всегда удается, т.к. некоторые вещества разлагаются при повышении температуры, некоторые вещества или растворители испаряются при повышенной температуре, т.е. нарушаются условия проведения процесса.
2. Концентрация
Также изменить число эффективных соударений можно, изменив концентрацию реагирующих веществ . Понятие концентрации, как правило, используется для газов и жидкостей, т.к. в газах и жидкостях частицы быстро двигаются и активно перемешиваются. Чем больше концентрация реагирующих веществ (жидкостей, газов), тем больше число эффективных соударений, и тем выше скорость химической реакции.
На основании большого числа экспериментов в 1867 году в работах норвежских ученых П. Гульденберга и П. Вааге и, независимо от них, в 1865 году русским ученым Н.И. Бекетовым был выведен основной закон химической кинетики, устанавливающий зависимость скорости химической реакции от концентрации реагирующих веществ:
Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ в степенях, равных их коэффициентам в уравнении химической реакции.
Для химической реакции вида: aA + bB = cC + dD закон действующих масс записывается так:
здесь v — скорость химической реакции,
CA и CB — концентрации веществ А и В, соответственно, моль/л
k – коэффициент пропорциональности, константа скорости реакции.
Например , для реакции образования аммиака:
закон действующих масс выглядит так:
Константа скорости реакции k показывает, с какой скоростью будут реагировать вещества, если их концентрации равны 1 моль/л, или их произведение равно 1. Константа скорости химической реакции зависит от температуры и не зависит от концентрации реагирующих веществ.
В законе действующих масс не учитываются концентрации твердых веществ, т.к. они реагируют, как правило, на поверхности, и количество реагирующих частиц на единицу поверхности при этом не меняется.
В большинстве случаев химическая реакция состоит из нескольких простых этапов, в таком случае уравнение химической реакции показывает лишь суммарное или итоговое уравнение происходящих процессов. При этом скорость химической реакции сложным образом зависит (или не зависит) от концентрации реагирующих веществ, полупродуктов или катализатора, поэтому точная форма кинетического уравнения определяется экспериментально, или на основании анализа предполагаемого механизма реакции. Как правило, скорость сложной химической реакции определяется скоростью его самого медленного этапа (лимитирующей стадии).
3. Давление
Концентрация газов напрямую зависит от давления . При повышении давления повышается концентрация газов. Математическое выражение этой зависимости (для идеального газа) — уравнение Менделеева-Клапейрона:
pV = νRT
Таким образом, если среди реагентов есть газообразное вещество, то при повышении давления скорость химической реакции увеличивается, при понижении давления — уменьшается .
Например. Как изменится скорость реакции сплавления извести с оксидом кремния:
при повышении давления?
Правильным ответом будет – никак, т.к. среди реагентов нет газов, а карбонат кальция – твердая соль, нерастворимая в воде, оксид кремния – твердое вещество. Газом будет продукт – углекислый газ. Но продукты не влияют на скорость прямой реакции.
4. Катализатор
Еще один способ увеличить скорость химической реакции – направить ее по другому пути, заменив прямое взаимодействие, например, веществ А и В серией последовательных реакций с третьим веществом К, которые требуют гораздо меньших затрат энергии (имеют более низкий активационный энергетический барьер) и протекают при данных условиях быстрее, чем прямая реакция. Это третье вещество называют катализатором .
Катализаторы – это химические вещества, участвующие в химической реакции, изменяющие ее скорость и направление, но не расходующиеся в ходе реакции (по окончании реакции не изменяющиеся ни по количеству, ни по составу). Примерный механизм работы катализатора для реакции вида А + В можно представить так:
A + K = AK
AK + B = AB + K
Процесс изменения скорости реакции при взаимодействии с катализатором называют катализом. Катализаторы широко применяют в промышленности, когда необходимо увеличить скорость реакции, либо направить ее по определенному пути.
По фазовому состоянию катализатора различают гомогенный и гетерогенный катализ.
Гомогенный катализ – это когда реагирующие вещества и катализатор находятся в одной фазе (газ, раствор). Типичные гомогенные катализаторы – кислоты и основания. органические амины и др.
Гетерогенный катализ – это когда реагирующие вещества и катализатор находятся в разных фазах. Как правило, гетерогенные катализаторы – твердые вещества. Т.к. взаимодействие в таких катализаторах идет только на поверхности вещества, важным требованием для катализаторов является большая площадь поверхности. Гетерогенные катализаторы отличает высокая пористость, которая увеличивает площадь поверхности катализатора. Так, суммарная площадь поверхности некоторых катализаторов иногда достигает 500 квадратных метров на 1 г катализатора. Большая площадь и пористость обеспечивают эффективное взаимодействие с реагентами. К гетерогенным катализаторам относятся металлы, цеолиты — кристаллические минералы группы алюмосиликатов (соединений кремния и алюминия), и другие.
Пример гетерогенного катализа – синтез аммиака:
В качестве катализатора используется пористое железо с примесями Al2O3 и K2O.
Сам катализатор не расходуется в ходе химической реакции, но на поверхности катализатора накапливаются другие вещества, связывающие активные центры катализатора и блокирующие его работу (каталитические яды). Их необходимо регулярно удалять, путем регенерации катализатора.
В биохимических реакция очень эффективными оказываются катализаторы – ферменты. Ферментативные катализаторы действуют эффективно и избирательно, с избирательностью 100%. К сожалению, ферменты очень чувствительны к повышению температуры, кислотности среды и другим факторам, поэтому есть ряд ограничений для реализации в промышленных масштабах процессов с ферментативным катализом.
Катализаторы не стоит путать с инициаторами процесса и ингибиторами.
Например , для инициирования радикальной реакции хлорирования метана необходимо облучение ультрафиолетом. Это не катализатор. Некоторые радикальные реакции инициируются пероксидными радикалами. Это также не катализаторы.
Ингибиторы – это вещества, которые замедляют химическую реакцию. Ингибиторы могут расходоваться и участвовать в химической реакции. При этом ингибиторы не являются катализаторами наоборот. Обратный катализ в принципе невозможен – реакция в любом случае будет пытаться идти по наиболее быстрому пути.
5. Площадь соприкосновения реагирующих веществ
Для гетерогенных реакций одним из способов увеличить число эффективных соударений является увеличение площади реакционной поверхности . Чем больше площадь поверхности контакта реагирующих фаз, тем больше скорость гетерогенной химической реакции. Порошковый цинк гораздо быстрее растворяется в кислоте, чем гранулированный цинк такой же массы.
В промышленности для увеличения площади контактирующей поверхности реагирующих веществ используют метод «кипящего слоя».
Например , при производстве серной кислоты методом «кипящего слоя» производят обжиг колчедана.
6. Природа реагирующих веществ
На скорость химических реакций при прочих равных условиях также оказывают влияние химические свойства, т.е. природа реагирующих веществ.
Менее активные вещества будут имеют более высокий активационный барьер, и вступают в реакции медленнее, чем более активные вещества.
Более активные вещества имеют более низкую энергию активации, и значительно легче и чаще вступают в химические реакции.
Более стабильные вещества — это, например, те вещества, которые окружают нас в быту, либо существуют в природе.
Например , хлорид натрия NaCl (поваренная соль), или воды H2O, или металлическое железо Fe.
Более активные вещества мы можем встретить в быту и природе сравнительно редко.
Например , оксид натрия Na2O или сам натрий Na в быту и в природе не не встречаем, т.к. они активно реагируют с водой.
При небольших значениях энергии активации (менее 40 кДж/моль) реакция проходит очень быстро и легко. Значительная часть столкновений между частицами заканчивается химическим превращением. Например, реакции ионного обмена происходят при обычных условиях очень быстро.
При высоких значениях энергии активации (более 120 кДж/моль) лишь незначительное число столкновений заканчивается химическим превращением. Скорость таких реакций пренебрежимо мала. Например, азот с кислородом практически не взаимодействует при нормальных условиях.
При средних значениях энергии активации (от 40 до 120 кДж/моль) скорость реакции будет средней. Такие реакции также идут при обычных условиях, но не очень быстро, так, что их можно наблюдать невооруженным глазом. К таким реакциям относятся взаимодействие натрия с водой, взаимодействие железа с соляной кислотой и др.
Вещества, стабильные при нормальных условиях, как правило, имеют высокие значения энергии активации.
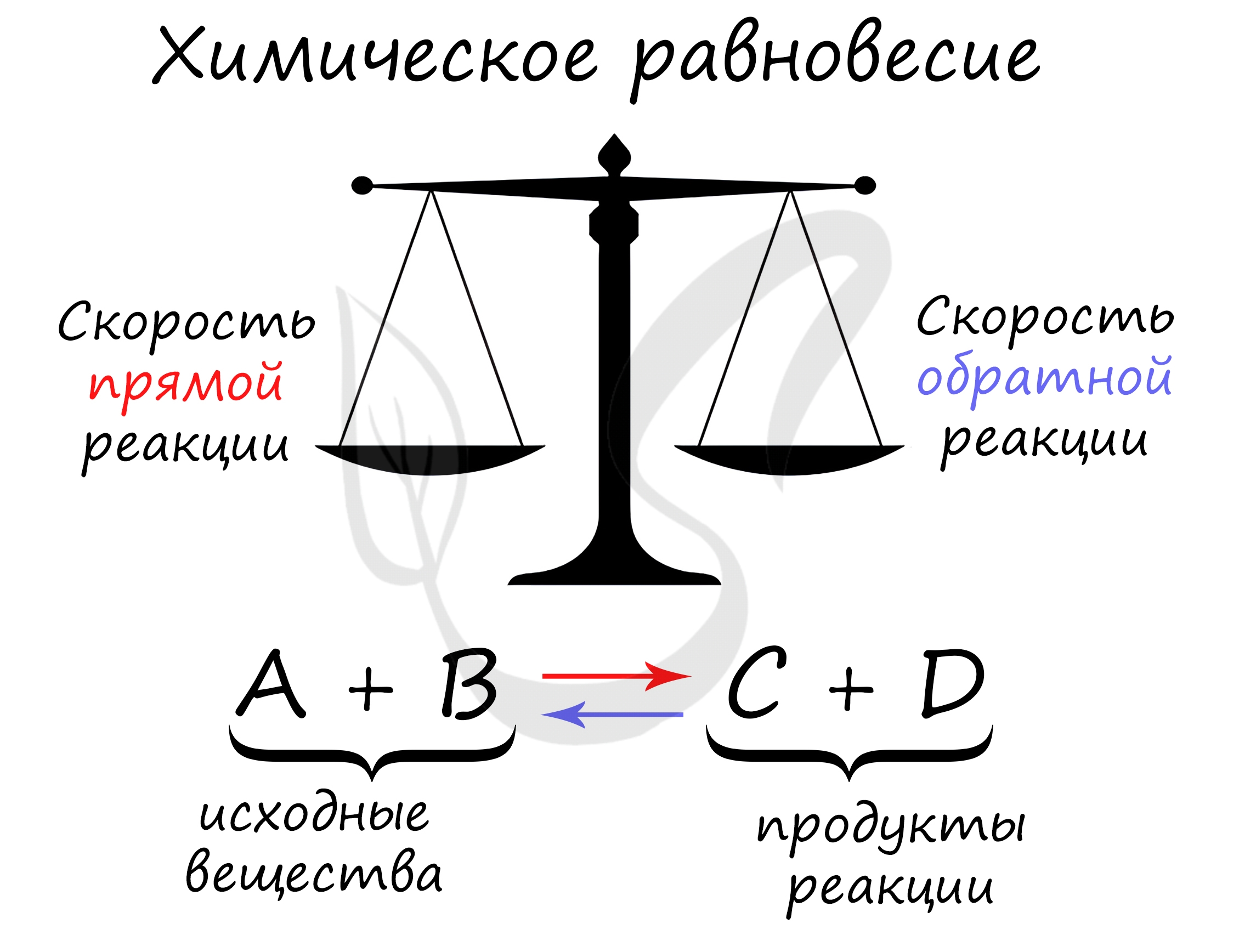
Химическое равновесие
Химическое равновесие — состояние химической системы, при котором скорость прямой реакции равна скорости обратной.
В большом количестве заданий, которые мне довелось увидеть, я ни один раз видел, как коверкают это определение. Например, в заданиях верно-неверно предлагают похожий вариант, однако говорят о «равенстве концентраций исходных веществ и продуктов» — это грубая ошибка. Химическое равновесие — равенство скоростей.
Принцип Ле Шателье
В 1884 году французским химиком Анри Ле Шателье был предложен принцип, согласно которому, если на систему, находящуюся в состоянии равновесия, оказать внешнее воздействие (изменить температуру, давление, концентрацию), то система будет стремиться компенсировать внешнее воздействие.
Это принцип обоснован термодинамически и доказан. Однако в такой абстрактной формулировке его сложно применить для решения конкретных задач по химическому равновесию. В этой статье я покажу конкретные примеры и обозначу алгоритм действия, чтобы вы могли успешно справляться с заданиями.
Влияние изменения концентрации на химическое равновесие
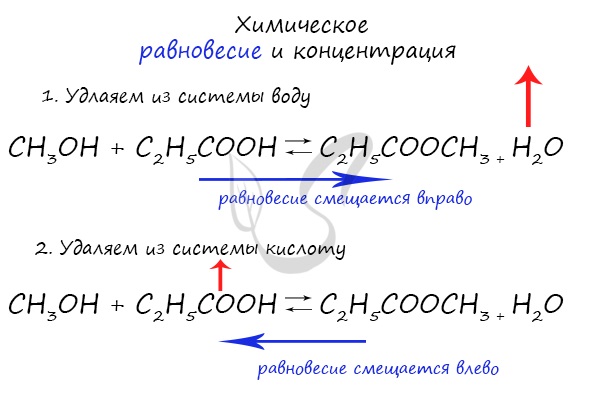
При увеличении концентрации какого-либо компонента химической реакции, система будет стремиться восстановить равновесие: равновесие будет смещаться в сторону расходования добавленного компонента.
Объясню проще: если вы увеличиваете концентрацию вещества, которое находится в левой части, равновесие сместится в правую сторону. Если добавляете вещество из левой части (продуктов реакции) — смещается в сторону исходных веществ. Посмотрите на пример ниже.
Если мы попытаемся удалить какое-либо вещество из системы (уменьшить его концентрацию), то система будет стремиться заполнить «пустое» место, которые мы создали. Наглядно демонстрирую на примере:
Можно подвести итог полученным знаниям таким образом: «Куда добавляем — оттуда смещается, откуда берем — туда смещается». Воспользуйтесь этой или придумайте свое правило для запоминания этой закономерности 😉
Изменения давления и химическое равновесие
Если речь в задании идет об изменении давления, то первое, что нужно сделать, это посчитать количество газов в уравнении слева и справа. Твердые вещества и жидкости считать не нужно. Например:
В приведенном уравнении количество молекул газа в левой части — 1, в правой — 2.
Запомните правило: «При увеличении давления равновесие смещается в сторону меньших газов, при уменьшении давления — в сторону больших газов». Для нашей системы правило действует таким образом:
В случае, если слева и справа количество молекул газа одинаково, например, в реакции:
Слева — 2 газа, и справа — 2. В такой реакции увеличение или уменьшение давления не повлияет на химическое равновесие.
Изменение температуры и химическое равновесие
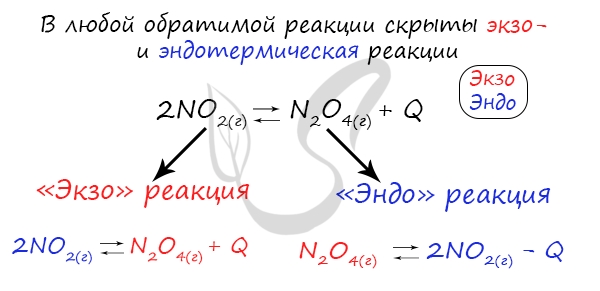
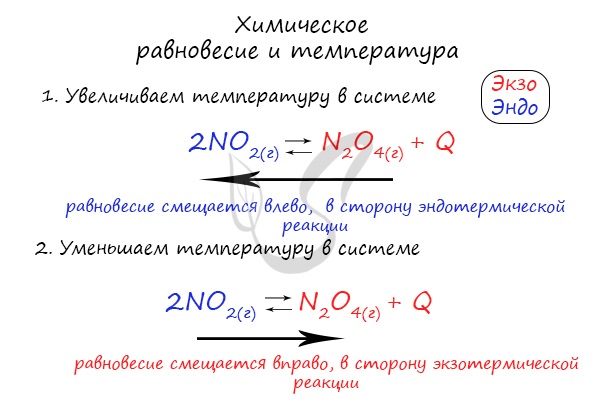
Если в задании увеличивают или уменьшают температуру, то первое, что вы должны оценить: экзотермическая это реакция или эндотермическая.
Следуйте следующему правилу: «При увеличении температуры равновесие смещается в сторону эндотермической реакции, при уменьшении — в сторону экзотермической реакции». У любой обратимой реакции есть экзо- и эндотермические части:
Поэтому данное правило универсально и применимо для всех реакций. Для примера разберем следующие задачи:
Чтобы не осталось белых пятен, возьмем экзотермическую реакцию и повторим с ней подобный эксперимент.
Катализатор и ингибитор
Действие катализатора и ингибитора соответственно касается только ускорения и замедления химической реакции. Они никоим образом не влияют на равновесие.
Константа равновесия
Константой равновесия называют отношения скоростей прямой и обратной реакции. Для реакции типа aA + bB = cC + dD константа равновесия будет записана следующим образом:
Решим задачу. Дана реакция: 2NO + Cl2 ⇄ 2NOCl . Вычислите константу равновесия, если равновесные концентрации веществ для данной реакции: c(NO) = 1.8 моль/л , c(Cl2) = 1.2 моль/л , c(NOCl) = 0.8 моль/л.
Константу равновесия для данной задачи можно представить в виде 1.64 * 10 -1 .
© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
ВЛИЯНИЕ ДАВЛЕНИЯ НА КОНСТАНТУ ХИМИЧЕСКОГО
РАВНОВЕСИЯ (УРАВНЕНИЕ ПЛАНКА)
Для установления влияние давления на реакции, протекающие с участием газообразных веществ, воспользуемся константой равновесия, выраженной через равновесные мольные доли, Kх= f(T, p).
Выражение (9), записанное в виде 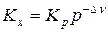
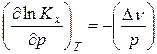
Считая газы, участвующие в реакции, идеальными, можно из уравнения Менделеева-Клапейрона выразить изменение числа моль газообразных веществ в реакции 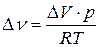
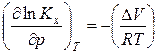
Уравнения (18) и (19) описывают влияние давления на химическое равновесие в идеальной газовой реакции и называют уравнением Планка. Проведем анализ данного уравнения:
1) если реакция протекает с увеличением объема (количества вещества), то при повышении давления 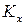
А + B = 3C с ростом давления равновесие смещается в сторону исходных веществ;
2) если реакция протекает с уменьшением объема (количества вещества), то при повышении давления 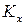
3) если реакция протекает без изменения объема (количества вещества), то при повышении давления 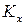
А + B = 2C с ростом давления равновесие не изменяется.
Влияние давления на химическое равновесие в растворе незначительно, так как объем раствора практически не изменяется.
3. растворы и гетерогенные равновесия
3.1. Основные понятия и определения
Термодинамическую систему однородную по физическому строению и химическим свойствам во всех точках, называют гомогенной.
Термодинамическую систему, состоящую из различных по физическим или химическим свойствам частей, отделенных друг от друга поверхностями раздела, называют гетерогенной.
Любая гетерогенная система состоит из нескольких фаз. Фаза – это гомогенная часть гетерогенной системы, ограниченная поверхностью раздела, при переходе через которую свойства системы меняются скачкообразно. Системы делятся на одно–, двух–, трехфазные и т.д.
Каждая система состоит из одного или нескольких веществ, называемых компонентами. Вещества, образующие термодинамическую систему, могут находиться в различных агрегатных состояниях: газообразном, жидком, твердом. Числом независимых компонентов называют наименьшее число индивидуальных компонентов, необходимое для образования данной системы, которое равно общему числу индивидуальных веществ, входящих в данную систему, за вычетом числа уравнений, связывающих равновесные концентрации этих веществ. По числу компонентов различают одно–, двух–, трех– и т.д. компонентные системы.
Любая система характеризуется внешними ( 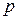
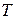
Число концентрационных параметров данной фазы равно числу независимых компонентов, входящих в ее состав фазы, за вычетом единицы (так как, например, если система состоит их двух компонентов, то концентрацию второго компонента можно определить, зная концентрацию первого).
Число независимых термодинамических параметров состояния данной системы, произвольное изменение которых в определенных пределах не вызывает исчезновения одних и образование других фаз называют числом термодинамических степеней свободы или вариантностью системы. По числу термодинамических степеней свободы системы разделяются на инвариантные ( 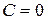
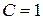
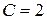
3.2. Термодинамика растворов
3.2.1. ОСНОВНЫЕ ПОНЯТИЯ
Раствором называют гомогенную однофазную систему, состоящую минимум из двух независимых компонентов, в каждом элементарном объеме которого одинаковые физические, химические и термодинамические свойства. В жидких растворах обычно различают растворитель – это вещество, которое имеется в растворе в избытке, и растворенные вещества, хотя все компоненты раствора термодинамически равноценны. Компоненты, находящиеся в растворе в меньшем количестве называют растворенными веществами.
Растворы подразделяют на идеальные и реальные. Идеальным называют раствор, все компоненты которого характеризуются одинаковой формой и размером молекул и одинаковой энергией межмолекулярных взаимодействий. Идеальные растворы встречаются довольно редко. Это гомогенные смеси близких по физико-химическим свойствам веществ (смеси оптических изомеров, соседних членов одного и того же гомологического ряда). Моделью идеального газового раствора является смесь идеальных газов.
Большинство растворов являются реальными, их компоненты отличаются либо по форме, либо по размерам, либо по энергии межмолекулярных взаимодействий.
Все свойства растворов подразделяют на экстенсивные и интенсивные.
Экстенсивные свойства, зависят как от общей массы раствора, так и от его состава, например 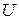
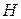
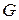
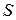
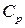
Интенсивные свойства, зависят только от состава раствора и не зависят от его общей массы, например, давление насыщенного пара.
Для характеристики растворов используют средние мольные и парциальные мольные свойства.
Среднее мольное свойство – экстенсивное свойство 1 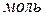
Парциальное мольное свойство 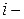
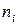
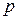
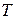
Среди парциальных молярных величин наибольшее значение имеет парциальная мольная энергия Гиббса, которая называется химическим потенциалом 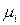
Химический потенциал является интенсивным свойством раствора.
3.2.2. УСЛОВИЕ РАВНОВЕСИЯ В ГОМОГЕННЫХ РАСТВОРАХ
Равновесие в гомогенном идеальном растворе выражает уравнение Гиббса–Дюгема:

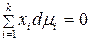
которое для двухкомпонентного раствора записывается в виде
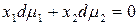
Равновесие в гомогенном реальном растворе выражает уравнение Дюгема–Маргулеса:

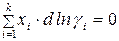
Для двухкомпонентного раствора условие равновесия записывается:
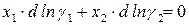
3.3. гетерогенные равновесия
3.3.1. равновесие в гетерогенной системе. Правило фаз гиббса
Условием термодинамического равновесия в гетерогенной системе является равенство химических потенциалов каждого компонента во всех фазах при 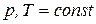

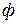
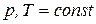
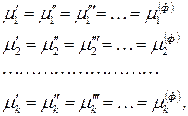
где индекс 1, 2,…, 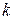
¢,²,¢¢¢,…, 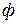

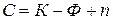
где 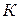
n – число внешних параметров, влияющих на состояние равновесия.
Если на систему влияют два внешних параметра ( 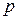
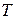
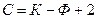
Применим правило фаз Гиббса к анализу диаграммы состояния однокомпонентной системы, например, воды. В области средних давлений и средних температур вода может находиться в жидком, твердом (лед) и газообразном (пар) состояниях.

плоскость ОВС отвечает состоянию воды;
АОС – состоянию пара;
АОВ – состоянию льда;
О – тройная точка;
ОВ – кривая плавления;
ОС – кривая испарения;
ОА – кривая возгонки;
ОD – кривая давления насыщенного пара над переохлажденной водой.
Определим число степеней свободы в точках 1, 2 и тройной точке О.
В точке 1 вода находится в жидком состоянии, следовательно, число фаз 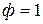
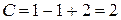
Число степеней свободы равно двум или система дивариантна. Это означает, что можно произвольно в определенных пределах изменять два параметра: давление и температуру, при этом число и вид фаз системы не изменится.
Точка 2 находится на кривой испарения, следовательно, в равновесии находятся две фазы: жидкость и пар. Тогда
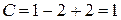
Система моновариантна, следовательно, возможно изменение одного параметра: температуры или давления, при котором число и вид фаз системы не изменится.
В тройной точке О в равновесии находятся три фазы: вода, лед и пар, тогда
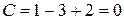
Система нонвариантна. Это означает, что три фазы могут находиться в равновесии только при определенных условиях.
3.3.2. Уравнение состояния однокомпонентной двухфазной системы
Состояние однокомпонентной двухфазной системы характеризуется уравнением Клаузиуса–Клапейрона:
где 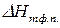
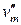
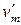
Для процесса возгонки и испарения можно допустить, что 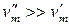
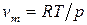

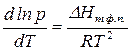
Разделив переменные и проинтегрировав в определенных пределах в узком интервале температур, считая 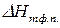
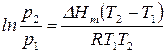
На основе полученного уравнения можно рассчитать:
1) температуру кипения вещества 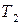
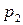
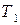
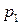
2) давление насыщенного пара индивидуального вещества 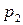
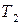
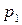
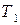
3) среднюю мольную теплоту испарения или возгонки вещества, если известны значения давления насыщенного пара вещества при двух температурах.
3.3.3. фазовое равновесие жидкость-пар
Пусть существуют в состоянии равновесия жидкость и выделяющийся из нее пар. Если жидкий раствор является идеальным, то во всем интервале концентраций растворитель и растворенное вещество подчиняются закону Рауля:

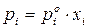
где 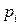
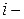
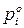
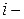
Для двухкомпонентного раствора можно записать:
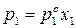
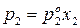
Так как 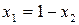
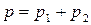
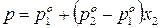
Таким образом, зависимость давления насыщенного пара компонентов и общего давления пара от состава идеального раствора является линейной (диаграмма 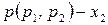
На практике чаще приходится встречаться с неидеальными растворами, которые не подчиняются закону Рауля. Для описания зависимости давления насыщенного пара компонента от состава реального раствора в закон Рауля вводится коэффициент активности:
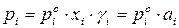
Для двухкомпонентного раствора общее давление смеси равно:
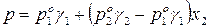
Поскольку коэффициенты активности 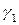
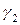
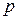
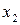
зависят от относительной величины энергии взаимодействия молекул жидкой смеси.

Точки на диаграммах 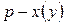
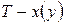
Как видно из рис. 4, в точке азеотропа состав жидкой и паровой фаз одинаков. Бинарные смеси, которые содержат азеотроп, называют азеотропными.
Состав равновесного с жидким раствором пара определяется согласно закону Дальтона:

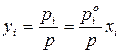

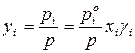
Из анализа последних уравнений видно, что рассчитать равновесный состав пара можно только для идеального раствора заданного состава. Для расчета равновесного состава паровой фазы реального раствора необходимо знать коэффициенты активности, численные значения которых определяют только экспериментальным путем.
Для представления данных по фазовому равновесию жидкость-пар кроме рассмотренных диаграмм применяют также диаграммы 
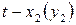
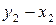
Для разделения жидких бинарных смесей используют методы перегонки и ректификации (многократной перегонки), которые основаны на различие составов жидкой и паровой фаз. Азеотропные смеси этими методами разделить невозможно. Для разделения азеотропных смесей необходимо создать условия, устраняющие азеотроп. Например, изменить значения внешних параметров ( 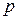
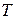
Эбуллиоскопия
Эбуллиоскопия – явление повышения температуры кипения раствора нелетучего вещества по сравнению с температурой кипения чистого растворителя.
Основной закон эбуллиоскопии записывается:

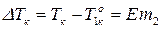
где 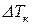
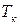
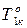

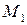
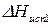
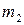
3.3.4. Фазовое равновесие твердое тело-жидкость. Уравнение шредера
Предположим, что в состоянии термодинамического равновесия существуют раствор твердого вещества в жидком растворителе и кристаллы данного твердого вещества. Равновесие в такой системе описывается уравнением Шредера:
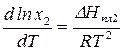
где 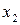
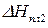
После интегрирования получаем:
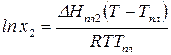
где 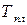
Полученное уравнение справедливо для растворов, близких по свойствам к идеальным, поэтому уравнение Шредера позволяет рассчитывать растворимость только малорастворимых веществ.
Криоскопия
Криоскопия – явление понижения температуры замерзания раствора нелетучего вещества по сравнению с температурой замерзания чистого растворителя.
Основной закон криоскопии записывается:

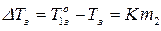
где 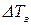
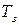
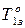
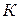
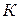

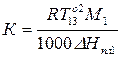
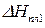
Методы криоскопии и эбуллиоскопии часто применяют для расчета молекулярной массы растворенного вещества.
3.3.5. фазовое равновесие жидкость-жидкость
Пусть в сосуде находятся две жидкости, практически не смешивающиеся друг с другом, например, вода и хлороформ. Если ввести в эту систему небольшое количество третьего вещества, например йода, то оно вполне определенным образом распределится между двумя жидкими фазами. В соответствии с законом распределения Нернста: при установлении равновесия отношение концентраций распределяющегося вещества в двух несмешивающихся жидкостях есть величина постоянная при постоянной температуре:

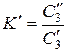
где 
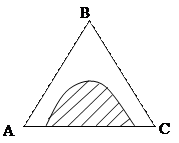
Состояние трехкомпонентных систем с ограниченной растворимостью принято изображать с помощью треугольных диаграмм. На рисунке приведена диаграмма растворимости в трехкомпонентной системе с одной парой ограниченно смешивающихся компонентов 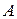
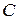
4. химическая кинетика
Химическая кинетика – наука о скорости протекания химической реакции.
Скорость химической реакции – изменение концентрации одного из реагирующих веществ в единицу времени.
Поскольку в реакциях вещества участвуют в стехиометрических соотношениях, за скорость реакции может быть принята производная от концентрации любого из реагирующих веществ по времени:

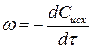
где 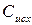
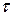
Концентрация исходных веществ убывает, поэтому перед производной стоит знак минус.


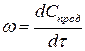
Скорость реакции в момент времени 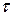
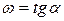
4.1. основной закон химической кинетики.
http://studarium.ru/article/156
http://helpiks.org/8-97511.html