Химические свойства воды. 8-й класс
Разделы: Химия
Класс: 8
Цель: продолжить формирование представлений о воде как о химическом веществе.
Оборудование и реактивы. Штатив с пробирками, химический стакан, шпатель; фильтровальная бумага, универсальная индикаторная бумага; прибор для опытов с электрическим током; натрий, вода, цинк, медь, оксид бария, оксид меди (II), уголь.
Наглядность. Видеофильм “Химические свойства воды” [1], плакаты “Химические свойства воды”, “Изменение окраски индикаторов в различных средах”, “Ряд активности металлов”.
Это пятый урок в теме “Растворы. Вода”.
Тип урока – комбинированный.
Технология уровневой дифференциации (Приложение 1).
Ход урока
I. Организационный момент. Проверка готовности
План урока (на доске):
- Проверка домашнего задания;
- “0” – срез знаний (Приложение 2);
- Химические свойства воды;
- Д/з – §29 с.84-87 [2];
– выучить новые определения;
– изготовить карточку “Светофор”;
– в рабочей тетради №117 (а,г,д,ж,з) [3]; №118 [3]; в сборнике задач №4.40 [4] – по уровням сложности.
II. Проверка знаний по изученной теме
УЧИТЕЛЬ – На прошлом уроке мы познакомились со способами получения воды. В чем заключается очистка питьевой воды? (№3 с 87 [2])
УЧАЩИЙСЯ 1 – Очистка воды состоит из нескольких этапов. Первый – отстаивание (в промышленных масштабах проводят в бассейнах).
УЧАЩИЙСЯ 2 – Далее в промышленных масштабах следует фильтрация через слой песка для удаления механических примесей.
УЧАЩИЙСЯ 3 – Затем проводят обеззараживание хлором, озоном или ультрафиолетом, чтобы избавиться от болезнетворных микроорганизмов.
УЧАЩИЙСЯ 4 – От растворимых примесей избавляются с помощью перегонки (для получения питьевой воды).
УЧИТЕЛЬ – Молодцы. А теперь проведем самостоятельную работу по изученному ранее материалу. Время на ее выполнение – 5 минут. Удачи.
Через 5 минут учащиеся меняются тетрадями с соседом по парте и проводят взаимопроверку по готовым ответам ( карта взаимопроверки) (Приложение 2).
Затем при необходимости осуществляется коррекция знаний у доски.
III. Изучение нового материала
УЧИТЕЛЬ – Тема сегодняшнего урока “Химические свойства воды”. Что такое химические свойства?
УЧАЩИЙСЯ – Это химические реакции, в которые вступает вещество.
УЧИТЕЛЬ – Каковы признаки химической реакции?
УЧАЩИЙСЯ – Образование нового вещества.
УЧИТЕЛЬ – Образование новых веществ помогают обнаружить индикаторы. Это вещества, изменяющие свой цвет в различных средах. На плакате показано изменение окраски универсального индикатора. В нейтральной среде он имеет желто-зеленый цвет (учитель опускает бумагу в стакан с водой), в кислой – красный, а в щелочной или основной – синий. Посмотрите следующий опыт – в стакан с водой и индикаторной бумагой учитель помещает кусочек натрия.
УЧИТЕЛЬ – Что вы наблюдаете?
УЧАЩИЙСЯ – Выделение тепла в виде огня, движение кусочка натрия по поверхности воды и появление синего окрашивания индикаторной бумаги.
УЧИТЕЛЬ – Все эти явления свидетельствуют о протекании химической реакции между натрием и водой, которую можно записать следующим образом:
УЧИТЕЛЬ – К какому типу относится эта реакция?
УЧИТЕЛЬ – Что еще надо добавить в это уравнение, чтобы указать на выделение энергии в ходе этой реакции?
УЧАЩИЙСЯ – Символ Q.
УЧИТЕЛЬ – Как называется реакция, протекающая с выделением тепла?
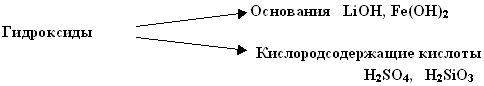
УЧИТЕЛЬ – Допишите в это уравнение нужный тепловой эффект. Т.к. индикатор окрасился в темно-синий цвет, то в результате реакции образовалось новое вещество – основание или гидроксид. Что такое “оксид” вы уже знаете, “гидроксид” содержит в своем названии еще один корень “гидр”, т.е. “водород”. Таким образом, это понятие можно расшифровать так: “Гидроксиды – это вещества, содержащие в своем составе группу ОН”. Другое название этого класса веществ “основания”, к нему мы вернемся чуть позже. Чтобы представленная схема была уравнением реакции, надо расставить коэффициенты. Попробуйте это сделать.
На доске учитель записывает слова “индикатор”, “гидроксид”, “основание”.
После проверки этого задания учитель объясняет, как правильно и быстро расставить коэффициенты в этом уравнении, обращая внимание учащихся на более удобную для данного случая запись формулы воды (НОН).
УЧИТЕЛЬ – А теперь посмотрите следующий опыт. В пробирку с водой и индикаторной бумагой помещаем кусок другого металла – цинка. Наблюдаются ли какие-то видимые изменения?
УЧИТЕЛЬ – О чем может свидетельствовать этот факт?
УЧАЩИЙСЯ – О том, что не образуются новые вещества.
УЧИТЕЛЬ – Почему же некоторые металлы реагируют с водой очень бурно, а другие в тех же условиях остаются неизменными?
УЧАЩИЙСЯ – Может быть, они обладают разной способностью к этой реакции?
УЧИТЕЛЬ – Т.е. разной активностью. Посмотрите на ряд активности металлов. Оказывается все металлы можно разделить на 3 группы по этому признаку. Первая включает в себя очень активные металлы, такие, как натрий. Это металлы IA,IIA групп и алюминий. Вторая – металлы средней активности, например, цинк, железо. Третья группа содержит металлы неактивные, такие, как серебро, золото, медь. Металлы каждой из этих групп по-разному реагируют с водой. Активные – при комнатной температуре с выделением большого количества тепла, средние – при нагревании с образованием оксидов и водорода. Металлы же третьей группы не реагируют с водой даже при нагревании. Теперь попробуйте записать уравнение реакции взаимодействия цинка и воды.
У доски один из учащихся записывает схему реакции:
УЧИТЕЛЬ – Если эта реакция идет при нагревании, то, как записать ее в виде термохимического уравнения?
УЧАЩИЙСЯ – Надо добавить “-Q”.
УЧИТЕЛЬ – К какому типу относится эта реакция?
УЧАЩИЙСЯ – Эндотермическая, замещения.
УЧИТЕЛЬ – Надо ли ее уравнивать?
УЧАЩИЙСЯ – Нет, все уравнено.
УЧИТЕЛЬ – Теперь посмотрите, как проводят реакцию взаимодействия с водой железа (фрагмент видеофильма). Запишите уравнение этой реакции, указав тепловой эффект:
Если же требуется составить уравнение реакции воды с неактивным металлом, то пишут так:
Кроме металлов в реакции с водой вступают некоторые неметаллы. Например, углерод:
Поместим кусочек угля в воду. Что вы наблюдаете?
УЧАЩИЙСЯ – Нет никаких изменений, нет реакции.
УЧИТЕЛЬ – При каких же условиях возможна эта реакция?
УЧАЩИЙСЯ – При нагревании, значит, надо добавить “-Q” в уравнение.
УЧИТЕЛЬ – Кроме простых веществ в реакции с водой вступают сложные вещества. Вы уже знаете о существовании оксидов. Именно они и взаимодействуют с водой. Теперь пришло время сказать, что свойства оксидов металлов и неметаллов принципиально отличаются друг от друга, поэтому выделяют оксиды металлов (основные) и оксиды неметаллов (кислотные). Давайте посмотрим, как идет реакция между оксидом активного металла, например, оксидом бария, и водой, поместив в пробирку индикаторную бумагу.
УЧИТЕЛЬ – Какие изменения свидетельствуют о прохождении реакции?
УЧАЩИЙСЯ – Изменение окраски индикатора.
УЧИТЕЛЬ – Какое вещество образовалось в ходе реакции?
УЧАЩИЙСЯ – Основание, т.к. цвет индикатора синий.
УЧИТЕЛЬ – Запишите уравнение данной реакции:
Обратите внимание на то, что индекс “2” относится ко всей группе “ОН”, поэтому ее пришлось взять в скобки. Валентность этой группы I. Ее надо учитывать при составлении формул гидроксидов или оснований. Как вы думаете, почему название этой группы оксидов “основные”?
УЧАЩИЙСЯ – они образуют основания.
УЧИТЕЛЬ – Подробнее с основаниями и оксидами мы познакомимся в следующих темах, а сейчас посмотрите, как проходит взаимодействие с водой кислотного оксида (фрагмент видеофильма). Запишите уравнение реакции оксида углерода (IV) с водой:
Если оксид кислотный, то чем будет являться полученное в результате реакции вещество?
УЧИТЕЛЬ – А каким будет цвет индикаторной бумаги в этом растворе?
УЧИТЕЛЬ объясняет, как вывести формулу полученной кислоты и записывает на доске в колонку новых понятий слова “основный оксид”, “кислотный оксид”, “кислота”.
УЧИТЕЛЬ – Кислотам можно дать следующее определение: “Кислоты – это сложные вещества, состоящие из атомов водорода и кислотного остатка”. Более подробно с классификацией и свойствами кислот мы познакомимся в следующей теме. Еще одно свойство воды мы рассмотрим в следующем опыте.
УЧИТЕЛЬ включает прибор для опытов с электрическим током.
УЧИТЕЛЬ – Сейчас я пропускаю электрический ток через воду. Что вы наблюдаете?
УЧАЩИЙСЯ – Выделение пузырьков в стакане с водой.
УЧИТЕЛЬ – А что означают эти пузырьки?
УЧАЩИЙСЯ – Выделяется какой-то газ.
УЧИТЕЛЬ – Какой же газ выделяется при разложении воды? Напишите уравнение этой реакции:
УЧАЩИЙСЯ – В этой реакции выделяются два газа – водород и кислород.
УЧИТЕЛЬ – Расставьте коэффициенты и не забудьте указать тепловой эффект этой реакции.
Далее идет проверка этого задания у доски.
УЧИТЕЛЬ – На этом знакомство с химическими свойствами мы заканчиваем, но этими реакциями они не исчерпываются. Вода, действительно, уникальное вещество, но узнать подробнее о ее взаимодействии с другими веществами вы сможете в 11 классе (плакат “Химические свойства воды”). Кому интересно, расширить свои познания о воде, может прийти и сделать это на консультации или обратившись к справочной литературе, в том числе и Интернету.
IV. Обобщение нового материала
УЧИТЕЛЬ – А сейчас давайте сделаем вывод о том, в какие реакции вступает вода?
УЧАЩИЙСЯ – С металлами высокой и средней активности; с некоторыми неметаллами; с некоторыми основными и кислотными оксидами.
УЧИТЕЛЬ – Укажите типы для всех реакций, которые мы написали. При каких условиях они протекают?
Далее следует проверка типов реакций №№ 4-8.
УЧИТЕЛЬ – Попробуем вспомнить новые понятия, с которыми мы познакомились на этом уроке.
Проходит проговаривание всех новых определений, которые выписаны на доске (индикатор, гидроксид, основание, основный оксид, кислотный оксид, кислота).
V. Закрепление нового материала
УЧИТЕЛЬ – А теперь потренируемся в составлении и узнавании реакций с участием воды. На доске представлены две группы карточек с левой и правой частями уравнений реакций. Ваша задача добавить необходимую правую часть уравнения к левой. Обратите внимание на то, что в левой части больше карточек, чем в правой.
Ученики по очереди выходят к доске и составляют уравнения реакций из карточек:
Левая часть Правая часть Ва + 2НОН
ВаО + НОН
Na2O + HOH
Ag + HOH
SO2 + HOH
SO3 + HOH
CuO + HOH
2K + 2HOH→
→
→
→
→
→
→
→Ва(ОН)2 + Н2
Ва(ОН)2
2NaOH2KOH + H2
При необходимости идет взаимокоррекция знаний. Учитель только контролирует этот процесс.
Те ученики, что работают быстрее (другой уровень), приступают к выполнению заданий из карточек: “Вставить пропущенные формулы веществ, необходимых в реакции”:
Задание третьего уровня сложности предполагает решение задачи типа:
“Определите количество и массу воды, необходимые для получения 400 г гидроксида натрия из его оксида”.
VI. Подведение итогов
УЧИТЕЛЬ напоминает о цели урока и просит поднять руки тех, кто считает, что она не достигнута. На основании имеющихся или отсутствующих у учеников вопросов делается вывод о достижении цели и понимании изученного на этом уроке материала. Выставляются рейтинговые оценки по итогам “0”-среза и работе на уроке (оценка за “0”-срез может быть улучшена правильными полными ответами на уроке).
VII. Домашнее задание
1) Прочитать до конца §29 с.84-87 [2].
2) Выучить определения по новой теме.
3) Изготовить карточку “Светофор” с указанием активных, малоактивных и неактивных металлов в соответствующих цветовых частях.
4) В рабочей тетради №117 (а, г, д, ж, з) [3]; №118 [3]; в сборнике задач №4.40 [4] – по уровням сложности.
Урок химии. Химические свойства воды.
Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
8 класс. Урок № 35.
Тема. Химические свойства воды.
Цель урока: изучить с обучающимися химические свойства воды. Научить записывать уравнения реакций воды с активными металлами, оксидами металлов и неметаллов.
Планируемые результаты обучения
1) личностные. Ф ормировать ответственное отношение к обучению, готовность и способность к саморазвитию и самообразованию на основе мотивации к обучению и познанию.
2) метапредметные. Развивать умение применять знаки и символы для решения учебных и познавательных задач.
3) предметные. Уметь составлять уравнения реакций воды с активными металлами, а также оксидами металлов и неметаллов.
Демонстрационный опыт №12. Взаимодействие воды с металлами (натрием, магнием).
Демонстрационный опыт №13. Взаимодействие воды с оксидами кальция, фосфора, углекислым газом. Испытание полученных растворов индикаторами.
Оборудование: периодическая система химических элементов Д.И. Менделеева, таблица растворимости кислот, оснований, солей, мультимедиа доска, комплект реактивов и химической посуды для выполнения демонстрационных опытов, учебник «Х имия. 8 класс. / Г.Е. Рудзитис, Ф.Г. Фельдман. — М.: Просвещение, 2014».
1. Организация начала урока.
Проверяю готовность класса к уроку, отмечаю отсутствующих, записываем число и « Классная работа» .
Просмотр наличия выполнения домашнего задания, один обучающийся на доске записывает ответы домашнего задания для самопроверки правильности.
2. Актуализация опорных знаний обучающихся. Подготовка к усвоению нового материала.
2.1. На рабочих местах фронтальная беседа по вопросам (демонстрация вопросов на мультимедиа доске).
1. Какие простые вещества мы изучили?
2. Назовите формулы простых веществ кислорода и водорода.
3. Приведите примеры соединений, содержащих атомы водорода и запишите их формулы.
4. В результате каких реакций можно получить водород?
5. Что называют химической реакцией?
6. Какие типы реакций Вы знаете?
2.2. Объявляются (и комментируются) оценки за практическую работу.
3. Формулирование темы урока при участии обучающихся.
— На предыдущем уроке мы выполняли практическую работу по приготовлению растворов солей.
— Вы заметили главную особенность растворов — свойства воды и свойства соли в растворе сохраняются.
— То есть, приготовление растворов — это физическое явление.
— А возможно ли такое взаимодействие с водой, при котором образуются новые вещества, то есть будет протекать химическая реакция между водой и веществом?
— Как можно сформулировать тему урока в этом случае?
Обучающиеся формулируют возможную тему урока.
— Запишите тему нынешнего урока: Химические свойства воды.
4. Формулирование целей и задач урока при помощи обучающихся. Мотивация учебной деятельности.
— изучить взаимодействие воды с другими веществами, в результате которого образуются новые химические вещества;
— научиться составлять уравнения химических реакций воды с различными простыми и сложными веществами;
— повторить алгоритм составления уравнений химических реакций;
— ф ормировать ответственное отношение к обучению, готовность и способность к саморазвитию.
5. Изучение нового материала. Химические реакции.
5.1. Разложение под действием электрического тока или сильного нагревания (около 2000 о С).
В результате реакции образуются прозрачные газообразные вещества — водород и кислород
Демонстрационный опыт №12. Взаимодействие воды с металлами (натрием, магнием).
Вода при комнатной температуре легко вступает в реакцию с активными металлами. При этом атом металла замещает один из атомов водорода, вытесняя его из воды с последующим образованием газообразного водорода. Также образуются хорошо растворимые в воде гидроксиды металлов.
2 Na + 2 HOH = 2 NaOH + H 2
С a + 2 HOH = С a ( OH ) 2 + H 2
5.3. Взаимодействие с металлами средней активными ( Mg , Zn , Fe ).
Вода при повышенной температуре (500 – 600 о С) вступает в реакцию с металлами средней активности. При этом атом металла замещает атомы водорода, вытесняя их из воды в виде газообразного водорода. Также образуются оксиды металлов.
М g + HOH = MgO + H 2
Zn + HOH = ZnO + H 2
Ф И З К У Л Ь Т М И Н У Т К А
Демонстрационный опыт №13. Взаимодействие воды с оксидами кальция, фосфора, углекислым газом. Испытание полученных растворов индикаторами.
Вода при комнатной температуре легко вступает в реакцию со сложными веществами — оксидами активных металлов:
С aO + H 2 O = С a ( OH ) 2
При добавлении к образующемуся раствору гидроксида металла (щелочи) раствора красного лакмус а весь объём раствора становится синим , а прозрачный раствор фенолфталеин а становится малиновым.
Вода при комнатной температуре легко вступает в реакцию со сложными веществами — оксидами неметаллов:
Вода вступает в реакцию с оксидом фосфора ( V ) при комнатной температуре:
При нагревании или с горячей водой реакция протекает по-другому:
При добавлении к образующемуся раствору кислоты раствора синего лакмус а весь объём раствора становится красным , а прозрачный раствор фенолфталеин а не изменяет свой цвет.
5.6. Взаимодействие с некоторыми неметаллами при нагревании.
Водяной пар при температуре свыше 1000°C взаимодействует с раскаленным коксом (углём) с образованием водяного газа (смесь водорода и оксида углерода (II) – угарного газа).
6. Первичное закрепление изученного материала.
6.1. Игра «Найди пару». К формуле простого или сложного вещества найдите соответствующую формулу продукта реакции его с водой.
Г) Na 4) С a ( OH ) 2
7. Закрепление, обсуждение и коррекция изученного материала.
Обсуждение правильности выполнения заданий игры, повторение химических свойств воды.
8. Подведение итогов занятия.
Подводится итог-обобщение изученного на уроке материала.
Объявление оценок, полученных обучающимися за урок.
9. Задаётся и объясняется домашнее задание.
— Ребята! Запишите, пожалуйста, домашнее задание к следующему уроку (задание появляется на мультимедиа доске или записано на обороте обычной доски):
Учить §32 (с.107, 108) (химические свойства воды),
Урок химии в 8 классе «Типы химических реакций на примере свойств воды»
Целью данного урока является знакомство учащихся с химическими свойствами воды , рассмотрение условий взаимодействия оксидов металлов и неметаллов с водой, знакомство с понятиями электролиз, фотолиз, гидролиз.
Просмотр содержимого документа
«Урок химии в 8 классе «Типы химических реакций на примере свойств воды»»
Типы химических реакций на примере свойств воды
Цель урока: Познакомить учащихся с химическими свойствами воды и рассмотреть их по признаку “число и состав исходных веществ и продуктов реакции”, рассмотреть условия взаимодействия оксидов металлов и неметаллов с водой, рассмотреть понятия электролиз, фотолиз, гидролиз, продолжить формирование умений составлять уравнения химических реакций, определять тип химических реакций по числу и составу реагирующих веществ и продуктов.
применение знаний, умений и навыков в новых условиях — создание проблемной ситуации;
контроль и самоконтроль знаний, умений и навыков с помощью домашней работы;
уметь устанавливать существенные признаки, являющиеся основой различных классификаций;
уметь составлять уравнения химических реакций, определять тип химических реакций по числу и составу реагирующих веществ и продуктов
развитие умений сравнивать, обобщать, правильно формулировать задачи и излагать мысли;
развитие логического мышления, внимания и умения работать в проблемной ситуации.
формирование у учащихся познавательного интереса к химии;
воспитание таких качеств характера, как настойчивость в достижении цели;
воспитание интереса и любви к предмету через содержание учебного материала, умение работать в коллективе, взаимопомощи, культуры общения.
Элементы содержания: электролиз, фотолиз, фотосинтез, гидролиз
Оборудование: натрий, карбид кальция, оксид кальция, оксид железа, вода, медиапроектора, наборы для лабораторной работы, фенолфталеин, пробирки, штатив для пробирок, флаконы с реактивами.
Тип урока: изучения нового материала
1. Организационный момент.
2. Промежуточный контроль знаний.
3. Изучение новой темы.
5. Домашнее задание.
I. Организационный момент.
Цель: подготовиться к проведению урока, к наиболее эффективной работе на уроке.
Проверяется готовность к уроку, раздаются план урока (Приложение 1), листы с тестом (Приложение 2), инструкции для выполнения лабораторной работы (Приложение 5), лотки с демонстрационным материалом, лист наблюдений (Приложение 5), объявляются этапы урока.
Вступительное слово учителя. На этом уроке мы рассмотрим новую тему “Типы химических реакций на примере свойств воды”. Для этого нам нужно вспомнить материал, который мы уже прошли в темах “Типы химических реакций”, “Химические уравнения”. Сейчас мы выполним тест по этим темам.
II. Промежуточный контроль знаний по темам “Типы химических реакций”, “Химические уравнения” по технологии “Взаимопередачи заданий”
Цель: проверить умения составлять уравнения химических реакций, определять тип химических реакций по числу и составу реагирующих веществ и продуктов и продолжить формировать эти умения в случае недостаточной сформированности..
Учащиеся выполняют тест – 5 минут (Приложение 2). После того, как учащиеся выполнят тест, необходимо проверить работу соседа и поставить оценку, затем тесты передать на проверку учителю. Учитель просит класс поднять руки, кто написал тест на 5 или 4 балла. На закрытой доске или на экране медиапроектора открывают заранее подготовленные ответы теста для самопроверки.
Для медиапроектора, правильные варианты
Тест по темам “Типы химических реакций”, “Химические уравнения”
Время выполнения — 5 минут
Расставьте коэффициенты в схемах реакций, укажите тип химической реакции по признаку “число и состав исходных веществ и продуктов реакции”
1. 2 Cu + O2 — 2 CuO реакция соединения
3. 2 AL + 3 CuBr2 — 2 AlBr3 + 3 Cu реакция замещения
Расставьте коэффициенты в схемах реакций, укажите тип химической реакции по признаку “число и состав исходных веществ и продуктов реакции”
2. Si + 2 F2 — SiF4 реакция соединения
4. 2 FeBr3 + 3 Zn —3 ZnBr2 + 2 Fe реакция замещения
III. Изучение нового учебного материала.
Учебная цель: В результате этого урока мы должны рассмотреть химические свойства воды. В ходе урока мы узнаем, в каких реакциях разложения, соединения, замещения и обмена участвует вода. Вывод цели с помощью учеников
Слово учителя: Моя цель на уроке рассказать вам об этом, помочь вам запомнить эти реакции, и мы продолжим учиться составлять уравнения химических реакций, определять тип химических реакций по числу и составу реагирующих веществ и продуктов.
Основные положения нового учебного материала, который вы сегодня должны освоить.
Самое удивительное вещество на нашей планете — оксид водорода H2O
Доклад ученика (Приложение 3), возможно презентация, индивидуальная форма работы
В это время ученики составляют конспект доклада в объеме пяти предложений.
Примерное содержание конспекта
Россия занимает первое место в мире по запасам пресной воды.
Вода в России сосредоточена в реках, озерах, водохранилищах
40% суши – это засушливые и полузасушливые регионы мира, имеют только 2% мировых запасов пресной воды
Наш регион также относится к засушливым регионам
Вскоре 2/3 населения планеты будут жить в странах, испытывающих нехватку воды.
Химические свойства воды. Объяснение с опорой на знания учеников.
1. Реакция разложения. Что такое реакция разложения?
Сегодня мы познакомимся с новым типом реакций разложения — электролиз
Электролиз – реакция, протекающая под действием постоянного электрического тока
Давайте вспомним процесс фотосинтеза.
Доклад ученика (Приложение 4), возможно презентация, индивидуальная форма работы
Здесь мы познакомимся с еще одним типом реакции разложения
Фотолиз – разложения воды под действием света
Совокупность этих процессов называют фотосинтезом
Уравнение реакции фотосинтеза (реакция синтеза)
Коэффициенты в уравнении реакции выставляются с опорой на знания учеников фронтально или у доски вызванным учеником
2. Реакции соединения. Фронтальный опрос класса: дать определение реакции соединения.
Сегодня мы рассмотрим реакции соединения на примере взаимодействия оксидов металлов и неметаллов с водой
1. Реакция гашения извести
Запись реакции на доске, с помощью ученика, демонстрация ее учителем и демонстрация ЦОР, видео “Взаимодействие оксида кальция с водой”,
CaO + H2O
негашеная известь
гидроксид кальция, растворимое основание, щелочь
Обратить внимание учеников, что такое щелочь
Закрепление. Фронтальный опрос: Что такое щелочь? (Щелочи – это растворимые основания.)
Какие металлы и оксиды каких металлов образуют растворимые основания – щелочи? (Щелочи образуют металлы I группы, главной подгруппы, металлы II группы, главной подгруппы, начиная с кальция.)
2. Реакция образования растворимых, кислородсодержащих кислот из оксидов неметаллов
P2O5 + 3 H2O — 2H3PO4 фосфорная кислота или гидроксид фосфора
Обратить внимание учеников, что гидроксиды – это не только основания, но и кислородсодержащие кислоты.
Правило – вода реагирует с оксидами металлов и неметаллов, если образуются растворимые гидроксиды (основания или кислоты)
Закрепление, фронтальный опрос: Посмотрите в учебник, страница 171, и объясните, почему в одном случае оксиды взаимодействуют с водой, а других случаях взаимодействие не происходит?
Выполнение Лабораторной работы “Исследование взаимодействия оксидов металлов с водой” (Приложение 5), работа в группах, по методу КСО
Организация работы класса. Перед началом работы один ученик напоминает правила техники безопасности всему классу.
Класс делится на малые группы по 4 человека, например, по скорости работы или по желанию учащихся.
Во всех группах учащимся раздаются инструкции лабораторной работы.
3. Реакции замещения. Объяснение учителя с опорой на знания учеников.
Что такое реакция замещения?
Уравнение реакции взаимодействия натрия с водой на доске записывает вызванный ученик, остальные ученики в Приложение 1. План урока. После этого демонстрируется ЦОР “Взаимодействия натрия с водой” и объясняются учителем особенности эксперимента.
4. Реакция соединения. Объяснение учителя с опорой на знания учеников.
Актуализация знаний. Что такое реакция соединения? Почему в таблице растворимости в некоторых клетках стоят прочерки?
Гидролиз – это реакция обменного разложения вещества с водой. То есть это одновременно реакция и обмена и разложения.
Демонстрация опыта учителем и объяснение его результатов с записью уравнения на доске учеником
Гидролиз фосфида кальция.
IV. Закрепление учебного материала
Учебная цель: Закрепить новые понятия и учебные навыки
Что такое электролиз воды?
Что такое фотолиз воды?
Что такое гидролиз?
Что объединяет эти реакции?
Интерактив. Химические свойства воды
Задание учащимся во время просмотра ресурса
1. Расставить коэффициенты
2. Определить тип реакции
V. Задание на дом
Представлено в рабочих листах.
Цель: выучить реакции соединения, разложения, обмена, замещения на примере реакций с участием воды, научиться писать эти реакции самостоятельно, уметь применять полученные знания в новой ситуации (проблемный вопрос).
Формулируется проблемный вопрос, для домашнего задания, выставляются оценки за урок, уметь применять полученные знания в новой ситуации (проблемный вопрос).
Проблемный вопрос. Как химические свойства воды зависят от строения молекулы воды и химической связи этой молекулы?
Параграф 33 “Типы химических реакций на примере свойств воды”, страница168-173, упражнение 1-3
Обсуждение с учащимися, что понравилось в проведенном уроке, а что вызвало затруднение.
1. Химия 8, 9 класс. Мультимедийное приложение к учебнику О.С.Габриеляна. Электронное учебное издание. ООО “Дрофа” 2011.
2. Планирование к учебнику “Химия”, 8, 9 класс, Габриелян О.С. Единая коллекция цифровых образовательных ресурсов
Вода – самое привычное и самое необычное вещество на планете. Нет на Земле вещества более важного для нас, чем обыкновенная вода, и в то же время не существует другого такого же вещества, в свойствах которого было бы столько противоречий и аномалий, сколько в её свойствах.
Почти ¾ поверхности нашей планеты занято океанами и морями. Твёрдой водой – снегом и льдом – покрыто 20% суши. Поверхностные воды сосредоточены в Мировом океане — 91% всей воды на Земле. Поверхность Мирового океана (акватория) составляет 361 млн/км квадратных. Она в 2 раза больше площади суши, занимающей 149 млн/км квадратных. Если распределить воду ровным слоем, то она покроет Землю толщиной в 3000 метров. На каждого жителя Земли приблизительно приходится 0,33 кубических километров морской воды и 0,008 кубических километров пресной воды. Подавляющая часть пресной воды на Земле находится в таком состоянии, которое делает её труднодоступной для человека. Почти 70% пресных вод заключено в ледниковых покровах полярных стран и в горных ледниках, 30% — в водоносных слоях под землёй, а в руслах всех рек содержатся одновременно всего лишь 0,006% пресных вод.
Тело человека почти на 63 – 68 % состоит из воды. Почти все биохимические реакции в каждой живой клетке – это реакции в водных растворах. С водой удаляются из нашего тела ядовитые шлаки; вода, выделяемая потовыми железами и испаряющаяся с поверхности кожи, регулирует температуру нашего тела. Большинство обитателей земного шара и растения состоят более чем на половину из воды. Например, млекопитающие содержат 60 – 68 %; рыбы – 70 %; водоросли – 90 – 98 %.
В растворах же (преимущественно водных) протекает большинство технологических процессов на предприятиях химической промышленности, в производстве лекарственных препаратов и пищевых продуктов.
Вода – это важный источник энергоресурсов. Все гидроэлектри-ческие станции мира, от маленьких до самых крупных, превращают механическую энергию водного потока в электрическую исключительно с помощью водяных турбин с соединёнными с ними электрогенераторами. На атомных электростанциях атомный реактор нагревает воду, водяной пар вращает турбину с генератором и вырабатывает электрический ток.
От воды зависит климат планеты. Геофизики утверждают, что Земля давно бы остыла и превратилась в безжизненный кусок камня, если бы не вода. У неё очень большая теплоёмкость. Нагреваясь, она поглощает тепло; остывая, отдаёт его. Земная вода и поглощает, и возвращает очень много тепла и тем самым «выравнивает» климат. А от космического холода предохраняет Землю те молекулы воды, которые рассеяны в атмосфере – в облаках и в виде паров… без воды обойтись нельзя – это самое важное вещество на Земле.
Молекулы воды обнаружены в межзвёздном пространстве. Вода входит в состав комет, большинства планет солнечной системы и их спутников.
Примерно до конца 19 века вода считалась бесплатным неистощимым даром природы. Её не хватало только в слабонаселённых районах пустынь. В 20 веке взгляд на воду резко изменился. В результате быстрого роста населения земного шара и бурного развития промышленности проблема снабжения человечества чистой пресной водой стала чуть ли не мировой проблемой номер один. В настоящее время люди используют ежегодно около 3000 млрд кубических метров воды, и эта цифра непрерывно быстро растёт. Во многих густонаселённых промышленных районах чистой воды уже не хватает.
В настоящее время проблема загрязнения водной среды является очень актуальной, т.к. сейчас люди начинают забывать всем известное выражение «вода – это жизнь». Без воды человек не может прожить более трех суток, но, даже понимая всю важность роли воды в его жизни, он все равно продолжает наносить вред водным объектам, безвозвратно изменяя их естественный режим сбросами и отходами.
Каждый житель Земли в среднем потребляет 650 м кубических воды в год (1780 литров в сутки). Однако для удовлетворения физиологических потребностей достаточно 2,5 литра в день, т.е. около 1 м кубического в год. Большое количество воды требуется сельскому хозяйству (69%) главным образом для орошения; 23% воды потребляет промышленность; 6% расходуется в быту.
Недостаток пресной воды на земном шаре можно восполнить различными путями: опреснять морскую воду, а также заменять ею, где это возможно в технике, пресную воду; очищать сточные воды до такой степени, чтобы их можно было спокойно спускать в водоёмы и водотоки, не боясь загрязнить, и использовать вторично; экономно расходовать пресную воду, создавая менее водоёмкую технологию производства, заменяя, где это можно, пресную воду высокого качества водой более низкого качества и т.д.
Вода участвует во многих химических реакциях, например, в живых организмах – фотосинтез, дыхание, передвижение веществ к органам и тканям. В воде растворяются оксиды, образуя кислоты и щелочи. Гидролиз – это разложение веществ водой.
Загрязнение нефтью и нефтепродуктами приводит к появлению нефтяных пятен, что затрудняет процессы фотосинтеза в воде из-за прекращения доступа солнечных лучей, а также вызывает гибель растений и животных. Каждая тонна нефти создает нефтяную пленку на площади до 12 кв. км. Восстановление пораженных экосистем занимает 10-15 лет.
Загрязнение сточными водами в результате промышленного производства, минеральными и органическими удобрениями в результате сельскохозяйственного производства, а также коммунально-бытовыми стоками ведет к эвтрофикации водоемов – обогащению их питательными веществами, приводящему к чрезмерному развитию водорослей, и к гибели других водных экосистем. Загрязнение ионами тяжелых металлов нарушает жизнедеятельность водных организмов и человека.
Кислотные дожди приводят к закислению водоемов и к гибели экосистем.
Радиоактивное загрязнение связано со сбросом в водоемы радиоактивных отходов.
Тепловое загрязнение вызывает сброс в водоемы подогретых вод ТЭС и АЭС, что приводит к массовому развитию сине-зелёных водорослей, так называемому цветению воды, уменьшению количества кислорода и отрицательно влияет на флору и фауну водоемов.
Механическое загрязнение повышает содержание механических примесей.
Бактериальное и биологическое загрязнение связано с разными патогенными организмами, грибами и водорослями непроточной водой (озер, прудов), а иногда к заболачиванию местности
http://infourok.ru/urok-himii-himicheskie-svojstva-vody-4119127.html
http://multiurok.ru/index.php/files/urok-khimii-v-8-klasse-tipy-khimicheskikh-reaktsii.html