Для удаления аммиака есть два способа
Практически весь аммиак удаляется из организма:
- с мочой в виде мочевины , которая синтезируется в печени,
- в виде образующихся в эпителии канальцев почек солей иона аммония .
В клетки печени и почек аммиак попадает в составе глутамина и аспарагина, глутаминовой кислоты, аланина и в свободном виде. Кроме этого, при метаболизме он образуется в большом количестве и в самих гепатоцитах.
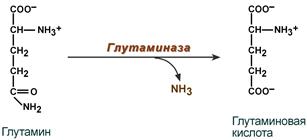
В клетке глутамин и аспарагин дезаминируются соответственно глутаминазой и аспарагиназой с образованием аммиака (точнее, иона аммония).
Реакция дезаминирования глутамина
Аланин вступает в реакцию трансаминирования. Образованный в результате реакции пируват идет в глюконеогенез или энергетический обмен. Параллельно образуется глутаминовая кислота.
В целом глутаминовая кислота в гепатоците может появляться тремя путями: 1) из крови, 2) при дезаминировании глутамина, 3) при трансаминировании α-кетоглутарата с аспартатом или аланином. Происхождение и дальнейшая ее судьба зависит от конкретных концентраций всех задействованных веществ. Обычно далее глутамат дезаминируется глутаматдегидрогеназой с образованием аммиака .
Синтез мочевины
В печени весь удаляемый аммиак используется для синтеза мочевины. Увеличение синтеза мочевины наблюдается при распаде тканевых белков и азотистых соединений (голодание, воспалительные процессы, сахарный диабет) или при избыточном белковом питании. У младенцев и детей синтез мочевины может быть снижен по двум причинам: незрелость печени и активный синтез белков и нуклеиновых кислот при росте организма. Определение концентрации мочевины в крови является ценным диагностическим показателем.
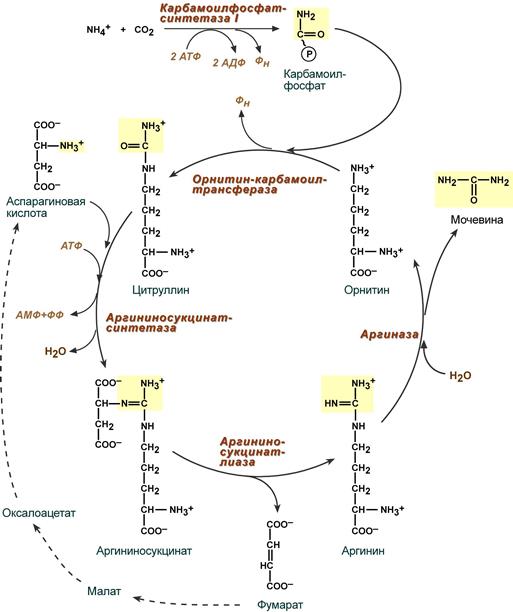
Реакции синтеза мочевины являются циклическим процессом и получили название орнитиновый цикл . Синтез мочевины начинается в митохондриях (первая и вторая реакции), оставшиеся три реакции идут в цитозоле. Для переноса цитруллина и орнитина через митохондриальную мембрану существуют специальные переносчики.
В образовании одной молекулы мочевины участвует 1 молекула NH4 + , 1 молекула CO2, аминогруппа 1 молекулы аспарагиновой кислоты, затрачивается 4 макроэргических связи трех молекул АТФ.
Реакция синтеза карбамоилфосфата и орнитиновый цикл
Как побочный продукт орнитинового цикла образуется фумаровая кислота, переносимая обратно в митохондрии. Здесь в реакциях ЦТК из нее образуется оксалоацетат, который трансаминируется с глутаматом до аспартата, выходит в цитозоль и вновь реагирует с цитруллином.
В противоположность аммиаку мочевина является нетоксичным и нейтральным соединением. При хронической почечной недостаточности, когда продукты азотистого обмена не выводятся из организма, токсичное действие на организм оказывает совсем не мочевина, а совокупность более чем 200 других веществ.
Синтез аммонийных солей
Непосредственный синтез аммонийных солей или аммониегенез происходит в просвете канальцев почек из секретируемых сюда аммиака и ионов водорода и фильтрующихся органических и неорганических анионов первичной мочи. Около 10% всего аммиака выводится почками в виде аммонийных солей.
Часть глутамина крови, не задержавшаяся в печени, достигает почек. В эпителиальных клетках почечных канальцев, в основном в дистальных канальцах, имеется фермент глутаминаза , гидролизующая амидную группу с образованием глутамата. Глутамат, в свою очередь, дезаминируется глутаматдегидрогеназой и полученный α-кетоглутарат сгорает в ЦТК. Также, особенно при голодании, α-кетоглутарат вовлекается в синтез глюкозы.
Параллельно в эпителии происходят процессы клеточного дыхания, сопровождающиеся образованием угольной кислоты, которая диссоциирует на ион Н + и карбонат-ион НСО3 − . Ионы водорода секретируются в первичную мочу, карбонат-ионы – в кровь.
- либо диффундирует в просвет канальца, где соединяется с ионом Н + , образуя ионы аммония NH4 + . Они связываются с неорганическими (фосфаты, хлориды, сульфаты) или с органическими анионами (уксусной, щавелевой, молочной кислот),
- либо связывается с ионом ионом Н + в самой клетке, образуя ионы аммония NH 4 + , который секретируется в обмен на ионы Na + .
Орнитиновый цикл мочевинообразования
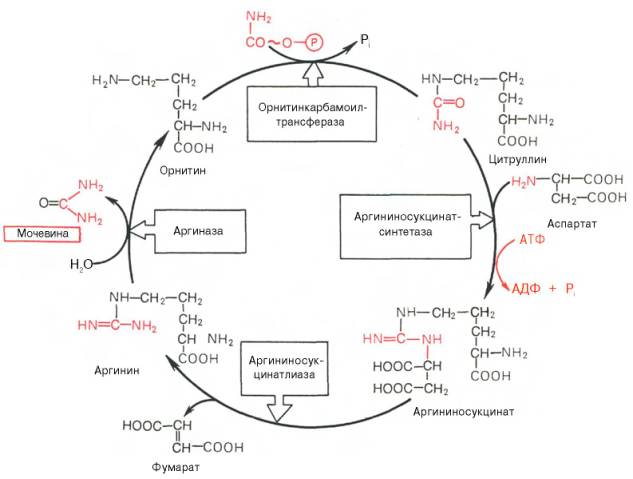
Основным механизмом обезвреживания аммиака в организме является биосинтез мочевины. Последняя выводится с мочой в качестве главного конечного продукта белкового, соответственно аминокислотного, обмена. На долю мочевины приходится до 80–85% от всего азота мочи. Основным и, возможно, единственным местом синтеза мочевины является печень. Впервые Г. Кребс и К. Гензеляйт в 1932 г. вывели уравнения реакций синтеза мочевины, которые представлены в виде цикла, получившего в литературе название орнитинового цикла мочевинообразования Кребса. Следует указать, что в биохимии это была первая циклическая система метаболизма, описание которой почти на 5 лет опеределило открытие Г. Кребсом другого метаболического процесса – цикла трикарбоновых кислот (см. ранее). Дальнейшие исследования в основном подтвердили циклический характер биосинтеза мочевины в печени. Благодаря исследованиям Г. Коена, С. Ратнер и сотр. были уточнены промежуточные этапы и ферментные системы, катализирующие образование мочевины.
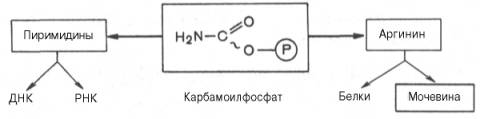
Таким образом, весь цикл мочевинообразования может быть представлен следующим образом. На первом этапе синтезируется макроэргическое соединение карбамоилфосфат – метаболически активная форма аммиака, используемая в качестве исходного продукта для синтеза пиримидиновых нуклеотидов (соответственно ДНК и РНК) и аргинина (соответственно белка и мочевины):
К настоящему времени открыты три разных пути синтеза карбамоил-фосфата de novo, катализируемые тремя разными ферментами. Первую необратимую реакцию катализирует регуляторный фермент – аммиакзави-симая карбамоилфосфатсинтетаза (КФ 6.3.4.16):
Реакция требует затраты двух молекул АТФ, открыта в митохондриях клеток печени и используется преимущественно для синтеза аргинина и мочевины. В этой реакции в качестве активного стимулирующего ал-лостерического эффектора действует N-ацетилглутамат.
Вторую, также необратимую, реакцию катализирует глутаминзависимая карбамоилфосфатсинтетаза (КФ 6.3.5.5):
Данная реакция открыта в цитозоле клеток животных и требует наличия ионов Mg 2+ . Следует указать, что благодаря включению гидролитической стадии она используется преимущественно для синтеза пиримидиновых нуклеотидов (см. далее). Фермент широко распространен в клетках животных.
Третью обратимую реакцию катализирует карбаматкиназа (КФ 2.7.2.2):
Реакция открыта у разных микроорганизмов и, возможно, используется скорее для ресинтеза АТФ, чем для синтеза карбамоилфосфата.
На втором этапе цикла мочевинообразования происходит конденсация карбамоилфосфата и орнитина с образованием цитруллина; реакцию катализирует орнитин-карбамоилтрансфераза (КФ 2.1.3.3).
На следующей стадии цитруллин превращается в аргинин в результате двух последовательно протекающих реакций. Первая из них, энергозави-симая,– это конденсация цитруллина и аспарагиновой кислоты с образованием аргининосукцината (эту реакцию катализирует аргининосукцинат-синтетаза). Аргининосукцинат распадается в следующей реакции на аргинин и фумарат при участии другого фермента – аргининосукцинатлиазы. На последнем этапе аргинин расщепляется на мочевину и орнитин под действием аргиназы.
Необходимо подчеркнуть, что аргиназа содержится в печени тех животных, которые экскретируют с мочой мочевину как основной и конечный продукт азотистого обмена. В печени птиц, например, аргиназа отсутствует, поскольку птицы вместо мочевины выделяют мочевую кислоту. Орни-тиновый цикл мочевинообразования с учетом новых данных представлен на рис. 12.5.
Суммарная реакция синтеза мочевины без учета всех промежуточных продуктов может быть представлена в следующем виде:
Данная реакция сопровождается снижением свободной энергии (ΔG 0 = –40 кДж), поэтому процесс всегда протекает в направлении синтеза мочевины. Следует указать, что синтез мочевины энергетически дорого обходится организму. На синтез одной молекулы мочевины требуется
затрата четырех высокоэнергетических фосфатных групп: две молекулы АТФ расходуются на синтез карбамоилфосфата и одна – на образование аргининоянтарной кислоты, при этом АТФ расщепляется на АМФ и РРi, который при гидролизе также образует две молекулы Рi.
Из приведенной схемы процесса мочевинообразования нетрудно видеть, что один из атомов азота мочевины имеет своим источником свободный аммиак (через карбамоилфосфат); второй атом азота поступает из ас-партата. Аммиак образуется главным образом в процессе глутаматде-гидрогеназной реакции. В процессе пополнения запасов аспартата участвуют три сопряженные реакции: сначала фумарат под действием фумаразы присоединяет воду и превращается в малат, который окисляется при участии малатдегидрогеназы с образованием оксалоацетата; последний в реакции трансаминирования с глутаматом вновь образует аспартат.
Учитывая известные фактические данные о механизмах обезвреживания аммиака в организме, можно сделать следующее заключение. Часть аммиака используется на биосинтез аминокислот путем восстановительного аминирования α-кетокислот по механизму реакции трансаминирования. Аммиак связывается при биосинтезе глутамина и аспарагина. Некоторое количество аммиака выводится с мочой в виде аммонийных солей. В форме креатинина, который образуется из креатина и креатинфосфата, выделяется из организма значительная часть азота аминокислот. Наибольшее количество аммиака расходуется на синтез мочевины, которая выводится с мочой в качестве главного конечного продукта белкового обмена в организме человека и животных. Подсчитано, что в состоянии азотистого равновесия организм взрослого здорового человека потребляет и соответственно выделяет примерно 15 г азота в сутки; из экскретируемого с мочой количества азота на долю мочевины приходится около 85%, креатинина – около 5%, аммонийных солей – 3%, мочевой кислоты – 1% и на другие формы – около 6%.
В процессе эволюции живые организмы выработали различные типы азотистого обмена. Это аммониотелический тип, при котором главным конечным продуктом азотистого обмена является аммиак; он свойствен преимущественно рыбам. При уреотелическом типе обмена основным конечным продуктом обмена белков является мочевина; такой тип характерен для человека и животных. Урикотелический тип характерен для птиц и рептилий; главным конечным продуктом данного типа обмена является мочевая кислота.
Синтез карбамоилфосфата – ключевая реакция синтеза мочевины

Карбамоилфосфат синтезируется в митохондриях в комплексной реакции, которая катализируется карбамоилфосфат синтетазой I. Этот аллостерический фермент активируется N –ацетилглутаминовой кислотой. Потребление 2 молекул АТФ делает синтез карбамоил-фосфата необратимой реакцией.
Карбамоилфосфат синтетаза I (КФС-1) катализирует образование карбомоилфосата в митохондриях. Из цитозоля выделена карбомоилфосфатсинтетаза-2 (КФС-2), которая катализирует образование карбомоилфосфата, используемого для синтезе пиримидиновых нуклеотидов.
Образование цитруллина происходит благодаря использованию высокоэнергетического фосфата карбамоилфосфатаи катализируется орнитин-карбамоил трансферазой (ОКТ). Продукт реакции цитруллин транспортируется в цитозоль, где завершается образование мочевины.
Мочевина — природный антиоксидант (радиопротектор).
Энергетическая емкость ЦСМ.
Суммарная реакция синтеза мочевины:


На синтез одной молекулы мочевины расходуется 4 макроэргических связи 3-х молекул АТФ:
2 АТФ – на стадии синтеза корбомоилфосфата и одна АТФ – на стадии синтеза аргинино-сукцината (если учитывать, что в данной реакции образуется АМФ, то можно считать энергозатраты этой реакции равной 2 АТФ, т.е. энергетическая емкость ЦСМ равна 4 АТФ).
Биологическая роль ЦСМ.
1. Механизм детоксикации NH3.
2. Механизм регуляции КЩС
3. ЦСМ — поставщик орнитина.
4. Имея митохондриальную локализацию, регулирует потоки а/к по различным путям ———> ГНГ, биосинтез белка, липогенез.
Между циклом мочевинообразования и циклом трикарбоновых кислот устанавливается тесная связь на уровне субстратов
Связь ЦСМ с ЦТК и обменом аминокислот (цикл Кребса-Гензелейта («трехколесный велосипед»).
Ферменты: 1 — карбамоилфосфатсинтетаза-1. │
2 — карбамоилфосфаттрансфераза. │ ферменты
3 — аргининосукцинатсинтетаза. │ ЦСМ
6 — фумараза. │ ферменты
7 — малатдегидрогеназа │ ЦТК
8 — АсАТ│ ферменты
9 — ГДГ │ обмена а/к
Регуляция ЦСМ.
1. Краткосрочная: на уровне 1-го фермента, который вместе с 8-ым направляет азот ГЛУ (а значит и всех а/к) в карбамоилфосфат.
2. Долгосрочная: определяется уровнем липолиза, Ац-КоА. Ац-КоА при недостатке углеводов, является наиболее предпочтительным субстратом, чем липиды.
Косвенные доводы позволяют предположить, что углеводы и белки (а/к) способны полностью обеспечить энергетический потенциал клетки.
Врожденные дефекты ферментов ЦСМ, основные клинические проявления.
Дефицит ферментов орнитинового цикла встречается в популяции с частотой 1 случай на 25000 новорожденных и начинает проявляться в неонатальный период. К настоящему времени описаны врожденные дефекты каждого фермента, участвующего в синтезе мочевины. Все дефекты (за исключением дефицита аргиназы) сопровождаются тяжелой гипераммониемией. Высокий уровень аммиака оказывает токсическое действие на центральную нервную систему. Не поддающаяся лечению гипераммонийемия завершается тяжелым нарушениями психики.
http://xumuk.ru/biologhim/194.html
http://megaobuchalka.ru/3/7023.html