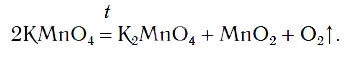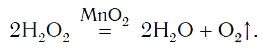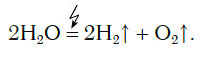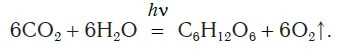Получение кислорода
История открытия кислорода
Открытие кислорода ознаменовало новый период в развитии химии. С глубокой древности было известно, что для горения необходим воздух. Процесс горения веществ долгое время оставался непонятным. В эпоху алхимии широкое распространение получила теория флогистона, согласно которой вещества горят благодаря их взаимодействию с огненной материей, то есть с флогистоном, который содержится в пламени. Кислород был получен английским химиком Джозефом Пристли в 70-х годах XVIII века. Химик нагревал красный порошок оксида ртути (II), в итоге вещество разлагалось, с образованием металлической ртути и бесцветного газа:
Оксиды – бинарные соединения, в состав которых входит кислород При внесении тлеющей лучины в сосуд с газом она ярко вспыхивала. Ученый считал, что тлеющая лучина вносит в газ флогистон, и он загорается. Д. Пристли пробовал дышать полученным газом, и был восхищен тем, как легко и свободно им дышится. Тогда ученый и не предполагал, что удовольствие дышать этим газом предоставлено каждому. Результатами своих опытов Д. Пристли поделился с французским химиком Антуаном Лораном Лавуазье.
Имея хорошо оснащенную на то время лабораторию, А. Лавуазье повторил и усовершенствовал опыты Д. Пристли. А. Лавуазье измерил количество газа, выделяющееся при разложении определенной массы оксида ртути. Затем химик нагрел в герметичном сосуде металлическую ртуть до тех пор, пока она не превратилась в оксид ртути (II). Он обнаружил, что количество выделившегося газа в первом опыте равно газу, поглотившемуся во втором опыте. Следовательно, ртуть реагирует с каким-то веществом, содержащимся в воздухе. И это же вещество выделяется при разложении оксида. Лавуазье первым сделал вывод, что флогистон здесь совершенно ни при чем, и горение тлеющей лучины вызывает именно неизвестный газ, который в последствии был назван кислородом. Открытие кислорода ознаменовало крах теории флогистона!
Способы получения и собирания кислорода в лаборатории
Лабораторные способы получения кислорода весьма разнообразны. Существует много веществ, из которых можно получить кислород. Рассмотрим наиболее распространенные способы.
1) Разложение оксида ртути (II)
Одним из способов получения кислорода в лаборатории, является его получение по описанной выше реакции разложения оксида ртути (II). Ввиду высокой токсичности соединений ртути и паров самой ртути, данный способ используется крайне редко.
2) Разложение перманганата калия
Перманганат калия (в быту мы называем его марганцовкой) – кристаллическое вещество темно-фиолетового цвета. При нагревании перманганата калия выделяется кислород. В пробирку насыплем немного порошка перманганата калия и закрепим ее горизонтально в лапке штатива. Недалеко от отверстия пробирки поместим кусочек ваты. Закроем пробирку пробкой, в которую вставлена газоотводная трубка, конец которой опустим в сосуд- приемник. Газоотводная трубка должна доходить до дна сосуда-приемника. Ватка, находящаяся около отверстия пробирки нужна, чтобы предотвратить попадание частиц перманганата калия в сосуд-приемник (при разложении выделяющийся кислород увлекает за собой частички перманганата). Когда прибор собран, начинаем нагревание пробирки. Начинается выделение кислорода.
Уравнение реакции разложения перманганата калия:
2KMnO4 t° → K2MnO4 + MnO2 + O2↑
Как обнаружить присутствие кислорода? Воспользуемся способом Пристли. Подожжем деревянную лучину, дадим ей немного погореть, затем погасим, так, чтобы она едва тлела. Опустим тлеющую лучину в сосуд с кислородом. Лучина ярко вспыхивает! Газоотводная трубка была не случайно опущена до дна сосуда-приемника. Кислород тяжелее воздуха, следовательно, он будет собираться в нижней части приемника, вытесняя из него воздух. Кислород можно собрать и методом вытеснения воды. Для этого газоотводную трубку необходимо опустить в пробирку, заполненную водой, и опущенную в кристаллизатор с водой вниз отверстием. При поступлении кислорода газ вытесняет воду из пробирки.
Разложение пероксида водорода
Пероксид водорода – вещество всем известное. В аптеке оно продается под названием «перекись водорода». Данное название является устаревшим, более правильно использовать термин «пероксид». Химическая формула пероксида водорода Н2О2 Пероксид водорода при хранении медленно разлагается на воду и кислород. Чтобы ускорить процесс разложения можно произвести нагрев или применить катализатор.
Катализатор – вещество, ускоряющее скорость протекания химической реакции
Нальем в колбу пероксид водорода, внесем в жидкость катализатор. Катализатором может служить порошок черного цвета – оксид марганца MnO2. Тотчас смесь начнет вспениваться вследствие выделения большого количества кислорода. Внесем в колбу тлеющую лучину – она ярко вспыхивает. Уравнение реакции разложения пероксида водорода:
2H2O2 MnO2 → 2H2O + O2↑
Обратите внимание: катализатор, ускоряющий протекание реакции, записывается над стрелкой, или знаком «=», потому что он не расходуется в ходе реакции, а только ускоряет ее.
Разложение хлората калия
Хлорат калия – кристаллическое вещество белого цвета. Используется в производстве фейерверков и других различных пиротехнических изделий. Встречается тривиальное название этого вещества – «бертолетова соль». Такое название вещество получило в честь французского химика, впервые синтезировавшего его, – Клода Луи Бертолле. Химическая формула хлората калия KСlO3. При нагревании хлората калия в присутствии катализатора – оксида марганца MnO2, бертолетова соль разлагается по следующей схеме:
2KClO3 t°, MnO2 → 2KCl + 3O2↑.
Разложение нитратов
Нитраты – вещества, содержащие в своем составе ионы NO3⎺. Соединения данного класса используются в качестве минеральных удобрений, входят в состав пиротехнических изделий.
Нитраты – соединения термически нестойкие, и при нагревании разлагаются с выделением кислорода:
Обратите внимание, что все рассмотренные способы получения кислорода схожи. Во всех случаях кислород выделяется при разложении более сложных веществ.
Реакция разложения – реакция, в результате которой сложные вещества разлагаются на более простые В общем виде реакцию разложения можно описать буквенной схемой:
Реакции разложения могут протекать при действии различных факторов. Это может быть нагревание, действие электрического тока, применение катализатора. Существуют реакции, в которых вещества разлагаются самопроизвольно.
Получение кислорода в промышленности
В промышленности кислород получают путем выделения его из воздуха.
Воздух – смесь газов, основные компоненты которой представлены в таблице.
Сущность этого способа заключается в глубоком охлаждении воздуха с превращением его в жидкость, что при нормальном атмосферном давлении может быть достигнуто при температуре около -192°С. Разделение жидкости на кислород и азот осуществляется путем использования разности температур их кипения, а именно: Ткип.
N2 = -196°С (при нормальном атмосферном давлении).
При постепенном испарении жидкости в газообразную фазу в первую очередь будет переходить азот, имеющий более низкую температуру кипения, и, по мере его выделения, жидкость будет обогащаться кислородом. Многократное повторение этого процесса позволяет получить кислород и азот требуемой чистоты. Такой способ разделения жидкостей на составные части называется ректификацией жидкого воздуха.
- В лаборатории кислород получают реакциями разложения
- Реакция разложения – реакция, в результате которой сложные вещества разлагаются на более простые
- Кислород можно собрать методом вытеснения воздуха или методом вытеснения воды
- Для обнаружения кислорода используют тлеющую лучину, она ярко вспыхивает в нем
- Катализатор – вещество, ускоряющее химическую реакцию, но не расходующееся в ней
Тема урока «Кислород и водород. Получение, свойства, применение»
Разделы: Химия
Цель урока: закрепить знания учащихся о кислороде и водороде как химических элементах и простых веществах, способах их получения и практическом использовании.
- Обучающие:
закрепить на уровне атомно-молекулярной теории представления о кислороде и водороде, как химических элементах, простых веществ; понятии аллотропия, катализатор;
продолжить формировать практические умения по обращению с химическим оборудованием и реактивами. - Развивающие: развивать познавательные умения (умение наблюдать, сравнивать, делать выводы).
- Воспитывающие:
воспитывать аккуратность при выполнении эксперимента;
воспитывать коммуникативные умения.
Оборудование и реактивы: раствор перекиси водорода 3%, оксид марганца (IV), приборы для получения кислорода и водорода, спички, спиртовка, лучинка, гранулы цинка, соляная кислота. Таблицы “Кислород в природе”, “Электрохимический ряд металлов”, CD диск “Виртуальная лаборатория”.
Девиз: “Незнающие пусть научатся, а знающие вспомнят еще раз”
Учитель: Сегодня предметом нашего внимания будут кислород и водород, которые имеют большое значение для жизни на нашей планете. Мы повторим их способы получения, свойства и области применения. Начнем урок с устного химического диктанта. Я буду задавать вопросы, а вы должны определить о каком химическом элементе или образованном им веществе идет речь.
Узнай “Кто я?”. (Слайд 2; 3)
Самый распространенный химический элемент на Земле?
Самый распространенный химический элемент во Вселенной?
Массовая доля этого элемента в организме человека составляет 61%?
В твердом состоянии притягивается магнитом?
Самый легкий газ на нашей планете?
Образуется в результате реакций замещения между металлом и кислотой?
Этот элемент образует два простых вещества, одно из которых имеет запах свежести?
Является хорошим восстановителем?
В составе воздуха на него приходится 21%?
Необходим для дыхания?
Его открыл Лавуазье?
Его открыл Кавендиш?
Учитель: А теперь вспомним, как получаются эти газы (на столе стоят приборы для собирания газов).
Каким прибором необходимо воспользоваться для получения и собирания водорода? Почему?
Что нужно взять для получения водорода?
А любой ли металл для этого подходит?
Игра “Третий лишний”.
Какой металл не будет вытеснять водород из кислот? (Слайды 4; 5)
| А) Mg, AI, Cu. | Б) Ag, Fe, Na. |
Давайте проведем опыт по получению водорода. Как доказать его наличие? Почему необходимо проверять водород на чистоту? (ученик получает водород и доказывает его наличие).
Каким прибором необходимо воспользоваться для получения и собирания кислорода? Почему?
Какими способами можно собирать кислород? Почему?
Из какого вещества мы на практической работе получали кислород?
Как мы доказываем, что получили кислород?
Из какого еще вещества можно получить кислород? (Из перекиси водорода). Какое вещество необходимо добавить к перекиси водорода? Чем оно является? Что называется катализатором?
Один ученик проделывает опыт по получению кислорода из перекиси водорода. Учащиеся записывают уравнение реакции его получения.
Учитель: Так как получение кислорода в больших количествах дорогостоящий процесс, мы воспользуемся “Виртуальной лабораторией”, чтобы продемонстрировать свойства кислорода. (Ученики работают с CD диском. Проделывают реакции горения угля, серы и железа в кислороде и записывают уравнения реакций).
Учитель: С какими веществами взаимодействует кислород? (С неметаллами, металлами, сложными веществами). Что при этом образуется? Что называется оксидами?
Игра в “крестики-нолики” (Слайд 6)
| CaO | HCI | PH3 |
| S | BaO | Cu |
| H2O | H2S | AI2O3 |
(Выигрышный путь – формулы оксидов.)
На доске написаны уравнения химических реакций. Найдите допущенные там ошибки: (Слайды 7; 8)
Чем является водород в химических реакциях с оксидами металлов?
К нам поступила телеграмма: “Пропали вещества, вместо них появились многоточия” Текст этой телеграммы перед Вами. Напишите пропавшие вещества и расставьте коэффициенты.
ТЕЛЕГРАММА (Слайд 9; 11)
Осуществите цепочку превращений. (Слайд 10; 12)
| H2 O→ O2 →CuO →Cu | KMnO4 → O2 → H2 O→ H2 |
А как получали водород в прошлом? Один из самых старых способов – взаимодействие водяного пара с раскаленным железом – способ Лавуазье.
Таким способом его получали в России в царской армии для наполнения воздушных шаров, пропуская пар через раскаленные дула пушек. Таким же способом его получали в блокадном Ленинграде для наполнения аэростатов воздушного заграждения.
Вычислите объем выделившегося водорода, если в реакцию вступило 2 моль воды?
Где сейчас используются водород и кислород?
Водород: (Слайды 13–18)
Протекающие в звездах (и на Солнце) превращения атомов водорода в атомы гелия сопровождаются выделением огромного количества тепла и света. Без них жизнь на Земле была бы невозможна.
Значительная часть расходуется на производство аммиака, являющегося сырьем для получения пластмасс, синтетических волокон, лекарственных препаратов.
Небольшое количество водорода используется в пищевой промышленности для преобразования жидких растительных масел в маргарин.
Жидкий водород применяется как ракетное топливо. Исследуется возможность использования водорода в двигателях внутреннего сгорания. Создано множество вариантов водородных двигателей для автомобилей. Но пока водород в 4 раза дороже бензина. Возможно, что в будущем топливом номер один будет “металлический” водород.
Кислород: (Слайды 19–25)
Необходим для дыхания. Достаточно 7–8 минут прекращения поступления кислорода в кровь, чтобы в коре головного мозга произошли необратимые изменения и восстановление жизни стало практически невозможным.
Используют в химической промышленности для получения оксидов, кислот, пластмасс.
Используется при выплавке чугуна и стали.
Жидкий кислород используется в ракетных двигателях.
На высоте 15–25 км образует озоновый слой, состоящий из атомов кислорода, который защищает Землю от жестких ультрафиолетовых лучей.
Используется при сварке и резке металлов.
Применяется для ускорения процессов окисления (горения).
В санаториях больным предлагают кислородный коктейль, который готовят путем пропускания сильной струи кислорода через фруктовые соки. Применение кислородного коктейля снимает усталость, повышает производительность труда, улучшает общее самочувствие и способствует нормализации сна.
Учитель: Знакомство с соединениями, в которые входят кислород и водород, мы продолжим на последующих уроках.
Урок 17. Получение кислорода
В уроке 17 «Получение кислорода» из курса «Химия для чайников» выясним, как получают кислород в лабораторных условиях; узнаем, что такое катализатор, и как растения влияют на производство кислорода на нашей планете.
Наиболее важным для человека и других живых организмов веществом, входящим в состав воздуха, является кислород. Большие количества кислорода используются в промышленности, поэтому важно знать, как можно его получать.
Получение кислорода в лабораторных условиях
В химической лаборатории кислород можно получать нагреванием некоторых сложных веществ, в состав которых входят атомы кислорода. К числу таких веществ относится вещество KMnO4, которое имеется в вашей домашней аптечке под названием «марганцовка».
Вы знакомы с простейшими приборами для получения газов. Если в один из таких приборов поместить немного порошка KMnO4 и нагреть, то будет выделяться кислород (рис. 76):
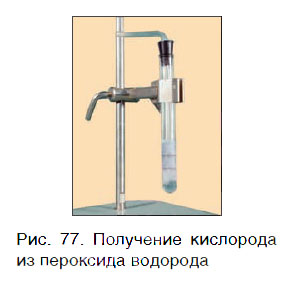
Кислород можно также получить разложением пероксида водорода H2O2. Для этого в пробирку с H2O2 следует добавить очень небольшое количество особого вещества — катализатора — и закрыть пробирку пробкой с газоотводной трубкой (рис. 77).
Для данной реакции катализатором является вещество, формула которого MnO2. При этом протекает следующая химическая реакция:
Обратите внимание на то, что ни в левой, ни в правой частях уравнения формулы катализатора нет. Его формулу принято записывать в уравнении реакции над знаком равенства. Для чего же добавляется катализатор? Процесс разложения H2O2 при комнатных условиях протекает очень медленно. Поэтому для получения заметных количеств кислорода необходимо много времени. Однако эту реакцию можно резко ускорить путем прибавления катализатора.
Катализатор — это вещество, которое ускоряет химическую реакцию, но само в ней не расходуется.
Именно потому, что катализатор не расходуется в реакции, мы не записываем его формулу ни в одной из частей уравнения реакции.
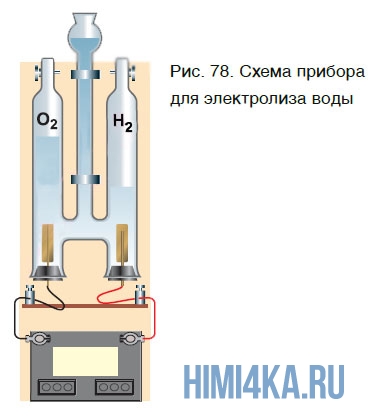
Еще один способ получения кислорода — разложение воды под действием постоянного электрического тока. Этот процесс называется электролизом воды. Получить кислород можно в приборе, схематично изображенном на рисунке 78.
При этом протекает следующая химическая реакция:
Кислород в природе
Огромное количество газообразного кислорода содержится в атмосфере, растворено в водах морей и океанов. Кислород необходим всем живым организмам для дыхания. Без кислорода невозможно было бы получать энергию за счет сжигания различных видов топлива. На эти нужды ежегодно расходуется примерно 2% атмосферного кислорода.
Откуда берется кислород на Земле и почему его количество остается примерно постоянным, несмотря на такой расход? Единственным источником кислорода на нашей планете являются зеленые растения, производящие его под действием солнечного света в процессе фотосинтеза. Это очень сложный процесс, включающий много стадий. В результате фотосинтеза в зеленых частях растений углекислый газ и вода превращаются в глюкозу C6H12O6 и кислород. Суммарное
уравнение реакций, протекающих в процессе фотосинтеза, можно представить следующим образом:
Установлено, что примерно одну десятую часть (11%) производимого зелеными растениями кислорода дают наземные растения, а остальные девять десятых (89%) — водные растения.
Получение кислорода и азота из воздуха
Огромные запасы кислорода в атмосфере позволяют получать и использовать его в различных производствах. В промышленных условиях кислород, азот и некоторые другие газы (аргон, неон) получают из воздуха.
Для этого воздух сначала превращают в жидкость (рис. 79) путем охлаждения до такой низкой температуры, при которой все его компоненты переходят в жидкое агрегатное состояние.
Затем эту жидкость медленно нагревают, в результате чего при разных температурах происходит последовательное выкипание (т. е. переход в газообразное состояние) веществ, которые содержатся в воздухе. Собирая выкипающие при разных температурах газы, по отдельности получают азот, кислород и другие вещества.
Краткие выводы урока:
- В лабораторных условиях кислород получают разложением некоторых сложных веществ, в состав которых входят атомы кислорода.
- Катализатор — вещество, которое ускоряет протекание химической реакции, но само при этом не расходуется.
- Источником кислорода на нашей планете являются зеленые растения, в которых протекает процесс фотосинтеза.
- В промышленности кислород получают из воздуха.
Надеюсь урок 17 «Получение кислорода» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
http://urok.1sept.ru/articles/568777
http://himi4ka.ru/arhiv-urokov/urok-17-poluchenie-kisloroda.html