Уравнения реакций взаимодействия кислорода с бором
Среди элементов IIIa группы один лишь бор относится к неметаллам. Представляет собой аморфное кристаллическое вещество красного или темного цвета, может быть бесцветным.
Общая характеристика элементов IIIa группы
От B к Tl (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств. Уменьшается электроотрицательность, энергия ионизация, сродство к электрону.
Оксид бора проявляется кислотные свойства, алюминий и галлий — типичные амфотерные элементы, у соединений индий и таллия преобладают основные свойства.
Электронные конфигурации у данных элементов схожи, так как они находятся в одной группе (главной подгруппе!), общая формула ns 2 np 1 :
- B — 2s 2 2p 1
- Al — 3s 2 3p 1
- Ga — 4s 2 4p 1
- In — 5s 2 5p 1
- Tl — 6s 2 6p 1
Природные соединения
Получение
Бор получают путем пиролиза бороводородов, методом металлотермии (вытеснением активным металлом) и термическим разложением бромида бора в присутствии катализатора
BBr3 + H2 → (вольфрам, t = 1000-1200 С°) B + HBr
Химические свойства
- Реакции с фтором
Необходимо заметить, что бор довольно инертный неметалл. При комнатной температуре без нагревания он реагирует только со фтором:
Реакции с неметаллами
При нагревании бор реагирует с другими галогенами, азотом, фосфором, углеродом и кислородом.
При сильном нагревании бор способен восстановить кремний из его оксида:
Ионы бора окрашивают пламя в оттенки зеленого цвета.
Оксид и гидроксид бора
Оксид и гидроксид бора (борная кислота) проявляют кислотные свойства.
© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Бор (B)
Первыми бор получили французы Гей-Люссак и Тенар в 1808 году.
В природе элементарный бор не встречается. Почит во всех минералах бор связан с кислородом, он встречается в небольших концентрациях во многих природных соединениях, в виде боратов и боросиликатов, в изверженных и осадочных породах, в водах морей, соляных озер, горячих гейзеров, грязевых вулканов.
Электронная конфигурация бора — 1s 2 2s 2 2p 1 (см. Электронная структура атомов).
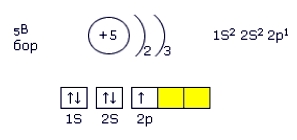
Рис. Электронная конфигурация атома бора.
На внешнем электронном слое бора находятся три электрона, которые он может либо отдавать, либо принимать еще 3, проявляя кислотность +3 или -3.
Бор, как простое вещество
Бор является инертным (при н. у.) неметаллом, образует ряд аллотропных модификаций, отличающихся строением кристаллической решетки — это самое твердное (после алмаза) природное вещество, обладающее малой электропроводностью. Свойства бора во многом зависят от его модификации и чистоты.
Химические свойства бора:
- при комнатной температуре бор вступает в реакцию только со фтором;
- при t=500-700°C реагирует с кислородом, серой, хлором: 4B + 3O2 = 2B2O3;
- при t=1200°C реагинует с кремнием (силицид бора) и азотом (нитрид бора): 3B + Si = B3Si;
- при t=2000°C реагинует с углеродом: 3C + 12B = B12C3;
- в сплавах с металлами бор образует бориды различного состава (в зависимости от условий сплавления и концентрации бора): Ni + 2B = NiB2; 2Ni + B = Ni2B;
- с парами воды бор вступает в реакцию при температуре красного каления: 6H2O + 2B = 2H3BO3 + 3H2.
- взаимодействует с горячими концентрированными азотной и серной кислотой, а также царской водкой: 3HNO3 + B = 3NO2 + H3BO3.
- с кислотами неокислителями бор не реагирует.
Соединения бора
Борная кислота (H3BO3) — это слабая одноосновная кислота, представляет собой растворимое в воде бесцветное кристаллическое вещество.
Борную кислоту получают из минерала сассолина.
Кислотные свойства борной кислоты обусловлены образованием протона при ее взаимодействии с водой:
При нагревании борная кислота, теряя воду, превращается в метаборную кислоту:
Борная кислота применяется как дезинфицирующее и антисептическое средство, для изготовления эмалей, специальных стекол, цементов, косметики, средств гигиены.
Борный ангидрид (B2O3) — диэлектрическое бесцветное кристаллическое вещество, легко переходящее в стеклообразное состояние.
Энергично вступает в реакцию с водой, образуя борную кислоту: B2O3 + 3H2O = 2H3BO3.
Получение борного ангидрида:
Борный ангидрид нашел применение в производстве специальных стекол и для получения бора.
Получение бора:
- металлотермией получают аморфный «грязый» бор (магний и натрий выступают в роли восстановителей): B2O3 + 3Mg = 2B + 3MgO;
- кристаллический бор высокой частоты получают при температуре 800°C восстановлением галогенидов бора водородом: 2BBr3 + 3H2 = 6HBr + 2B;
- промышленным способом бор получают электролизом расплава K[BF4] и B2O3 (t=800-1000°C).
Применение бора:
- в изготовлении полупроводников (бор — полупроводник p-типа с дырочной проводимостью);
- для изготовления огнеупорных, кислотостойких материалов (силициды устойчивы к действию воды, щелочей, кислот, высокой температуры);
- в качестве металлургических добавок при изготовлении жаропрочной, механически и коррозионноустойчивой стали;
- для изготовления деталей реактивных двигателей, газовых турбин, работающих в тяжелых условиях высоких температур;
- в ядерной энергетике для изготовления замедлителей быстрых нейтронов и для биологической защиты.
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
Кислород: химия кислорода
Кислород
Положение в периодической системе химических элементов
Кислород расположен в главной подгруппе VI группы (или в 16 группе в современной форме ПСХЭ) и во втором периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение кислорода
Электронная конфигурация кислорода в основном состоянии :
+8O 1s 2 2s 2 2p 4 1s 

Атом кислорода содержит на внешнем энергетическом уровне 2 неспаренных электрона и 2 неподеленные электронные пары в основном энергетическом состоянии.
Физические свойства и нахождение в природе
Кислород О2 — газ без цвета, вкуса и запаха, немного тяжелее воздуха. Плохо растворим в воде. Жидкий кислород – голубоватая жидкость, кипящая при -183 о С.
Озон О3 — при нормальных условиях газ голубого цвета со специфическим запахом, молекула которого состоит из трёх атомов кислорода.
Кислород — это самый распространённый в земной коре элемент. Кислород входит в состав многих минералов — силикатов, карбонатов и др. Массовая доля элемента кислорода в земной коре — около 47 %. Массовая доля элемента кислорода в морской и пресной воде составляет 85,82 %.
В атмосфере содержание свободного кислорода составляет 20,95 % по объёму и 23,10 % по массе.
Способы получения кислорода
В промышленности кислород получают перегонкой жидкого воздуха.
Лабораторные способы получения кислорода:
- Разложение некоторых кислородосодержащих веществ:
Разложение перманганата калия:
Разложение бертолетовой соли в присутствии катализатора MnO2 :
2KClO3 → 2KCl + 3O2
Разложение пероксида водорода:
2HgO → 2Hg + O2
Соединения кислорода
Основные степени окисления кислород +2, +1, 0, -1 и -2.
| Степень окисления | Типичные соединения |
| +2 | Фторид кислорода OF2 |
| +1 | Пероксофторид кислорода O2F2 |
| -1 | Пероксид водорода H2O2 Пероксид натрия Na2O2 и др. |
| -2 | Вода H2O Оксиды металлов и неметаллов Na2O, SO2 и др. Соли кислородсодержащих кислот Кислородсодержащие органические вещества Основания и амфотерные гидроксиды |
Химические свойства
При нормальных условиях чистый кислород — очень активное вещество, сильный окислитель. В составе воздуха окислительные свойства кислорода не столь явно выражены.
1. Кислород проявляет свойства окислителя (с большинством химических элементов) и свойства восстановителя (только с более электроотрицательным фтором). В качестве окислителя кислород реагирует и с металлами , и с неметаллами . Большинство реакций сгорания простых веществ в кислороде протекает очень бурно, иногда со взрывом.
1.1. Кислород реагирует с фтором с образованием фторидов кислорода:
С хлором и бромом кислород практически не реагирует, взаимодействует только в специфических очень жестких условиях.
1.2. Кислород реагирует с серой и кремнием с образованием оксидов:
1.3. Фосфор горит в кислороде с образованием оксидов:
При недостатке кислорода возможно образование оксида фосфора (III):
Но чаще фосфор сгорает до оксида фосфора (V):
1.4. С азотом кислород реагирует при действии электрического разряда, либо при очень высокой температуре (2000 о С), образуя оксид азота (II):
N2 + O2→ 2NO
1.5. В реакциях с щелочноземельными металлами, литием и алюминием кислород также проявляет свойства окислителя. При этом образуются оксиды:
2Ca + O2 → 2CaO
Однако при горении натрия в кислороде преимущественно образуется пероксид натрия:
2Na + O2→ Na2O2
А вот калий, рубидий и цезий при сгорании образуют смесь продуктов, преимущественно надпероксид:
K + O2→ KO2
Переходные металлы окисляются кислород обычно до устойчивых степеней окисления.
Цинк окисляется до оксида цинка (II):
2Zn + O2→ 2ZnO
Железо , в зависимости от количества кислорода, образуется либо оксид железа (II), либо оксид железа (III), либо железную окалину:
2Fe + O2→ 2FeO
4Fe + 3O2→ 2Fe2O3
3Fe + 2O2→ Fe3O4
1.6. При нагревании с избытком кислорода графит горит , образуя оксид углерода (IV):
при недостатке кислорода образуется угарный газ СО:
2C + O2 → 2CO
Алмаз горит при высоких температурах:
Горение алмаза в жидком кислороде:
Графит также горит:
Графит также горит, например, в жидком кислороде:
Графитовые стержни под напряжением:
2. Кислород взаимодействует со сложными веществами:
2.1. Кислород окисляет бинарные соединения металлов и неметаллов: сульфиды, фосфиды, карбиды, гидриды . При этом образуются оксиды:
4FeS + 7O2→ 2Fe2O3 + 4SO2
Ca3P2 + 4O2→ 3CaO + P2O5
2.2. Кислород окисляет бинарные соединения неметаллов:
- летучие водородные соединения ( сероводород, аммиак, метан, силан гидриды . При этом также образуются оксиды:
2H2S + 3O2→ 2H2O + 2SO2
Аммиак горит с образованием простого вещества, азота:
4NH3 + 3O2→ 2N2 + 6H2O
Аммиак окисляется на катализаторе (например, губчатое железо) до оксида азота (II):
4NH3 + 5O2→ 4NO + 6H2O
- прочие бинарные соединения неметаллов — как правило, соединения серы, углерода, фосфора ( сероуглерод, сульфид фосфора и др.):
CS2 + 3O2→ CO2 + 2SO2
- некоторые оксиды элементов в промежуточных степенях окисления ( оксид углерода (II), оксид железа (II) и др.):
2CO + O2→ 2CO2
2.3. Кислород окисляет гидроксиды и соли металлов в промежуточных степенях окисления в водных растворах.
Например , кислород окисляет гидроксид железа (II):
Кислород окисляет азотистую кислоту :
2.4. Кислород окисляет большинство органических веществ. При этом возможно жесткое окисление (горение) до углекислого газа, угарного газа или углерода:
CH4 + 2O2→ CO2 + 2H2O
2CH4 + 3O2→ 2CO + 4H2O
CH4 + O2→ C + 2H2O
Также возможно каталитическое окисление многих органических веществ (алкенов, спиртов, альдегидов и др.)
http://prosto-o-slognom.ru/chimia/508_bor_B.html
http://chemege.ru/kislorod/









