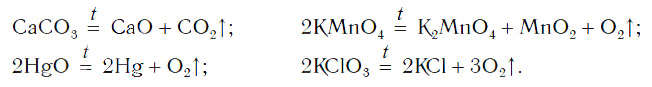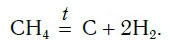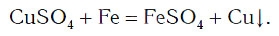Реакции замещения
Тип урока. Приобретение новых знаний.
Вид урока. Лабораторная работа.
Обучающие – рассмотреть новый тип реакций – реакции замещения; научить учащихся писать уравнения реакций замещения; формировать умение предсказывать продукты реакций замещения; дать первоначальные понятия об электрохимическом ряде напряжений металлов.
Развивающие – развивать умения ставить несложные проблемы, формулировать гипотезы и проводить их опытную проверку; совершенствовать умения работать с лабораторным оборудованием и реактивами; продолжить формирование умений оформлять результаты учебного эксперимента; развивать способность к адекватному само- и взаимоконтролю.
Воспитательные – продолжить формирование научного мировоззрения учащихся; воспитывать культуру общения через работу в парах «ученик–ученик», «учитель–ученик», а также наблюдательность, внимание, пытливость, инициативу.
Методы и методические приемы. Лабораторная работа; фронтальный опрос; самостоятельная работа с карточками, взаимопроверка результатов самостоятельной работы в парах, выставление отметок; работа с наглядными средствами – периодической системой химических элементов Д.И.Менделеева и карточками.
Оборудование и реактивы. Кодоскоп, карточки с заданиями для самостоятельной работы по теме «Реакции разложения и соединения», карточки с таблицей «Классификация реакций на основании количества и состава реагирующих веществ», лабораторный штатив с пробирками, кристаллизатор, прибор для получения водорода, лучинка, спички; цинк и магний в гранулах, железный гвоздь, медная проволока, растворы – соляной кислоты, хлорида меди(II), хлорида железа(II).
Учитель. Думаю, что урок вам понравится, вы узнаете много нового. Сегодня вы не соскучитесь, потому что сами будете проводить опыты. Но для начала проверим материал прошлого урока.

Проводится фронтальный опрос, во время которого трое учащихся записывают на доске решение домашних упражнений (Габриелян О.С. «Химия-8», М.: изд-во «Дрофа», 2002, упр. 1а, б; 2г; с. 100.)
Учитель. На прошлом уроке* вы познакомились с классификацией химических реакций. По каким признакам классифицируют реакции?
Ученик. Реакции классифицируют по количеству вступивших и образовавшихся веществ и по их составу.
Учитель. С реакциями каких типов вы познакомились?
Ученик. С реакциями разложения и соединения.
Учитель. Дайте определение реакции разложения.
Ученик. Реакцией разложения называется реакция, в результате которой из одного сложного вещества образуется несколько простых или сложных веществ.
Учитель. Какая реакция называется реакцией соединения?
Ученик. Реакцией соединения называется реакция, в результате которой из двух или более простых или сложных веществ образуется одно сложное вещество.
Учитель. Для чего в схемах химических реакций расставляют коэффициенты?
Ученик. Для того, чтобы соблюдался закон сохранения массы веществ.
Учитель проверяет домашние упражнения, выполненные на доске, ученики задают дополнительные вопросы отвечающим, выставляются оценки.
Задание 1а, б, с. 100. Запишите в виде химических уравнений следующие предложения:
а) при обжиге карбоната кальция образуются оксид кальция и оксид углерода(IV);
б) при взаимодействии оксида фосфора(V) с водой образуется фосфорная кислота.
Укажите типы этих реакций. Какая из них экзотермическая, а какая – эндотермическая?
Первая – реакция разложения, эндотермическая:
СаСО3 
Вторая – реакция соединения, экзотермическая:
Задание 2г, с. 100. Составьте уравнение по следующей схеме и укажите тип реакции:
СuОН 
Под формулами веществ напишите их названия.
Тип реакции – разложение:
Учитель. Следующий этап урока – самостоятельная работа на два варианта.
Самостоятельная работа (8–10 мин)
Задание. Расставьте коэффициенты, укажите типы химических реакций.
1) MgO + CO2 
2) NO2 + O2 + H2O 
3) Na2O + H2O 
4) KClO3 
5) CO + O2 
1) KNO3 
2) SO2 + O2 
3) SO3 + H2O 
4) K2O + H2O 
5) NO + O2 
Максимально можно набрать 10 баллов (по 1 баллу за правильно указанный тип химической реакции и по 1 баллу за правильно расставленные коэффициенты).
На «5» – 10–9 баллов,
на «4» – 8–7 баллов,
на «3» – 6–5 баллов.
После выполнения заданий учащиеся, сидящие за одной партой, обмениваются работами. Ученики взаимно проверяют работы с помощью кодоскопа, им выставляют отметки по вышеуказанным критериям.
Учитель. Сейчас вы познакомитесь еще с одним типом химических реакций – реакциями замещения, научитесь записывать уравнения этих реакций, предсказывать, какие вещества должны образоваться, потренируетесь в расстановке коэффициентов.

Учитель. Какие ассоциации вызывает у вас название «реакция замещения»?
Выслушать все мнения, выбрать предположение о том, что одно должно замещаться другим.
Учитель. Каким по составу – простым или сложным – должно быть вещество, которое замещает элемент сложного вещества?
Ученик. Простым.
Учитель. Каким должен быть состав вещества, в котором происходит замещение?
Ученик. Это вещество должно быть сложным, чтобы атомы одного элемента могли замещаться, а атомы других элементов остались.
Учитель. Обозначим простое вещество буквой А, а сложное вещество – двумя буквами – ВС. Как в этом случае записать общую схему реакции замещения?
Ученик у доски записывает общую схему реакции замещения, учащиеся на местах делают записи в таблицу (табл. 1), которую начали заполнять на прошлом уроке.
| Тип реакции | Уравнения реакций в общем виде |
|---|---|
| Реакция соединения | Соединение двух (нескольких) простых веществ в одно сложное вещество: А + В = АВ. Соединение двух бинарных веществ в одно трехэлементное сложное вещество: АВ + СВ = АСВ2 |
| Реакция разложения | Разложение сложного вещества на два (несколько) простых вещества: АВ = А + В. Разложение трехэлементного сложного вещества на два бинарных вещества: АСВ2 = АВ + ВС |
| Реакция замещения | Взаимодействие простого вещества со сложным, в результате которого образуются другие – простое и сложное – вещества: А + ВС = В + АС |
Учитель. Реакцией замещения называется реакция, в которой участвуют одно простое и одно сложное вещество, при этом атомы простого вещества замещают один из видов атомов в сложном веществе и образуются новые вещества – простое и сложное (запись определения в тетрадь).
Рассмотрим на практике реакции замещения. Для этого проведем лабораторную работу. (Учащиеся получают карточки с таблицей (табл. 2) для составления отчета по лабораторной работе «Реакции замещения»). В карточке заполнена графа, дающая представление о том, что нужно сделать. Две другие графы вы заполните после выполнения опытов.
Прежде чем приступить к выполнению опытов, вспомните, что работать с растворами кислот нужно осторожно, т. к. они опасны. С растворами работайте по принципу «не разлей», с твердыми веществами – по принципу «не рассыпь». Опыт проводить над кристаллизатором. Вещества наливать и насыпать в небольших количествах.
Приступаем к выполнению опыта № 1.
Лабораторная работа «Реакции замещения»
| № опыта | Ход работы (что нужно сделать) | Наблюдения (что увидели) | Уравнения химических реакций, выводы |
|---|---|---|---|
| 1 | Налейте в пробирку раствор соляной кислоты, затем добавьте гранулу цинка | Выделяются пузырьки газа | Произошла химическая реакция: Zn + 2HCl = ZnCl2 + H2  . Это реакция замещения, цинк вытеснил водород из соляной кислоты . Это реакция замещения, цинк вытеснил водород из соляной кислоты |
| 2 | Налейте в пробирку раствор соляной кислоты, затем добавьте гранулу магния | Выделяются пузырьки газа | Произошла химическая реакция: Mg + 2HCl = MgCl2 + H2  . Это реакция замещения, магний вытеснил водород из соляной кислоты . Это реакция замещения, магний вытеснил водород из соляной кислоты |
| 3 | Налейте в пробирку раствор хлорида меди(II), опустите в раствор железный гвоздь | Гвоздь покрывается красным налетом | Произошла химическая реакция: Fe + CuCl2 = FeCl2 + Cu. Это реакция замещения, железо вытеснило медь из раствора соли |
| 4 | Налейте в пробирку раствор хлорида железа(II) и опустите в раствор медную проволоку | Никаких изменений не происходит | Эта реакция невозможна: FeCl2 + Cu  .Менее активная медь не может вытеснить более активное железо из раствора соли .Менее активная медь не может вытеснить более активное железо из раствора соли |
Фронтальная беседа
(обсуждение результатов опыта)
Учитель. Можем ли мы сказать, что произошла химическая реакция?
Ученик. Да, поскольку выделился газ.
Учитель. Чтобы составить уравнение химической реакции, надо предположить, какие вещества образовались в результате этой реакции. (Учитель у доски объясняет принцип составления уравнений реакций такого типа и предлагает учащимся самостоятельно расставить коэффициенты.)
Из уравнения реакции видно, что получился газ водород. Открою вам маленький секрет: вы сейчас прошли тем же путем, который проделал английский химик Генри Кавендиш. Именно он предложил такой способ получения водорода в лаборатории.
Но водород еще нужно собрать. Догадайтесь, как собрать водород в другую пробирку.
Правило при работе с кислотами:
«Не разлей!» Фото Л.Ларионовой
Ученик. Нужно закрыть пробирку пробкой с газоотводной трубкой, конец которой опустить в другую пробирку.
Учитель. Что находится в пустой пробирке?
Ученик. Воздух.
Учитель. Найдите относительную молекулярную массу водорода и скажите, что легче – водород или воздух?
Ученик. Легче водород, потому что его относительная молекулярная масса Mr(H2) равна двум.
Учитель. В этом случае пробирку, в которую собирают водород, необходимо перевернуть вверх дном. Такой способ собирания газов называется способом вытеснения воздуха.
Учитель проводит демонстрационный опыт. после этого учащиеся приступают к самостоятельному выполнению опыта № 2.
Фронтальная беседа
(обсуждение результатов опыта)
Учитель. Можем ли мы сказать, что произошла химическая реакция?
Ученик. Да, т.к. выделился газ.
Учитель. Предположите, какой газ выделился в результате этой химической реакции.
Ученик. В результате замещения атомов водорода в соляной кислоте на атомы магния выделился водород.
Учитель. Составьте уравнение этой химической реакции и расставьте в нем коэффициенты. Сравните скорости взаимодействия магния и цинка с соляной кислотой.
Оказывается, скорость взаимодействия металла с кислотой зависит от активности металла. Все металлы в зависимости от своей активности расположены в ряд. Этот ряд называется электрохимическим рядом напряжений металлов. Посмотрите, какой неметалл занесен в этот ряд.
Ученик. Неметалл в ряду металлов – водород.
Учитель. Металлы, стоящие в электрохимическом ряду напряжений до водорода, способны вытеснять его из растворов кислот. Будет ли медь вытеснять водород из раствора соляной кислоты?
Ученик. Нет, такая реакция невозможна, т.к. медь находится в электрохимическом ряду напряжений металлов за водородом.
Учитель демонстрирует опыты, подтверждающие выдвинутую гипотезу, и делает вывод, что электрохимический ряд напряжений металлов позволяет не только предсказывать продукты реакции, но и определять возможность протекания той или иной реакции.
Учащиеся выполняют опыты № 3 и 4.
Фронтальная беседа
(обсуждение результатов опыта)
Учитель. Что вы наблюдали при проведении этих опытов?
Ученик. В первой реакции гвоздь покрылся красным налетом меди, а во второй никаких изменений не произошло.
Учитель. Почему невозможна вторая реакция?
Ученик. Медь в электрохимическом ряду напряжений металлов находится правее железа, значит, она менее активна и не может его вытеснить.
Учитель. Запишите уравнения взаимодействия железа с хлоридом меди(II). (Результаты работы проверяются с помощью кодоскопа.)

Учитель. Итак, сегодня вы познакомились еще с одним типом химических реакций – реакциями замещения. Узнали, что продукты реакций замещения можно предсказывать, используя электрохимический ряд напряжений металлов. Теперь для закрепления полученных знаний выполните упражнения.
На доске предложены схемы реакций замещения. Укажите, какие из этих реакций можно осуществить, а какие – нет. Дайте развернутый ответ. (Спрашивать по одному ученику на составление каждого уравнения реакции.)
Задание. Расставьте коэффициенты в схемах возможных химических реакций.
Аg + Н2SO4 (р-р) 
Fe + НСl 
АgNO3 + Сu 
СuO + H2 
Al + FeSO4 
Fe(NO3)3 + Hg 
Аl + Н2SO4 (р-р) 
Ответ. Уравнения возможных реакций:
Заключительная часть. Учитель подводит итоги урока, анализирует полученные результаты.
Домашнее задание. По учебнику О.С.Габриеляна «Химия-8» § 27, упр. 2а, 3в, с. 100.
* См. № 7/2006, «Реакции разложения и соединения»
Литература
Габриелян О.С. Химия. 8 класс. М.: Дрофа, 2002, 208 с.; Габриелян О.С., Воскобойникова Н.П., Яшукова А.В. Настольная книга учителя. 8 класс. М.: Дрофа, 2002, 416 с.; Габриелян О.С., Смирнова Т.В. Изучаем химию в 8 классе. Методическое пособие к учебнику О.С.Габриеляна «Химия-8» для учащихся и учителей. М.: Блик и Ко, 2001, 224 с.; Кузнецова Н.Е., Титова И.М.,
Гара Н.Н., Жегин А.Ю. Химия. 8 класс. М: Вентана-Граф, 2003, 224 с.; Гин А. Приемы педагогической техники. Пособие для учителя. М.: Вита-Пресс, 2003, 88 с.
Урок 13. Типы химических реакций
В уроке 13 «Типы химических реакций» из курса «Химия для чайников» мы узнаем о типах химических реакций; подробно рассмотрим каждый тип и научимся их различать.
Мир химических реакций весьма разнообразен. Самые различные химические реакции постоянно происходят в природе, осуществляются человеком. Можно ли классифицировать химические реакции? Что положить в основу их классификации? Сущность всякой химической реакции состоит в превращении веществ: разрушаются исходные вещества и образуются продукты реакций, меняется число и состав исходных веществ и продуктов реакции. Характер этих изменений и положен в основу классификации химических реакций.
Реакции соединения
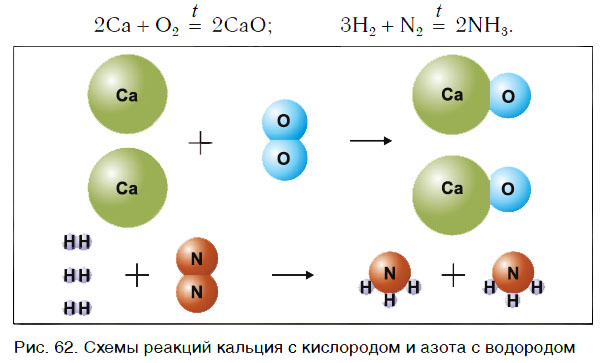
Рассмотрим уравнения следующих реакций (рис. 62):
Чем сходны данные реакции между собой? Тем, что в результате взаимодействия двух веществ получается только одно вещество. Такие реакции получили название реакций соединения.
Реакции соединения — это реакции, в результате которых из двух или нескольких веществ образуется одно новое сложное вещество.
В одних случаях из двух простых веществ получается одно сложное, в других — соединяются два и более простых или сложных веществ:
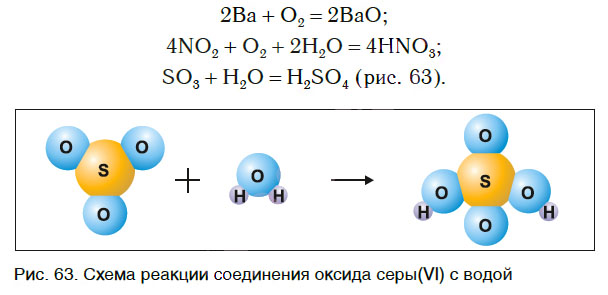
Реакции разложения
Рассмотрим уравнения следующих реакций:
Можно заметить, что из одного сложного вещества получается два или более новых веществ. Это реакции разложения. В них могут образовываться как простые, так и сложные вещества.
Реакции разложения — это реакции, в результате которых из одного сложного вещества образуется несколько новых веществ.
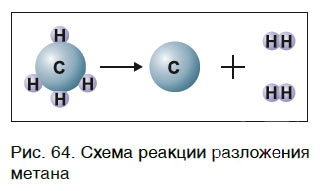
Для начала реакции разложения обычно необходимо нагреть исходные вещества. Например, негашеную известь CaO в промышленности получают нагреванием известняка CaCO3, реакция разложения происходит при температуре около 1000 °С. К такому типу реакций относится и реакция разложения метана CH4 (рис. 64) — составной части природного газа:
Реакции замещения
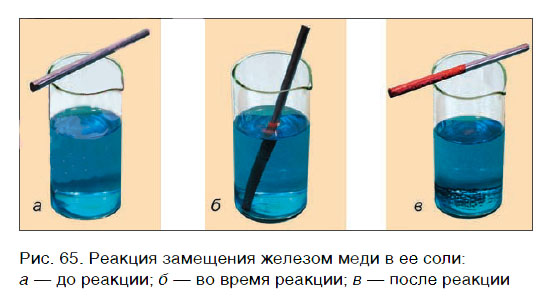
А могут ли взаимодействовать между собой два вещества: одно простое и одно сложное? Проверим это на опыте. В раствор медного купороса опустим небольшой кусочек железа — кнопку, гвоздь, канцелярскую скрепку с хорошо очищенной поверхностью. Через 2—3 мин извлечем железо из раствора и увидим, что на его поверхности образовался темно-красный налет меди. В химическую реакцию вступили простое (Fe) и сложное (CuSO4) вещества, и образовались новое простое (Cu) и новое сложное (FeSO4) вещества:
Из опыта и уравнения химической реакции хорошо видно, что атомы железа заместили атомы меди в сложном веществе (рис. 65). Такие химические реакции относятся к реакциям замещения.
Реакции замещения — это реакции, в результате которых атомы простого вещества замещают атомы одного из элементов в сложном веществе.
Для протекания таких реакций необходимо соблюдать некоторые особые условия. Не все простые вещества обязательно должны взаимодействовать со сложными веществами. В дальнейшем при изучении химии вы познакомитесь с этими условиями, а также с другими типами химических реакций.
Краткие выводы урока:
- Реакции соединения — это реакции, в результате которых из двух или нескольких веществ образуется одно новое сложное вещество.
- Реакции разложения — это реакции, в результате которых из одного сложного вещества образуется несколько новых веществ.
- Реакции замещения — это реакции, в которых атомы простого вещества замещают атомы одного из элементов в сложном веществе.
Надеюсь урок 13 «Типы химических реакций» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии. Если вопросов нет, то переходите к следующему уроку.
Урок по химии в 8 классе «Типы химических реакций. Реакции замещения и обмена»
Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
Урок по химии в 8 классе
Тема: «Типы химических реакций. Реакции замещения и обмена».
Образовательные: рассмотреть типы реакций по составу и сложности веществ – реакции замещения и обмена; обобщить сведения о типах химических реакций; закрепить умение составлять химические уравнения, описывать признаки реакций.
Развивающие: продолжить развитие умений наблюдать, сравнивать, обобщать, делать выводы, работать с химическими реактивами и оборудованием.
Воспитательные: воспитывать толерантность, уважение к научному познанию, умение работать в группе; совершенствовать коммуникативные умения в ходе выполнения опытов, развивать самостоятельность.
Требования к знаниям и умениям учащихся:
Должны знать и понимать: сущность понятия «химическая реакция» (взаимодействие, превращение), признаки и условия протекания химических реакций, типы реакций, правила написания химических уравнений, закон сохранения массы в современной формулировке, правила безопасной работы с веществами.
Должны уметь: определять тип химической реакции по данному уравнению, расставлять коэффициенты в данной схеме уравнения, доказывать закон сохранения массы по выведенному уравнению химической реакции, записывать уравнения реакций, самостоятельно производить несложные химические эксперименты, соблюдая правила безопасной работы.
Постановка учебной задачи, сообщение плана работы (слово учителя) –2 мин
Фронтальный опрос – 11 мин
Изучение нового материала, выполнение демонстрационного и лабораторных опытов учащимися – 25 мин
Повторение и проверка степени усвоения материала – 5 мин;
Подведение итогов и домашнее задание – 2 мин
Средства обучения: оборудование и реактивы для демонстрационных и лабораторных опытов учащихся, справочная таблица «Растворимость оснований, кислот и солей в воде», ряд активности металлов, учебник «Химия – 9» О,С,Габриелян (издательство ДРОФА,2012 г.), рабочая тетрадь к учебнику.
Тип урока – комбинированный.
Вид урока – беседа с демонстрационными и лабораторными опытами.
Оборудование (для учителя и учащихся): пробирки, штативы для пробирок, спиртовка, лучинка, спички, универсальная индикаторная бумага, предметное стекло, пипетка, держалка.
Реактивы: цинк (гранулы), алюминий, медь, стальные скрепки, растворы – гидроксид натрия, серная кислота, соляная кислота, сульфат меди ( II ), хлорид железа ( III ), карбонат натрия, хлорид калия, фенолфталеин.
Приветствие. Постановка учебной задачи, сообщение плана работы. Девиз урока:
«Скажи мне, и я забуду,
Покажи мне, и я запомню.
Дай мне действовать самому,
И я научусь!» (Древнекитайская мудрость)
Проверка домашнего задания.
1) Во время проверки домашнего задания учитель проверяет теоретические знания по пройденному материалу:
— какие классификации реакций вы знаете? (по тепловому эффекту и по составу и количеству веществ)
— на какие типы делятся реакции по тепловому эффекту? (эндотермические – идущие с поглощением тепла; экзотермические – идущие с выделением тепла)
— какие типы реакций вы знаете по количеству и составу веществ? (соединения и разложения)
— какие реакции называются реакциями разложения? (реакции, в результате которых из одного сложного вещества образуется несколько новых веществ)
— какие реакции называются реакциями соединения? (реакции, в результате которых из нескольких веществ образуется одно сложное вещество);
2) Визуально проверяет выполнение упр. 1 стр. 177 и упр. 1,2 стр.182;
3) Разбираются реакции, вызвавшие затруднения;
4) Проводится выполнение упр. 7,6 стр. 110 (РТ):
Упр.7 стр. 110 (РТ) (под диктовку с места):
а) 2 Na + Cl 2 → 2 NaCl (соединение)
в) 2 Fe ( OH )3 → Fe 2 O 3 + 3 H 2 O (разложение)
г) 4 Al + 3 O 2 → 2 Al 2 O 3 (соединение)
д) 2 AgBr → 2 Ag + Br 2 (разложение)
е) Na 2 O + H 2 O → 2 NaOH (соединение)
Упр. 6 стр. 110 (РТ) (по одному ученики вызываются к доске):
Во время написания уравнений проверяется умения записывать формулы по названиям веществ, называть вещества по формулам, расставлять стехиометрические коэффициенты в уравнении реакций; знания классов неорганических веществ и выученных типов химических реакций.
На доску вывешиваются карточки – подсказки по типам реакций.
Изучение нового материала.
1) Реакции замещения. Проведение лабораторного опыта №1 «Взаимодействие металлов с соляной кислотой». Повторение правил техники безопасности при проведении опытов. Повторение признаков химических реакций (выпадение или исчезновение осадка, выделение газа, появление запаха, изменение цвета, выделение тепла и света, поглощение тепла). Класс работает по вариантам:
1 – взаимодействие цинка с кислотой ( Zn + 2 HCl → ZnCl 2 + H 2↑);
2 – взаимодействие алюминия с кислотой (2 Al + 6 HCl → 2 AlCl 3 + 3 H 2↑);
3 
Ученики, согласно инструкции выполняют лабораторные опыты, отмечают признаки химических реакций, записывают уравнения соответствующих химических реакций.
— как вы думаете, какой газ это выделяется?
— у меня есть пробирка, как собрать в неё выделяющийся водород? Почему?
— чтобы проверить водород, поднесем к отверстию зажженную лучинку – раздастся хлопок.
На примере первых двух реакций формулируется определение реакций замещения – реакций между простым и сложным веществами, в результате которых атомы простого вещества замещают атомы одного из химических элементов в сложном веществе.
На доску вывешивается карточка подсказка.
Почему же в третьем случае реакция не идет? Чтобы объяснить причину этого обратимся к ряду активности металлов. Работа с рядом активности металлов (почему водород расположен в этом ряду, как изменяется активность металлов).
Вывод: с кислотами взаимодействуют металлы, стоящие в ряду активности до водорода.
Используя этот ряд можно еще для прогнозирования возможности протекания реакций вытеснения одних металлов из растворов их солей другими. Проведение демонстрационного эксперимента №1: взаимодействие сульфата меди с железом и хлорида железа ( III ) с медью.
F
Вывод: чтобы реакция между металлом и раствором соли была практически осуществима, необходимо, чтобы металл в ряду активности находился левее, т.е. был активнее металла соли.
О
а) 2 Al + 3 CuCl 2 → 2 AlCl 3 + 3 Cu б) AlCl 3 + Cu →
в 
2) Реакции обмена. Проведение лабораторного опыта №2 «Взаимодействие растворов двух сложных веществ».
1 вариант – взаимодействие гидроксида натрия и сульфата меди ( II )
(щёлочь + соль1 → основание + соль2)
2 вариант – взаимодействие карбоната натрия и соляной кислоты
3 вариант – взаимодействие гидроксида натрия с соляной кислотой
NaOH + HCl → NaCl + H 2 O
(щёлочь + кислота → соль + вода)
реакция нейтрализации (объяснить почему такое название: кислота – среда кислая, щелочь – щелочная, в результате реакции – среда нейтральная)
Ученики, согласно инструкции выполняют лабораторные опыты, отмечают признаки химических реакций, записывают уравнения соответствующих химических реакций. При составлении первой реакции используется таблица растворимости.
На примере этих реакций формулируется определение реакций обмена – реакций между сложными веществами, при протекании которых их молекулы обмениваются своими составными частями.
На доску вывешивается карточка подсказка.
Проведение демонстрационного эксперимента №2: взаимодействие хлорида калия и гидроксида натрия.
N
Вопросы: наблюдаете ли вы признаки химической реакции? Какой можно сделать вывод? Когда же реакции ионного обмена идут до конца?
Вывод: реакции ионного обмена идут до конца, если выпадает осадок, выделяется газ или образуется вода.
Проведение демонстрационного эксперимента №3: взаимодействие серной кислоты и гидроксида меди ( II ).
Вопросы: наблюдаете ли вы признаки химической реакции? Какой можно сделать вывод?
Вывод: реакции нейтрализации между любым основанием и любой кислотой протекают до конца.
Отработка навыков – упр. 6 стр. 113 (РТ).
в 
Уравняйте реакции и укажите тип реакций по признаку «число и состав исходных веществ и продуктов реакции». (Во время работы учитель проверяет усвоение изученного материала, исправляет ошибки и корректирует работу учеников)
http://himi4ka.ru/arhiv-urokov/urok-13-tipy-himicheskih-reakcij.html
http://infourok.ru/material.html?mid=38603