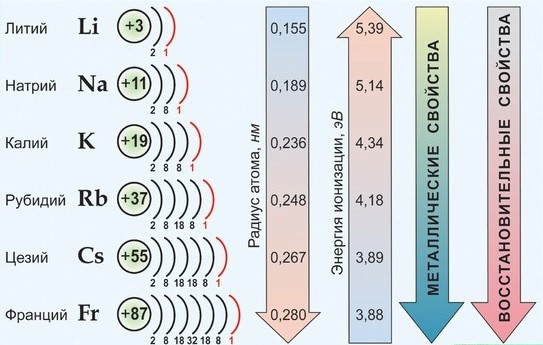
Общая характеристика металлов главной подгруппы IА группы
все атомы имеют крайне низкие величины энергии сродства к электрону и ЭО.
Элементы данной подгруппы имеют значительное сходство друг с другом, что обусловлено одинаковым строением внешнего электронного слоя атомов и аналогией в их важнейших характеристиках:
— атомы всех элементов на предвнешнем электронном слое имеют устойчивые 8-электронные конфигурации соответствующего благородного газа (у Li — оболочка Не);
— все атомы имеют очень низкие значения Eион и легко превращаются в катионы Me + ;
Физические свойства щелочных металлов
В чистом виде щелочные металлы представляют собой легкие, мягкие вещества серебристо-белого цвета на срезе, быстро тускнеющие на воздухе вследствие окисления (цезий имеет золотисто-желтый оттенок). Металлы отличаются высокой электро- и теплопроводностью.
Пары щелочных металлов интенсивно окрашены в различные цвета: Na — пурпурный, К — сине-зеленый, Rb — зеленовато-синий.
Щелочные металлы очень легкоплавки: Cs и Rb плавятся в руках; самый тугоплавкий Li имеет т. пл. 180°С. Плотность этих металлов также невелика — натрий и калий легче воды, а литий плавает даже в керосине.
Щелочные металлы хорошо растворяются в жидком аммиаке, полученные растворы имеют темно-синюю окраску (образуются коллоидные растворы).
Химические свойства
1. Взаимодействие с кислородом
Уже на воздухе щелочные Me немедленно окисляются, a Rb и Cs — самовоспламеняются
При повышении Т все металлы сгорают с образованием ослепительного пламени.
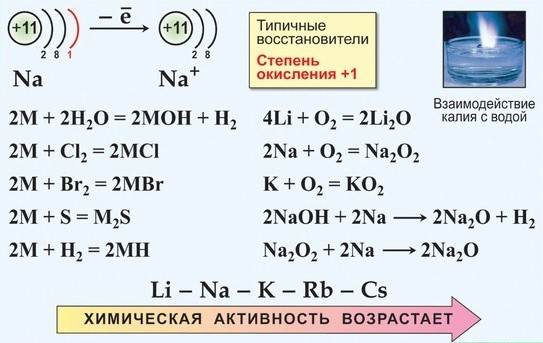
Все щелочные металлы очень химически активны, сильные восстановители:
С активными окислителями, водой и кислотами реакции протекают настолько бурно, что происходит самовоспламенение или взрыв. Часто реакции проводят в охлаждаемой среде. Реакции с неметаллами осуществляют в вакууме или в среде инертных газов.
а) только Li при горении образует нормальный оксид:
б) Na при горении образует бесцветный или слегка желтоватый пероксид
в) К, Rb и Cs сгорают с образованием окрашенных супероксидов:
г) К, Rb и Cs легко реагируют с озоном, образуя озониды:
2. Взаимодействие с галогенами
Соединение щел. Me с галогенами протекает очень бурно, часто в режиме горения, особенно с F2 и Cl2:
3. Взаимодействие с другими неметаллами (S, С, Si, Р)
а) все щел. Me реагируют с фосфором и серой (металлы предварительно нагревают):
2Na + S = Na2S сульфид натрия
3Na + Р = Na3Р фосфид натрия
б) с углеродом и кремнием реагирует непосредственно только литий:
2Li + 2С = Li2C2 карбид лития
4. Взаимодействие с водородом
Наиболее легко реакция протекает между водородом и предварительно слабо нагретым литием:
5. Взаимодействие с водой
6. Взаимодействие с кислотами
Реакции протекают очень энергично, даже со слабыми кислотами.
1) реакции с кислотами за счет восстановления ионов Н + :
2Na + 2HCl = 2NaCl + H2
2) реакции с кислотами за счет восстановления анионов:
3) реакции с органическими кислотами:
7. Взаимодействие со спиртами и фенолами
8. Взаимодействие с галогеналканами (реакция Вюрца)
9. Замещение атомов водорода в гидридах неметаллов
а) реакции с аммиаком расплавленных щелочных металлов:
б) реакции с ацетиленом и некоторыми его гомологами
2 Na + НС=СН → NaC =CNa + Н2
Способы получения
1. Электролиз расплавов солей или щелочей
2NaCI = 2Na + Cl2 (аналогично получают Li , К)
Выделение металлов происходит на ртутном, свинцовом или стальном катоде
2. Вакуум-термический способ
Металлы восстанавливают из расплавов их солей активными металлами:
I группа главная подгруппа Периодической системы Менделеева (щелочные металлы)
I группа главная подгруппа Периодической системы Менделеева представляет собой щелочные металлы. К щелочным металлам относят химические элементы:
Литий Li,
Натрий Na,
Калий K,
Цезий Cs,
Рубидий Rb
Франций Fr
Эти металлы очень активны, поэтому их хранят под слоем вазелина или керосина.
Общая характеристика щелочных металлов
От Li к Fr (сверху вниз в периодической таблице) происходит увеличение:
- атомного радиуса,
- металлических, основных, восстановительных свойств,
- реакционной способности.
Уменьшается
- электроотрицательность,
- энергия ионизация,
- сродство к электрону.
Электронные конфигурации у данных элементов схожи, все они содержат 1 электрон на внешнем уровне ns 1 :
Следовательно, типичная степень окисления щелочных металлов в соединениях +1.
Нахождение щелочных металлов в природе
Способы получения щелочных металлов
Литий
- Литий получают в промышленности электролизом расплавахлорида лития в смеси с KCl или BaCl2 (эти соли служат для понижения температуры плавления смеси):
- Известен также способ получения лития из его оксида в вакууме при 300°С:
Натрий
- Натрий получают электролизом расплава хлорида натрия с добавками хлорида кальция:
2NaCl (расплав) → 2Na + Cl2
Электролитом обычно служит смесь NaCl с NaF и КСl (что позволяет проводить процесс при 610–650°С).
- Натрий можно получить, прокаливая соду с углем в закрытых тиглях, пары металла конденсируются на крышке тигля, выход реакции невысокий:
Калий
- Калий получают также электролизом расплавов солей или расплава гидроксида калия, однако на практике таким способом их не получают из-за высокой химической активности
- Наиболее распространены методы термохимического восстановления: восстановление калия из расплавов хлоридов или гидроксидов.:
KCl + Na = K + NaCl
KOH + Na = K + NaOH
В качестве восстановителей используют пары натрия, карбид кальция, алюминий, кремний
Цезий, Рубидий
- Цезий и рубидий получают восстановлением их хлоридов специально подготовленным кальцием при 700–800 °С:
Са + 2CsCl → 2Cs + CaCl2
- В качестве восстановителя также используют цирконий, реакция протекает при 650 °С:
- В промышленности используют преимущественно физико-химические методы выделения чистого цезия: многократную ректификацию в вакууме
Химические свойства щелочных металлов
Качественные реакции — окрашивание пламени солями щелочных металлов
Цвет пламени:
Li — карминно-красный
Na — желтый
K — фиолетовый
Rb — буро-красный
Cs — фиолетово-красный
Взаимодействие щелочных металлов с простыми веществами — неметаллами
С кислородом
- Литий образует оксид:
- Натрий образует пероксид:
- Калий образует надпероксид:
С галогенами (F, Cl, Br, I)
Щелочные металлы образуют галогениды:
С водородом
Щелочные металлы образуют гидриды:
С серой
Щелочные металлы образуют сульфиды:
С азотом
При комнатной температуре взаимодействует только литий:
Остальные щелочные металлы реагируют с азотом при нагревании:
С углеродом
Щелочные металлы при нагревании образуют карбиды, преимущественно ацетилениды:
С фосфором
Щелочные металлы активно реагируют с фосфором образуя фосфиды:
Взаимодействие щелочных металлов со сложными веществами
С водой
Щелочные металлы реагируют с водой при обычных условиях:
С кислотами
- С растворами HCl, H2SO4щелочные металлы взаимодействуют с образованием соли и выделением водорода:
с концентрированной серной:
с разбавленной азотной
с концентрированной азотной
- Со слабыми кислотами
С солями
В расплаве щелочные металлы могут взаимодействовать с некоторыми солями:
3Na + AlCl3 → 3NaCl + Al
Запомните! В растворе щелочные металлы взаимодействуют с водой, а не с солями других металлов.
Химические свойства металлов
О чем эта статья:
8 класс, 9 класс, ЕГЭ/ОГЭ
Металлы — это химические элементы, атомы которых способны отдавать электроны с внешнего энергетического уровня, превращаясь в положительные ионы (катионы) и проявляя восстановительные свойства.
В окислительно-восстановительных реакциях металлы способны только отдавать электроны, являясь сильными восстановителями. В роли окислителей выступают простые вещества — неметаллы (кислород, фосфор) и сложные вещества (кислоты, соли и т. д.).
Металлы в природе встречаются в виде простых веществ и соединений. Активность металла в химических реакциях определяют, используя электрохимический ряд, который предложил русский ученый Н. Н. Бекетов. По химической активности выделяют три группы металлов.
Ряд активности металлов
Металлы средней активности
Общие химические свойства металлов
Взаимодействие с неметаллами
Щелочные металлы сравнительно легко реагируют с кислородом, но каждый металл проявляет свою индивидуальность:
оксид образует только литий
натрий образует пероксид
калий, рубидий и цезий — надпероксид
Остальные металлы с кислородом образуют оксиды:
2Zn + O2 = 2ZnO (при нагревании)
Металлы, которые в ряду активности расположены левее водорода, при контакте с кислородом воздуха образуют ржавчину. Например, так делает железо:
С галогенами металлы образуют галогениды:
Медный порошок реагирует с хлором и бромом (в эфире):
При взаимодействии с водородом образуются гидриды:
Взаимодействие с серой приводит к образованию сульфидов (реакции протекают при нагревании):
Реакции с фосфором протекают до образования фосфидов (при нагревании):
Основной продукт взаимодействия металла с углеродом — карбид (реакции протекают при нагревании).
Из щелочноземельных металлов с углеродом карбиды образуют литий и натрий:
Калий, рубидий и цезий карбиды не образуют, могут образовывать соединения включения с графитом:
С азотом из металлов IA группы легко реагирует только литий. Реакция протекает при комнатной температуре с образованием нитрида лития:
Взаимодействие с водой
Все металлы I A и IIA группы реагируют с водой, в результате образуются растворимые основания и выделяется H2. Литий реагирует спокойно, держась на поверхности воды, натрий часто воспламеняется, а калий, рубидий и цезий реагируют со взрывом:
Металлы средней активности реагируют с водой только при условии, что металл нагрет до высоких температур. Результат данной реакции — образование оксида.
Неактивные металлы с водой не взаимодействуют.
Взаимодействие с кислотами
Если металл расположен в ряду активности левее водорода, то происходит вытеснение водорода из разбавленных кислот. Данное правило работает в том случае, если в реакции с кислотой образуется растворимая соль.
2Na + 2HCl = 2NaCl + H2
При взаимодействии с кислотами-окислителями, например, азотной, образуется продукт восстановления кислоты, хотя протекание реакции также неоднозначно.
Металлы IА группы:
Металлы IIА группы
Такие металлы, как железо, хром, никель, кобальт на холоде не взаимодействуют с серной кислотой, но при нагревании реакция возможна.
Взаимодействие с солями
Металлы способны вытеснять из растворов солей другие металлы, стоящие в ряду напряжений правее, и могут быть вытеснены металлами, расположенными левее:
Zn + CuSO4 = ZnSO4 + Cu
На металлы IА и IIА группы это правило не распространяется, так как они реагируют с водой.
Реакция между металлом и солью менее активного металла возможна в том случае, если соли — как вступающие в реакцию, так и образующиеся в результате — растворимы в воде.
Взаимодействие с аммиаком
Щелочные металлы реагируют с аммиаком с образованием амида натрия:
Взаимодействие с органическими веществами
Металлы IА группы реагируют со спиртами и фенолами, которые проявляют в данном случае кислотные свойства:
Также они могут вступать в реакции с галогеналканами, галогенпроизводными аренов и другими органическими веществами.
Взаимодействие металлов с оксидами
Для металлов при высокой температуре характерно восстановление неметаллов или менее активных металлов из их оксидов.
3Са + Cr2O3 = 3СаО + 2Cr (кальциетермия)
Вопросы для самоконтроля
С чем реагируют неактивные металлы?
С чем связаны восстановительные свойства металлов?
Верно ли утверждение, что щелочные и щелочноземельные металлы легко реагируют с водой, образуя щелочи?
Методом электронного баланса расставьте коэффициенты в уравнении реакции по схеме:
Mg + HNO3 → Mg(NO3)2 + NH4NO3 + Н2O
Как металлы реагируют с кислотами?
Подведем итоги
От активности металлов зависит их химические свойства. Простые вещества — металлы в окислительно-восстановительных реакциях являются восстановителями. По положению металла в электрохимическом ряду можно судить о том, насколько активно он способен вступать в химические реакции (т. е. насколько сильно у металла проявляются восстановительные свойства).
Напоследок поделимся таблицей, которая поможет запомнить, с чем реагируют металлы, и подготовиться к контрольной работе по химии.
http://zadachi-po-khimii.ru/neorganicheskaya-ximiya/i-gruppa-glavnaya-podgruppa-periodicheskoj-sistemy-mendeleeva-shhelochnye-metally.html
http://skysmart.ru/articles/chemistry/khimicheskie-svojstva-metallov