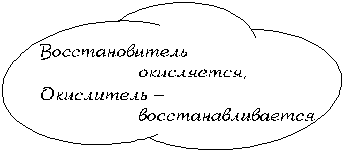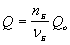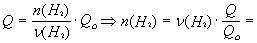Уравнения соединения по химии примеры
9.1. Какие бывают химические реакции
Вспомним, что химическими реакциями мы называем любые химические явления природы. При химической реакции происходит разрыв одних и образование других химических связей. В результате реакции из одних химических веществ получаются другие вещества (см. гл. 1).
Выполняя домашнее задание к § 2.5, вы познакомились с традиционным выделением из всего множества химических превращений реакций четырех основных типов, тогда же вы предложили и их названия: реакции соединения, разложения, замещения и обмена.
| Реакции соединения – химические реакции, в которых из двух или нескольких менее сложных по элементному составу веществ получается более сложное вещество. |
Примеры реакций соединения:
| Реакции разложения – химические реакции, в которых из одного сложного по элементному составу вещества получаются два или несколько менее сложных веществ. |
Примеры реакций разложения:
2Ag2O 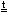
CaCO3 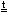
(NH4)2Cr2O7 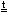
| Реакции замещения – химические реакции, в которых атомы или группы атомов одного из исходных веществ замещают атомы или группы атомов в другом исходном веществе. |
Примеры реакций замещения:
CuSO4 + Fe = FeSO4 + Cu ; (7)
2NaI + Cl2 = 2NaCl + I2; (8)
CaCO3 + SiO2 = CaSiO3 + CO 2 . (9)
| Реакции обмена – химические реакции, в которых исходные вещества как бы обмениваются своими составными частями. |
Примеры реакций обмена:
Ba(OH)2 + H2SO4 = BaSO4 + 2H2O; (10)
HCl + KNO2 = KCl + HNO2; (11)
AgNO3 + NaCl = AgCl + NaNO3. (12)
Традиционная классификация химических реакций не охватывает все их разнообразие – кроме реакций четырех основных типов существует еще и множество более сложных реакций.
Выделение двух других типов химических реакций основано на участии в них двух важнейших нехимических частиц: электрона и протона.
При протекании некоторых реакций происходит полная или частичная передача электронов от одних атомов к другим. При этом степени окисления атомов элементов, входящих в состав исходных веществ, изменяются; из приведенных примеров это реакции 1, 4, 6, 7 и 8. Эти реакции называются окислительно-восстановительными.
| Окислительно-восстановительные реакции (ОВР) – химические реакции, в которых происходит изменение степеней окисления атомов, входящих в состав реагирующих веществ. |
В другой группе реакций от одной реагирующей частицы к другой переходит ион водорода (Н + ), то есть протон. Такие реакции называют кислотно-основными реакциями или реакциями с передачей протона.
| Кислотно-основные реакции (КОР) – химические реакции, сопровождающиеся передачей протона. |
Среди приведенных примеров такими реакциями являются реакции 3, 10 и 11. По аналогии с этими реакциями окислительно-восстановительные реакции иногда называют реакциями с передачей электрона. С ОВР вы познакомитесь в § 2, а с КОР – в следующих главах.


а) HgO Hg + O2
(t); б) Li2O + SO2
Li2SO3; в) Cu(OH)2
CuO + H2O
(t);
г) Al + I2 AlI3; д) CuCl2 + Fe
FeCl2 + Cu
; е) Mg + H3PO4
Мg3(PO4)2 + H2
;
ж) Al + O2 Al2O3 (t); и) KClO3 + P P2O5 + KCl (t); к) CuSO4 + Al
Al2(SO4)3 + Cu
;
л) Fe + Cl2 FeCl3 (t); м) NH3 + O2
N2 + H2O (t); н) H2SO4 + CuO
CuSO4 + H2O.
Укажите традиционный тип реакции. Отметьте окислительно-восстановительные и кислотно-основные реакции. В окислительно-восстановительных реакциях укажите, атомы каких элементов меняют свои степени окисления.
Рассмотрим окислительно-восстановительную реакцию, протекающую в доменных печах при промышленном получении железа (точнее, чугуна) из железной руды:
Определим степени окисления атомов, входящих в состав как исходных веществ, так и продуктов реакции
+III –II
+II –II
+IV –II
3CO
Как видите, степень окисления атомов углерода в результате реакции увеличилась, степень окисления атомов железа уменьшилась, а степень окисления атомов кислорода осталась неизменной. Следовательно, атомы углерода в этой реакции подверглись окислению, то есть потеряли электроны (окислились), а атомы железа – восстановлению, то есть присоединили электроны (восстановились) (см. § 7.16). Для характеристики ОВР используют понятия окислитель и восстановитель.
| Атомы-окислители – атомы, принимающие электроны в ходе данной ОВР. |
| Атомы-восстановители – атомы, отдающие электроны в ходе данной ОВР. |
Таким образом, в нашей реакции атомами-окислителями являются атомы железа, а атомами-восстановителями – атомы углерода.
| Вещество-окислитель – исходное вещество данной ОВР, содержащее атомы-окислители |
| Вещество-восстановитель – исходное вещество данной ОВР, содержащее атомы-восстановители. |
В нашей реакции веществом-окислителем является оксид железа(III), а веществом-восстановителем – оксид углерода(II).
В тех случаях, когда атомы-окислители и атомы-восстановители входят в состав одного и того же вещества (пример: реакция 6 из предыдущего параграфа), понятия » вещество-окислитель» и » вещество-восстановитель» не используются.
Таким образом, типичными окислителями являются вещества, в состав которых входят атомы, склонные присоединять электроны (полностью или частично), понижая свою степень окисления. Из простых веществ это прежде всего галогены и кислород, в меньшей степени сера и азот. Из сложных веществ – вещества, в состав которых входят атомы в высших степенях окисления, не склонные в этих степенях окисления образовывать простые ионы: HNO3 (N +V ), KMnO4 (Mn +VII ), CrO3 (Cr +VI ), KClO3 (Cl +V ), KClO4 (Cl +VII ) и др.
Типичными восстановителями являются вещества, в состав которых входят атомы, склонные полностью или частично отдавать электроны, повышая свою степень окисления. Из простых веществ это водород, щелочные и щелочноземельные металлы, а также алюминий. Из сложных веществ – H2S и сульфиды (S –II ), SO2 и сульфиты (S +IV ), йодиды (I –I ), CO (C +II ), NH3 (N –III ) и др.
В общем случае почти все сложные и многие простые вещества могут проявлять как окислительные, так и восстановительные свойства. Например:
SO2 + Cl2 = S + Cl2O2 (SO2 – сильный восстановитель);
SO2 + C = S + CO2 (t) (SO2 – слабый окислитель);
C + O2 = CO2(t) (C – восстановитель);
C + 2Ca = Ca2C (t) (С – окислитель).
Вернемся к реакции, разобранной нами в начале этого параграфа.
+III -II
+II -II
+IV -II
3CO
Обратите внимание, что в результате реакции атомы-окислители (Fe +III ) превратились в атомы-восстановители (Fe 0 ), а атомы-восстановители (C +II ) превратились в атомы-окислители (C +IV ). Но CO2 в любых условиях очень слабый окислитель, а железо, хоть и является восстановителем, но в данных условиях значительно более слабым, чем CO. Поэтому продукты реакции не реагируют друг с другом, и обратная реакция не протекает. Приведенный пример является иллюстрацией общего принципа, определяющего направление протекания ОВР:
Окислительно-восстановительные реакции протекают в направлении образования более слабого окислителя и более слабого восстановителя.
Окислительно-восстановительные свойства веществ можно сравнивать только в одинаковых условиях. В некоторых случаях это сравнение может быть проведено количественно.
Выполняя домашнее задание к первому параграфу этой главы, вы убедились, что подобрать коэффициенты в некоторых уравнениях реакций (особенно ОВР) довольно сложно. Для упрощения этой задачи в случае окислительно-восстановительных реакций используют следующие два метода:
а) метод электронного баланса и
б) метод электронно-ионного баланса.
Метод электронного баланса вы изучите сейчас, а метод электронно-ионного баланса обычно изучается в высших учебных заведениях.
Оба эти метода основаны на том, что электроны в химических реакциях никуда не исчезают и ниоткуда не появляются, то есть число принятых атомами электронов равно числу электронов, отданных другими атомами.
Число отданных и принятых электронов в методе электронного баланса определяется по изменению степени окисления атомов. При использовании этого метода необходимо знать состав как исходных веществ, так и продуктов реакции.
Рассмотрим применение метода электронного баланса на примерах.
Пример 1. Составим уравнение реакции железа с хлором. Известно, что продуктом такой реакции является хлорид железа(III). Запишем схему реакции:
Fe + Cl2 FeCl3.
Определим степени окисления атомов всех элементов, входящих в состав веществ, участвующих в реакции:
+III –I
FeCl3.
Атомы железа отдают электроны, а молекулы хлора их принимают. Выразим эти процессы электронными уравнениями:
Fe – 3e – = Fe +III ,
Cl2 + 2e – = 2Cl –I .
Чтобы число отданных электронов было равно числу принятых, надо первое электронное уравнение умножить на два, а второе – на три:
2
3
Cl2 + 2e – = 2Cl –I
3Cl2 + 6e – = 6Cl –I .
Введя коэффициенты 2 и 3 в схему реакции, получаем уравнение реакции:
2Fe + 3Cl2 = 2FeCl3.
Пример 2. Составим уравнение реакции горения белого фосфора в избытке хлора. Известно, что в этих условиях образуется хлорид фосфора(V):
0
Молекулы белого фосфора отдают электроны (окисляются), а молекулы хлора их принимают (восстанавливаются):
| P4 – 20e – = 4P +V Cl2 + 2e – = 2Cl –I | 1 10 | 2 20 | P4 – 20e – = 4P +V Cl2 + 2e – = 2Cl –I | P4 – 20e – = 4P +V 10Cl2 + 20e – = 20Cl –I |
Полученные первоначально множители (2 и 20) имели общий делитель, на который (как будущие коэффициенты в уравнении реакции) и были разделены. Уравнение реакции:
Пример 3. Составим уравнение реакции, протекающей при обжиге сульфида железа(II) в кислороде.
+II –II
0
FeS
Fe2O3
В этом случае окисляются и атомы железа(II), и атомы серы(– II). В состав сульфида железа(II) атомы этих элементов входят в отношении 1:1 (см. индексы в простейшей формуле).
Электронный баланс:
| 4 | Fe +II – e – = Fe +III S –II – 6e – = S +IV | Всего отдают 7е – |
| 7 | O2 + 4e – = 2O –II |
Пример 4. Составим уравнение реакции, протекающей при обжиге дисульфида железа(II) (пирита) в кислороде.
0
FeS2
Fe2O3
Как и в предыдущем примере, здесь тоже окисляются и атомы железа(II), и атомы серы, но со степенью окисления – I. В состав пирита атомы этих элементов входят в отношении 1:2 (см. индексы в простейшей формуле). Именно в этом отношении атомы железа и серы вступают в реакцию, что и учитывается при составлении электронного баланса:
4
2S –I – 10e – = 2S +IV
11
Встречаются и более сложные случаи ОВР, с некоторыми из них вы познакомитесь, выполняя домашнее задание.


2.Составьте уравнения ОВР, обнаруженных вами при выполнении задания к § 1 этой главы. На этот раз для расстановки коэффициентов используйте метод электронного баланса. 3.Используя метод электронного баланса, составьте уравнения реакций, соответствующие следующим схемам: а) Na + I2 NaI;
б) Na + O2 Na2O2;
в) Na2O2 + Na Na2O;
г) Al + Br2 AlBr3;
д) Fe + O2 Fe3O4 (t);
е) Fe3O4 + H2 FeO + H2O (t);
ж) FeO + O2 Fe2O3 (t);
и) Fe2O3 + CO Fe + CO2 (t);
к) Cr + O2 Cr2O3 (t);
л) CrO3 + NH3 Cr2O3 + H2O + N2 (t);
м) Mn2O7 + NH3 MnO2 + N2 + H2O;
н) MnO2 + H2 Mn + H2O (t);
п) MnS + O2 MnO2 + SO2 (t)
р) PbO2 + CO Pb + CO2 (t);
с) Cu2O + Cu2S Cu + SO2 (t);
т) CuS + O2 Cu2O +SO2 (t);
у) Pb3O4 + H2 Pb + H2O (t).
Почему происходят химические реакции?
Для ответа на этот вопрос вспомним, почему отдельные атомы объединяются в молекулы, почему из изолированных ионов образуется ионный кристалл, почему при образовании электронной оболочки атома действует принцип наименьшей энергии. Ответ на все эти вопросы один и тот же: потому, что это энергетически выгодно. Это значит, что при протекании таких процессов выделяется энергия. Казалось бы, что и химические реакции должны протекать по этой же причине. Действительно, можно провести множество реакций, при протекании которых выделяется энергия. Энергия выделяется, как правило, в виде теплоты.
| Экзотермическая реакция – химическая реакция, при которой происходит выделение теплоты. |
Если при экзотермической реакции теплота не успевает отводиться, то реакционная система нагревается.
Например, в реакции горения метана
выделяется столько теплоты, что метан используется как топливо.
Тот факт, что в этой реакции выделяется теплота, можно отразить в уравнении реакции:
Это так называемое термохимическое уравнение. Здесь символ «+Q» означает, что при сжигании метана выделяется теплота. Эта теплота называется тепловым эффектом реакции.
Откуда же берется выделяющаяся теплота?
Вы знаете, что при химических реакциях рвутся и образуются химические связи. В данном случае рвутся связи между атомами углерода и водорода в молекулах СН4, а также между атомами кислорода в молекулах О2. При этом образуются новые связи: между атомами углерода и кислорода в молекулах СО2 и между атомами кислорода и водорода в молекулах Н2О. Для разрыва связей нужно затратить энергию (см. «энергия связи» , «энергия атомизации» ), а при образовании связей энергия выделяется. Очевидно, что, если «новые» связи более прочные, чем «старые» , то энергии выделится больше, чем поглотится. Разность между выделившейся и поглощенной энергией и составляет тепловой эффект реакции.
Тепловой эффект (количество теплоты) измеряется в килоджоулях, например:
Такая запись означает, что 484 килоджоуля теплоты выделится, если два моля водорода прореагируют с одним молем кислорода и при этом образуется два моля газообразной воды (водяного пара).
Таким образом, в термохимических уравнениях коэффициенты численно равны количествам вещества реагентов и продуктов реакции.
| Термохимическое уравнение реакции – уравнение реакции, включающее тепловой эффект реакции, рассчитанный на количества вещества, задаваемые коэффициентами этого уравнения. |
От чего зависит тепловой эффект каждой конкретной реакции?
Тепловой эффект реакции зависит
а) от агрегатных состояний исходных веществ и продуктов реакции,
б) от температуры и
в) от того, происходит ли химическое превращение при постоянном объеме или при постоянном давлении.
Зависимость теплового эффекта реакции от агрегатного состояния веществ связана с тем, что процессы перехода из одного агрегатного состояния в другое (как и некоторые другие физические процессы) сопровождаются выделением или поглощением теплоты. Это также может быть выражено термохимическим уравнением. Пример – термохимическое уравнение конденсации водяного пара:
В термохимических уравнениях, а при необходимости и в обычных химических уравнениях, агрегатные состояния веществ указываются с помощью буквенных индексов:
(г) – газ,
(ж) – жидкость,
(т) или (кр) – твердое или кристаллическое вещество.
Зависимость теплового эффекта от температуры связана с различиями в теплоемкостях исходных веществ и продуктов реакции.
Так как в результате экзотермической реакции при постоянном давлении всегда увеличивается объем системы, то часть энергии уходит на совершение работы по увеличению объема, и выделяющаяся теплота будет меньше, чем в случае протекания той же реакции при постоянном объеме.
Тепловые эффекты реакций обычно рассчитывают для реакций, протекающих при постоянном объеме при 25 ° С и обозначают символом Qo.
Если энергия выделяется только в виде теплоты, а химическая реакция протекает при постоянном объеме, то тепловой эффект реакции (QV) равен изменению внутренней энергии (D U) веществ-участников реакции, но с противоположным знаком:
QV = – U.
Под внутренней энергией тела понимают суммарную энергию межмолекулярных взаимодействий, химических связей, энергию ионизации всех электронов, энергию связей нуклонов в ядрах и все прочие известные и неизвестные виды энергии, » запасенные» этим телом. Знак » – » обусловлен тем, что при выделении теплоты внутренняя энергия уменьшается. То есть
U = – QV .
Если же реакция протекает при постоянном давлении, то объем системы может изменяться. На совершение работы по увеличению объема также уходит часть внутренней энергии. В этом случае
U = – (QP + A) = –(QP + P V),
где Qp – тепловой эффект реакции, протекающей при постоянном давлении. Отсюда
QP = – U – P V .
Величина, равная U + P V получила название изменение энтальпии и обозначается D H.
H = U + P V.
QP = – H.
Таким образом, при выделении теплоты энтальпия системы уменьшается. Отсюда старое название этой величины: » теплосодержание» .
В отличие от теплового эффекта, изменение энтальпии характеризует реакцию независимо от того, протекает она при постоянном объеме или постоянном давлении. Термохимические уравнения, записанные с использованием изменения энтальпии, называются термохимическими уравнениями в термодинамической форме. При этом приводится значение изменения энтальпии в стандартных условиях (25 °С, 101,3 кПа), обозначаемое Hо. Например:
2Н2(г) + О2(г) = 2Н2О(г) Hо = – 484 кДж;
CaO(кр) + H2O(ж) = Сa(OH)2(кр) Hо = – 65 кДж.
Зависимость количества теплоты, выделяющейся в реакции (Q) от теплового эффекта реакции (Qo) и количества вещества (nБ) одного из участников реакции (вещества Б – исходного вещества или продукта реакции) выражается уравнением:
Здесь Б – количество вещества Б, задаваемое коэффициентом перед формулой вещества Б в термохимическом уравнении.
Задача
Определите количество вещества водорода, сгоревшего в кислороде, если при этом выделилось 1694 кДж теплоты.
Решение
2Н2(г) + О2(г) = 2Н2О(г) + 484 кДж.
(Н2) = 2 моль,
Qo = 484 кДж.
= 2 мольЧ (1694 кДж/484 кДж) = 7 моль.


2.Как вы думаете, может ли реакционная система при протекании экзотермической реакции охлаждаться?
3.Какое количество теплоты выделится при сгорании 320 г серы в кислороде по реакции:
4.Какое количество теплоты выделится при сгорании 405 г алюминия в кислороде по реакции:
5.Определите объем водорода, прореагировавшего с кислородом (объему газов измерены при н. у.), если при этом выделилось 114,4 кДж теплоты.
6.Тепловой эффект реакции взаимодействия кристаллического алюминия с газообразным хлором равен 1408 кДж. Запишите термохимическое уравнение этой реакции и определите массу алюминия, необходимого для получения 2816 кДж теплоты с использованием этой реакции.
7.Определите количество теплоты, выделяющейся при сгорании на воздухе 1 кг угля, содержащего 90 % графита, если тепловой эффект реакции горения графита в кислороде равна 394 кДж.
Кроме экзотермических реакций возможны реакции, при протекании которых теплота поглощается, и, если ее не подводить, то реакционная система охлаждается. Такие реакции называют эндотермическими.
| Эндотермическая реакция – химическая реакция, при которой происходит поглощение теплоты. |
Таким образом, энергия, выделяющаяся при образовании связей в продуктах этих и им подобных реакций, меньше, чем энергия, необходимая для разрыва связей в исходных веществах.
Что же является причиной протекания таких реакций, ведь энергетически они невыгодны?
Раз такие реакции возможны, значит существует какой-то неизвестный нам фактор, являющийся причиной их протекания. Попробуем его обнаружить.
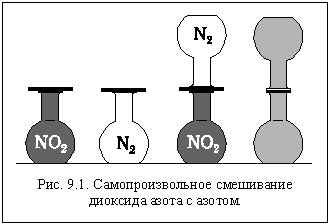
Возьмем две колбы и заполним одну из них азотом (бесцветный газ), а другую – диоксидом азота (бурый газ) так, чтобы и давление, и температура в колбах были одинаковыми. Известно, что эти вещества между собой не вступают в химическую реакцию. Герметично соединим колбы горлышками и установим их вертикально, так, чтобы колба с более тяжелым диоксидом азота была внизу (рис. 9.1). Через некоторое время мы увидим, что бурый диоксид азота постепенно распространяется в верхнюю колбу, а бесцветный азот проникает в нижнюю. В результате газы смешиваются, и окраска содержимого колб становится одинаковой.
Что же заставляет газы смешиваться?
Хаотическое тепловое движение молекул.
Приведенный опыт показывает, что самопроизвольно, без какого бы то ни было нашего (внешнего) воздействия может протекать процесс, тепловой эффект которого равен нулю. А он действительно равен нулю, потому что химического взаимодействия в данном случае нет (химические связи не рвутся и не образуются), а межмолекулярное взаимодействие в газах ничтожно и практически одинаково.
Наблюдаемое явление представляет собой частный случай проявления всеобщего закона Природы, в соответствии с которым системы, состоящие из большого числа частиц, всегда стремятся к наибольшей неупорядоченности.
Мерой такой неупорядоченности служит физическая величина, называемая энтропией.
| Энтропия – физическая величина, характеризующая степень неупорядоченности систем, состоящих из большого числа частиц, находящихся в тепловом движении. |
чем БОЛЬШЕ ПОРЯДКА – тем МЕНЬШЕ ЭНТРОПИЯ,
чем МЕНЬШЕ ПОРЯДКА – тем БОЛЬШЕ ЭНТРОПИЯ.
Уравнения связи между энтропией (S) и другими величинами изучаются в курсах физики и физической химии. Единица измерений энтропии [S] = 1 Дж/К.
Энтропия возрастает при нагревании вещества и уменьшается при его охлаждении. Особенно сильно она возрастает при переходе вещества из твердого в жидкое и из жидкого в газообразное состояние.
Что же произошло в нашем опыте?
При смешении двух разных газов степень неупорядоченности возросла. Следовательно, возросла энтропия системы. При нулевом тепловом эффекте это и послужило причиной самопроизвольного протекания процесса.
Если теперь мы захотим разделить смешавшиеся газы, то нам придется совершить работу, то есть затратить для этого энергию. Самопроизвольно (за счет теплового движения) смешавшиеся газы никогда не разделятся!
Итак, мы с вами обнаружили два фактора, определяющих возможность протекания многих процессов, в том числе и химических реакций:
1) стремление системы к минимуму энергии (энергетический фактор) и
2) стремление системы к максимуму энтропии (энтропийный фактор).
Посмотрим теперь, как влияют на возможность протекания химических реакций различные комбинации этих двух факторов.
1. Если в результате предполагаемой реакции энергия продуктов реакции оказывается меньше, чем энергия исходных веществ, а энтропия больше (» под гору к большему беспорядку» ), то такая реакция может протекать и будет экзотермической.
2. Если в результате предполагаемой реакции энергия продуктов реакции оказывается больше, чем энергия исходных веществ, а энтропия меньше (» в гору к большему порядку» ), то такая реакция не идет.
3. Если в предполагаемой реакции энергетический и энтропийный факторы действуют в разные стороны (» под гору, но к большему порядку» или » в гору, но к большему беспорядку» ), то без специальных расчетов сказать что-либо о возможности протекания такой реакции нельзя (» кто перетянет» ). Подумайте, к какому из этих случаев относятся эндотермические реакции.
Возможность протекания химической реакции можно оценить, рассчитав изменение в ходе реакции физической величины, зависящей как от изменения энтальпии, так и от изменения энтропии в этой реакции. Такая физическая величина называется энергией Гиббса (в честь американского физикохимика XIX в. Джозайя Уилларда Гиббса).
G = H – T S
Условие самопроизвольного протекания реакции:
G
| [предыдущий раздел] | [содержание] | [следующий раздел] |


Сервер создается при поддержке Российского фонда фундаментальных исследований
Не разрешается копирование материалов и размещение на других Web-сайтах
Вебдизайн: Copyright (C) И. Миняйлова и В. Миняйлов
Copyright (C) Химический факультет МГУ
Написать письмо редактору
1. Реакции соединения
Теория:
- Если поместить немного красного фосфора в ложечку для сжигания веществ и поджечь его, то фосфор загорится ярким пламенем. При этом из фосфора и кислорода воздуха образуется белый дым, состоящий из маленьких частичек оксида фосфора(\(V\)):
- Внесём ложечку с горящим фосфором в колбу, чтобы заполнить её густым дымом из оксида фосфора(\(V\)), затем достанем ложечку из колбы, прильём в колбу воду, закроем горлышко колбы пробкой и взболтаем содержимое.
- В первом случае из двух простых веществ образовалось одно сложное , состоящее из двух элементов.
- Во втором случае прореагировали сложные вещества и образовалось новое сложное вещество , в состав которого входят атомы трёх элементов.
при производстве азотной кислоты из оксида азота(\(II\)) получают оксид азота(\(IV\)):
Химические соединения
Содержание:
Химические соединения – сложные вещества, молекулы которых состоят из двух или более атомов различных элементов, объединенных определенной химической связью.
На странице -> решение задач по химии собраны решения задач и заданий с решёнными примерами по всем темам химии.
Химические соединения
В соответствии с формулировкой периодического закона мы рассмотрели некоторые свойства свободных атомов и простых веществ. На примере аллотропии мы убедились в том, что не только электронное строение нейтрального атома, но также состав и пространственное строение простого вещества определяют его свойства. Аналогичным будет наш подход к рассмотрению сложного вещества.
Если простых веществ известно в настоящее время около 400, то сложных — во много раз больше: около 100 тысяч неорганических, несколько миллионов органических и несколько десятков тысяч элементоорганических.
Они различаются по агрегатному состоянию, по распространению в природе, по способности давать новые образования из того же числа атомов тех же элементов (новые модификации — по аналогии с аллотропией для простых веществ).
Рассмотрим несколько вопросов, важных для понимания природы химического соединения.
Смесь и химическое соединение
Представим себе, что мы взяли мелко раздробленные железо и серу тщательно их перемешали при обычных условиях. Это будет смесь двух простых веществ. Для сравнения возьмем соединение железа и серы — сернистое железо FeS. Мы можем убедиться в том, что свойства атомов железа и серы в соединении отличаются от свойств простых веществ.
Так, железо притягивается магнитом, независимо от того, взяли мы чистое железо или смесь последнего с серой. Соединение (сернистое железо) магнитом не притягивается.
Сера хорошо растворяется в сероуглероде. Соединение FeS в сероуглероде не растворяется.
При действии на смесь соляной кислоты происходит выделение водорода. Взаимодействие сернистого железа с кислотой приводит к образованию сероводорода.
А между тем смесь можно приготовить так, чтобы она по внешнему виду не отличалась от соединения. Однако это лишь внешнее, кажущееся сходство. Внутренние же их отличия велики. Иными словами: смесь только внешне может казаться однородной, химические воздействия показывают ее неоднородность. Химическое соединение — однородно.
Изучение и сопоставление физических и химических свойств смеси и соединения приводит нас к выводу о качественном отличии свойств атомов элементов в смеси (простые вещества) и химическом соединении.
Другая характерная черта химического соединения — наличие связей между атомами разных элементов. В зависимости от составляющих соединения атомов эти связи могут быть ионными, ковалентными и металлическими.
Одна из важнейших характеристик соединения — его форма, его состав.
Простейшая и истинная формула химического соединения
Простейшую формулу можно определить в результате химического анализа, истинную — только имея данные об истинном молекулярном весе соединения. Так, по результатам анализа можно установить простейшую формулу СН, но какому соединению (например, С2Н2 или С6Н6) она отвечает, сказать нельзя, если неизвестен молекулярный вес соединения. Эти данные о молекулярном весе, строго говоря, можно получить в том случае, если вещество газообразно или может быть переведено в газообразное состояние без разложения или какого-либо другого изменения состава, иными словами, для тех соединений, к которым приложимо понятие молекулы.
Рассмотрим два примера:
Пример 1. При окислении кислородом воздуха 34 г газообразного вещества образовалось 28 г азота и 54 г воды. Плотность этого вещества по водороду равна 8,5. Определить его истинную формулу.
Решение. Вначале необходимо установить количественный и качественный состав вещества.
В 34 г соединения находится 28г азота. Подсчитаем, сколько граммов водорода содержится в 34 г соединения.
В одной грамм-молекуле воды «содержится» два грамм-атома водорода. Так как грамм-молекулярный вес воды равен 18 е, то
Следовательно, соединение состоит только из азота и водорода, так как сумма их весовых количеств составляет
Находим формулу соединения:
Простейшая формула соединения: NH3.
Однако это еще не окончательный ответ. В условии задачи указана плотность вещества водороду (8,5). Значит, молекулярный вес вещества: М = 2D = 2 * 8,5 = 17. Молекулярный вес NH3 также 17. Установленная формула оказывается истинной.
Такая проверка оказывается необходимой потому, что часто в химических соединениях истинное отношение чисел грамм-атомов элементов не совпадает в точности с простейшими отношениями, а оказывается кратным им. Особенно часто это встречается в органической химии. Однако и в неорганической химии встречаются подобные примеры. Кроме только что найденного соединения с водородом состава NH3 (аммиак), азот образует другое N2H4 (гидразин), где простейшее отношение N : Н = 1 : 2. Другой пример: Н2О2 (перекись водорода), простейшая формула НО.
Пример 2. Число атомов кислорода в соединении вдвое больше числа атомов азота. Плотность соединения по водороду 46. Найти истинную формулу соединения.
Решение. Простейшая формула N02. Молекулярный вес этого соединения M NO2 = 14+32=46. Найдем истинный молекулярный вес:
т.е. он вдвое превосходит тот, который получается из простейшей формулы. Следовательно формула соединения N2O4.
Для большинства твердых неорганических соединений (с ионной или сильно полярной связью) можно определить простейшие формулы.
О постоянстве состава веществ
В XIX в. при изучении состава различных веществ выяснилось, что весовые отношения между элементами в сложных веществах всегда постоянны, причем эти отношения являются такими же, как и в одной молекуле этого вещества. Точно так же постоянны и отношение чисел грамм-атомов в одной грамм-молекуле. Более того, числа грамм-атомов в грамм-молекуле относятся друг к другу, как простые целые числа (Дж. Дальтон).
В начале XIX в. французский ученый Пруст установил закон постоянства состава: каждое вещество имеет определенный состав независимо от способа получения.
Несколько ранее другой французский ученый Бертолле утверждал обратное: состав вещества зависит от способа получения. Бертолле установил это, изучая составы сложных солевых систем.
В тот период закон Пруста был подтвержден изучением состава большого числа соединений (окислов, галогенидов, сульфидов металлов), состоящих из атомов двух элементов.
Однако, как впоследствии выяснилось, закон постоянства состава оказался верным лишь в том случае, когда речь идет о веществах, имеющих молекулярное строение (соединения в газообразном состоянии и соединения с молекулярной структурой).
Более совершенная экспериментальная техника позволяет зарегистрировать сейчас отклонения от стехиометрического состава даже у ряда «испытанных» окислов, сульфидов, галогенидов и т. п. Все это еще раз указывает на то, что внешние условия в определенной степени (различной для разных соединений) влияют на состав соединения.
Вот почему приходится говорить об ограниченности действия закона постоянства состава.
Надо сказать, что такой взгляд на химическое соединение, сложившийся в конце XIX и начале XX вв., удалось экспериментальна подтвердить с помощью рентгеноструктурного анализа. Некоторые общие положения были выработаны раньше, главным образом, трудами Д. И. Менделеева и Н. С. Курнакова.
Несмотря на отклонения от стехиометрического состава, наблюдающиеся у многих соединений, мы в дальнейшем не будем принимать их во внимание, следуя закону постоянства состава.
Химические связи в соединениях
Характер химических связей в соединениях зависит от положения элементов в периодической системе и, в первую очередь, от заполнения внешних уровней. Так, хлориды элементов III периода имеют ковалентные связи и лишь в хлориде натрия эта связь имеет типично ионный характер.
Степень смещения электронной пары в связи элемент — хлор можно изобразить следующей схемой:
Иногда характер химической связи изображают следующим образом:
Физические свойства соединений зависят не только от характера одиночной связи (в нашем примере: элемент—хлор), но и от формы соединения. Так, меняется структура веществ (поваренная соль — кристалическое соединение; хлор при обычных условиях — газо-образное вещество, состоящее из двухатомных молекул). Нередко по температурам плавления хлоридов можно составить представление о типе связи. Считают, что ионные соединения плавятся при температурах выше 600° С.
Иное изменение характера химической связи наблюдается в соединениях натрия с элементами III периода: от металлической связи (у натрия) через ковалентную (Na3P, Na2S) к ионной (NaCl).
Химические свойства соединений также находятся в зависимости от типа химической связи. Иллюстрацией этого положения могут служить реакции соединений элементов III периода с водой.
До сих пор мы рассматривали химические связи в соединениях, состоящих из атомов двух элементов (бинарные соединения). Между тем известно, что существует большое число и более сложных соединений.
Каким же образом происходит возникновение новых связей? Оказывается, образование сложных соединений является результатом электростатического взаимодействия между исходными соединениями. Нередко существенную роль в возникновении такого взаимодействия играют электронные пары одного из атомов. Так, например, осуществляется образование солей аммония: нейтральная молекула аммиака присоединяет из кислот атом водорода, имеющий окислительное число +1:
В отличие от ковалентной связи, образующейся за счет обобщения двух электронов, принадлежавших разным атомам, эта новая связь образуется за счет предоставления одним из атомов пары электронов. От ковалентной она отличается только своим происхождением, так как в ионе аммония все четыре связи N—Н равноценны. Заметим, что образование новой связи произошло без изменения окислительного числа атома азота (N). Изучении соединений, содержащих ион NHJ, показывает, что этот ион выступает во многих случаях как целое (соли аммония). Более того, образование атомом водорода (окислительное число + 1) новой связи оказывает влияние на его прежнюю связь в соединении с «о-валентной связью (например, в
Если исходные вещества (NH3 и НСI) являются газообразными при обычных условиях, то хлористый аммоний, как и другие соли аммония, — кристаллическое вещество, имеющее сравнительно высокую температуру плавления.
Не всегда можно достаточно наглядно, как в только что рассмотренном случае, представить схематически процесс образования новых связей и изменения прежних. Однако мы хотели бы обратить внимание на имеющее место образования симметричных сочетаний атомов, подобных иону NH). Например: СН4, [ ВН4] -1 . Последнее соединение образуется в результате взаимодействия гидрида бор) с гидридом натрия: NaH+BH3=Na[ВН4] (схематически). Для кислородных соединений характерно образование соединений, содержащих ион 

Электростатические взаимодействия играют большую роль щ только в образованиях новых устойчивых соединений, но в ход различных химических процессов, например, идущих в растворах.
Таким образом, любой химический процесс так или иначе связан с изменением прежних химических связей и возникновением новых. Иногда, как мы это рассматривали уже раньше, реакция идет с изменением окислительных чисел элементов.
Классификация неорганических соединений
Большое значение в познании окружающего нас мира имеет разработка классификации объектов, явлений, понятий, которые изучает та или иная наука. Химия является наукой о химически) элементах и образуемых ими простых и сложных веществах. Ясно, что для каждого круга объектов может быть выработана своя классификация, но очевидно также и то, что все три классификации -I элементов, простых веществ и соединений — должны быть связаны между собой. В основе классификации соединений лежит изучение их состава, свойств, строения, типов химической связи.
Изучение свойств кислородных соединений, проведенное в конце XVIII и первой половине XX в., позволило разработать классификацию кислородных соединений элементов: окислы, основания, кислоты, соли.
Более глубокое раскрытие взаимосвязи между этими классами удалось осуществить в результате открытия периодического закона, теории электролитической диссоциации, теории химической связи.
В этом параграфе мы напомним лишь самые элементарные сведения о классах кислородных соединений. Окислами называются соединения, которые состоят из атомов кислорода и какого-нибудь другого химического элемента. Они подразделяются на солеобразующие и несолеобразующие. К последним относятся: N2O, NO, SiO. Солеобразующие окислы разделяются на основные, кислотные и амфотерные. Это деление основано на способности, соединяясь друг с другом, образовать соли.
Некоторые основные окислы, соединяясь с водой, образуют основания:
Однако большинство основных окислов с водой не соединяется, при разложении соответствующих оснований получается основной окисел и вода:
Многие кислотные окислы, соединяясь с водой, образуют кислоты:
Некоторые кислотные окислы с водой не соединяются; их можно получить разложением кислоты:
Основные окислы, реагируя с кислотными окислами или кислотами образуют соли:
Кислотные окислы, реагируя с основными окислами или основаниями (точнее: щелочами, т. е. растворимыми в воде основаниями), образуют соли:
Основания и кислоты вступают в реакцию друг с другом с образованием солей
Некоторые вопросы образования солей будет рассмотрено далее на основе теории электролитической диссоциации.
Кроме окислов, существует еще одна группа соединений, которые состоят из атомов кислорода и атомов другого элемента. Это перекиси, которые надо рассматривать как производные (соли) перекиси водорода:
Если окислительное число кислорода в окислах равно — 2, то в перекисях его следует признать равным — 1.
Впервые отличие перекисей от окислов оказалось возможным показать на основе периодической системы элементов Д. И. Менделеева. По сравнению с высшими солеобразующими окислами, в перекисях число атомов кислорода, приходящееся на одно и то же число атомов элемента, больше: Na2O (окисел), Na2O2 (перекись),
Среди солеобразующих окислов выделяется также звено особых окислов: ( 
Процессы образования кислот (и солей), идущие с участием этих окислов, сопровождаются изменением окислительного числа элемента. Например:
в зависимости от условий реакции. Таким образом, если при растворении в воде ангидрида азотной кислоты образуется только азотная кислота
здесь происходит образование еще одного соединения азота. В реакции (3) окислительное число азота не меняется, в реакциях (1) и (2) — меняется:
К этим реакциям мы еще вернемся при изучении процессов окисления — восстановления.
Рассмотренная выше классификация кислородных соединений строилась на основе состава и свойств (способность к солеобразованию) этих соединений. Однако оказалось, что способность образовывать соли присуща не только кислородным соединениям. Наряду с рассмотренными выше кислородными кислотами, существуют кислоты бескислородные. Известно, что водные растворы таких водородных соединений, как: 
Кислотные функции соединения — как определила теория электролитической диссоциации — связаны со способностью диссоциировать (разлогаться) с образованием иона водорода.
Таким образом, принцип группировки различных неорганических Соединений по соответствующим классам основывается как на изучении состава, так и на изучении свойств и реакций, идущих с участием рассматриваемых соединений.
Следовательно, результат химического процесса существенно влияет на наши представления о исходных веществах, о принадлежности их к тому или иному классу.
Графическое изображение формул химических соединений
Наглядное изображение связей, существующих между атомами в химическом соединении, издавна привлекало внимание ученых.
Так в органической химии на основе теории строения, разработанной А М Бутлеровым, широко пользуются структурными формулами отличие от валовых формул, описывающих качественный и количественный состав соединения, структурные формулы позволяют наглядно представить, в какой последовательности соединены атомы в молекуле, какие части молекул остаются неизменными, где происходит разрыв химических связей и т. п. Совершенно очевидно, что к графическому изображению сложных соединений можно прибегнуть лишь после того, как определены окислительные числа элементов, изучены свойства соединений (функциональные группы) и определён класс соединения.
Для того чтобы пояснить сказанное, обратимся к конкретному примеру. Хорошо известно, что валовой формулой С2Н6О можно представить состав двух соединений: этилового спирта и диметилового эфира. Изучение свойств того и другого позволяет раскрыть различную последовательность связей (формулы строения):
Каждая чёрточка в этих структурных формулах отвечает ковалентной связи, образованной парой электронов (по одному электрону от каждого из связанных атомов).
Остановимся теперь на ряде примеров из области неорганической химии. С этой целью обратимся к рассмотрению кислот хлора — кислородных и бескислородной хлористоводородной (соляной) кислоты.
В молекуле соляной кислоты HCI всего одна связь, соединяющая H и CI парой электронов. При графическом изображении молекулы соляной кислоты, вместо указанной пары электронов, ставится черточка:
Кислородные кислоты хлора являются одноосновными:
В левом столбце мы изобразили формулы кислородных кислот хлора несколько необычно, а именно так, чтобы было удобно перейти от них к структурным формулам. Действительно, валовые формулы, написанные в правом столбце, не дают представления о последовательности связей атомов в молекуле. В каждой кислородной кислоте, из числа тех, которые изучаются в средней школе водород кислоты (т. е. водород, способный замещаться на металл связан с кислородом Н—О—, а кислород, в свою очередь, с cooтветствующим элементом, в данном случае, хлором:
Эта структурная формула составлена не только с учетом класса соединения (кислота), но и соответствует окислительным числам элементов, входящих в соединение (хлорноватистая кислота)
Аналогичным образом составляются структурные формулы остальных кислот хлора. Например:
Пример. Рассмотрим структурные формулы кислородных кислот серы и фосфора: H2SO4 и Н3РО4.
Решение. Последовательность составления этих формул может быть paзличной. Например, такая:
Графическое изображение формулы можно начинать и по-другому, например с выражения окислительного числа центрального атома:
а затем, размещая остальные атомы
При любой последовательности изображения связей важно, чтобы учитывалось не только окислительное число элементов, но и класс соединения.
Однако графический способ изображения формул химических соединений далеко не полностью передает пространственную структуру соединения. Это замечание распространяется, главным образом, на те соединения, при определении состава которых мы вынуждены ограничиться простейшей формулой (многие твёрдые вещества). Примеры такого рода соединений будут приведены далее)
Кроме того, как мы уже имели возможность убедиться на примере солей аммония, число связей между атомами не всегда совпадает с окислительным числом элементов.
Поэтому графическое изображение формул соединений имеет ограниченное применение. Наиболее целесообразно ими пользоваться при рассмотрении соединений с ковалентными связями, степень полярности которых невелика.
Услуги по химии:
Лекции по химии:
Лекции по неорганической химии:
Лекции по органической химии:
Присылайте задания в любое время дня и ночи в ➔
Официальный сайт Брильёновой Натальи Валерьевны преподавателя кафедры информатики и электроники Екатеринбургского государственного института.
Все авторские права на размещённые материалы сохранены за правообладателями этих материалов. Любое коммерческое и/или иное использование кроме предварительного ознакомления материалов сайта natalibrilenova.ru запрещено. Публикация и распространение размещённых материалов не преследует за собой коммерческой и/или любой другой выгоды.
Сайт предназначен для облегчения образовательного путешествия студентам очникам и заочникам по вопросам обучения . Наталья Брильёнова не предлагает и не оказывает товары и услуги.
http://www.yaklass.ru/p/himija/89-klass/klassifikatciia-khimicheskikh-reaktcii-i-zakonomernosti-ikh-protekaniia-212242/klassifikatciia-khimicheskikh-reaktcii-po-chislu-i-sostavu-vstupivshikh-_-212243/re-3995ef63-ec2c-4921-8802-a2aa005f396e
http://natalibrilenova.ru/himicheskie-soedineniya/