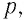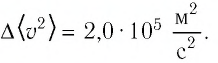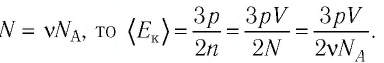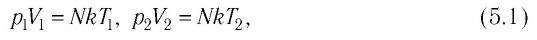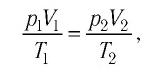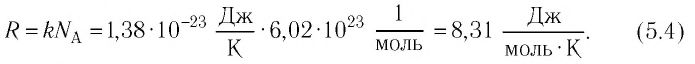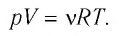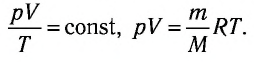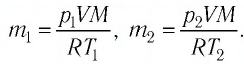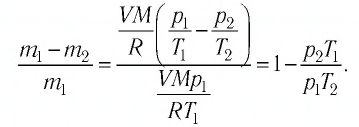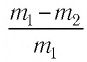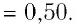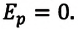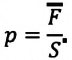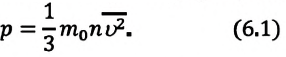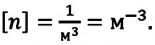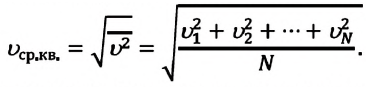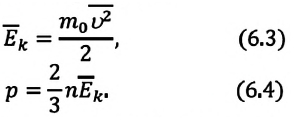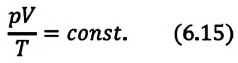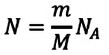Уравнение состояния идеального газа
Содержание:
Уравнение состояния идеального газа получило название «уравнение Менделеева-Клапейрона». Давление смеси химически невзаимодействующих газов равно сумме их парциальных давлений: закон Дальтона.
На странице -> решение задач по физике собраны решения задач и заданий с решёнными примерами по всем темам физики.
Уравнение состояния идеального газа
Уравнение состояния идеального газа — это p = nkT называется уравнением Менделеева Клапейрона и оно даёт взаимосвязь трёх важнейших макроскопических параметров, описывающих состояние идеального газа давления, объёма и температуры. Поэтому уравнение Менделеева Клапейрона называется ещё уравнением состояния идеального газа.
Термодинамические параметры газа
В предыдущих главах было показано, что при описании свойств газа можно пользоваться величинами, характеризующими молекулярный мир (микромир), например энергией молекулы, скоростью ее движения, массой и т. п. Числовые значения таких величин мы можем определять только с помощью расчета. Все такие величины принято называть микроскопическими (от греческого «микрос» — малый).
Однако для описания свойств газов можно пользоваться и такими величинами, числовые значения которых находят простым измерением с помощью приборов, например давлением, температурой и объемом газа. Значения таких величин определяются совместным действием огромного числа молекул, поэтому они называются макроскопическими (от греческого «макрос» — большой).
Соотношение (4.1): 
Если взять определенную массу газа т, то при постоянных р, V и Т газ будет находиться в равновесном состоянии. Когда происходят изменения этих параметров, то в газе протекает тот или иной процесс. Если этот процесс состоит из ряда непрерывно следующих друг за другом равновесных состояний газа, то он называется равновесным процессом. Равновесный процесс должен протекать достаточно медленно, так как при быстром изменении параметров давление и температура не могут иметь соответственно одинаковые значения во всем объеме газа. В этой главе рассматриваются только равновесные процессы в газах, при которых масса газа остается постоянной.
Когда процесс в газе заканчивается, то газ переходит в новое состояние, а его параметры приобретают новые постоянные числовые значения, вообще говоря, отличные от их значений в начале процесса. Если же при постоянной массе газа значения всех его параметров в начале и в конце процесса окажутся одинаковыми, то процесс называется круговым или замкнутым.
Соотношение между значениями тех или иных параметров в начале и конце процесса называется газовым законом. Газовый закон, выражающий связь между всеми тремя параметрами газа, называется объединенным газовым законом.
Отметим еще, что такого процесса в газе, при котором изменялся бы только один параметр газа, не существует, так как значения этих параметров взаимосвязаны. Примером сказанного является закон Шарля, выражающий связь между р и Т.
Объединенный газовый закон. Приведение объема газа к нормальным условиям
Связь между давлением, объемом и температурой определенной массы газа устанавливается с помощью соотношения (4.9):
Поскольку 

Так как при постоянной массе газа N остается неизменным, 
Поскольку значения р, V и Т в (5.2) относятся к одному и тому же состоянию газа, можно следующим образом сформулировать объединенный газовый закон: при постоянной массе газа произведение объема на давление, деленное на абсолютную температуру газа, есть величина одинаковая для всех состояний этой массы газа.
Следовательно, если числовые значения параметров в начале процесса, происходящего с какой-либо определенной массой газа, обозначить через р1 , V1 и Т1, а их значения в конце процесса соответственно через р2 , V2 и Т2, то
Формулы (5.2) и (5.3) представляют собой математическое выражение объединенного газового закона.
На практике иногда нужно установить, какой объем V0 займет имеющаяся масса газа при нормальных условиях, т. е. при Т0=273 К и при р0=1,013 . 10 5 Па. Если значения параметров для этой массы газа в каком-либо произвольном состоянии, отличном от нормального, обозначить через р, V и Т, то на основании (5.3) получаем 
Формула (5.4) позволяет приводить объем заданной массы газа к нормальным условиям.
Молярная газовая постоянная. Определение числового значения постоянной Больцмана
Формула (5.1) справедлива для любой массы газа, в которой содержится N молекул. Если применить эту формулу к одному молю какого-либо газа, то N нужно заменить постоянной Авогадро NA, а V — объемом одного моля Vмоль
Так как в одном моле любого газа содержится одно и то же число молекул NA, то произведение 

Числовое значение R можно найти, если применить (5.5) к состоянию одного моля газа при нормальных условиях, так как при этом 
Это числовое значение R в СИ необходимо запомнить, так как им часто пользуются при расчетах и при решении задач.
Теперь легко найти числовое значение постоянной Больнмана 



Уравнение Клапейрона — Менделеева. Плотность газа
Выясним, как будет выглядеть соотношение (5.1), если в него ввести молярную газовую постоянную R. Так как N — полное число молекул в массе газа т, а 
где 
Поскольку 


Соотношение (5.7) называется уравнением Клапейрона — Менделеева или уравнением состояния для произвольной массы идеального газа. Для одного моля идеального газа уравнение Клапейрона — Менделеева принимает вид
С помощью формулы (5.7) легко выяснить, какими величинами определяется плотность газа. Так как 
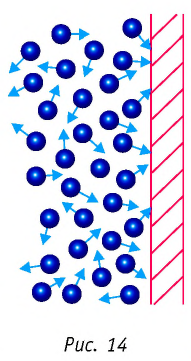
Зависимость средней квадратичной скорости молекул газа от температуры
Выясним теперь, как можно с помощью вычислений находить среднюю квадратичную скорость движения молекул газа 



Отметим, что под т в формуле (5.10) подразумевается масса одной молекулы в кг. Так как 



Наконец, из (5.9) следует, что 
Среднюю квадратичную скорость можно находить по любой из формул (5.10)—(5.12). Из функции Максвелла можно получить формулы для средней арифметической скорости и наивероятнейшей скорости. Средняя арифметическая скорость
Наконец, наивероятнейшую скорость вычисляют так:
(Используя график функции Максвелла (рис. 3.3), поясните, почему 


Изохорический процесс
Процессы, при которых масса газа и один из его параметров остаются постоянными, называются изопроцессами (от греческого «изос» — равный, одинаковый). Поскольку имеется три параметра газа, существует три различных изопроцесса. Первый из них (изохорический) рассмотрен выше (§ 4.3). Процесс в газе, который происходит при постоянной массе и неизменном объеме, называется изохорическим (от греческого «хора» — пространство). Графики для этого процесса называются изохорами (рис. 4.3).
Отметим, что к любому изопроцессу применим объединенный газовый закон и формулы (5.3), (5.7) и (5.8) с учетом того, что один из параметров остается постоянным. При изохорическом процессе постоянным остается объем V, поэтому формула (5.3) после сокращения на V принимает вид
Итак, изохорический процесс подчиняется закону Шарля: при постоянной-массе газа и неизменном объеме давление газа прямо пропорционально его абсолютной температуре. Это видно и из уравнения Клапейрона — Менделеева (5.7):
Так как V, т, 
Изобарический- процесс
Процесс в газе, который происходит при постоянной массе и неизменном давлении, называется изобарическим (от греческого «барос» — тяжесть). Этот процесс был изучен французским физиком Л. Гей-Люссаком в 1802 г.
Поскольку при изобарическом процессе р постоянно, то после сокращения на р формула (5.3) принимает вид
Формула (5.16) является математическим выражением закона Гей-Люссака: при постоянной массе газа и неизменном давлении объем газа прямо пропорционален его абсолютной температуре. (Это видно и из уравнения Клапейрона — Менделеева (5.7): так как р, т, 
На рис. 5.1 схематически изображен опыт Гей-Люссака. Колба с газом помещается в сосуд с водой и льдом.
В пробку вставлена трубка, изогнутая таким образом, что свободный конец ее горизонтален. Газ в колбе отделен от окружающего воздуха небольшим столбиком ртути в трубке. Температуру газа определяют по термометру, а объем — по положению столбика ртути. Для этого на трубке нанесены деления, соответствующие определенному внутреннему объему трубки (при градуировке трубки можно учесть и расширение сосуда при нагревании, но оно сравнительно мало’).
Сначала по положению столбика ртути 1 определяют 
Оказывается, что изобара представляет собой прямую линию (рис. 5.2, а), которая пересекается с осью абсцисс в точке А.
Из подобия треугольников на рис. 5.2, а следует
Обозначив 

Здесь 
Если повторять этот опыт для разных газов или для разных масс газа, то все графики будут пересекаться в точке А, соответствующей t=—273°С (рис. 5.2, б), т. е. коэффициент 
Отметим, что для газов коэффициенты 


Изотермический процесс
Процесс в газе, который происходит при постоянной температуре, называется изотермическим.
Изотермический процесс в газе был изучен английским ученым Р. Бойлем и французским ученым Э. Мариоттом. Установленная ими опытным путем связь получается непосредственно из формулы (5.3) после сокращения на Т:
Формула (5.18) является математическим выражением закона Бойля — Мариотта: при постоянной массе газа и неизменной температуре давление газа обратно пропорционально его объему. Иначе говоря, в этих условиях произведение объема газа на соответствующее давление есть величина постоянная: 
Соотношение (5.19) можно получить и из (5.7) или (5.8), так как при постоянном Г справа в формулах (5.7) и (5.8) стоит постоянная величина. График зависимости р от V при изотермическом процессе в газе представляет собой гиперболу и называется изотермой. На рис. 5.3 изображены три изотермы для одной и той же массы газа, но при разных температурах Т.
Отметим еще, что из формулы (5.9) непосредственно вытекает, что при изотермическом процессе плотность газа изменяется прямо пропорционально давлению:
(Подумайте, как проверить закон Бойля — Мариотта на опыте.)
Внутренняя энергия идеального газа
Как отмечалось, силы взаимодействия молекул в идеальном газе отсутствуют. Это означает, что молекулярно-потенциальной энергии у идеального газа нет. Кроме того, атомы идеального газа представляют собой материальные точки, т. е. не имеют внутренней структуры, а значит, не имеют и энергии, связанной с движением и взаимодействием частиц внутри атома. Таким образом, внутренняя энергия идеального газа представляет собой только сумму знамений кинетической энергии хаотического движения всех его молекул:
Поскольку у материальной точки вращательного движения быть не может, то у одноатомных газов (молекула состоит из одного атома) молекулы обладают только поступательным движением. Так как среднее значение энергии поступательного движения молекул определяется соотношением(4.8): 



Для произвольной массы одноатомного идеального газа имеем
Если молекула газа состоит из двух жестко связанных атомов (двухатомный газ), то молекулы при хаотическом движении приобретают еще и вращательное движение, которое происходит вокруг двух взаимно перпендикулярных осей. Поэтому при одинаковой температуре внутренняя энергия двухатомного газа больше, чем одноатомного, и выражается формулой
Наконец, внутренняя энергия многоатомного газа (молекула содержит три или больше атомов) в два раза больше, чем у одно-атомного при той же температуре:
поскольку вращение молекулы вокруг трех взаимно перпендикулярных осей вносит в энергию теплового движения такой же вклад, как поступательное движение молекулы по трем взаимно перпендикулярным направлениям.
Отметим, что формулы (5.23) и (5.24) теряют силу для реальных газов при высоких температурах, так как при этом в молекулах возникают еще колебания атомов, что ведет к увеличению внутренней энергии газа. (Почему это не относится к формуле (5.22)?)
Работа газа при изменении его объема
Физический смысл молярной газовой постоянной. Опыт показывает, что сжатый газ в процессе своего расширения может выполнять работу. Приборы и агрегаты, действия которых основаны на этом свойстве газа, называют пневматическими. На этом принципе действуют пневматические молотки, механизмы для закрывания и открывания дверей на транспорте и т. д.
Представим себе цилиндр с подвижным поршнем, заполненный газом (рис. 5.4).
Пока давление газа внутри цилиндра и окружающего наружного воздуха одинаковы, поршень неподвижен. Пусть при этом температура газа и окружающей среды равна 
Будем теперь медленно нагревать газ в цилиндре до температуры 






Нетрудно сообразить, что при изохорическом процессе работа газа равна нулю, так как никакого изменения объема, занятого газом, в этом случае не происходит. Вообще следует помнить, что газ выполняет работу только в процессе изменения своего объема, т. е. при 


Выясним, как можно определить работу газа по графику зависимости р от V в том или ином газовом процессе. При изобарическом процессе график зависимости р от V представляет собой прямую линию, параллельную оси абсцисс, так как р постоянно. Из рис. 5.5 видно, что работа газа в этом случае численно равна заштрихованной площади.
Выясним, как найти работу газа при изотермическом процессе. На рис. 5.6 изображена изотерма идеального газа. При таком процессе газ выполняет работу, так как 




Разбивая интервал 





Можно строго доказать, что работа газа при любом процессе выражается площадью, ограниченной двумя ординатами, отрезком оси абсцисс и графиком того процесса в координатах V и р.
Выясним теперь физический смысл молярной газовой постоянной R. Применяя формулу (5.25) к одному молю идеального газа, получим
Но из уравнения Клапейрона — Менделеева (5.8) для одного моля можно записать для двух состояний газа:
Подставляя это выражение в (5.26), будем иметь 
Из (5.27) следует, что молярная газовая постоянная численно равна работе, совершаемой одним молем идеального газа при его изобарическом нагревании на один кельвин.
Из соотношения 
Услуги по физике:
Лекции по физике:
Присылайте задания в любое время дня и ночи в ➔
Официальный сайт Брильёновой Натальи Валерьевны преподавателя кафедры информатики и электроники Екатеринбургского государственного института.
Все авторские права на размещённые материалы сохранены за правообладателями этих материалов. Любое коммерческое и/или иное использование кроме предварительного ознакомления материалов сайта natalibrilenova.ru запрещено. Публикация и распространение размещённых материалов не преследует за собой коммерческой и/или любой другой выгоды.
Сайт предназначен для облегчения образовательного путешествия студентам очникам и заочникам по вопросам обучения . Наталья Брильёнова не предлагает и не оказывает товары и услуги.
Идеальный газ в физике — основные понятия, формулы и определение с примерами
Содержание:
Идеальный газ:
Наиболее простым из всех агрегатных состояний вещества является газообразное. Поэтому изучение свойств веществ начинают с газов. Газ (греч. chaos — хаос) — такое агрегатное состояние вещества, когда составляющие его частицы почти свободно и хаотически движутся между соударениями, во время которых происходит резкое изменение их скорости. Термин «газ» предложил в начале XVII в. нидерландский химик Ян Батист ван Гельмонт (1579— 1644).
Макро- и микропараметры:
При изучении механики в 9-м классе вы познакомились с понятием «состояние механической системы тел». Параметрами этого состояния являются координаты, скорости или импульсы тел. В тепловых процессах основными физическими величинами, характеризующими состояние макроскопических тел без учёта их молекулярного строения, являются давление
Одна из важнейших задач молекулярно-кпнетической теории состоит в установлении связи между макроскопическими и микроскопическими параметрами.
Идеальный газ
Для теоретического объяснения свойств газов используют их упрощённую модель — идеальный газ.
Идеальный газ — модель газа, удовлетворяющая следующим условиям: 1) молекулы газа можно считать материальными точками, которые хаотически движутся; 2) силы взаимодействия между молекулами идеального газа практически отсутствуют (потенциальная энергия их взаимодействия равна нулю); силы действуют только во время столкновений молекул, причём это силы отталкивания.
Поведение молекул идеального газа можно описать, используя законы Ньютона и учитывая, что между соударениями молекулы движутся практически равномерно и прямолинейно.
Модель идеального газа можно использовать в ограниченном диапазоне температур и при достаточно малых давлениях. Так, например, свойства водорода и гелия при нормальном атмосферном давлении и комнатной температуре близки к свойствам идеального газа.
Изучая физику в 7-м классе, вы узнали, что давление газа на стенки сосуда, в котором он находится, как и на любое тело, помещённое внутрь сосуда, создаётся в результате ударов частиц, образующих газ (рис. 14). Вследствие хаотичности их движения усреднённое по времени давление газа в любой части сосуда одинаково, и его можно определить по формуле
Выражение (3.1) называют основным уравнением молекулярно-кинетической теории идеального газа. Это уравнение позволяет рассчитать макроскопический параметр давление р идеального газа через массу 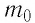
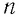
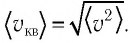
Зависимость давления газа от среднего значения квадрата скорости 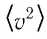
Обозначим через 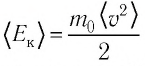
Из выражения (3.2) следует, что давление идеального газа зависит от средней кинетической энергии поступательного движения его молекул и их концентрации.
Баллон электрической лампы наполнен газом, плотность которого 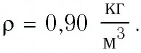
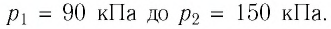

Решение. Покажем, что между плотностью р газа и концентрацией 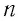
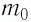
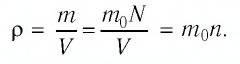
Тогда основное уравнение молекулярно-кинетической теории можно записать в виде: 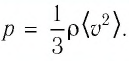
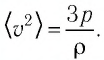
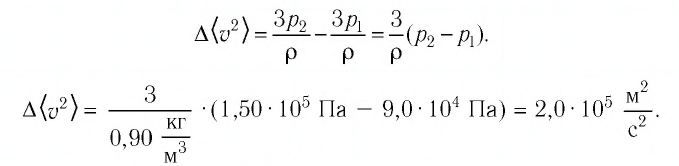
Ответ:
В сосуде вместимостью 
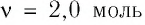
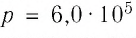
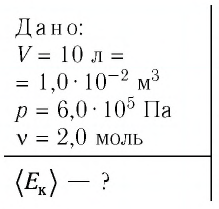
Решение. Из основного уравнения молекулярно-кинетической теории, записанного в виде 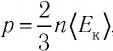
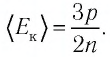
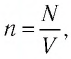
Ответ:
Уравнение состояния идеального газа
Выясним, как связаны между собой макроскопические параметры идеального газа, которые характеризуют его равновесное состояние: давление, масса всего газа, объём, предоставленный ему, и температура.
Состояние макроскопической системы полностью определено, если известны её макроскопические параметры — давление р, масса 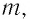
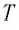
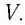
Если при переходе идеального газа из одного состояния в другое число его т
молекул 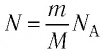
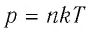
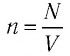
где 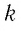
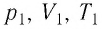
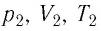
При неизменных массе и молярной массе идеального газа отношение произведения его давления и объёма к абсолютной температуре является величиной постоянной.
Уравнение (5.2) связывает два рассматриваемых состояния идеального газа независимо от того, каким образом газ перешёл из одного состояния в другое.
Уравнение состояния в виде (5.2) впервые вывел в 1834 г. французский физик Бенуа Клапейрон (1799—1864), поэтому его называют уравнением Клапейрона.
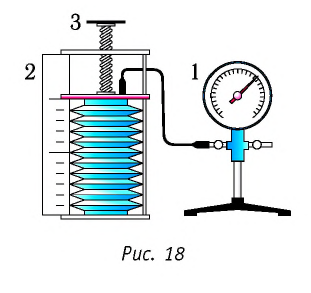
В справедливости уравнения состояния можно убедиться, воспользовавшись установкой, изображённой на рисунке 18. Манометром 1, соединённым с герметичным гофрированным сосудом, регистрируют давление газа внутри сосуда. Объём газа в сосуде можно рассчитать, используя линейку 2. Температура газа в сосуде равна температуре окружающей среды и может быть измерена термометром.
Измерив параметры газа 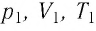
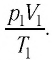
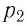
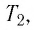
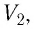
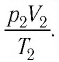
Уравнение состояния (5.2) можно применять для газов при следующих условиях:
- не очень большие давления (пока собственный объём всех молекул газа пренебрежимо мал по сравнению с предоставленным ему объёмом);
- не слишком низкие или же высокие температуры (пока абсолютное значение потенциальной энергии межмолекулярного взаимодействия пренебрежимо мало по сравнению с кинетической энергией теплового движения молекул).
Поскольку число частиц 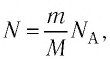
Величину, равную произведению постоянной Больцмана 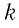
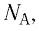
С учётом выражения (5.4) уравнение (5.3) примет вид:
Поскольку количество вещества 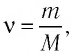
Уравнение состояния в виде (5.5) впервые получил русский учёный Д. И. Менделеев (1834—1907) в 1874 г., поэтому его называют уравнением Клапейрона—Менделеева.
Отметим, что уравнение Клапейрона—Менделеева связывает между собой макроскопические параметры конкретного состояния идеального газа. Используя уравнение Клапейрона-Менделеева, можно описать различные процессы, происходящие в идеальном газе.
Давление смеси газов
В повседневной жизни часто приходится иметь дело не с газом, состоящим из одинаковых молекул, а со смесью нескольких разнородных газов, не вступающих в химические реакции при рассматриваемых условиях. Например, воздух в комнате является смесью азота, кислорода, инертных газов и водорода, а также некоторых других газов.
Вследствие теплового движения частиц каждого газа, входящего в состав газовой смеси, они равномерно распределяются по всему предоставленному смеси объёму. Столкновения частиц обеспечивают в смеси тепловое равновесие.
Каждый газ вносит свой вклад в суммарное давление, производимое газовой смесью, создавая давление, называемое парциальным.
Парциальное давление — давление газа, входящего в состав газовой смеси, если бы он один занимал весь объём, предоставленный смеси, при той же температуре.
Смесь идеальных газов принимают за идеальный газ.
Из истории физики:
Фундаментальные исследования газовых смесей провёл английский учёный Джон Дальтон (1766-1844). Им сформулирован закон независимости парциальных давлений компонентов смеси (1801-1802). В 1802 г. на несколько месяцев раньше французского учёного Жозефа Гей-Люссака (1778-1850) Дальтон установил закон теплового расширения газов, а также ввёл понятие атомного веса.
При постоянных массе и молярной массе отношение произведения давления идеального газа и его объёма к абсолютной температуре является величиной постоянной (уравнение состояния идеального газа):
Парциальное давление — давление газа, входящего в состав газовой смеси, если бы он один занимал весь объём, предоставленный смеси, при той же температуре.
Баллон с газом, давление которого 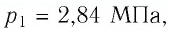
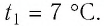
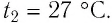
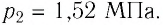

Решение. Если пренебречь тепловым расширением баллона, то его вместимость не изменяется. Запишем уравнение Клапейрона—Менделеева для начального и конечного состоянии газа, считая его идеальным:
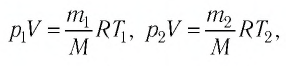
откуда
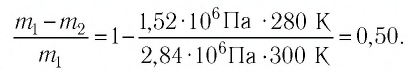
Ответ:
Основное уравнение молекулярно-кинетической теории идеального газа
В молекулярной физике изучаются свойства вещества во всех агрегатных состояниях, в том числе и газообразном. В природе почти нет отдельно взятого газа, реальный газ атмосферы представляют собой сложную систему разных газов.
Основная задача молекулярно-кинетической теории — установление связи между макроскопическими и микроскопическими параметрами, характеризующими свойства этой сложной системы. С этой целью реальный газ сложного состава заменяется упрощенной, идеализированной моделью.
Идеальный газ:
Первый шаг в создании любой физической теории состоит в построении идеализированной модели реального объекта. Такая модель всегда имеет упрощенный вид действительности, и с ее помощью изучаются количественные и качественные закономерности и свойства реального объекта с учетом определенных ограничений.
Для изучения свойств газов в молекулярно-кинетической теории применяется идеализированная модель — «идеальный газ».
Идеальный газ — это газ, удовлетворяющий следующим условиям:
- — линейные размеры молекул во много раз меньше расстояний между ними и не принимаются во внимание. Поэтому можно сказать, что молекулы идеального газа не взаимодействуют друг с другом, то есть потенциальная энергия взаимодействия молекул идеального газа равна нулю:
Поэтому идеальный газ можно сколько угодно сжимать; —только при соударении молекул друг с другом или со стенками сосуда между ними возникают силы отталкивания;
- — соударения молекул абсолютно упругие;
- — скорость молекул может иметь произвольные значения, движение каждой молекулы подчиняется законам классической механики.
Свойства идеального газа характеризуются микроскопическими и макроскопическими параметрами и связями между ними.
Микроскопические параметры газа — это параметры, характеризующие движение молекул газа. К ним относятся масса молекулы, его скорость, импульс и кинетическая энергия поступательного движения молекулы.
Макроскопическими являются такие параметры газа, как ее давление, объем и температура, определяющие свойства газа в целом.
Основной задачей молекулярно-кинетической теории является установление взаимной связи между микроскопическими параметрами, характеризующими молекулы газа, и макроскопическими (измеряемыми) величинами, характеризующими газ.
Основное уравнение молекулярно-кинетической теории идеального газа:
Известно, что давление газа возникает в результате многочисленных непрерывных и беспорядочных соударений молекул газа о стенки сосуда, в котором он находится. Это давление равно среднему значению модуля равнодействующей силы, приходящейся на единицу площади:
В 1857 г. немецкий физик Рудольф Клаузиус (1822-1888), используя модель идеального газа, определил уравнение для давления газа, называемое основным уравнением молекулярно-кинетической теории идеального газа.
Основное уравнение молекулярно-кинетической теории идеального газа — это уравнение, связывающее макроскопический параметр газа — его давление, с микроскопическими параметрами, характеризующими молекулы газа:
Где 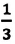
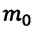
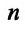
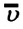
Концентрация молекул — это число молекул в единице объема:
Единица концентрации в СИ:
Средняя квадратичная скорость молекул равна корню квадратному из средней арифметической величины квадратов скоростей отдельных молекул:
Так как среднее значение квадрата скорости молекул связано со средним значением кинетической энергии их поступательного движения, то, следовательно, и давление идеального газа зависит от среднего значения кинетической энергии молекул:
Давление идеального газа прямо пропорционально концентрации молекул и среднему значению кинетической энергии молекул.
Если принять во внимание, что плотность газа 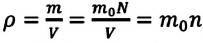
Вы исследовали идеальный газ с позиций MKT и определили связь между его макроскопическими и микроскопическими параметрами.
Уравнение Клапейрона
Связь между тремя макроскопическими параметрами (давление, объем и температура), характеризующими состояние идеального газа, определяет уравнение состояние идеального газа.
Уравнение состояния идеального газа — это уравнение, описывающее состояние газа и устанавливающее связь между параметрами его начального и конечного состояний.
Если число молекул идеального газа остается постоянным, то есть масса и молярная масса не меняются, то при переходе идеального газа из одного состояния в другое, из формул (6.2) и (6.9) имеем для этих состояний:
Где 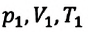
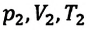
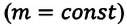
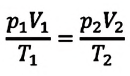
Это уравнение (6.15), характеризующее состояние идеального газа, впервые в 1834 году получил французский физик Бенуа Клапейрон (1799-1864), поэтому его назвали уравнением Клапейрона.
Отношение произведения давления идеального газа данной массы на его объем к абсолютной температуре является постоянной величиной.
Уравнение Менделеева-Клапейрона:
Приняв во внимание формулу, связывающую число частичек вещества, общую массу вещества, молярную массу и число Авогадро,
в формуле (6.14), получим:
Произведение постоянной Больцмана на постоянную Авогадро также является постоянной величиной. Оно называется универсальной газовой постоянной, обозначается буквой 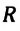
Приняв во внимание выражение (6.17) в (6.16), получаем выражение, характеризующее состояние идеального газа и называемое уравнением Менделеева-Клапейрона.
Физический смысл универсальной газовой постоянной определяется из последнего выражения.
Универсальная газовая постоянная равна отношению произведения давления и объема к абсолютной температуре одного моля любого газа.
Уравнение Менделеева-Клапейрона можно записать и в таком виде:
Где 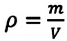
| Рекомендую подробно изучить предметы: |
|
| Ещё лекции с примерами решения и объяснением: |
- Уравнение МКТ идеального газа
- Уравнение состояния идеального газа
- Температура в физике
- Парообразование и конденсация
- Зависимость веса тела от вида движения
- Движение тел под воздействием нескольких сил
- Абсолютно упругие и неупругие столкновения тел
- Механизмы, работающие на основе правила моментов
При копировании любых материалов с сайта evkova.org обязательна активная ссылка на сайт www.evkova.org
Сайт создан коллективом преподавателей на некоммерческой основе для дополнительного образования молодежи
Сайт пишется, поддерживается и управляется коллективом преподавателей
Whatsapp и логотип whatsapp являются товарными знаками корпорации WhatsApp LLC.
Cайт носит информационный характер и ни при каких условиях не является публичной офертой, которая определяется положениями статьи 437 Гражданского кодекса РФ. Анна Евкова не оказывает никаких услуг.
Газовые смеси. Теплоемкость газов. Смеси идеальных газов, определение их состава и теплоемкости смеси газа
1.3. Уравнение состояния идеального газа
Вид уравнений состояний (1.1) для реальных веществ достаточно сложен.
В связи с этим в термодинамике используются упрощенные физические модели рабочих тел.
Для рабочих тел в газообразном состоянии самой простой и исторически первой является модель идеального газа . Под идеальным газом понимается газ, в котором силы межмолекулярного взаимодействия (притяжение и отталкивание) отсутствуют, а сами молекулы рассматриваются как материальные точки. Идеальный газ подчиняется уравнению Клайперона – Менделеева
где m – масса газа в системе; μ – молярная масса газа; R μ = 8314 Дж/(кмоль·К) – универсальная газовая постоянная, которая не зависит ни от вида газа, ни от условий его существования. Уравнение состояния (1.2) получено путем объединения законов Бойля-Мариотта и Гей-Люссака с учетом закона Авогадро .
Молярная масса μ = m /n , кг/моль, – масса вещества, взятого в количестве одного моля. 1 моль – это единица количества вещества, в которой содержится столько же частиц, сколько в 12 граммах углерода. Количество вещества – n = N/N A , моль, где N – число частиц (атомов, молекул), N A ≈ 6,02·10 23 – число атомов в 12 граммах углерода (число Авогадро ). Численно μ = Мr·10 -3 , где Mr – относительная молекулярная масса вещества (табл. Менделеева ) (например: =2 кг/кмоль).
В удельных величинах (т.е. для 1 кг газа) уравнение (1.2) будет иметь вид
где R – удельная газовая постоянная, Дж/(кг·К).
Поясним физический смысл удельной газовой постоянной R . Для первого состояния уравнение (1.2) запишется в виде , для второго состояния при том же давлении – . Вычтем из второго уравнения первое и найдем, что , т.е. удельная газовая постоянная есть работа, совершаемая 1 кг газа при его нагреве на 1 градус при постоянном давлении.
Экспериментальные данные показывают, что реальный газ тем ближе к идеальному, чем ниже его плотность. Другими совами, с уменьшением объема данного количества газа, вызываемым повышением давления или понижением температуры, любой газ будет давать все большие отклонения от свойств идеального газа. Таким образом, под понятие «идеальный газ» подходят все реальные газы при высоких температурах и малых давлениях.
В практике зачастую рабочим телом является смесь однородных газов (например, воздух), каждый из которых можно считать идеальным и которые не вступают между собой в химические реакции.
Такая смесь также является идеальным газом и подчиняется уравнению состояния (1.2) для смеси
где R=R μ / μ – газовая постоянная смеси; μ –средняя (кажущаяся) молярная масса смеси (условная величина, относящаяся к однородному представляемому газу, у которого число молекул и общая масса равны числу молекул и массе смеси).
Масса смеси равна массе всех составляющих компонент
Основным законом, определяющим поведение газовой смеси является закон Дальтона :
каждый отдельный газ ведет себя в газовой смеси так, как будто он один при температуре смеси занимает весь объем смеси,
каждый отдельный газ, входящий в газовую смесь, имеет такое давление, какое бы он имел бы, если бы он один занимал весь объем газовой смеси.
Отсюда величина р (абсолютное давление смеси) определяется как
где р i – парциальное давление i -го компонента, т.е. давление, которое имел бы i -й компонент, если бы он один занимал весь объем смеси при той же температуре ().
Состав смеси задается массовыми или молярными долями составляющих смесь компонент, а также объемными долями (концентрациями).
Массовой долей называется отношение массы каждого газа к общей массе смеси: .
Из уравнения (1.3) следует, что .
Объемной долей называется отношение парциального объема (объем, который занимал бы газ, если его давление и температура равнялись давлению и температуре смеси газов, т.е. ) к общему объему смеси газов: . Из определений парциальных давления и объема и постоянства температуры следует:

Просуммировав последнее равенство по всем компонентам смеси, получим , т.е. сумма парциальных объемов газов, составляющих смесь, равна объему смеси газов.
Сумма объемных долей равна единице: .
Молярной долей компонента называют отношение количества вещества каждого газа n i к количеству вещества смеси газов n . Из соотношений и и закона Авогадро (в равных объемах разных идеальных газов, находящихся при одинаковых температурах и одинаковых давлениях, заключено равное число молекул, т.е. ) следует:
т.е. задание смеси молярными долями равнозначно заданию ее объемными долями.
Массовые и объемные доли связаны соотношением:

Если смесь задана массовыми долями g i , то газовая постоянная смеси и молярная масса смеси вычисляются следующим образом:
Если смесь задана объемными долями r i , то формулы для вычисления молярной массы смеси и газовой постоянной смеси следующие:

Парциальные давления и объемы газов определяются по закону Бойля –Мариотта (при постоянной температуре газа произведение давления газа на его объем есть величина постоянная, т.е.):

Международная система единиц (СИ) и ее основные единицы.
Основные термодинамические параметры и их размерность.
Что понимают под равновесным состоянием термодинамической системы?
Понятие равновесного и неравновесного состояний.
Что такое уравнение состояния системы?
Геометрическая интерпретация состояния системы, термодинамического процесса.
Что называется идеальным газом? В чем отличие идеального газа от реального?
Что такое газовая постоянная? Ее физический смысл, размерность и способы определения.
Сообщение рабочему телу теплоты в каком-либо процессе вызывает изменение его состояния и, в общем случае, сопровождается изменением температуры. Изменение температуры, как и любого другого параметра состояния рабочего тела, не зависит от вида процесса, а зависит от его начального (1 ) и конечного (2 ) состояния, т.е. (для элементарного процесса изменение параметра заменяется его дифференциалом ).
Отношение количества теплоты δQ , сообщаемого телу, к изменению температуры тела dT в элементарном термодинамическом процессе называется истинной теплоемкостью тела в данном процессе:
Нижний индекс здесь указывает на то обстоятельство, что теплоемкость так же, как и теплота, зависит от характера процесса. Кроме того, теплоемкость зависит от количества тела и его термодинамического состояния. Следует также отметить, что в данном процессе не меняется химический состав тела, не содержится переход вещества из одного агрегатного состояния в другое, не происходит растворения компонентов и пр.
В зависимости от выбранной единицы количества вещества различают массовую, объемную и мольную удельные теплоемкости:
Наиболее часто на практике используется понятие массовой теплоемкости.
2.1. Истинная и средняя теплоемкости
Теплоемкость реального вещества не является постоянной величиной. Она изменяется с изменением температуры, причем эта зависимость может быть весьма значительной (рис. 2.1).
Удельное количество теплоты процесса вычисляется по формуле
Применяют следующие способы по определению этой величины:
по результатам эксперимента зависимость теплоемкости от температуры представляют в виде аппроксимационного полинома
где – коэффициенты аппроксимации. В справочной литературе приводятся эти коэффициенты. Тогда
в практических расчетах в интервале температур t 1 , t 2 теплоемкость считают постоянной величиной, равной
которую называют средней теплоемкостью в данном интервале в отличие от истинной теплоемкости, введенной в (2.1). В справочных данных приводятся средние теплоемкости от 0 до фиксированной температуры t , полученные опытным путем, т.е.
Среднюю теплоемкость в интервале температур t 1 , t 2 по этим справочным данным можно вычислить по формуле
Тогда удельное количество теплоты процесса определится как
2.2. Изохорная и изобарная теплоемкости
В термодинамике имеют большое значение
равная отношению количества теплоты в процессе при постоянном объеме к изменению температуры тела,
равная отношению количества теплоты в процессе при постоянном давлении к изменению температуры тела.
В теплотехнических расчетах используют таблицы, в которых приводятся полученные опытным путем числовые значения удельных изобарной и изохорной теплоемкостей для различных веществ в зависимости от температуры.
2.3. Теплоемкость смесей газов
При расчетах часто приходится иметь дело со смесями газов, а в таблицах приводятся теплоемкости только для отдельных газов.
Если смесь газов задана массовыми долями g i , то удельные массовые теплоемкости смеси определяются по формулам
Если смесь газов задана объемными долями r i , то удельные объемные теплоемкости смеси определяются по формулам
Выпишите единицы измерения удельной теплоемкости.
Как вводится понятие средней теплоемкости?
3. Закон сохранения и превращения энергии
Понятие энергии связано с движением материи.
Энергия может принимать многие формы – механической работы, теплоты, химической энергии, энергии электрического и магнитного полей.
В термодинамическом процессе взаимодействие окружающей среды и закрытой термодинамической системы осуществляется путем обмена энергией в форме теплоты и механической работы.
3.1. Внутренняя энергия
Любая среда обладает некоторым запасом внутренней энергией U (Дж), которую в технической термодинамике представляют как сумму кинетической и потенциальной энергий молекул и атомов среды. Кинетическая энергия этих частиц определяется их скоростью и массой, потенциальная – силами взаимодействия между ними, которые зависят от их взаимного расположения. Внутренняя энергия системы – это энергия, заключенная в самой системе. Значит, внутренняя энергия может характеризовать состояние тела наряду с величинами р , V , T .
Внутренняя энергия обладает свойством аддитивности, т.е. внутренняя энергия сложной системы равна сумме внутренних энергий составляющих её частей:
Внутренняя энергия 1 кг вещества называется удельной внутренней энергией u = U / m (Дж/кг).
Для большинства технических приложений термодинамики важно не абсолютное значение U , а изменение этой величины. Поэтому количественное определение внутренней энергии однородной системы часто определяется по отношению к некоторому условно выбранному стандартному состоянию.
3.2. Закон сохранения энергии в термодинамике
Совершая термодинамический процесс, закрытая система взаимодействует с внешней средой (внешними телами и полями), т.е. обменивается энергией. В технической термодинамике рассматриваются два вида передачи энергии – путем передачи теплоты и совершением механической работы.
Передача теплоты происходит между телами, имеющими различную температуру и приведенными в соприкосновение, или между телами с различными температурами, находящимися на расстоянии, посредством электромагнитных волн (тепловое излучение). Передача теплоты происходит на молекулярном (микрофизическом) уровне без видимого движения тел.
Передача энергии в форме работы происходит с перемещением всего тела или его части в пространстве. При этом способе тело либо движется в силовом поле, либо изменяет свой объем под действием внешнего давления. Работа представляет собой макрофизическую форму передачи энергии.
Следует заметить, что теплота и работа в отличие от энергии тела не являются функциями его состояния, а зависят от вида процесса, определяют этот процесс, т.е. являются функциями самого процесса.
Многочисленные опыты и наблюдения привели к открытию фундаментального закона природы – закону сохранения энергии: энергия в природе не возникает из ничего и не исчезает, или количество энергии неизменно, она только переходит из одной формы в другую, или
где Q – теплота, участвующая в процессе; L – совершаемая работа; ΔЕ – изменение энергии системы. Здесь и далее условимся считать:
работу положительной , если эта работа совершается рабочим телом, и отрицательной , если совершается работа над рабочим телом системы;
теплоту, подведенную к телу, – положительной , а отведенную – отрицательной,
кроме того, изменение любого параметра состояния в конечном процессе будем обозначать символом Δ (дельта), а в элементарном процессе – d (дифференциал соответствующего параметра). При любом конечном термодинамическом процессе изменение параметра состояния (давление, температура, внутренняя энергия, энтальпия, энтропия и т.д.) не зависит от вида процесса, а определяется начальным и конечным состоянием.
В общем случае термодинамическая система обладает внутренней энергией U , кинетической энергией (в термодинамике система рассматривается как целое, движущееся со скоростью w ) – mw 2 /2, потенциальной – mgz (z – высота, на которой находится система). Изменение полной энергии в процессе 1 –2 можно представить как:
Работа, совершаемая в этом процессе, складывается из работы L об, связанной с изменением объема рабочего тела системы (деформационная работа), работы L дв по перемещению системы в пространстве, технической работы L тех (при перемещении системы в различных технических устройств, например, в двигателе, паровом котле, компрессоре и т.п.), работы против сил трения L тр:
L = L об + L дв + L тех + L тр.
Теплота, участвующая в процессе, представляет собой сумму теплоты Q внеш, задействованной в обмене с внешней средой, и теплоты трения Q тр:
Учитывая, что Q тр = L тр (многочисленные эксперименты показали, что работа потока, затраченная на преодоление трения, полностью превращается в теплоту, воспринимаемую потоком), закон сохранения энергии в термодинамике для 1 кг рабочего однородного вещества (т.е. в удельных массовых величинах) в элементарном процессе можно записать:

(индекс внеш пропущен за ненадобностью).
Следует подчеркнуть, что в правой части (3.1) под знаком дифференциала находятся функции состояния, а остальные – величины, зависящие от характера протекания термодинамического процесса. Так как работа и теплота являются функциями процесса, а не функциями состояния, то знак δ обозначает лишь тот факт, что в элементарном процессе величины, следующие за ним – произвольные бесконечно малые, а не приращения каких-либо определенных функций. Таким образом, δq и δl –элементарные (т.е. соответствующие бесконечно малым изменениям состояния системы) количества теплоты и работы.
Если термодинамическая система не меняет своего положения в пространстве и единственным видом работы является работа, связанная с изменением объема системы, то уравнение (3.1) принимает более простой вид:
Работа δl об совершается либо против сил внешнего давления и, тогда, объем рабочего тела расширяется, либо, наоборот, внешняя среда совершает работу над телом, сжимая его. Для равновесных процессов, когда давление среды равно давлению в рабочем теле, эта работа вычисляется как р dv , где v – удельный объем рабочего вещества.
называют первым началом термодинамики: подведенная к закрытой покоящейся термодинамической системе теплота расходуется на изменение внутренней энергии системы и на совершение работы по изменению объема системы . Балансовое соотношение (3.2) называют еще лекций по теоретическому литературоведению. 1. Барокко: .
Л. А. Елисеева © Федеральное государственное бюджетное учреждение науки Государственная публичная научно-техническая библиотека Сибирского отделения ран (гпнтб со ран), 2013
Случайных блужданий / А. Н. Бородин , И. А. Ибрагимов; под. 241. Дорогокупец П.И. Термодинамика минералов и минеральных равновесий. каталогов: конспект лекции по курсу «Справочно. государственного технического университета. Серия, Технические науки. – .
Н. В. Басова [и др.];под общ ред. Н. В. Басовой. Ростов н/Д: Феникс, 2008
Курс) Письменный Д. Т. Конспект лекций по высшей математике [Текст] : . Техническая термодинамика Рудобашта, С. П. Теплотехника [Текст] : учебник для студ. вузов, обучающихся по . 2008. — 204 с. 10 Бородин , И. Ф. Автоматизация технологических процессов.
Список научных трудов казнму за период 2008 — 1 06 2013 г (1)
. «Рентгенолгические методы исследования» Лекции по клинической онкологии. Алматы. второго закона термодинамики » 2-Международный. и экспертная оценка технического оснащения организаций здравоохранения. академика РАМН Ю.И. Бородина , Бишкек, 2009,С. .
Отправить свою хорошую работу в базу знаний просто. Используйте форму, расположенную ниже
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
Размещено на http://www.allbest.ru/
Министерство образования и науки РФ
Федеральное государственное бюджетное образовательное учреждение
Волгоградский Государственный Технический университет
Кировский вечерний факультет
Семестровая работа по дисциплине:
ТОПЛИВО, ГАЗОВЫЕ СМЕСИ И ТЕПЛОЕМКОСТЬ
Выполнил: студент гр.ТВБ-385
Проверил: доц. Горюнов В.А.
топливо сжигание температура окислитель
В промышленной печи при постоянном давлении сжигают топливо (этанол). В качестве окислителя используют воздух с температурой T 1 =660К. Заданы коэффициенты избытка воздуха: а= 1,0 и коэффициент полноты сгорания топлива ж =0,9. Определить теоретическое значение максимальной температуры горения Тг. Теплотой, вносимой топливом, пренебречь.
Таб. №1. Состав и теплота сгорания топлива
Таб. №2. Формулы средних изохорных массовых теплоемкостей (c v)
0,691 + 7,1*10 — 5 Т
0,775 + 11,7*10 -5 Т
1,328 + 28,07*10 -5 Т
0,716 + 7,54*10 -5 Т
0,628 + 6,75*10 -5 Т
Таб. №3. Результаты расчета
Максимальная теоретическая температура сгорания находится с помощью уравнения теплового баланса:
где: Q o — Теплота, вносимая окислителем;
Qh — Низшая теплота сгорания топлива;
ж — Коэффициент полноты сгорания топлива;
Qn. Сг- Теплота, полученная продуктами сгорания;
Находим теплоту, выделяющуюся при сжигании топлива (жQ h).
Из таблицы 2 берется значение Q h:
Q h =27100 кДж/кг
Из таблицы 1 берется значение ж (в моём варианте ж=0,9)
ж *Q H =0,9*27100=24390 кДж/кг
Находим теплоту, вносимую окислителем:
Q o = С р. возд. *m возд* T 1
Определяем среднюю изохорную массовую теплоемкость воздуха по формуле, приведенной в таблице №2
c v возд= 0,691 + 7,1*10 -5 *660=0,73786 кДж/кг*К
Вычисляем среднюю изобарную массовую теплоемкость по формуле Майера:
Ср возд= c v возд +R=0.73786+0.287=1.02486 кДж/кг*К
Определяем теоретически необходимую массу воздуха:
m o возд=2,67* C p +8H p — O p /0,23= (2,67*0,52+8*0,13-0,35)/0,23= (1,3884+1,04-0,35)/0,23=2,0784/0,23=9,0365 Кг/Кг
Определяем действительную массу воздуха:
m возд =а*m o возд =1,0*9,0365 =9,0365 Кг/Кг
Q o =С р. возд. *m возд* T 1 =1.02486*9,0365*660=6112.36 кДж/кг
Вычисляем теплоту, внесённую окислителем и сгоревшим топливом:
жQ H +Q o =24390+6112.36=30502.36 кДж/кг
Находим теплоту продуктов сгорания (Qn.Сг):
Q n . Сг = С Р, п.сг*m п, сг * T 2 .
а) Определяем массу продуктов сгорания:
m п, сг =1+m возд =1+9,0365=10.0365
b) Вычисляем массовые доли компонентов в продуктах сгорания:
g co 2 =m co 2 /m п, сг =3.67*С Р / m п, сг =3.67*0.52/10.0365=0.1901
g H 2 o =m H 2 o / m п, сг =9*H p / m п, сг =9*0.13/10.0365=0.1166
g o2 =m o2 /m п, сг =0.23*(a-1) *m o возд /m п, сг =0.23*(1.0-1) *9,0365/ 10.0365=0
g N2 =m N2 /m п, сг =0.77*a*m o возд /m п, сг =0.77*1.0*9,0365/10.0365 = =0.693
c) Находим среднюю изобарную массовую теплоемкость продуктов сгорания по формуле:
С Р, п. сг= g (co 2) * С р(co 2) + g (H 2 o) * С р (H 2 O) + g (o 2) * С р(O 2) + g (N 2) * С р(N 2) =
Находим изобарные теплоемкости компонентов продуктов сгорания:
a) c v(co 2) = 0,775 + 11,7*10 -5 *Т 2
b) c v(H2 o) =1.328+28.07*10 -5 *Т 2
c) c v(O 2) =0.628+6.75*10 -5 *Т 2
d) c v(N 2) =0.716+7.54*10 -5 *Т 2
Используя формулу Майера находим с р. :
1. С р (co 2) =c v(co 2) +R=0.775+11.7*10 -5 *Т 2 +0.189=0.964+11.7*10 -5 *Т 2
2. С р (H2O) = c v(H2 o) +R=1.328+28.07*10 -5 *Т 2 +0.462=1.79+28.07*10 -5 *Т 2
3. С р (O 2) = c v(O 2) +R=0.628+6.75*10 -5 *Т 2 +0.260=0.888+6.75*10 -5 *Т 2
4. С р (N 2) = c v(N 2) +R=0.716+7.54*10 -5 *Т 2 +0.297=1.013+7.54*10 -5 *Т 2
Таким образом находим среднюю изобарную массовую теплоемкость продуктов сгорания по формуле:
С Р, п. сг= g (co 2) * С р(co 2) + g (H 2 o) * С р (H 2 O) + g (o 2) * С р(O 2) + g (N 2) * С р(N 2) =0.1901*(0.964+11.7*10 -5 *Т 2) +0.1166*(1.79+28.07*10 -5 *Т 2) +0*(0.888+6.75*10 -5 *Т 2) +0.693*(1.013+7.54*10 -5 *Т 2) =0,1832+2,2242*10 -5 *Т 2 +0,2087+3,2729*10 -5 *Т 2 +0+0,702+5,2252*10 -5 *Т 2 =1,0939+10,7223*10 -5 *Т 2 =1,0939+10,7223*10 -5 *3934.89= =1.516
Находим теплоту продуктов сгорания Q n . Сг:
Q n . Сг = С Р, п.сг*m п, сг * T 2 =(1,0939+10,7223*10 -5 *Т 2) *10.0365*T 2
Используя уравнение теплового баланса определяем максимальную теоретическую температуру горения(T 2):
24390=(1,0939+10,7223*10 -5 *Т 2) *10.0365*T 2 сокращаем обе стороны на 10.0365:
10.7223*10 -5 *(Т 2) 2 +1.09369*T 2 — 2430.13=0
1.09369 + 1,495/0,000214=1875 К
Размещено на Allbest.ru
Подобные документы
Определение массовой, объемной и мольной теплоемкость газовой смеси. Расчет конвективного коэффициента теплоотдачи и конвективного теплового потока от трубы к воздуху в гараже. Расчет по формуле Д.И. Менделеева низшей и высшей теплоты сгорания топлива.
контрольная работа , добавлен 11.01.2015
Газовые смеси, теплоемкость. Расчет средней молярной и удельной теплоемкости. Основные циклы двигателей внутреннего сгорания. Термический коэффициент полезного действия цикла дизеля. Водяной пар, паросиловые установки. Общее понятие о цикле Ренкина.
курсовая работа , добавлен 01.11.2012
Удельная теплоемкость — отношение теплоты, полученной единицей количества вещества, к изменению температуры. Зависимость количества теплоты от характера процесса, а теплоемкости — от условий его протекания. Термодинамические процессы с идеальным газом.
реферат , добавлен 25.01.2009
Определение теплоты сгорания для газообразного топлива как суммы произведений тепловых эффектов составляющих горючих газов на их количество. Теоретически необходимый расход воздуха для горения природного газа. Определение объёма продуктов горения.
контрольная работа , добавлен 17.11.2010
Молярная масса и массовые теплоемкости газовой смеси. Процесс адиабатного состояния. Параметры рабочего тела в точках цикла. Влияние степени сжатия, повышения давления и изобарного расширения на термический КПД цикла. Процесс отвода теплоты по изохоре.
курсовая работа , добавлен 07.03.2010
Определение расхода воздуха и количества продуктов горения. Расчет состава угольной пыли и коэффициента избытка воздуха при спекании бокситов во вращающихся печах. Использование полуэмпирической формулы Менделеева для вычисления теплоты сгорания топлива.
контрольная работа , добавлен 20.02.2014
Методика расчета горения топлива на воздухе: определение количества кислорода воздуха, продуктов сгорания, теплотворной способности топлива, калориметрической и действительной температуры горения. Горение топлива на воздухе обогащённым кислородом.
курсовая работа , добавлен 08.12.2011
Термодинамика как область физики, исследующая процессы преобразования теплоты в работу и другие виды энергии. Характеристика ключевых особенностей схемы газового термометра. Рассмотрение основных свойств идеального газа. Сущность понятия «теплоемкость».
презентация , добавлен 15.04.2014
Описание котлоагрегата до перевода на другой вид топлива. Характеристика принятых к установке горелок. Обоснование температуры уходящих газов. Расчет объемов воздуха и продуктов сгорания при сжигании двух видов топлива. Тепловой баланс и расход топлива.
дипломная работа , добавлен 13.06.2015
Назначение туннельных сушилок. Состав топлива и расчет воздуха на горение. Определение общего объема продуктов горения при сжигании топлива и теоретической температуры. Технологический расчет сушильного туннеля. Теплотехнический расчет процесса сушки.
В тепловых двигателях (машинах) рабочим телом являются смеси различных газов. Если компоненты смеси не вступают в химические реакции между собой, и каждый компонент подчиняется уравнению состояния Клайперона, то такая смесь рассматривается как идеальный газ.
Для расчета смеси необходимо определить μ см — среднемолярную массу и R c м -удельную газовую постоянную смеси. Для их определения необходимо знать состав смеси, т. е. какие компоненты и в каких количествах образуют данную смесь, какие параметры имеет каждый компонент входящий в смесь.
Каждый компонент смеси ведет себя так, как если бы в смеси не было других газов, занимает весь располагаемый объем, в котором находится смесь, следует своему уравнению состояния и оказывает на стенки свое так называемое парциальное давление, при этом температура всех компонентов смеси одинакова и равна температуре смеси.
По закону Дальтона давление смеси Р равно сумме парциальных давлений отдельных компонентов, входящих в смесь:
где n- число компонентов смеси.
По закону Амага — объем смеси V равен сумме парциальных объемов отдельных компонентов, входящих в смесь при температуре и под давлением смеси:

где — парциальный объем, м 3 ; V- объем смеси, м 3
Состав смеси задают объемными (молярными) или массовыми долями.
Объемная доля i-го компонента — это отношение парциального объема компонента к объему смеси, т. е. , тогда сумма объемных долей компонентов смеси равна 1, т. е. . Если значение заданы в %, то их сумма = 100%.
Молярная доля i-го компонента n i – это отношение числа киломолей компонента N i к числу киломолей смеси N, т. е. , где 
Учитывая, что идеальный газ при одинаковых условиях имеет одинаковый объем киломоля, то после подстановки получаем: , т. е. для идеальных газов молярные и объемные доли численно равны.
Массовая доля i-го компонента — это отношение массы компонента к массе смеси : , отсюда следует, что масса смеси равна сумме масс компонентов , а так же сумма массовых долей компонентов равна 1 (или 100%).
Пересчет объемных долей в массовые и обратно производится на основе следующих соотношений:

где ρ = μ/22,4, кг/м 3 .
Откуда следует, что массовая доля i-го компонента определится из соотношения:

где — плотность смеси, кг/м 3 , — объемная доля i-го компонента.
В дальнейшем можно определить через объемные доли.

Плотность смеси для объемных долей определяется из соотношения



Парциальное давление определяется по формулам:


Уравнения состояния компонентов и смеси в целом имеют вид:


откуда после преобразований получаем для массовых долей


Плотность и удельный объем смеси для массовых долей:
; 
Для расчета парциальных давлений используется формула:

Пересчет массовых долей в объемные выполняется по формуле:

При определении теплоемкости смеси газов исходят из положения о том, что для нагрева (охлаждения) газовой смеси необходимо нагреть (охладить) каждый из компонентов смеси
где Q i =M i c i ∆t – теплота, затраченная на изменение температуры i-го компонента смеси, с i – массовая теплоемкость i-го компонента смеси.
Теплоемкость смеси определяется из соотношения (если смесь задана массовыми долями)


Молярная и объемная теплоемкости для смеси заданной объемными долями определяются



Пример 1.5 Сухой воздух по массе состоит из g О2 =23,3% кислорода и g N 2 =76,6% азота. Определить состав воздуха по объему (r О2 и r N 2) и газовую постоянную смеси.
1. Из табл.1 находим кг/кмоль и кг/кмоль
2. Определяем объемные доли кислорода и азота:
1. Газовая постоянная воздуха (смеси) определится по формуле:

Пример 1.6 . Определить количество теплоты потребное для нагревания газовой смеси массой М=2 кг при Р=const, состоящей в % по массе: , , , , при изменении температуры от t 1 =900 о С до t 2 =1200 о С.
1. Определяем среднюю массовую теплоемкость компонентов, составляющих газовую смесь при Р=const и t 1 =900 о С (из П2):
1,0258 кДж/кг·К; =1,1045 кДж/кг·К;
1,1078 кДж/кг·К; =2,1097 кДж/кг·К;
2. Определяем среднюю массовую теплоемкость компонентов, составляющих газовую смесь при Р=const и t 1 =1200 о С (из П2):
1,0509 кДж/кг·К; =1,153 кДж/кг·К;
1,1359 кДж/кг·К; =2,2106 кДж/кг·К;
3. Определяем среднюю массовую теплоемкость смеси для интервала температур: t 2 =1200 о С и t 1 =900 о С:
4. Количество теплоты для нагревания 2 кг смеси при Р=const:
Первый закон термодинамики устанавливает количественную связь между изменением внутренней энергии системы и механической работой, совершаемой против сил внешнего давления окружающей среды в результате подвода теплоты к рабочему телу.
Для закрытой термодинамической системы уравнение первого закона имеет вид
Теплота, сообщаемая рабочему телу (или системе) идет на приращение ее внутренней энергии (dU), вследствие повышения температуры тела, и на совершение внешней работы (dL), вследствие расширения рабочего тела и увеличения его объема.
Первый закон может быть записан в виде dH=dq+VdP=dq-dL 0 ,
где dL 0 =VdP – элементарная работа изменения давления называется полезной внешней (технической) работой.
dU – изменение внутренней энергии рабочего тела (системы), включающей в себя энергию теплового движения молекул (поступательное, вращательное и колебательное) и потенциальную энергию взаимодействия молекул.
Так как переход системы из одного состояния в другое происходит в результате подвода теплоты, поэтому рабочее тело нагревается и его температура повышается на dT и объем увеличивается на dV.
Повышение температуры тела вызывает увеличение кинетической энергии его частиц, а увеличение объема тела приводит к изменению потенциальной энергии частиц. В результате внутренняя энергия тела увеличивается на dU, поэтому внутренняя энергия U есть функция состояния тела и может быть представлена в виде функции двух независимых параметров U=f 1 (P,V); U=f 2 (P,T), U=f 3 (υ,T). Изменение внутренней энергии в термодинамическом процессе определяется только начальным (U 1) и конечным (U 2) состоянием т. е.
В дифференциальном виде изменение внутренней энергии запишется
а) в функции от удельного объема и температуры
б) в функции от температуры, т.к. , то
Для практических расчетов, в которых необходимо учесть изменение С v от температуры, имеются эмпирические формулы и таблицы удельной внутренней энергии (часто молярной). Для идеальных газов молярная внутренняя энергия смеси U м определяется по формуле

Для смеси заданной массовыми долями . Таким образом внутренняя энергия есть свойство системыи характеризует состояние системы .
Энтальпия – тепловая функция состояния, введенная Камерлинг-Оннесом, (лауреат Нобелевской премии, 1913 г.), представляющая собой сумму внутренней энергии, системы U и произведение давления системы P на ее объем V.
Так как входящие в нее величины являются функциями состояния, поэтому H также функция состояния т. е. Н=f 1 (P,V); H=f 2 (V,T); H=f 3 (P,T).
Изменение энтальпии dH влюбом термодинамическом процессе определяется начальным H 1 и конечном H 2 состоянием и не зависит от характера процесса. Если система содержит 1 кг вещества, то применяется удельная энтальпия , Дж/кг.
Для идеального газа дифференциальное уравнение имеет вид
соответственно удельная энтальпия определяется по формуле
Уравнение первого закона термодинамики dq=dU+Pdυ, когда единственным видом работы является работа расширения Pdυ=d(Pυ)- υdP, тогда dq=d(U+Pυ)-υdP, откуда
Тема: Теплоемкость, энтальпия, смеси идеальных газов, внутренняя энергия, работа, термодинамические процессы.
Цель работы: Закрепление знаний, полученных при теоретическом обучении, приобретение навыков в осуществлении теплотехнических расчетов.
I. Основные определения, формулы и уравнения
1. Смеси идеальных газов
Газовой смесью называется механическая смесь нескольких газов, химически не взаимодействующих между собой. Каждый из газов, входящих в смесь, называется газовым компонентом; ведет себя так, как если бы других газов в смеси не было, т.е. равномерно распределяется по всему объему смеси. Давление, которое оказывает каждый газ смеси на стенки сосуда, называюется парциальным. Основным законом для смесей идеальных газов является закон Дальтона, согласно которому давление смеси равно сумме парциальных давлений газов, образующих смесь:
2. Внутренняя энергия
Внутренняя энергия тела представляет собой совокупность кинетической энергии движения микрочастиц, составляющих тело, и потенциальной энергии их. взаимодействия, определяемой. силами взаимного притяжения или отталкивания. Абсолютную величину внутренней энергии определить не возможно, поэтому в термодинамических расчетах вычесляется не абсолютная величина внутренней энергии, а ее изменение, т.е.

где U 1 и U 2 — внутренняя энергия начального и конечного состояния рабочего тела (газа);
u 1 и и 2 — уд. внутренняя энергия начального и конечного состояния рабочего тела.
Отсюда вытекает, что изменение внутренней энергии не зависит от характера и пути процесса, а определяется состоянием рабочего тела в начале и конце процесса изменения.
Особенностью идеального газа является отсутствие в нем сил молекулярных взаимодействий, а значит и отсутсвие внутренней потенциальной энергии, т.е. U n =0 и и„ = 0. Следовательно, внутренняя энергия идеального газа:
U=U k =f(T) unu u=u k =f(T).
В термодинамике всякое изменение состояния рабочего тела в результате обмена энергией с окружающей средой называется процессом. При этом изменяются основные параметры рабочего тела:
Преобразования теплоты в механическую работу связано с процессом изменения состояния рабочего тела. Процессы изменения состояния газа могут быть процессами расширения и сжатия. Для произвольной массы газа М (кг) работа равна:
L = М l = Мр (v 2 — v 1) = , Дж
где l = р (v 2 -v 1) Дж/кг — работа 1 кг газа или удельная работа.
4. Энтальпия газа,
Энтальпия — это параметр, характеризующий потенциальную энергию связи рабочего тела (газа) с окружающей средой. Энтальпия и удельная энтальпия:
I = U + pV, Дж и i i = и +pv , Дж/кг.
Удельной теплоемкостью называется количество тепла, которое нужно подвести к 1 кг газа, чтобы нагреть его на 1°С в данном интервале температур.
Удельная теплоемкость бывает массовой, объeмной и киломольной. Между массовой С, объемной C и киломольной С теплоемкостями существует связь:

где Vo 22,4 м 3 /кмоль — уд. объем газа при нормальных условиях.
Массовая уд. теплоемкость газовой смеси:
Объемная удельная теплоемкость газовой смеси:
Киломольная удельная теплоемкость газовой смеси:
6.Уравнение для определения количества тепла
Количество тепла, отдаваемое или воспринимаемоен рабочим телом (газом) можно определить по уравнению:
Q = M C m (t 2 -t 1), Дж или Q = VC (t-t), Дж, где М и V — весовое или объемное количество газа, кг или м 3 ;
t u t — температура газа в конце и а начале процесса ° С;
С и С — массовая и объемная средняя уд. теплоемкость газа
При t cp = Дж/кгК или Дж/м 3 К
7. Первый закон термодинамики
Этот закон рассматривает взаимопревращения тепла и механической работы. По этому закону тепло превращается в механическую работу и наоборот, механическая работа в тепло в строго эквивалентных количествах. Уравнение эквивалентности тепла и работы имеет вид:
С учетом принципа эквивалентности тепла и работы, уравнение теплового баланса для произвольной массы газа:
Q = U + L и q =и+l= u –u +l
Атмосферный сухой воздух имеет следующий примерный массовый состав: g 02 =23,2%, g N 2 =76,8%.
Определить объемный состав воздуха, его газовую постоянную, кажущуюся молекулярную массу, парциальное давление кислорода и азота, если воздуха по барометру Р=101325 Па.
Определяю объемный состав воздуха:


где r – массовая доля;
m — относительная молекулярная масса;
g – объемная доля.
m возд. =m O2 r O2 +m N2 r N2 = 32·0,209 + 28·0,7908=6,688+22,14=28,83;

где R 0 – газовая постоянная.
Определяю парциальные давления различных газов:
P O 2 =P см · r О2 =101325·0,209=21176,9 (Па);
P N 2 =P см · r N 2 =101325·0,7908 = 80127,81 (Па);
где P O 2 , P N 2 – парциальное давление;
P см – давление смеси.
Сосуд разделен перегородкой на 2 части, объемы которых V 1 =1,5 м 3 и V 2 =1,0 м 3 . В первой части объемом V 1 содержится СО 2 при Р 1 =0,5 Мпа и t 1 =30°С; во второй части объемом V 2 содержится О 2 при Р 2 =0,2 Мпа и t 2 =57°С. Определить массовые и объемные доли СО 2 и О 2 , кажущуюся молекулярную массу смеси и ее газовую постоянную после того, как перегородка будет убрана и процесс смешения закончится.
Определяю индивидуальные газовые постоянные:
Для этого определяю относительную молекулярную массу: m(СО 2) =32+12=44; m(О 2)=32;


Согласно характеристическому уравнению Клайперона, определяю массы газов:


Определяю массовые доли:
Определяю объемные доли:
Определяю кажущуюся молекулярную массу воздуха:
m возд. =m О2 r O 2 +m СО2 r СО2 = 32·0,21 + 44·0,79=6,72+34,74=41,48;
Определяю индивидуальную газовую постоянную для воздуха (R):

В сосуде объемом 300л находится кислород при давлении Р 1 =0,2 Мпа и t 1 =20 0 С. Какое количество теплоты нужно подвести, чтобы температура кислорода повысилась до t 2 =300 0 С? Какое давление установится при этом в сосуде? Для расчета принять среднюю объемную удельную теплоемкость кислорода при н.у. С 02 =0,935
По закону Шарля определяю конечное давление процесса:
; 
где Р,Т – параметры газа.
Определяю индивидуальную газовую постоянную для кислорода (R):

Так как процесс изохорный то определяю количество теплоты которое нужно подвести по соответствующей формуле: Q v =M·С cv ·(T 2 -T 1) для этого согласно характеристическому уравнению Клайперона, определяю массу газа

Какое количество теплоты необходимо затратить, чтобы нагреть 2м 3 воздуха при постоянном избыточном давлении Р изб. =0,2 МПа от температуры 100 0 С до температуры 500 0 С. Какую работу при этом совершит воздух? Для расчета принять: давление атмосферы Р ат. =0,1 Мпа, среднюю массовую изобарную теплоемкость воздуха С pm =1,022 
Определяю индивидуальную газовую постоянную для воздуха:

Абсолютное давление равно сумме избыточного и атмосферного Р=Р изб. +Р ат. =0,1+0,2=0,3 МПа

Так как процесс изобарный то определяю Q и L по соответствующим формулам:
по закону Гей-Люссака определяю конечный объем:

Q=M·C pm ·(T 2 -T 1)= 5,56·1022·400=2272928 (Дж);
L=P·(V 2 -V 1)=300000·2,15=645000 (Дж).
В цилиндре находится воздух при давлении Р=0,5 Мпа и температуре t 1 =400 0 C. От воздуха отнимается теплота при Р=const так, что в конце процесса устанавливается температура t 2 =0 0 C. Объем цилиндра, в котором находится воздух V 1 =400л.
Определить количество отнятой теплоты, конечный объем, изменеие внутренней энегии и совершенную работу сжатия C pm =1,028 
Так как процесс изобарный то по закону Гей-Люссака определяю конечный объем:

Согласно характеристическому уравнению Клайперона, определяю массу газа:
Из предыдущей задачи R=286,7 

Определяю количество теплоты которое выделяется:
Q=M·C pm ·(T 2 -T 1)=1,03·1028·(273-673)=-423536 (Дж);
Определяю количество затраченной работы:
L=P·(V 2 -V 1)= 500000·(0,16-0,4)=-120000 (Дж);
Из уравнения, по которому определяется полное количество, определяю изменение количества внутренней энергии:

Воздух, имеющий обьем V 1 =0,02 м3 при давлении Р 1 =1,1МПа и t 1 =25с расширяется в цилиндре с подвижным поршнем до давления Р 2 =0,11Мпа. Найти конечный обьем V 2 , конечную температуру t 2 , работу, произведенную воздухом, и подведенную теплоту, если расширение в цилиндре происходит:
б) адиабатно с показателем адиабаты к=1,4
в) политропно с показателем политропы n=1,3
P 1 /P 2 =V 2 /V 1
V 2 =0,02·1,1/0,11=0,2M 3
Q=L=RMT 1 Ln(V 2 /V 1)=P 1 V 1 Ln(V 2 /V 1)=1,1·10 6 ·0,02Ln(0,2/0,02)=22000Дж
V 1 /V 2 =(P 2 /P 1) 1/k
V 2 =V 1 /(P 2 /P 1) 1/k =0,02/(0,11/1,1) 1/1,4 =0,1036M 3
T 2 /T 1 =(P 2 /P 1) k-1/k
T 2 =(P 2 /P 1) k-1/k ·T 1 =(0,11/1,1) 1,4-1/1,4 ·298=20,32k
L=1/k-1(P 1 V 1 -P 2 V 2) =(1/1,4-1)· (1,1·10 6 ·0,02 -0,11·10 6 ·0,1)=2,0275·10 6 Дж
V 1 /V 2 =(P 2 /P 1) 1/n
V 2 =V 1 /(P 2 /P 1) 1/n =0,02/(0,11/1,1) 1/1,3 =0,118M 3
T 2 /T 1 =(P 2 /P 1) n-1/n
T 2 =(P 2 /P 1) n-1/n ·T 1 =(0,11/1,1) 1,3-1/1,3 ·298=175k
L= 1/n-1(P 1 V 1 -P 2 V 2)= (1/(1,3-1))· (1,1·10 6 ·0,02 -0,11·10 6 ·0,118)=30000Дж
1. «Энергия», Москва, 1975.
2. Литвин А.М. «Теоретические основы теплотехники», издательство «Энергия», Москва,1969.
3. Тугунов П.И., Самсонов А.А., «Основы теплотехники, тепловые двигатели и паросиловое хозяйство», издательство «Недра», Москва, 1970.
4. Крутов В.И., «Теплотехника», издательство «Машиностроение», Москва, 1986.
http://www.evkova.org/idealnyij-gaz-v-fizike
http://samimiy.ru/arrangement/gas-mixtures-heat-capacity-of-gasesssss.html