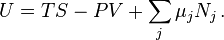Уравнения состояния контакт систем и условия равновесия
МОДЕЛИ БИОЛОГИЧЕСКИХ СИСТЕМ, ОПИСЫВАЕМЫЕ
ОДНИМ ДИФФЕРЕНЦИАЛЬНЫМ УРАВНЕНИЕМ ПЕРВОГО ПОРЯДКА
Модели, приводящие к одному дифференциальному уравнению. Понятие решения одного автономного дифференциального уравнения. Стационарное состояние (состояние равновесия). Устойчивость состояния равновесия. Методы оценки устойчивости. Решение линейного дифференциального уравнения Примеры: экспоненциальный рост, логистический рост.
Изучение математических моделей биологических систем начнем с систем первого порядка, которым соответствует одно дифференциальное уравнение первого порядка:
Если система автономная, то правая часть уравнений не зависит явно от времени и уравнение имеет вид:
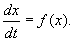
Состояние таких систем в каждый момент времени характеризуется одной единственной величиной – значением переменной x в данный момент времени t.
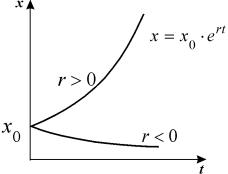
Рассмотрим плоскость t, x. Решениями уравнения (2.1): x( t) являются кривые на плоскости t, x , называемые интегральными кривыми (рис. 2.1)
Пусть заданы начальные условия 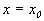
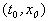
Рис. 2.1. Интегральные кривые x ( t ); – решения уравнения f ( x ) = 0

Интегральные кривые уравнения (2.1) не могут пересекаться. Решения уравнения (2.1) не могут быть периодическими, они монотонны.
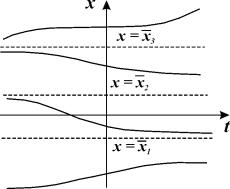
Поведение интегральных кривых на плоскости t, x можно установить, не решая в явном виде дифференциального уравнения (2.1), если известен характер движения изображающей точки на фазовой прямой.
Рассмотрим плоскость t, x , причем фазовую прямую совместим с осью x . Построим на плоскости t, x точку с абсциссой t и с ординатой, равной смещению изображающей точки по оси x в данный момент времени t. С течением времени в соответствии с уравнением (2.1) изображающая точка будет двигаться по фазовой прямой (рис. 2.2), а на плоскости t, x описывать некую кривую. Это будет интегральная кривая уравнения (2.1).
Решения одного автономного дифференциального уравнения либо уходят в бесконечность (чего не бывает в реальных системах), либо асимптотически приближаются к стационарному состоянию.
Стационарное состояние (точка покоя, особая точка, состояние равновесия)
В стационарном состоянии значения переменных в системе не меняются со временем. На языке дифференциальных уравнений это означает:
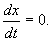
Если левая часть уравнения равна нулю, значит равна нулю и его правая часть:
Корни алгебраического уравнения (2.3): 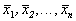
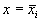
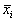
Реальные биологические системы испытывают многочисленные флуктуации, переменные при малых отклонениях возвращаются к своим стационарным значениям. Поэтому при построении модели важно знать, устойчивы ли стационарные состояния модели.
Рис. 2.3. К понятию устойчивости состояния равновесия

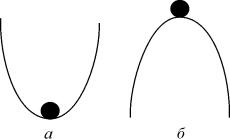
Устойчивость состояния равновесия
Каждый имеет интуитивное представление об устойчивости. На рис. 2.3. в обоих положениях (а и б) шарик находится в равновесии, т.к. сумма сил, действующих на него, равна нулю.
Попытайтесь ответить на вопрос : «Какое из этих состояний равновесия устойчиво?»
Скорее всего, Вы дали правильный ответ. Сказать, как Вы догадались? Вы дали шарику малое отклонение от состояния равновесия . В случае ( а) шарик вернулся. В случае ( б) покинул состояние равновесия навсегда.
Устойчивое состояние равновесия можно определить так: если при достаточно малом отклонении от положения равновесия система никогда не уйдет далеко от особой точки, то особая точка будет устойчивым состоянием равновесия, что соответствует устойчивому режиму функционирования системы.
Строгое математическое определение устойчивости состояния равновесия уравнения dx/dt = f( x) выглядит следующим образом :
Состояние равновесия устойчиво по Ляпунову, если задав сколь угодно малое положительное 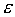
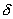
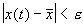
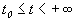
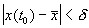
Иначе говоря, для устойчивого состояния равновесия справедливо утверждение: если в момент времени 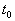
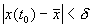
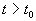
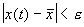
Другими словами: c тационарное состояние называется устойчивым, если малые отклонения не выводят систему слишком далеко из окрестности этого стационарного состояния. Пример — шарик в ямке (с трением или без трения).
Стационарное состояние называется асимптотически устойчивым, если малые отклонения от него со временем затухают. Пример — шарик в ямке в вязкой среде.
Стационарное состояние называется неустойчивым, если малые отклонения со временем увеличиваются. Пример: шарик на горке.
Устойчивое стационарное состояние представляет собой простейший тип аттрактора.
Аттрактором называется множество, к которому стремится изображающая точка системы с течением времени (притягивающее множество).
В нашем курсе мы рассмотрим следующие типы аттракторов:
· устойчивая точка покоя;
· предельный цикл — режим колебаний с постоянными периодом и амплитудой (начиная с размерности системы 2 );
· Области с квазистохастическим поведением траекторий в области аттрактора, например, «странный аттрактор» (начиная с размерности 3 ).
Аналитический метод исследования устойчивости стационарного состояния (метод Ляпунова). Линеаризация системы в окрестности стационарного состояния.
Метод Ляпунова приложим к широкому классу систем различной размерности, точечным системам, которые описываются обыкновенными дифференциальными уравнениями, и распределенным системам, описываемым уравнениями в частных производных, непрерывным и дискретным.
Рассмотрим метод линеаризации Ляпунова для одного автономного дифференциального уравнения первого порядка. Пусть 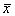
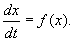
Пусть система, первоначально находившаяся в стационарном состоянии, отклонилась от него и перешла в близкую точку с координатой: 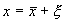

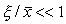
Перейдем в уравнении (2.1) от переменной x к переменной 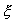
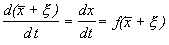
Учтем, что 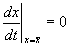
Правую часть разложим в ряд Тейлора в точке 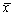
где
Отбросим члены порядка 2 и выше. Останется линейное уравнение:
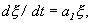
которое носит название линеаризованного уравнения или уравнения первого приближения. Интеграл этого уравнения для 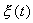
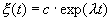
где 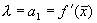
Если SYMBOL 108 \f «Symbol» \s 12 l SYMBOL 60 \f «Symbol» \s 12 0 , то при 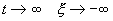
Если же SYMBOL 108 \f «Symbol» \s 12 l SYMBOL 62 \f «Symbol» \s 12 > 0 , то при 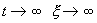
Если SYMBOL 108 \f «Symbol» \s 12 l =0 , то уравнение первого приближения не может дать ответа на вопрос об устойчивости состояния равновесия системы. Необходимо рассматривать члены более высокого порядка в разложении в ряд Тейлора. Такие случаи мы рассмотрим в лекции 6.
Аналогичные рассуждения проводятся при рассмотрении устойчивости стационарных состояний более сложных динамических систем.
Итак, устойчивость стационарного состояния 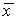
В случае одного уравнения вопрос об устойчивости состояния равновесия нетрудно решить, рассматривая график функции f(x).
По определению в стационарной точке правая часть уравнения (2.1) ‑ функция f(x) обращается в нуль.
Здесь возможны три случая (рис. 2.4 а, б, в).
1. Вблизи состояния равновесия функция f(x) меняет знак с плюса на минус при возрастании x (рис. 2.4 а).
Отклоним изображающую точку системы в сторону 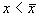
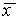
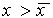
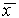
Рис. 2.4. Определение устойчивости стационарного состояния по графику функции f( x)
a – стационарное состояние 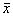
б, в ‑ стационарное состояние 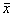
2. Вблизи состояния равновесия функция f ( x) меняет знак с минуса на плюс при возрастании x ( рис. 2.4 б) .
Проведите рассуждения, аналогичные случаю 1. Поместите изображающую точку в область 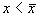
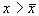
В обоих случаях изображающая точка удаляется от состояния равновесия. Стационарное состояние неустойчиво.
3. Вблизи состояния равновесия функции f(x) не меняет знак ( рис 2.4 в) .
Поскольку 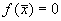
Вопрос. Является ли состояние равновесия в случае 3 устойчивым?
Ответ. Нет. По определению устойчивости.
1. Рост колонии микроорганизмов
За время D t прирост численности равен:
где R – число родившихся и S – число умерших за время SYMBOL 68 \f «Symbol» \s 12 D t особей пропорциональные этому промежутку времени:
В дискретной форме:
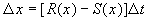
Разделив на SYMBOL 68 \f «Symbol» \s 12 D t и переходя к пределу при t SYMBOL 174 \f «Symbol» \s 12 ® 0 , получим дифференциальное уравнение
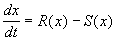
В простейшем случае, когда рождаемость и смертность пропорциональны численности:
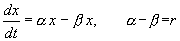
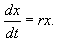
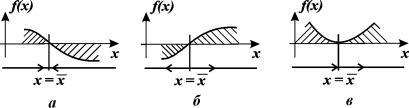
Разделим переменные и проинтегрируем:
Переходя от логарифмов к значениям переменной x и определяя произвольную постоянную С из начальных условий, получим экспоненциальную форму динамики роста.
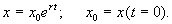
График функции (2.8) при положительных (размножение) и отрицательных (вымирание) значениях константы скорости роста представлен на рис. 2.5. Роль этой модели в развитии математической биологии и экологии мы обсудим в Лекции 3.
Рис. 2.5. Экспоненциальная форма динамики роста численности колонии микроорганизмов в соответствии с системой уравнений (2.7)

2. Вещество переходит в раствор
Пусть количество вещества, переходящего в раствор, пропорционально интервалу времени и разности между максимально возможной концентрацией Р и концентрацией x в данный момент времени: 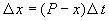
В форме дифференциального уравнения этот закон выглядит в
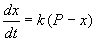
Разделим в этом уравнении переменные, и проинтегрируем:
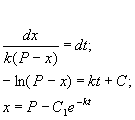
Здесь C 1 — произвольная постоянная. Если x (0) = 0,
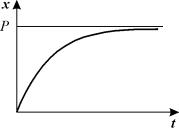
График этой функции представлен на рис. 2.6. – он представляет собой кривую с насыщением.
Рис. 2.6. Концентрация вещества х в зависимости от времени. График уравнения 2.9.

Какие дифференциальные уравнения можно решать аналитически?
Лишь для ограниченных классов дифференциальных уравнений разработаны аналитические методы решения. Подробно они изучаются в курсах дифференциальных уравнений. Отметим основные из них/
1. Уравнения с разделяющимися переменными решаются в интегралах. К ним относятся оба приведенные выше примера.
2. Линейные дифференциальные уравнения (не обязательно автономные).
3. Некоторые специальные виды уравнений.
Решение линейного уравнения
Линейным дифференциальным уравнением 1-го порядка называют уравнение, линейное относительно искомой функции и ее производной. Оно имеет вид:
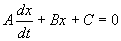
Здесь A, B, C — заданные непрерывные функции от t.
Пусть в некотором интервале изменения t A SYMBOL 185 \f «Symbol» \s 12 _ 0 . Тогда на него можно разделить все члены уравнения. При этом получим:
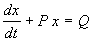
Eсли Q=0 , уравнение (2.12) называется однородным, если Q SYMBOL 185 \f «Symbol» \s 12 _ 0 – неоднородным.
Решим сначала однородное уравнение.
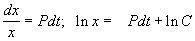
Общее решение линейного однородного уравнения имеет вид:
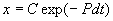
Чтобы найти решение неоднородного уравнения применим метод вариации постоянной. Будем считать С неизвестной функцией t . Подставляя правую часть выражения (2.13) в уравнение (2.12), имеем:
Теперь С находим интегрированием: 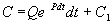
Итак, общее решение линейного неоднородного уравнения первого порядка:
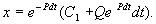
Таким образом, решение уравнения (2.12) представляет собой сумму двух слагаемых:
1) общее решение однородного уравнения (2.13) и
2) частное решение неоднородного уравнения, которое получается из общего решения, если С1 = 0.
Рассмотрим еще один пример, который относится к классическим моделям математической экологии. Логистическое уравнение было предложено Ферхюльстом в 1838 г. Оно имеет вид:
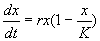
Это уравнение обладает двумя важными свойствами. При малых х численность х возрастает, при больших – приближается к определенному пределу К .
Уравнение (2.15) можно решить аналитически. Ход решения следующий. Произведем разделение переменных:
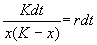
Представим левую часть в виде суммы и проинтегрируем
Переходя от логарифмов к переменным, получим:
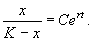
Здесь С – произвольная постоянная, которая определяется начальным значением численности x0 :
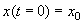
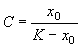
Подставим это значение С в формулу (2.17):
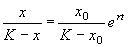
Отсюда получим решение – зависимость численности от времени:
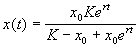
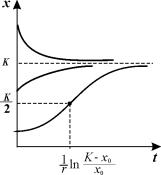
График функции (2.18) при разных начальных значениях численности популяции представлен на рис. 2.7.
Рис.2.7. Динамика численности в логистической модели 2.18
при разных начальных значениях численности

Если начальное значение х0 К/2, кривая роста имеет точку перегиба. Если х0 > К, численность со временем убывает.
В приведенных примерах в правой части уравнений стоят полиномы первой и второй степени. Если в правой части ‑ более сложная нелинейная функция, алгебраическое уравнение для стационарных значений может иметь несколько корней. Какое из этих решений реализуется в этом случае, будет зависеть от начальных условий.
В дальнейшем мы, как правило, не будем искать аналитическое решение для наших моделей. Для более сложных нелинейных уравнений это и невозможно. Однако важные заключения относительно свойств моделей можно сделать и на основании качественного их исследования, в первую очередь путем исследования устойчивости стационарных состояний и типов поведения системы вблизи этих состояний. При этом следует иметь в виду, что с помощью одного автономного дифференциального уравнения могут быть описаны только монотонные изменения переменной, и, следовательно, ни периодические, ни хаотические процессы не могут быть описаны. Для описания более сложного поведения необходимо либо переходить к системам большей размерности (2, 3 порядка и выше), либо вводить время в явном виде в правую часть уравнения. В Лекции 3 мы увидим, что дискретные уравнения и уравнения с запаздыванием могут описать и колебания, и динамический хаос.
iSopromat.ru
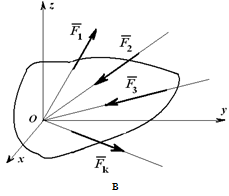
Рассмотрим условия равновесия произвольной плоской и пространственной систем сил, включая три основные формы и частные случаи равновесия для систем параллельных и сходящихся сил:
Из основной теоремы статики следует, что любая система сил и моментов, действующих на твердое тело, может быть приведена к выбранному центру и заменена в общем случае главным вектором и главным моментом.
Если система уравновешена, то получаем условия равновесия: R=0, MO=0. Из этих условий для пространственной системы сил получается шесть уравнений равновесия, из которых могут быть определены шесть неизвестных:
Формы условий равновесия
Первая форма
Для плоской системы сил (например, в плоскости Oxy) из этих уравнений получаются только три:
причем оси и точка O, относительно которой пишется уравнение моментов, выбираются произвольно. Это первая форма уравнений равновесия.
Вторая форма
Уравнения равновесия могут быть записаны иначе:
Это вторая форма уравнений равновесия, причем ось Ox не должна быть перпендикулярна линии, проходящей через точки A и B.
Третья форма
Это третья форма уравнений равновесия, причем точки A, B и C не должны лежать на одной прямой.
Предпочтительность написания форм уравнений равновесия зависит от конкретных условий задачи и навыков решающего.
Другие условия равновесия
При действии на тело плоской системы параллельных сил одно из уравнений исчезает и остаются два уравнения (рисунок 1.26, а):
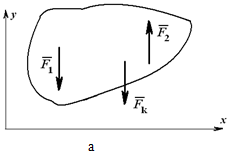
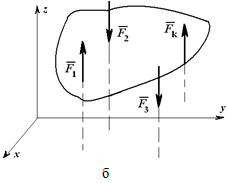
Для пространственной системы параллельных сил (рисунок 1.26, б) могут быть записаны три уравнения равновесия:
Для системы сходящихся сил (линии действия которых пересекаются в одной точке) можно написать три уравнения для пространственной системы:
и два уравнения для плоской системы:
В каждом из вышеприведенных случаев число неизвестных, находимых при решении уравнений, соответствует числу записанных уравнений равновесия.
Уважаемые студенты!
На нашем сайте можно получить помощь по техническим и другим предметам:
✔ Решение задач и контрольных
✔ Выполнение учебных работ
✔ Помощь на экзаменах
Уравнения состояния контакт систем и условия равновесия
Термодина́мика (греч. θέρμη — «тепло», δύναμις — «сила») — раздел физики, изучающий соотношения и превращения теплоты и других форм энергии. Термодинамика — это феноменологическая наука, опирающаяся на обобщения опытных фактов. Она изучает макроскопические системы, состоящие из огромного числа частиц —термодинамические системы. Процессы, происходящие в таких системах, описываются макроскопическими величинами, такими как давление или температура, которые не применимы к отдельным молекулам и атомам.
Современная феноменологическая термодинамика является строгой теорией, развиваемой на основе нескольких постулатов. Однако обоснование этих постулатов и их связь со свойствами и законами взаимодействия частиц, из которых построены термодинамические системы, даётся статистической физикой. Статистическая физика позволяет выяснить также и границы применимости термодинамики.
Законы термодинамики носят общий характер и не зависят от конкретных деталей строения вещества на атомарном уровне. Поэтому термодинамика успешно применяется в широком круге вопросов науки и техники, таких как энергетика, двигатели, фазовые переходы,химические реакции, явления переноса и даже чёрные дыры. Термодинамика имеет важное значение для самых разных областей физики и химии, химической технологии, аэрокосмической техники, машиностроения, клеточной биологии, биомедицинской инженерии,материаловедения и находит своё применение даже в таких областях, как экономика.
Разделы термодинамики
Современную феноменологическую термодинамику принято делить на равновесную (или классическую) термодинамику, изучающую равновесные термодинамические системы и процессы в таких системах, и неравновесную термодинамику, изучающую неравновесные процессы в системах, в которых отклонение от термодинамического равновесия относительно невелико и ещё допускает термодинамическое описание.
В равновесной термодинамике вводятся такие переменные, как внутренняя энергия, температура, энтропия, химический потенциал. Все они носят название термодинамических параметров (величин). Классическая термодинамика изучает связи термодинамических параметров между собой и с физическими величинами, вводимыми в рассмотрение в других разделах физики, например, с гравитационным или электромагнитным полем, действующим на систему. Химические реакции и фазовые переходы также входят в предмет изучения классической термодинамики. Однако изучение термодинамических систем, в которых существенную роль играют химические превращения, составляет предмет химической термодинамики, а техническими приложениями занимается теплотехника.
В системах, не находящихся в состоянии термодинамического равновесия, например, в движущемся газе, может применяться приближение локального равновесия, в котором считается, что соотношения равновесной термодинамики выполняются локально в каждой точке системы. Однако в неравновесной термодинамике переменные рассматриваются как локальные не только в пространстве, но и во времени, то есть в её формулы время может входить в явном виде. Отметим, что посвящённая вопросам теплопроводности классическая работа Фурье «Аналитическая теория тепла» (1822) опередила не только появление неравновесной термодинамики, но и работу Карно «Размышления о движущей силе огня и о машинах, способных развивать эту силу» (1824), которую принято считать точкой отсчёта в истории классической термодинамики.
Классическая термодинамика включает в себя следующие разделы:
- начала термодинамики (иногда также называемые законами или аксиомами)
- уравнения состояния и свойства простых термодинамических систем (идеальный газ, реальный газ, диэлектрики и магнетики и т. д.)
- равновесные процессы с простыми системами, термодинамические циклы
- неравновесные процессы и закон неубывания энтропии
- термодинамические фазы и фазовые переходы
Кроме этого, современная термодинамика включает также следующие направления:
- строгая математическая формулировка термодинамики на основе выпуклого анализа
- неэкстенсивная термодинамика
- применение термодинамики к нестандартным системам
Основы термодинамики
Термодинамика изучает системы, состоящие из очень большого числа частиц. Описание таких систем методами классической механики не только не представляется возможным, но и фактически лишено смысла. Особенности термодинамического описания возникают вследствие того, что поведение больших ансамблей частиц подчиняется статистическим закономерностям и не может быть сведено к анализу детерминированной эволюции динамических систем. Однако исторически термодинамика развивалась без опоры на представления статистической теории, и основные положения термодинамики могут быть сформулированы на основе ограниченного числа постулатов, являющихся обобщениями опытных фактов. Число этих постулатов варьируется у разных авторов в соответствии с тем, как строится аксиоматика термодинамики, но традиционно считается, что можно выделить четыре начала термодинамики.
Основные понятия термодинамики
Термодинамические системы
В термодинамике изучаются физические системы, состоящие из большого числа частиц и находящиеся в состоянии термодинамического равновесия или близком к нему. Такие системы называются термодинамическими системами. Это понятие в общем случае достаточно сложно определить строго, поэтому используется описательное определение, в котором термодинамической системой называется макроскопическая система, которая каким-то образом (например, с помощью реальной или воображаемой оболочки) выделена изокружающей среды и способна взаимодействовать с ней. Если оболочка не допускает обмен ни веществом, ни энергией между системой и окружающей средой, то такая оболочка называется адиабатической, а соответствующая система — изолированной или замкнутой. Системы, у которых оболочка не препятствует обмену веществом и энергией, называютсяоткрытыми.
Термодинамическое равновесие
Фундаментальным для классической термодинамики является понятие термодинамического равновесия, которое тоже плохо поддаётся логическому определению и формулируется как обобщение экспериментальных фактов. Утверждается, что любая замкнутая термодинамическая система, для которой внешние условия остаются неизменными, с течением времени переходит в равновесное состояние, в котором прекращаются все макроскопические процессы. При этом в системе на микроскопическом уровне могут происходить самые разные процессы, например, химические реакции, которые могут протекать и в прямом, и в обратном направлении, однако в среднем эти процессы компенсируют друг друга, и макроскопические параметры системы остаются неизменными, флуктуируя относительно равновесного значения. Флуктуации изучаются в статистической физике.
Термодинамические параметры
Термодинамика не рассматривает особенности строения тел на молекулярном уровне. Равновесные состояния термодинамических систем могут быть описаны с помощью небольшого числа макроскопических параметров, таких как температура, давление, плотность, концентрации компонентов и т. д., которые могут быть измерены макроскопическими приборами. Описанное таким образом состояние называется макроскопическим состоянием, и законы термодинамики позволяют установить связь между макроскопическими параметрами. Если параметр имеет одно и то же значение, не зависящее от размера любой выделенной части равновесной системы, то он называется неаддитивным или интенсивным, если же значение параметра пропорционально размеру части системы, то он называется аддитивным или экстенсивным. Давление и температура — неаддитивные параметры, а внутренняя энергия и энтропия — аддитивные параметры.
Макроскопические параметры могут подразделяться на внутренние, характеризующие состояние системы как таковой, и внешние, описывающие взаимодействие системы с окружающей средой и силовыми полями, воздействующими на систему, однако это разделение достаточно условно. Так, если газ заключен в сосуд с подвижными стенками и его объём определяется положением стенок, то объём является внешним параметром, а давление газа зависит от скоростей теплового движения молекул и является внутренним параметром. Напротив, если задаётся внешнее давление, то его можно считать внешним параметром, а объём газа — внутренним параметром. Постулируется, что в состоянии термодинамического равновесия каждый внутренний параметр может быть выражен через внешние параметры и температуру системы. Такая функциональная связь называется обобщённым уравнением состояния системы.
Термодинамические процессы
При изменении внешних параметров или при передаче энергии в систему в ней могут возникать сложные процессы на макроскопическом и молекулярном уровне, в результате которых система переходит в другое состояние. Равновесная термодинамика не занимается описанием этих переходных процессов, а рассматривает состояние, устанавливающееся после релаксации неравновесностей. В термодинамике широко применяются идеализированные процессы, в которых система переходит из одного состояния термодинамического равновесия в другое, которые непрерывно следуют друг за другом. Такие процессы называются квазистатическими или квазиравновесными процессами . Особую роль в методах термодинамики играют циклические процессы, в которых система возвращается в исходное состояние, совершая по ходу процесса работу и обмениваясь энергией с окружающей средой.
Начала термодинамики
Нулевое начало термодинамики
Нулевое начало термодинамики названо так потому, что оно было сформулировано уже после того, как первое и второе начало вошли в число устоявшихся научных понятий. Оно утверждает, что изолированная термодинамическая система с течением времени самопроизвольно переходит в состояние термодинамического равновесия и остаётся в нём сколь угодно долго, если внешние условия сохраняются неизменными. Оно также называется общим началом. Термодинамическое равновесие предполагает наличие в системе механического, теплового и химического равновесия, а также равновесия фаз. Классическая термодинамика постулирует лишь существование состояния термодинамического равновесия, но ничего не говорит о времени его достижения.
В литературе в нулевое начало также часто включают положения о свойствах теплового равновесия. Тепловое равновесие может существовать между системами, разделёнными неподвижной теплопроницаемой перегородкой, то есть перегородкой, позволяющей системам обмениваться внутренней энергией, но не пропускающей вещество. Постулат о транзитивности теплового равновесия утверждает, что если два тела, разделённые такой перегородкой (диатермической), находятся в тепловом равновесии между собой, то любое третье тело, находящееся в тепловом равновесии с одним из этих тел, будет находиться также и в тепловом равновесии с другим телом.
Иначе говоря, если две замкнутые системы A и B приведены в тепловой контакт друг с другом, то после достижения термодинамического равновесия полной системой A+B системы Aи B будут находиться в состоянии теплового равновесия друг с другом. При этом каждая из систем A и B сама по себе также находится в состоянии термодинамического равновесия. Тогда если системы B и C находятся в тепловом равновесии, то системы A и C также находятся в тепловом равновесии между собой.
В иноязычной и переводной литературе часто нулевым началом называют сам постулат о транзитивности теплового равновесия, а положение о достижении термодинамического равновесия могут называть «минус первым» началом. Важность постулата о транзитивности состоит в том, что он позволяет ввести некоторую функцию состояния системы, обладающую свойствами эмпирической температуры, то есть создавать приборы для измерения температуры. Равенство эмпирических температур, измеренных с помощью такого прибора — термометра, есть условие теплового равновесия систем (или частей одной и той же системы).
Первое начало термодинамики
Первое начало термодинамики выражает универсальный закон сохранения энергии применительно к задачам термодинамики и исключает возможность создания вечного двигателяпервого рода, то есть устройства, способного совершать работу без соответствующих затрат энергии.
Внутреннюю энергию U термодинамической системы можно изменить двумя способами, совершая над ней работу или посредством теплообмена с окружающей средой. Первое начало термодинамики утверждает, что теплота, полученная системой, идёт на увеличение внутренней энергии системы и на совершение этой системой работы, что можно записать как δQ = δA + dU. Здесь dU — полный дифференциал внутренней энергии системы, δQ — элементарное количество теплоты, переданное системе, а δA — бесконечно малая или элементарнаяработа, совершённая системой. Так как работа и теплота не являются функциями состояния, а зависят от способа перехода системы из одного состояния в другое, применяется запись с символом δ, чтобы подчеркнуть, что δQ и δA — это бесконечно малые величины, которые нельзя считать дифференциалами какой-либо функции.
Знаки при δQ и δA в приведённом выше соотношении выражают соглашение о том, что положительной считают работу, совершаемую системой, и теплоту, получаемую системой, принятое в большинстве современных работ по термодинамике.
Если система совершает только механическую работу вследствие изменения её объёма, то элементарная работа записывается как δA = P dV, где dV — приращение объёма. В квазистатических процессах эта работа равна работе внешних сил над системой, взятой с обратным знаком: δA внутр = –δA внеш, но для неквазистатических процессов это соотношение не выполняется. В общем случае элементарная работа записывается как сумма δA = A 1 da 1 + A 2 da 2 + . , где A 1, A 2, . — функции параметров a 1, a 2, . и температуры T, называемые обобщёнными силами.
Работу, связанную с изменением количества вещества в системе (химическую работу), могут выделять из общего выражения для работы в отдельное слагаемое.
Второе начало термодинамики
Второе начало термодинамики задаёт ограничения на направление процессов, которые могут происходить в термодинамических системах, и исключает возможность создания вечного двигателя второго рода. Фактически к этому результату пришёл уже Сади Карно в сочинении «О движущей силе огня и о машинах, способных развивать эту силу». Однако Карно опирался на представления теории теплорода и не дал ясной формулировки второго начала термодинамики. Это было сделано в 1850—1851 годах независимо Клаузиусом иКельвином. Имеется несколько различных, но в то же время эквивалентных формулировок этого закона.
Постулат Кельвина: «Невозможен круговой процесс, единственным результатом которого было бы производство работы за счёт охлаждения теплового резервуара». Такой круговой процесс называется процессом Томсона-Планка, и постулируется, что такой процесс невозможен.
Постулат Клаузиуса: «Теплота не может самопроизвольно переходить от тела менее нагретого к телу более нагретому». Процесс, при котором не происходит никаких других изменений, кроме передачи теплоты от холодного тела к горячему, называется процессом Клаузиуса. Постулат утверждает, что такой процесс невозможен. Теплота может переходить самопроизвольно только в одном направлении, от более нагретого тела к менее нагретому, и такой процесс является необратимым.
Приняв за постулат невозможность процесса Томсона-Планка, можно доказать, что процесс Клаузиуса невозможен, и наоборот, из невозможности процесса Клаузиуса следует, что процесс Томсона-Планка также невозможен.
Следствие второго начала термодинамики, постулированного в указанных формулировках, позволяет ввести для термодинамических систем ещё одну функцию термодинамического состояния S , названную энтропией, такую, что её полный дифференциал для квазистатических процессов записывается как dS=δQ/T . В совокупности с температурой и внутренней энергией, введёнными в нулевом и первом началах, энтропия составляет полный набор величин, необходимых для математического описания термодинамических процессов. Лишь две из упомянутых трёх величин, которыми термодинамика пополняет список используемых в физике переменных, являются независимыми.
Третье начало термодинамики
Третье начало термодинамики или теорема Нернста утверждает, что энтропия любой равновесной системы по мере приближения температуры к абсолютному нулю перестает зависеть от каких-либо параметров состояния и стремится к определённому пределу . Фактически содержание теоремы Нернста включает в себя два положения. Первое из них постулирует существование предела энтропии при стремлении к абсолютному нулю. Численное значение этого предела принято полагать равным нулю, поэтому в литературе иногда говорят о том, что энтропия системы стремится к нулю при стремлении температуры к 0 К. Второе положение теоремы Нернста утверждает, что все процессы вблизи абсолютного нуля, переводящие систему из одного равновесного состояния в другое, происходят без изменения энтропии .
Нулевые значения температуры и энтропии при абсолютном нуле приняты как удобные соглашения для устранения неоднозначности в построении шкалы для термодинамических величин. Нулевое значение температуры служит реперной точкой для построения термодинамической шкалы температур. Энтропия, обращающаяся в ноль при абсолютном нуле температуры, называется абсолютной энтропией. В справочниках термодинамических величин часто приводятся значения абсолютной энтропии при температуре 298,15 К, которые соответствуют увеличению энтропии при нагреве вещества от 0 К до 298,15 К.
Термодинамическое состояние
Динамическое, микро- и макросостояние
Моделирование всякой физической системы подразумевает указание полного набора параметров, необходимого для описания всех её возможных состояний и наблюдаемых величин. Описание термодинамических систем, состоящих из огромного числа частиц, варьируется в зависимости от того, какая степень детализации принимается для выбора набора параметров. Наиболее подробное описание в классической механике требует указания координат и импульсов всех частиц системы в какой-либо начальный момент времени и законов взаимодействия частиц, определяющих их эволюцию во времени. Описанное таким образом состояние системы называется динамическим. Для практических целей динамическое описание систем большого числа частиц непригодно. Следующим, более огрубленным уровнем описания является статистическое описание, когда динамические состояния усредняются по ячейкам фазового пространства в классической механике. В квантовой механике состояния различаются набором квантовых чисел и могут усредняться, например, по небольшим интервалам на шкале энергии. Такие состояния называются микросостояниями и изучаются в классической или квантовой статистической механике. Выбор способа описания системы зависит от характерных временных масштабов, на которых изучается эволюция системы.
Термодинамика имеет дело с макросостояниями, наиболее общим уровнем описания, где для указания состояния системы требуется минимальное число макроскопических параметров. Вообще говоря, проблема определения микро- и макросостояний и описания их статистических свойств относится к наиболее фундаментальным и пока не получившим окончательного решения вопросам статистической физики.
Функции состояния и уравнение состояния
При описании макросостояний используются функции состояния — это функции, однозначно определённые в состоянии термодинамического равновесия и не зависящие от предыстории системы и способа её перехода в равновесное состояние. Важнейшими функциями состояния при аксиоматическом построении термодинамики являются температура, внутренняя энергия и энтропия, вводимые в началах термодинамики, а также термодинамические потенциалы. Однако функции состояния не являются независимыми, и для однородной изотропной системы любая термодинамическая функция может быть записана как функция двух независимых переменных. Такие функциональные связи называются уравнениями состояния. Различают термическое уравнение состояние, выражающее связь между температурой, давлением и объёмом (или, что тоже самое, плотностью), калорическое уравнение состояние, выражающее внутреннюю энергию как функцию от температуры и объёма, и каноническое уравнение состояние, записываемое как термодинамический потенциал в соответствующих естественных переменных, из которого можно получить и термическое, и калорическое уравнения состояния. Знание уравнения состояния необходимо для применения общих принципов термодинамики к конкретным системам. Для каждой конкретной термодинамической системы её уравнение состояния определяется из опыта или методами статистической механики, и в рамках термодинамики оно считается заданным при определении системы.
Термическое уравнение состояния
Для изотропных однородных систем термическое уравнение состояния имеет наиболее простой вид: f(p,V,T)=0 или p = p(ρ,T). Уравнение состояния идеального газа называетсяуравнением Клапейрона — Менделеева и записывается как pV=νRT, где р — давление, V — объём, T — абсолютная температура, ν — число молей газа, а R — универсальная газовая постоянная [30] .
Для многокомпонентной системы число термических уравнений состояния равно числу компонентов, например, для смеси идеальных газов эти уравнения состояния выглядят как p iV = ν iRT, где ν i — число молей i-го компонента смеси. Общее давление при этом будет равно сумме парциальных давлений компонентов, p=Σp i. Это соотношение называется законом Дальтона.
Для реальных газов были предложены различные варианты уравнений состояния. Наиболее известные из них — уравнение Ван-дер-Ваальса, уравнение Дитеричи и уравнение, получающееся посредством вириального разложения. Получение уравнения состояния для жидкостей, твёрдых тел и плазмы является непростой задачей [31] . Для описания ударноволновых процессов в конденсированных средах может применяться уравнение состояния Ми — Грюнайзена.
Термическое уравнение состояния фотонного газа устанавливает зависимость давления электромагнитного излучения от температуры и не содержит других переменных.
Для пространственно однородного элемента упругой среды при его продольной деформации примером термического уравнения состояния служит закон Гука; в термодинамике деформируемого твёрдого тела термические уравнения состояния, связывающие температуру и компоненты тензоров напряжений и деформаций, входят в число определяющих уравнений; для магнитных сред используют магнитное уравнение состояния M = M(H,T), примером которого может служить закон Кюри; для диэлектриков уравнение состояния имеет вид P = P(E,T); здесь M — магнитный момент вещества, H — напряжённость магнитного поля, P — поляризация, E — напряжённость электрического поля.
Существование термического уравнения состояния вытекает из закона транзитивности термического равновесия, однако сама термодинамика ничего не говорит относительно вида функциональной зависимости между входящими в это уравнение переменными, за исключением того, что уравнение состояния должно удовлетворять определённым условиям устойчивости.
Основные формулы термодинамики
Условные обозначения
| Обозначение | Название величины | Размерность / Значение | Формула |
|---|---|---|---|
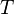 | Абсолютная температура | K | |
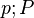 [40] [40] | Давление | Па | |
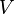 | Объём | м³ | |
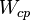 | Средняя энергия молекулы | Дж | |
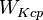 | Средняя кинетическая энергия молекулы | Дж | |
 | Масса | кг | |
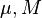 [41] [41] | Молярная масса | кг/моль | |
 | Постоянная Авогадро | 6.0221415(10)·10 23 моль -1 | |
 | Постоянная Больцмана | 1.3806505(24)·10 −23 Дж/К | |
 | Газовая постоянная | 8.314472(15) Дж/(К·моль) |  |
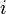 | Число степеней свободы молекулы | — | |
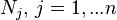 | Количество вещества в  -й компоненте -й компоненте  -компонентной смеси -компонентной смеси | моль | |
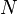 | вектор с координатами 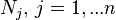 | моль | |
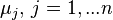 | Химический потенциал  -й компоненты -й компоненты  -компонентной смеси -компонентной смеси | Дж/моль | |
 | Внутренняя энергия | Дж | |
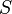 | Энтропия | Дж/К | |
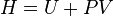 | Энтальпия | Дж | |
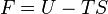 |
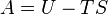

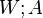

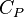


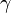

Формулы термодинамики идеального газа
| Уравнение состояния идеального газа (уравнение Клапейрона—Менделеева) | 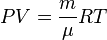 |
| Изменение внутренней энергии газа | 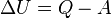 |
| Работа газа |  |
| Средняя энергия молекулы газа | 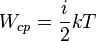 |
| Средняя кинетическая энергия молекулы газа: | 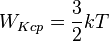 |
| Внутренняя энергия газа |  |
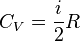
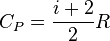
Выражение основных величин через термодинамические потенциалы
Все термодинамические потенциалы имеют свои канонические наборы переменных и используются для анализа процессов при соответствующих условиях. Так, для изотермических изохорических процессов (
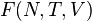
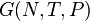


S(N,U,V) (энтропия)
— независимые переменные;
;
;
;
;
;
.
F(N,T,V) (свободная энергия Гельмгольца)
— независимые переменные;
;
;
;
;
;
.
G(N,T,P) (энергия Гиббса)
— независимые переменные;
;
;
;
;
;
.
U(N,S,V) (внутренняя энергия)
— независимые переменные;
;
;
;
;
;
.
Уравнение Гиббса и уравнение Гиббса—Дюгема
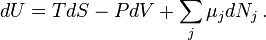
Значимость этого уравнения (и его более общих вариантов) состоит в том, что оно представляет собой тот фундамент, на котором базируется весь математический аппарат современной феноменологической термодинамики, как равновесной, так и неравновесной. По большому счёту, рассмотренные выше законы (начала) термодинамики нужны были именно для обоснования этого соотношения. Всю аксиоматику равновесной термодинамики можно свести к постулированию самого этого уравнения и свойств входящих в него термодинамических переменных.
С использованием других термодинамических потенциалов уравнение Гиббса можно переписать в следующих эквивалентных формах:

Среди термодинамических величин выделяют экстенсивные (внутренняя энергия, энтропия, объём и др.) и интенсивные (давление, температура и др.) величины. Величина называется экстенсивной, если ее значение для системы, сложенной из нескольких частей, равно сумме значений этой величины для каждой части. Предположением об экстенсивности термодинамических величин, однако, можно пользоваться, если рассматриваемые системы достаточно большие и можно пренебречь различными краевыми эффектами при соединении нескольких систем, например, энергией поверхностного натяжения. Пусть U (экстенсивная величина) является однородной функцией первого порядка от своих экстенсивных аргументов (математическое выражение аксиомы экстенсивности): для любого 0″ src=»http://upload.wikimedia.org/math/7/c/5/7c51dee4cd461ebcbbecf8fcee8d236a.png» style=»border:none;vertical-align:middle;margin:0px» />
Для любой дифференцируемой однородной функции первого порядка 
Для энергии 
Отсюда легко следует уравнение Гиббса — Дюгема:
Это уравнение показывает, что между интенсивными переменными существует одна связь, являющаяся следствием предположения об аддитивности свойств системы. В частности, непосредственным следствием соотношений Гиббса-Дюгема является выражение для термодинамического потенциала Гиббса через химические потенциалы 
Термодинамика сплошных сред
Приведённые выше формулировки аксиом термодинамики и соотношения для термодинамических потенциалов имеют место для простых систем — изотропных сред. Для более сложных сред — анизотропных жидкостей и твёрдых тел, сред с электромагнитными свойствами и других, законы термодинамики имеют более сложную формулировку, а термодинамические потенциалы формулируются в обобщенном виде с использованием тензоров. В физике сплошных сред (физике континуума) термодинамика рассматривается как её составная часть, вводящая в рассмотрение переменные, характеризующие тепловые (термические) и химические свойства среды, и их связь с другими физическими величинами, а аксиомы термодинамики включаются в общую систему аксиом.
http://isopromat.ru/teormeh/obzornyj-kurs/uravnenia-ravnovesia-sistemy-sil
http://www.sites.google.com/site/fizikadlavseh1/home/razdely-fiziki/termodinamika
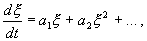
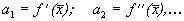

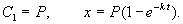
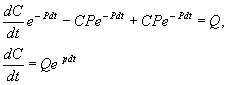
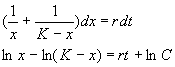


 — независимые переменные;
— независимые переменные;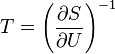 ;
;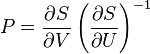 ;
; ;
;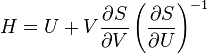 ;
; ;
; .
. — независимые переменные;
— независимые переменные; ;
;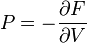 ;
; ;
;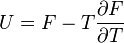 ;
; ;
;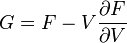 .
. — независимые переменные;
— независимые переменные;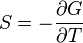 ;
;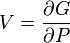 ;
;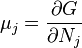 ;
;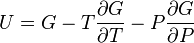 ;
;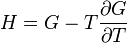 ;
;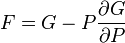 .
. — независимые переменные;
— независимые переменные; ;
;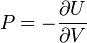 ;
; ;
;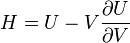 ;
;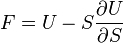 ;
;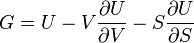 .
.