Добыча нефти и газа
Изучаем тонкости нефтегазового дела ВМЕСТЕ!
Уравнения состояния природных газов
Уравнением состояния называется аналитическая зависимость между термодинамическими параметрами, описывающими поведение вещества.
В качестве таких параметров используются: давление р, температура Т и плотность r.
Уравнение состояние совершенного газа
Определение совершенного газа. Совершенный газ — это газ в котором можно пренебречь объёмом молекул и взаимодействием их между собой
Подходы в описании уравнений состояния реальных газов:
· а) в уравнение совершенного газа вводится один коэффициент z, который учитывает отклонение данных газов от совершенного и называется коэффициентом сверхсжимаемости, а само модифицированное уравнение называют обобщённым газовым законом;
· в) получают эмпирические уравнения состояния с числом параметров больших двух.
Твердотопливные котлы в Украине котлы в Украине
Полное описание первых признаков и выраженных симптомов при гепатите В здесь
Уравнения состояния природных газов
СОСТАВ И ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА ПРИРОДНЫХ ГАЗОВ
Природные газы – это вещества, которые при нормальных (н.у.) и стандартных (с.у.) условиях являются газообразными. В зависимости от условий газы могут находиться в свободном, адсорбированном или растворённом состояниях.
В пластовых условиях газы в зависимости от их состава, давления и температуры (термобарического режима в пласте) могут находиться в различных агрегатных состояниях – газообразном, жидком, в виде газожидкостных смесей.
Свободный газ обычно расположен в повышенной части пласта и находится в газовой шапке. Если газовая шапка в нефтяной залежи отсутствует, то весь газ залежи растворён в нефти.
Давление, при котором имеющийся в залежи газ начинает выделяться из нефти, называется давлением насыщения. Давление насыщения нефти газом в пластовых условиях определяется составами, количеством нефти и газа, пластовой температурой.
Растворённый газ, по мере снижения давления при добыче, выделяется из нефти. Он называться попутным газом. В пластовых условиях все нефти содержат растворённый газ. Чем выше давление в пласте, тем больше газа может быть растворено в нефти. В 1 м 3 нефти содержание растворённого газа может достигать 1000 м 3 .
Состав природных газов
Природные газы, добываемые из газовых, газоконденсатных и нефтяных месторождений, состоят из углеводородов (УВ) метанового ряда СН4–С4Н10: метана, этана, пропана, изобутана и н-бутана, а также неуглеводородных компонентов: H2S, N2, CO, CO2, H2, Ar, He, Kr, Xe и других.
При нормальных и стандартных условиях термодинамически в газообразном состоянии существуют только УВ состава С1–С4. Углеводороды алканового ряда, начиная с пентана и выше, при этих условиях находятся в жидком состоянии, температуры кипения для изо-С5 равна 28 о С, а для н-С5 → 36 о С. Однако, в попутных газах иногда наблюдаются углеводороды С5 за счёт термобарических условий, фазовых переходов и других явлений.
Качественный состав газов нефтяного происхождения всегда одинаков (что нельзя сказать о газах вулканических извержений). Количественное распределение компонентов практически всегда различно.
Состав газовых смесей выражается в виде массовойилиобъемной концентрации компонентовв процентахи мольных долях.
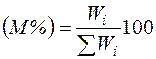
где Wi — масса i-го компонента; ΣWi — суммарная масса смеси.
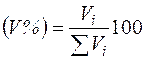
где Vi — объем i-го компонента в смеси; Σ Vi — суммарный объем газа.

где ni — число молей i-го компонента в смеси; Σпi — суммарное число молей газа в системе.
Зависимость между объемной и мольной концентрациями компонентов вытекает из закона Авогадро. Так как равные объемы любых газов при одинаковых температуре и давлении содержат одинаковое число молекул, то объем i-го компонента смеси будет пропорционален числу молей i-го компонента:
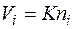
где К — коэффициент пропорциональности. Следовательно

т. е. концентрация компонента в процентах по молям (% мол.) в смеси газов при атмосферном давлении практически совпадает с объемной концентрацией этого компонента в процентах (% об.).
При высоких давлениях жидкие углеводороды растворяются в газовой фазе (газовые растворы, газоконденсаты). Поэтому при высоких давлениях плотность газа может приближаться к плотности легких углеводородных жидкостей.
В зависимости от преобладания в нефтяных газах легких (метан, этан) или тяжелых (пропан и выше) углеводородов газы разделяются на сухие и жирные.
Сухимгазом называют природный газ, который не содержит тяжелых углеводородов или содержит их в незначительных количествах.
Жирным газом называют газ, содержащий тяжелые углеводороды в таких количествах, когда из него целесообразно получать сжиженные газы или газовые бензины.
На практике принято считать жирным газом такой, в 1 м 3 которого содержится более 60г газового бензина.
Газы, добываемые из чисто газовых месторождений, содержат более 95 % метана (табл. 2.2) и представляют собой, так называемые, сухие газы.
| Месторождение | СН4 | С2Н6 | С3Н8 | С4Н10 | N2 | СО2 | Относит. плотность |
| Северо-Ставропольское | 98,9 | 0,29 | 0,16 | 0,05 | 0,4 | 0,2 | 0,56 |
| Уренгойское | 98,84 | 0,1 | 0,03 | 0,03 | 1,7 | 0,3 | 0,56 |
| Шатлыкское | 95,58 | 1,99 | 0,35 | 0,15 | 0,78 | 1,15 | 0,58 |
| Медвежье | 98,78 | 0,1 | 0,02 | – | 1,0 | 0,1 | 0,56 |
| Заполярное | 98,6 | 0,17 | 0,02 | 0,013 | 1,1 | 0,18 | 0,56 |
Тяжёлым нефтям свойственны сухиепопутные газы с преобладанием метана в их составе. Например, содержание метана в составе попутного газа Русского месторождения Западной Сибири (плотность нефти более 920 кг/м 3 ) аналогично содержанию метана в составе газа газового Уренгойского месторождения и составляет около 98,8 об. %.
Содержание метана в газах газоконденсатных месторождений колеблется в интервале 75–95 % (табл. 2.3). Попутный газ газоконденсатных месторождений и лёгких нефтей достаточно жирный.
| Месторождение | СН4 | С2Н6 | С3Н8 | С4Н10 | С5Н12 | N2 | СО2 | Отност. плотность |
| Вуктыльское | 74,80 | 8,70 | 3,90 | 1,80 | 6,40 | 4,30 | 0,10 | 0,882 |
| Оренбургское | 84,00 | 5,00 | 1,60 | 0,70 | 1,80 | 3,5 | 0,5 | 0,680 |
| Ямбургское | 89,67 | 4,39 | 1,64 | 0,74 | 2,36 | 0,26 | 0,94 | 0,713 |
| Уренгойское (БУ–8, БУ–14) | 88,28 | 5,29 | 2,42 | 1,00 | 2,52 | 0,48 | 0,01 | 0,707 |
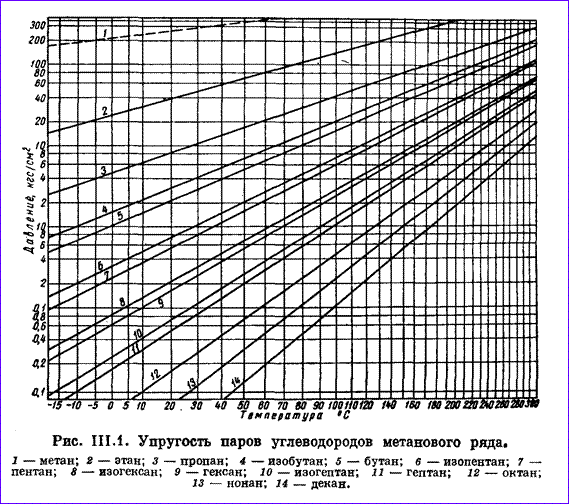
Газы, добываемые вместе с нефтью из нефтяных месторождений (попутные газы) представляют собой смесь метана, этана, пропан-бутановой фракции, газового бензина. При повышенном давлении углеводороды состава С3, С4 легко сжижаются. В пластовых условиях в газообразном состоянии находится практически один метан. При нормальных условиях углеводороды от метана СН4 до бутана С4Н10 находятся в газообразном состоянии. Остальные углеводороды при этих условиях — жидкости. Пропан и бутан при повышении давления легко переходят в жидкое состояние. Упругость насыщенных паров углеводородов, т. е. то давление, при котором газ начинает конденсироваться и переходить в жидкое состояние, повышается с ростом температуры и она тем выше, чем ниже плотность углеводорода. Упругость пара — нелинейная функция температуры. Графики на рис. 2.9 построены так, чтобы получить линейную зависимость между упругостью паров углеводородов и температурой: шкала упругости пара принята логарифмической, а температурная шкала (в °С) принята произвольной.
Удобство таких графиков заключается в том, что они позволяют легко и быстро определять по известной упругости пара при некоторой температуре упругость его паров при других температурах. Для этого проводят прямую линию через, известную точку и общую точку пересечения прямых упругостей паров (находящуюся вне графика на продолжении правой верхней части диаграммы).
Из рис. 2.9 следует, что давление паров метана наибольшее; при нормальных условиях его нельзя превратить в жидкость (пунктирная линия 1 давления ненасыщенного пара метана), так как его критическая температура t = -82,95° С. Давление насыщенных паров других углеводородов намного ниже. Например, бутан при t = — 20° С имеет упругость паров, равную 0,22 Мн/м 2 (2,2 кГ/см 2 ).
К расчёту физико-химических свойств газа как многокомпонентной смеси можно применять принцип аддитивности.
Аддитивный подход к расчёту физико-химических и технологических параметров означает, что каждый компонент газа в смеси ведёт себя так, как если бы он в данной смеси был один.
Следовательно, для оценки макроскопических свойств нефтяного газа (при н.у. и с.у.) применимы аддитивные методы расчётов физико-химических и технологических параметров (Псмеси):

где где Ni – мольная доля; gi – весовая доля; Vi – объёмная доля; Пi – физико-химическое свойство i-го компонента.
Для идеальных газов общее давление в системе (смеси газов) равно сумме парциальных давлений компонентов (закон Дальтона):

где Р – общее давление смеси газов; рi – парциальное давление i-го компонента в смеси. Откуда
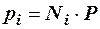

То есть, парциальное давление компонента в газовой смеси равно произведению его молярной доли на общее давление смеси газов.
Аддитивность парциальных объёмов (Vi) компонентов газовой смеси выражается законом Амага:

где V – общий объём смеси газов; Vi – мольный объём i-го компонента газа в смеси.
По аналогии с уравнениями (2.22–2.23) мольный объём компонента в газе можно оценить:

Как аддитивные величины рассчитывают все физико-химические свойства газа, например, плотность смеси газов:
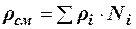
где ρi – плотность i–го компонента; Ni – мольная доля i–го компонента.
Уравнения состояния природных газов
Наука о веществе основывается на современных знаниях об атомах – мельчайших частицах элементов и молекулах – мельчайших частицах химических соединений. Атомы имеют размер порядка 10
8 см (одного ангстрема). Крупные молекулы, содержащие тысячи атомов, имеют размер около 10
6 см. Характер движения молекул и атомов, их взаимодействие определяют, в каком агрегатном состоянии находится вещество – в твердом, жидком или газообразном.
Молекулы могут совершать поступательное, вращательное и колебательное движение. Если вещество находится в газообразном или жидком состоянии, то возможны все три вида этих движений. Если же вещество затвердевает, преобладающей формой движения молекул и атомов становятся колебания.
При изучении состояния вещества стремятся найти взаимосвязь между давлением, при котором находится вещество, его плотностью и температурой. Если обозначить давление p, плотность ρ, а обратную ей величину – удельный объем вещества V и температуру Т, то состояние вещества будет характеризоваться соотношением р, V и Т или, как принято в термодинамике, 
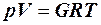

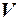

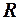

Газовая постоянная численно равна работе расширения 1 кг идеального газа в изобарическом процессе при увеличении температуры газа на 1 К.
При высоком сжатии газа его параметры уже не будут описываться уравнением состояния идеального газа. Ван-дер-Ваальсом были введены в уравнение состояния идеального газа (2.27) поправки: величина b, учитывающая объем самих молекул, и величина a/v 2 , учитывающая взаимодействие между молекулами. В результате было получено уравнение состояния «реального газа» (уравнение Ван-дер-Ваальса) в следующем виде:

Сложность применения уравнения (2.28) для практических расчетов заключается в том, что в газонефтепромысловом деле встречаются, как правило, смеси газов, для которых уравнение Ван-дер-Ваальса применимо с трудом.
Хорошее согласование с экспериментальными данными для газов, плотность которых не превышает двух третей от плотности газа при критических условиях, получают по уравнению Битти-Бриджмена
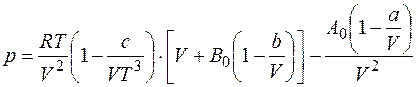
где а, Ь, с, Ао и Во — постоянные для данных компонентов природного газа, которые вычисляются на основании экспериментальных данных.
Коэффициент сверхсжимаемости. При большом числе компонентов расчеты по приведенным формулам становятся трудоемкими. Поэтому для расчета состояния реальных газов обычно пользуются обобщенным газовым законом в виде уравнения Клапейрона, в которое вводится поправка (коэффициент сверхсжимаемости), учитывающая отклонение реальных газов от законов сжатия и расширения идеальных газов.

где z – коэффициент сверхсжимаемости; 
Характер изменения коэффициента сверхсжимаемости z, который показывает отношение объема реального газа к объему идеального при одних и тех же условиях, с изменением температуры и давления можно установить, учитывая отличия реальных газов от идеальных. В последних молекулы занимают незначительный объем (по сравнению с объемом газа) и не испытывают сил притяжения друг к другу. Молекулы же реальных газов обладают определенными размерами, массой и взаимодействуют друг с другом. Поэтому реальный газ приближается к идеальным при низких давлениях, когда число молекул в единице объема невелико. Следовательно, при низких давлениях величина коэффициента сжимаемости должна быть близка к единице. С повышением давления молекулы газа сближаются и силы притяжения между молекулами начинают помогать внешним силам, сжимающим газ. Вследствие этого реальные газы должны сжиматься сильнее, чем при тех же условиях сжимаются идеальные газы. Следовательно, с ростом давления коэффициент сжимаемости z должен вначале уменьшаться. Когда углеводородный газ сжат до такой степени, что он приближается по свойствам к жидкостям, межмолекулярные расстояния уменьшаются настолько, что начинают проявляться взаимоотталкивающие силы между молекулами, препятствующие дальнейшему уменьшению объема газа. В этих условиях углеводородный газ должен сжиматься меньше, чем при малых давлениях, т. е. значения z вновь возрастают при увеличении давления.
С приближением давления и температуры к их критическим значениям свойства газовой и жидких фаз становятся одинаковыми, поверхность раздела между ними исчезает и плотности их уравниваются.
Критическая температура (Ткр) – максимальная температура, при которой газ и жидкость могут ещё сосуществовать в равновесии (табл. 2.4).
Критическое давление – давление паров вещества при критической температуре (табл. 2.3), а объём вещества при данных Ткр и pкр, отнесённый к 1 молю или к единице массы вещества, называется критическим удельным объёмом.
Упругость насыщенных паров углеводородов, это давление, при котором газ начинает конденсироваться и переходить в жидкое состояние, повышается с ростом температуры и она тем выше, чем ниже плотность углеводорода.
Таблица 2.4 Критические давления и температуры компонентов нефтяных газов
| № п./п. | Компонент | Относит. моляр. масса | РКРi, МПа | ТКРi, К |
| Метан, СН4 | 16,04 | 4,63 | 190,55 | |
| Этан, С2Н6 | 30,07 | 4,87 | 305,45 | |
| Пропан, С3Н8 | 44,09 | 4,26 | 369,82 | |
| изо-Бутан, i-С4Н10 | 58,12 | 3,65 | 408,13 | |
| н-Бутан, n-С4Н10 | 58,12 | 3,797 | 425,16 | |
| изо-Пентан, i-С5Н12 | 72,15 | 3,381 | 460,4 | |
| н-Пентан, n-С5Н12 | 72,15 | 3,369 | 469,6 | |
| н-Гексан, С6Н14 | 86,17 | 3,031 | 507,4 | |
| н-Гептан, С7Н16 | 100,20 | 2,736 | 640,61 | |
| Азот, N2 | 28,02 | 3,399 | 126,25 | |
| Двуокись углерода, СО2 | 44,01 | 7,387 | 304,15 | |
| Сероводород, Н2S | 34,08 | 9,01 | 373,55 |
Приведенные параметры газов.Коэффициент сжимаемости газов z, обычно определяют по экспериментальным графикам. Чтобы избежать построения графиков для каждого газа или их смесей, на основе экспериментальных данных составлен график изменения коэффициента z в зависимости от приведенной температуры и приведенного давления для метана (рис.2.2), который на основании закона соответственных состояний с достаточной точностью может быть использован для определения z, всех газов, состоящих на 95—96% из метана. Коэффициенты сжимаемости на этом графике поставлены в зависимость от приведенного давления p пр и приведенной температуры Tпр, которые определяются по формулам
 |  |
где р и Т — давление и температура газа; рКрi и Tкрi — критические давление и абсолютная температура i-го компонента; 
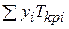

Таким образом, рпр и Tпр выражают давление и абсолютную температуру в долях от соответствующих критических величин.
Уравнения состояния нефти и газа
АВТОРЕФЕРАТ
диссертации на соискание ученой степени кандидата технических наук
Работа выполнена на кафедре “Теплогазоснабжение и вентиляция” Калининградского государственного технического университета
Научный руководитель – доктор технических наук, профессор Герасимов Анатолий Алексеевич
Официальные оппоненты – Богатырев Александр Федорович доктор технических наук, профессор филиал Национального исследовательского университета «МЭИ» в г. Смоленске, профессор кафедры физики – Дадашев Мирали Нуралиевич доктор технических наук, профессор Российский государственный университет нефти и газа им. И.М.Губкина, главный научный сотрудник кафедры физической и коллоидной химии
Ведущая организация – Всероссийский научно-исследовательский центр стандартизации, информации и сертификации сырья, материалов и веществ (ФГУП “ВНИЦСМВ”)
Защита диссертации состоится 18 мая 2012 года в 10:00 на заседании диссертационного совета Д 212.157.04 при ФГБОУ ВПО “НИУ МЭИ” по адресу: Москва, Красноказарменная ул., д.17, корп. Т, ауд. Т-206. Отзывы на автореферат, заверенные печатью организации, просим посылать по адресу:
111250, Москва, Красноказарменная ул., д.14, Ученый совет “НИУ МЭИ”.
С диссертацией можно ознакомиться в Научно-технической библиотеке Московского энергетического института.
Автореферат разослан “ ” апреля 2012 года.
Ученый секретарь диссертационного совета Д 212.157. к.т.н. А. К. Ястребов
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность работы. Простейшие органические соединения – углеводороды занимают огромный сектор в структуре современной экономики.
Информация о термодинамических свойствах этих веществ необходима при разработке промышленных процессов добычи, транспорта, хранения, переработки, при проектировании оборудования и моделировании процессов в системах автоматизированного управления, при совершении торговых операций.
В связи с этим, обеспечение науки и техники достоверными справочными данными о термодинамических свойствах технически важных углеводородов является важной народнохозяйственной задачей.
Однако восполнить информационный вакуум о термодинамических свойствах углеводородов на основе только опытных данных невозможно по причине достаточно большого количества этих веществ и ограниченности возможности экспериментальных исследований из-за растущих трудовых и материальных затрат.
Очевидный и единственный разумный выход заключается в развитии исследований, приводящих к созданию универсальных методов расчета термодинамических свойств технически важных углеводородов. Один из путей решения этой задачи – разработка фундаментальных уравнений состояния, которые с одной стороны в соответствии с требованиями современной науки, достоверно воспроизводят термодинамическую поверхность, а с другой позволяют рассчитывать термодинамические свойства с погрешностью, не превышающей погрешность эксперимента.
Настоящая диссертационная работа посвящена совершенствованию методов описания термодинамических свойств технически важных рабочих веществ с помощью фундаментальных уравнений состояния, а также разработке таких уравнений состояния для некоторых парафиновых, ароматических и нафтеновых углеводородов на основе экспериментальных данных о термических, калорических и акустических свойствах и расчету широкодиапазонных таблиц термодинамических свойств этих веществ.
Цель и задачи исследования — разработать локальные уравнения технически важных углеводородов, описывающие с высокой точностью упругость насыщенных паров, плотность жидкой и газовой фаз в диапазоне температуры от тройной точки до критической точки.
— разработать широкодиапазонные фундаментальные уравнения состояния в виде зависимости безразмерной свободной энергии Гельмгольца от собственных переменных – температуры и плотности, для нормальных алканов (н-гептан, н-нонан, н-декан, н-ундекан, н-додекан, н-тридекан), ароматических углеводородов (этилбензол, орто-, мета-, параксилола) и нафтеновых углеводородов (циклогексана), описывающие термические, калорические и акустические данные с погрешностью, близкой к погрешности эксперимента и рассчитать по ним таблицы термодинамических свойств указанных веществ во всем изученном диапазоне параметров состояния.
— адаптировать алгоритмическую программу нахождения коэффициентов и степеней фундаментальных индивидуальных уравнений состояния для разработки обобщенного фундаментального уравнения н-алканов. Программа должна обеспечивать активное использование разнородных опытных данных и учет многочисленных жестких требований, предъявляемых к уравнению состояния, а также позволять осуществлять моделирование термодинамической поверхности путем использования различных типов ограничений, контролирующих поведение производных термодинамических величин и обеспечивающих физическую форму поверхности состояния.
— разработать обобщенное фундаментальное уравнение состояния налканов в виде зависимости безразмерной свободной энергии Гельмгольца от приведенной температуры, приведенной плотности и ацентрического фактора Питцера. Уравнение должно позволять производить расчет всех термодинамических свойств нормальных алканов от пентана до пентаконтана с ошибкой близкой к погрешности экспериментальных данных в диапазоне температуры от тройной точки до 700 К при давлениях до 100 МПа.
Научная новизна работы. Разработана корректная методика определения давления насыщенных паров и энтальпии испарения вблизи тройной точки по калориметрическим данным и выполнен расчет указанных свойств, для исследуемых здесь углеводородов. Определена энтальпия сублимации углеводородов в тройной точке. Для ряда веществ значения получены впервые.
Получены локальные уравнения для технически важных углеводородов, описывающие с высокой точностью давление насыщенных паров, плотность насыщенной жидкой и газовой фазы в диапазоне температуры от тройной точки до критической точки.
Разработаны фундаментальные уравнения состояния для н-алканов (нгептан, н-нонан, н-декан, н-ундекан, н-додекан, н-тридекан), ароматических углеводородов (этилбензол, орто-, мета-, параксилола) и нафтеновых углеводородов (циклогексан), описывающие все термодинамические свойства в диапазоне температуры от тройной точки до 700 К при давлениях до МПа с точностью, близкой к точности экспериментальных данных. Для нундекана, н-тридекана, этилбензола, о-м-п-ксилолов уравнения получены впервые.
Впервые получено обобщенное фундаментальное уравнение состояния, описывающее все термодинамические свойства нормальных алканов от пентана до пентаконтана в диапазоне температуры от тройной точки до 700 К при давлениях до 100 МПа с точностью, близкой к точности экспериментальных данных.
Разработана программа, позволяющая аналитически описать термодинамическую поверхность технически важных газов и жидкостей в широком интервале параметров состояния единым обобщенным фундаментальным уравнением состояния. Программа обладает высоким быстродействием и позволяет обрабатывать большие массивы разнородных опытных данных. От ранее составленных программ построения взаимосогласованных уравнений состояния она принципиально отличается следующим:
— в основе программы лежит стохастический метод случайного поиска с возвратом при неудачном шаге. Данный алгоритм позволяет включать в обработку разнородные экспериментальные данные о термодинамических свойствах в собственных переменных без трансформации в переменные “температура — плотность” уравнения состояния, что позволяет реализовать нелинейный оптимизационный процесс, избегая процедуры линеаризации, ведущей к неизбежной потере точности.
— минимизируемый функционал содержит слагаемые, ответственные за точность аппроксимации результатов измерений разнородных данных о термодинамических свойствах, а также различные ограничения, накладываемые в виде неравенств на термодинамическую поверхность. Основными видами ограничений являются: критические условия, правило Максвелла, контроль кривизны идеальных кривых, положительность теплоемкости, контролирование знаков производных различных термодинамических величин и т.д.
Практическая ценность результатов диссертационной работы заключается в получении информации о термодинамических свойствах технически важных углеводородов в табличном и аналитическом виде, необходимой для практических расчетов новых технологических процессов и аппаратуры ректификации, экстракции, абсорбции и др., где исследуемые вещества являются исходным сырьем, растворителем, промежуточным либо конечным продуктом.
Разработанные автором алгоритм и программа определения коэффициентов обобщенного уравнения состояния могут быть использованы при обобщении данных о других теплофизических свойствах.
Апробация работы. Основные результаты работы докладывались:
— на научно-технической конференции с международным участием ” International Conference of Physics of Liquid Matter: Modern Problems”, Киев, май, 2010 г.
— на научно-технической конференции с международным участием “Мировые ресурсы и запасы газа, и перспективные технологии их освоения”, Москва, октябрь, 2010 г.
— на шестой юбилейной международной научной конференции, посвященной 50-летию пребывания КГТУ на калининградской земле “Инновации в науке и образовании – 2008”, Калининград, 2008 г.
— на седьмой международной конференции “Инновации в науке и образовании-2009”, Калининград, 2009 г.
— на восьмой международной конференции “Инновации в науке и образовании-2010”, Калининград, 2010 г.
— на XIII Российской конференции по теплофизическим свойствам веществ, Новосибирск, (28 июня – 1 июля), 2011 г.
Связь с планами основных научно-исследовательских работ.
Диссертация выполнена в рамках работы над инициативным научным проектом № 09 – 08 – 00683а “Теплофизические свойства технически важных углеводородов и их смесей в широком диапазоне параметров состояния” при поддержке Российского фонда фундаментальных исследований.
Публикации. По теме диссертации опубликовано двенадцать печатных работ, в т.ч. четыре работы в изданиях, рекомендованных ВАК РФ.
Структура и объем работы. Диссертация состоит из введения, четырех глав, заключения, списка литературы и приложения. Работа содержит страниц, из них 28 таблиц на 99 страницах, приложение на16 страницах и страница текста с 55 иллюстрациями. Список литературы включает 653 наименования на 51 странице.
СОДЕРЖАНИЕ РАБОТЫ
Во введении обоснована актуальность темы диссертации, сформулирована цель работы и сделан выбор объекта исследования – технически важных углеводородов.
В первой главе выполнен анализ экспериментальных данных о термодинамических свойствах углеводородов на линиях фазового равновесия «жидкость – газ», «твердое тело – газ», «твердое тело – жидкость», и отобраны наиболее надежные данные для разработки локальных уравнений. В результате анализа экспериментальных данных выявлено отсутствие надежных данные о давлении насыщенных паров вблизи температуры тройной точки, а также недостаток данных о кривой плавления некоторых углеводородов. Для устранения, указанного дефицита данных, разработана методика определения давления насыщенных паров и энтальпии испарения вблизи тройной точки по калориметрическим данным.
Предлагаемая автором методика сводится к следующему. Известно, что при низких температурах упругость насыщенных паров углеводородов достаточно надежно описывается уравнением Антуана Используя уравнение Клапейрона – Клаузиуса для энтальпии испарения hv, уравнение состояния идеального газа и, пренебрегая удельным объемом жидкой фазы в разности, после преобразований получим следующее уравнение где A, В, С – коэффициенты уравнения Антуана; R – газовая постоянная.
Таким образом, имея надежные данные о теплоте испарения углеводородов, можно рассчитать два коэффициента уравнения Антуана. Величину коэффициента А определяем по одному надежному значению давления насыщения, либо по нескольким значениям в диапазоне температур, где применимо уравнение Антуана. Однако надежные экспериментальные данные об энтальпии испарения вблизи тройной точки углеводородов, как правило, отсутствуют, в связи, с чем предлагается рассчитывать значения по термодинамическому тождеству где hv, hl — соответственно энтальпия насыщенного газа и жидкости; ho – энтальпия в состоянии идеального газа; h(pv,0) – изотермическое изменение энтальпии в диапазоне давлений от нуля до рv.
В первом приближении, учитывая малые значения давления, величиной h(pv,0) пренебрегают, считая h(pv,0) = 0. Затем определяют область, в пределах которой можно пренебречь величиной h(pv,0), либо производят уточнение величины h по кубическому УС, разработанному Брусиловским где ac, b, c, d – коэффициенты уравнения состояния, определяемые по значениям критических свойств и фактора ацентричности Питцера; (T) – температурная функция.
Предложен также и иной способ расчета давления насыщения по калорическим свойствам жидкой фазы, использующий термодинамическое тождество где g l, g v – свободная энергия Гиббса соответственно насыщенной жидкости и газа.
Значения gl известны для углеводородов в низкотемпературной области с высокой точностью, а величину gv рассчитывают по соотношению где g – свободная энергия Гиббса в состоянии идеального газа; g – изотермическое изменение свободной энергии Гиббса в диапазоне давлений от опорного ро = 101325 Па до искомого рv. Величина g рассчитывалась по соотношению, полученному из уравнения состояния Брусиловского Термодинамическое тождество (6) с учетом (7) и (8) решается численным методом и определяются значения рv. Расчет давления насыщенных паров н-алканов от н-С5 до н-С18, ароматических углеводородов и циклогексана выполнен двумя способами в диапазоне температуры от тройной точки Tt до Tt + (60 80) К. Погрешность расчетных значений pv и hv, не превышает ± 0,5% и только для н-пентана может возрастать до ±0,8 – 1,0 % вблизи температуры тройной точки. По значениям hv в тройной точке и данным об энтальпии плавления также определены значения энтальпии сублимации углеводородов в тройной точке.
На основе отобранных и взаимосогласованных экспериментальных данных о давлении насыщенных паров pv, плотности насыщенной жидкой l и газовой v фазы разработаны локальные уравнения, описывающие с высокой точностью указанные свойства в диапазоне температуры от тройной точки до критической точки.
Данные о pv аппроксимированы уравнением, имеющим форму, предложенную Вагнером. Число членов уравнения и степени по температуре определялись методом пошагового регрессионного анализа Для аппроксимации данных о плотности жидкой и газовой фаз использованы также достаточно известные формы уравнений, имеющие правильные асимптоты в критической точке. Уравнение (11) для плотности газовой фазы обеспечивает переход к идеально-газовому поведению при низких температурах и давлениях.
универсальная газовая постоянная; = 0,325; = 0,50 – критические индексы.
Средняя относительная погрешность описания указанных свойств составляла: pv – 0,06 – 0,15 %; l – 0,05 – 0,1 %; v – 0,2 – 0,5 %. Для ряда веществ в указанном диапазоне уравнения получены впервые.
Для описания линии плавления по экспериментальным данным определены коэффициенты уравнения Симона – Глатцеля. При отсутствии экспериментальных данных выполнен расчет указанных коэффициентов по модифицированной автором методике.
Во второй главе проводится обзор различных видов уравнений состояния, методов их разработки и обосновывается выбор формы уравнения состояния и метода определения его коэффициентов.
В последние годы для ряда технически важных веществ были разработаны уравнения состояния в форме зависимости свободной энергии Гельмгольца от температуры и плотности, в полной мере удовлетворяющие вышеуказанным требованиям. Для этих уравнений характерен такой выбор независимых переменных, при котором все термодинамические свойства рабочего вещества могут быть представлены через саму свободную энергию и ее частные производные. Независимыми переменными для свободной энергии Гельмгольца являются температура и удельный объем, т.е. они совпадают с традиционными независимыми переменными термических уравнений состояния.
Наибольшее распространение получили уравнения, описывающие безразмерную свободную энергию Гельмгольца где а(,T) – свободная энергия Гельмгольца; id (,) – идеальная часть; r(,) – избыточная часть; = /r; = Tr/T; r, Tr – опорные значения плотности и температуры (как правило принимают критические значения) Идеальная часть определяется по соотношению где 0 = 0/с – приведенная идеально-газовая плотность при р0 = 101325 Па и температуре Т0 = 298,15 К; 0 = Tc/T0; H0o – идеально-газовая энтальпия в опорной точке; S0o – идеально-газовая энтропия в опорной точке. Информация об изобарной теплоемкости идеального газа включается в уравнение состояния, и для расчета свойств достаточно одного исходного уравнения.
Для описания избыточной (конфигурационной) части свободной энергии Гельмгольца применяют различные формы уравнений. Наиболее широко исследовано и применяется на практике (исключая критическую область) уравнение вида Для описания термодинамических свойств исследуемых углеводородов и с учетом дальнейшей перспективы было выбрано 14-ти константное УС вида n13 4 4,75 exp( 2 ) n14 2 12,5 exp( 3 ) УС в форме (15) позволяет описывать термодинамические свойства как полярных, так и неполярных веществ и, обладая самостоятельной ценностью, также может быть использовано для описания свойств смесей определенного и неопределенного состава.
Особую группу УС представляют уравнения, в которых совмещается задача описания свойств в широкой области параметров состояния с требованием воспроизведения особо аномального поведения вещества в критической точке и ее окрестностях. На сегодняшний день широкое применение получили УС в форме свободной энергии, содержащие дополнительные слагаемые, позволяющие достаточно точно описывать все термодинамические свойства в критической области За последние годы выполнен большой объем исследований по оптимизации УС (14), (16) и разработке математических методов определения коэффициентов этого уравнения по разнородным экспериментальным данным.
При оптимизации формы УС используются как чисто детерминированные методы поиска, такие как пошаговый регрессионный анализ, так и стохастические методы случайного поиска — метод имитации отжига, метод случайного поиска с возвратом при неудачном шаге и т. д. Подробный обзор этих методов выполнен во второй главе диссертации.
Для отыскания коэффициентов УС (15) и оптимизации формы УС (16) использовался метод случайного поиска с возвратом при неудачном шаге.
Основными достоинствами этого метода случайного поиска являются: повышенное быстродействие, высокая надежность и помехоустойчивость, малая чувствительность к нерегулярностям поведения целевой функции, сравнительно простая внутренняя реализация, малая чувствительность к росту размерности множества оптимизации и т.д.
Минимизируемый функционал, являющийся критерием оптимальности при принятии решения алгоритмом, представлен следующей зависимостью:
где: W- весовой коэффициент, F- квадратичная функция, используемая для минимизации отклонений. Например, для pT — данных квадратичная функция определялась как:
Квадратичные функции для других свойств имеют аналогичный вид. Важным преимуществом метода является включение в обработку данных о свойствах в собственных переменных без трансформации в независимые переменные “температура-плотность” УС. Значения термодинамических величин определяются на основе дифференциальных уравнений термодинамики и включаются в минимизируемый функционал.
Используемый метод позволяет накладывать различные ограничения в виде неравенств на термодинамическую поверхность, обеспечивающие физическую форму поверхности состояния. Основными видами ограничений являются: критические условия, правило Максвелла, контроль кривизны идеальных кривых, положительность теплоемкости, контролирование знаков производных различных термодинамических величин и т.д. Ограничения в безразмерном виде входят как слагаемые в минимизируемый функционал.
Вышеописанные особенности используемого метода позволяют находить глобальный минимум оптимизируемого функционала при достаточно ограниченном наборе экспериментальных данных и посредством разнообразных ограничений моделировать термодинамическую поверхность, тем самым улучшая экстраполяционные возможности УС.
Третья глава посвящена анализу экспериментальных данных о термодинамических свойствах некоторых парафиновых, ароматических и нафтеновых углеводородов и разработке фундаментальных УС для этих веществ.
Выбор углеводородов обоснован их практической значимостью и отсутствием в литературе ФУС выбранной формы.
Для описания термодинамических свойств исследуемых углеводородов в диапазоне температур от тройной точки до начала термической диссоциации (
700К) и при давлениях до 100 МПа (исключая критическую область) разработаны УС в форме (15). Коэффициенты УС (15) представлены в таблице 1. Средняя относительная погрешность в описании различных свойств по уравнению (15) для исследуемых веществ представлена в таблице 2.
Для описания термодинамических свойств циклогексана в диапазоне температур от тройной точки до начала термической диссоциации и при давлениях до 100 МПа с учетом описания свойств в критической области разработано УС в форме (16). Коэффициенты и степени УС (16) представлены в таблице 3.
Поиск коэффициентов и степеней уравнения состояния осуществлялся одновременно посредством нелинейной оптимизационной процедуры, в основе которой лежит метод случайного поиска с возвратом при неудачном шаге. В процессе оптимизации формы уравнения проводился анализ значимости слагаемых, входящих в уравнение состояния, с удалением малозначимых. В целом выполненный анализ показывает, что разработанное уравнение, позволяет рассчитывать все термодинамические свойства циклогексана в диапазоне температуры от тройной точки до 700 К при давлениях до МПа, включая критическую область.
Таблица 1. Коэффициенты уравнения состояния (15).
Продолжение таблицы 1.
0,4958720910- 0,5540710110-7 -0,9318756110-4 0,7936917910- 0, 0,1310835410-2 -0,8764968510-2 -0,1670668110- -0,9300187710-1 -0,9221027610-1 0,6587624410- -0,2256085410-1 -0,5280525110-2 -0,1442208110- -0,6671953310-2 -0,1007029210-2 -0,2199883910- -0,1162550310-1 -0,1638669910-1 -0,1218008610- -0,1338453310-1 -0,7460854810-2 -0,1605808710- Окончание таблицы 1.
Ошибки расчета термодинамических свойств по УС (16) в регулярной части термодинамической поверхности находятся в следующих пределах:
плотность жидкой фазы 0,05 – 0,2%, плотность газовой фазы 0,1 – 0,5%, давления насыщенного пара 0,05 – 0,4 %, изобарной теплоемкости в жидкой фазе 0,3 – 0,6 %, изобарной теплоемкости в газовой фазе 0,5 – 1,0 %, скорости звука 0,2 – 0,4 %. Средняя погрешность в описании плотности в критической области составляет 1,5 %, а для теплоемкости – 4%.
Таблица 3. Коэффициенты и степени УС (16) для циклогексана.
Вещество н-гептан 0,15-0,3 0,4-1,0 0,8-1,0 0,1-0,3 0,05-0,15 0,5-0,7 0,8-0,9 0,9-1,0 0,4-0,6 0,3-0, н-нонан 0,1-0,3 0,5-0,6 1,0-1,2 0,1-0,4 0,08-0,2 0,4-0,6 1,5-2,0 0,5-0,6 0,4-0,7 0,1-0, н-декан 0,1-0,4 0,6-0,7 1,0-1,5 0,2-0,5 0,05-0,2 0,3-0,7 1,0-1,4 1,0-1,2 0,1-0,4 0,3-0, этилбензол 0,1-0,15 0,9-1,0 0,7 0,1-0,5 0,05-0,1 0,4-0,8 0,5-1,0 1,0-1,2 0,2-0,4 0,4-0, п-ксилол 0,05-0,15 0,2-0,4 0,8 0,2-0,5 0,05-0,2 0,3-0,6 0,4-1,3 2,0 0,2-0,4 0,5-0, циклогексан 0,1-0,3 0,4-0,7 0,5-0,9 0,2-0,6 0,05-0,2 0,6-0,8 0,6-0,9 1,0-1,3 0,4-0,5 0,2-0, Четвертая глава посвящена анализу современных фундаментальных обобщенных УС, выбору формы и разработке фундаментального обобщенного УС для нормальных алканов. Для описания термодинамических свойств налканов на основе разнородных экспериментальных данных получено фундаментальное обобщенное УС в форме (12), описывающие безразмерную свободную энергию Гельмгольца. Идеально-газовая часть определяется по соотношению (13).
Для описания избыточной (конфигурационной) части использована оптимизированная функциональная форма уравнения (15). Эта форма уравнения достаточно универсальна и может быть в дальнейшем распространена на более широкий класс веществ. Обобщение было выполнено в рамках теории термодинамического подобия с использованием одного определяющего критерия — ацентрического фактора Питцера.
Коэффициенты ni обобщенного уравнения состояния определяются по следующему соотношению:
где: – фактор ацентричности Питцера.
Обобщенная зависимость для н-алканов построена на подобии свойств в гомологическом ряду в функции числа атомов углерода.
Фактор ацентричности и критические свойства рассчитываются по числу атомов углерода в молекуле парафина:
где: n – число атомов углерода в молекуле; =1 — для четного номера n, =0 – для нечетного n; =0 — для четного номера n, =1 – для нечетного n; Коэффициенты уравнений представлены в таблице 4.
Таблица 4. Коэффициенты уравнений (20), (21) и (22).
Показатели степени уравнения (15) представлены в таблице 5. Коэффициенты сj,i зависимости (19) представлены в таблице 6.
Таблица 5. Показатели степени обобщенного УС состояния н-алканов.
В качестве оптимизационной процедуры при разработке УС была применена модификация метода случайного поиска с возвратом при неудачном шаге. Поиск коэффициентов сj,i и показателей степени ti осуществлялся одновременно в нелинейном варианте. Алгоритм был усовершенствован введением различных видов ограничений применительно к процедуре разработки обобщенного УС. На значения коэффициентов и степеней накладывались ограничения для удержания их в допустимом диапазоне, а также применялись различные ограничения, используемые ранее при разработке УС для индивидуальных веществ. В обработку включались PVT – данные, данные о давлении насыщенных паров, изобарной теплоемкости и скорости звука.
Ошибки расчета термодинамических свойств различны и находятся в следующих пределах (за исключением критической области): плотность жидкой фазы – 0,3 – 1,2 %; плотность газовой фазы – 0,5 – 3,0%; теплоемкости – 0,7 – 2,0%; давление насыщенных паров 0,3 – 5,0%. Большие значения относятся к «тяжелым» углеводородам.
1. Разработана методика и произведен расчет энтальпии испарения и давления насыщения углеводородов вблизи тройной точки на основе данных о калорических свойствах.
2. Разработаны локальные уравнения исследуемых углеводородов, описывающие c высокой точностью упругость насыщенных паров, плотность жидкой и газовой фаз в диапазоне температуры от тройной точки до критической точки.
3. Выполнен анализ современных фундаментальных УС и методов их разработки. Для описания термодинамических свойств технически важных углеводородов выбрано 14-ти константное уравнение состояния универсальной формы в виде зависимости свободной энергии Гельмгольца от температуры и плотности. Для определения коэффициентов фундаментального УС обоснованно выбран метод случайного поиска с возвратом при неудачном шаге.
4. По термическим и калорическим и акустическим экспериментальным данным, отобранным автором, для исследуемых углеводородов разработаны фундаментальные УС, описывающие с высокой точностью все термодинамические свойства в диапазоне температур от тройной точки до начала термической диссоциации при давлениях до 100 МПа (исключая критическую область).
5. Разработано фундаментальное УС циклогексана оптимизированной формы, отличающееся от существующих более высокой точностью описания термодинамических свойств, особенно в критической области.
6. Рассчитаны таблицы термодинамических свойств циклогексана (, cp, cv, h, s, w) на линии равновесия жидкой и газовой фазы и в однофазной области параметров состояния диапазоне температур от тройной точки до К и давлений до 100 МПа.
7. Посредством адаптации существующего метода построения УС, в основе которого лежит метод случайного поиска, разработана программа, позволяющая аналитически описать термодинамическую поверхность технически важных газов и жидкостей в широком интервале параметров состояния единым обобщенным фундаментальным уравнением состояния.
8. Разработано обобщенное фундаментальное УС н-алканов, описывающее безразмерную свободную энергию Гельмгольца в зависимости от приведенной температуры, приведенной плотности и фактора ацентричности Питцера. Разработанное УС позволяет рассчитывать все термодинамические свойства алканов от пентана до пентаконтана в диапазоне температуры от тройной точки до 700 К при давлениях до 100 МПа с погрешностью близкой к погрешности эксперимента и обеспечивает выполнение условий критической точки, правила Максвелла и правильные знаки производных термодинамического потенциала. В указанном диапазоне параметров уравнение не имеет аналогов в литературе.
Основные положения работы изложены в следующих публикациях:
1. Александров И.С. Энтальпия испарения и давление насыщенных паров налканов вблизи тройной точки / И.С. Александров, А.А. Герасимов // «Инновации в науке и образовании – 2008»: VI юбилейная международная научная конференция, посвященная 50-летию пребывания КГТУ на калининградской земле (21-23 окт.): труды, часть 1, КГТУ.- Калининград, 2008.С.179-181.
2. Александров И.С. Термические свойства нормального ундекана на линии насыщения / И.С. Александров, А.А. Герасимов // Инновации в науке и образовании –2009: VII международная научная конференция (20 – 22 октября): труды, часть 2 /КГТУ.- Калининград. 2009. С. 65-67.
3. Александров И.С. Термодинамические свойства этилбензола в диапазоне температур от тройной точки до 690 К при давлении до 100 МПа / И.С.
Александров // Инновации в науке и образовании – 2010: VIII международная научная конференция, посвященная 80-летию образования университета (19 – 21 октября): труды, часть 2 / КГТУ.- Калининград, 2010. С. 4. Александров И.С. Термические свойства ароматических углеводородов на линии насыщения / И.С. Александров, А.А. Герасимов // Известия КГТУ. – 2010. — №18. – С. 220-225.
5. Александров И.С. Энтальпия испарения и давление насыщенных паров налканов С5 – С18 вблизи тройной точки / И.С. Александров, А.А. Герасимов, Е.Б. Григорьев // Оборонный комплекс – научно-техническому прогрессу России. – 2010. — №4. – С. 56-61.
6. Александров И.С. Фундаментальное уравнение состояния этилбензола в диапазоне температур от тройной точки до начала термической диссоциации при давлениях до 100 МПа / И.С. Александров // Известия КГТУ. – 2011. — № 21. — С. 127-136.
7. Герасимов А.А. Термические свойства н-алканов С5 – С13 в диапазоне температуры от тройной точки до критической / А.А. Герасимов, И.С. Александров, Б.А. Григорьев, Е.Б. Григорьев, // Оборонный комплекс – научнотехническому прогрессу России. – 2011. — №. 1. – С. 43-57.
8. Александров И.С. Применение фундаментальных уравнений состояния для расчета термодинамических свойств нормального ундекана / И.С. Александров, А.А. Герасимов, Б.А. Григорьев // Теплоэнергетика. – 2011. — № 8.
– С. 67-74.
9. Григорьев Б.А. Моделирование термодинамических свойств и фазового поведения газовых конденсатов в пластовых условиях на базе фундаментальных многоконстантных уравнений состояния / Б.А. Григорьев, Г.А.
Ланчаков, А.А. Герасимов, И.С. Александров// Сборник научных статей.
Актуальные вопросы исследования пластовых систем месторождений углеводородов. Часть 2. / М.- «Газпром ВНИИГАЗ», 2011.
10. Александров И.С. Современный подход в разработке фундаментальных уравнений состояния технически важных рабочих веществ/ И.С. Александров, Б.А. Григорьев, А.А. Герасимов // Сборник научных статей. Актуальные вопросы исследования пластовых систем месторождений углеводородов. Часть 2. / М.- «Газпром ВНИИГАЗ», 2011 (в печати).
11. Gerasimov A.A. Fundamental equation of state and thermodynamic properties of cyclohexane in temperature range from 190 to 700 K and pressures up to MPa / A.A. Gerasimov, I.S. Alexandrov, B.A. Grigorev // 5-th International Conference of Physics of Liquid Matter: Modern Problems (May 21-24, 2010, Kyiv, Ukraine). Conference Book // Kyiv: Taras Shevchenko Kyiv National University, 2010. – P.3-2.O.
12. Александров И.С. Фундаментальные уравнения состояния о-м-пксилолов / И.С. Александров, Б. А. Григорьев, А.А. Герасимов // Оборонный комплекс – научно-техническому прогрессу России. – 2012 (принято в печать).




















© 2013 www.diss.seluk.ru — «Бесплатная электронная библиотека — Авторефераты, Диссертации, Монографии, Методички, учебные программы»
Материалы этого сайта размещены для ознакомления, все права принадлежат их авторам.
Если Вы не согласны с тем, что Ваш материал размещён на этом сайте, пожалуйста, напишите нам, мы в течении 1-2 рабочих дней удалим его.
http://poisk-ru.ru/s32782t11.html
http://diss.seluk.ru/av-fizika/701790-1-fundamentalnie-uravneniya-sostoyaniya-uglevodorodov-nefti.php