Добыча нефти и газа
Изучаем тонкости нефтегазового дела ВМЕСТЕ!
Уравнения состояния природных газов
Уравнением состояния называется аналитическая зависимость между термодинамическими параметрами, описывающими поведение вещества.
В качестве таких параметров используются: давление р, температура Т и плотность r.
Уравнение состояние совершенного газа
Определение совершенного газа. Совершенный газ — это газ в котором можно пренебречь объёмом молекул и взаимодействием их между собой
Подходы в описании уравнений состояния реальных газов:
· а) в уравнение совершенного газа вводится один коэффициент z, который учитывает отклонение данных газов от совершенного и называется коэффициентом сверхсжимаемости, а само модифицированное уравнение называют обобщённым газовым законом;
· в) получают эмпирические уравнения состояния с числом параметров больших двух.
Твердотопливные котлы в Украине котлы в Украине
Полное описание первых признаков и выраженных симптомов при гепатите В здесь
Контрольная работа: Основные свойства природных газов
| Название: Основные свойства природных газов Раздел: Рефераты по геологии Тип: контрольная работа Добавлен 18:23:16 30 декабря 2008 Похожие работы Просмотров: 2561 Комментариев: 20 Оценило: 3 человек Средний балл: 5 Оценка: неизвестно Скачать | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Свойства | Обозна чение | СН1 | С2 Н6 | С3 Н8 | i-С4 Н10 | n-С4 Н10 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| название | формула | ||
| метан | СН4 | 80 | 16,04 |
| этан | С2 Н6 | 7 | 30,07 |
| пропан | С3 Н8 | 3 | 44,1 |
| изобутан | С4 Н10 | 3 | 58,12 |
| Н-бутан | С4 Н10 | 1,5 | 58,12 |
| изопентан | С5 Н12 | 1 | 72,15 |
| Н-пентан | С5 Н12 | 0,4 | 72,15 |
| гексан | С6 Н14 | 2 | 86,18 |
| азот | N2 | 2,1 | 28,01 |
Плотность газовой смеси ρсм – масса m единицы объема V или отношение молекулярной массы М к объему моля Vм
ρсм = m / V = М / Vм =М / 22,4 кг/м 3
Молекулярная масса М – отношение массы молекулы вещества к 1/12 массы атома изотопа углерода 12 С.
Молекулярная масса природного газа (газовой смеси)

Мi – молекулярная масса i-того компонента смеси;
хi – объемное содержание i- того компонента.
Относительная плотность природного газа ρотн (по воздуху) – отношение плотности смеси ρсм к плотности воздуха ρв , взятых при одинаковых температуре и давлении (при стандартных условиях: t = 0 °С, Р = 0,1013 МПа):
При стандартных условиях ρв = 1,293 кг/м 3
Найдем общую молекулярную массу газовой смеси:
Ответ: ρсм = 0,991 кг/м 3 ; ρотн = 0,766 кг/м 3 .
Определить коэффициент сверхсжимаемости для газа.
Дано: состав газа
| Состав газа | формула | Объемное содержание хi , % | Критическая температура , К | Критическое давление , МПа | |
| Метан | СН4 | 62 | 191 | 4,58 | 8 |
| Этан | С2 Н6 | 15 | 305 | 4,86 | |
| Пропан | С3 Н8 | 10 | 370 | 4,34 | |
| Азот | N2 | 10 | 124,9 | 3,46 | |
| углекислота | CO2 | 3 | 304,1 | 7,50 |
Решение.
Коэффициент сверхсжимаемости реальных газов – это отношение объемов равного числа молей реального и идеального газов при одинаковых термобарических условиях:
Наиболее достоверные значения коэффициентов сверхсжимаемости получаются на основе лабораторных исследований пластовых проб газов. В случае отсутствия этих исследований прибегают к расчетному методу оценки по графику Г. Брауна. Для использования графика необходимо знать приведенное псевдокритическое давление Рпр и приведенную псевдокритическую температуру Тпр данного газа.
При известном компонентном составе рассчитывают псевдокритические (средние критические) давление и температуру:
Затем находят приведенные псевдокритические давление и температуру при данных давлении Р и температуре Т.
По кривым Р.Брауна (рис. 1) находим коэффициент сжимаемости Z , который составляет ≈ 0,78.
1. Гиматудинов Ш.К. Физика нефтяного и газового пласта. Изд. «Недра». М. 1971г.
2. Гиматудинов Ш.К., Ширковский А.И. Физика нефтяного и газового пласта. Изд. «Недра». М. 1982г.
3. Котяхов Ф.И. Физика нефтяного и газового коллектора. Изд. «Недра». М. 1997г.
4. Мирзаджанзаде А.Х., Аметов И.М., Ковалев А.Г. Физика нефтяного и газового пласта. Изд. «Недра». М. 1982г.
Уравнения состояния природных газов
СОСТАВ И ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА ПРИРОДНЫХ ГАЗОВ
Природные газы – это вещества, которые при нормальных (н.у.) и стандартных (с.у.) условиях являются газообразными. В зависимости от условий газы могут находиться в свободном, адсорбированном или растворённом состояниях.
В пластовых условиях газы в зависимости от их состава, давления и температуры (термобарического режима в пласте) могут находиться в различных агрегатных состояниях – газообразном, жидком, в виде газожидкостных смесей.
Свободный газ обычно расположен в повышенной части пласта и находится в газовой шапке. Если газовая шапка в нефтяной залежи отсутствует, то весь газ залежи растворён в нефти.
Давление, при котором имеющийся в залежи газ начинает выделяться из нефти, называется давлением насыщения. Давление насыщения нефти газом в пластовых условиях определяется составами, количеством нефти и газа, пластовой температурой.
Растворённый газ, по мере снижения давления при добыче, выделяется из нефти. Он называться попутным газом. В пластовых условиях все нефти содержат растворённый газ. Чем выше давление в пласте, тем больше газа может быть растворено в нефти. В 1 м 3 нефти содержание растворённого газа может достигать 1000 м 3 .
Состав природных газов
Природные газы, добываемые из газовых, газоконденсатных и нефтяных месторождений, состоят из углеводородов (УВ) метанового ряда СН4–С4Н10: метана, этана, пропана, изобутана и н-бутана, а также неуглеводородных компонентов: H2S, N2, CO, CO2, H2, Ar, He, Kr, Xe и других.
При нормальных и стандартных условиях термодинамически в газообразном состоянии существуют только УВ состава С1–С4. Углеводороды алканового ряда, начиная с пентана и выше, при этих условиях находятся в жидком состоянии, температуры кипения для изо-С5 равна 28 о С, а для н-С5 → 36 о С. Однако, в попутных газах иногда наблюдаются углеводороды С5 за счёт термобарических условий, фазовых переходов и других явлений.
Качественный состав газов нефтяного происхождения всегда одинаков (что нельзя сказать о газах вулканических извержений). Количественное распределение компонентов практически всегда различно.
Состав газовых смесей выражается в виде массовойилиобъемной концентрации компонентовв процентахи мольных долях.
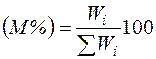
где Wi — масса i-го компонента; ΣWi — суммарная масса смеси.
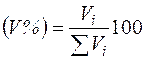
где Vi — объем i-го компонента в смеси; Σ Vi — суммарный объем газа.

где ni — число молей i-го компонента в смеси; Σпi — суммарное число молей газа в системе.
Зависимость между объемной и мольной концентрациями компонентов вытекает из закона Авогадро. Так как равные объемы любых газов при одинаковых температуре и давлении содержат одинаковое число молекул, то объем i-го компонента смеси будет пропорционален числу молей i-го компонента:
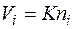
где К — коэффициент пропорциональности. Следовательно

т. е. концентрация компонента в процентах по молям (% мол.) в смеси газов при атмосферном давлении практически совпадает с объемной концентрацией этого компонента в процентах (% об.).
При высоких давлениях жидкие углеводороды растворяются в газовой фазе (газовые растворы, газоконденсаты). Поэтому при высоких давлениях плотность газа может приближаться к плотности легких углеводородных жидкостей.
В зависимости от преобладания в нефтяных газах легких (метан, этан) или тяжелых (пропан и выше) углеводородов газы разделяются на сухие и жирные.
Сухимгазом называют природный газ, который не содержит тяжелых углеводородов или содержит их в незначительных количествах.
Жирным газом называют газ, содержащий тяжелые углеводороды в таких количествах, когда из него целесообразно получать сжиженные газы или газовые бензины.
На практике принято считать жирным газом такой, в 1 м 3 которого содержится более 60г газового бензина.
Газы, добываемые из чисто газовых месторождений, содержат более 95 % метана (табл. 2.2) и представляют собой, так называемые, сухие газы.
| Месторождение | СН4 | С2Н6 | С3Н8 | С4Н10 | N2 | СО2 | Относит. плотность |
| Северо-Ставропольское | 98,9 | 0,29 | 0,16 | 0,05 | 0,4 | 0,2 | 0,56 |
| Уренгойское | 98,84 | 0,1 | 0,03 | 0,03 | 1,7 | 0,3 | 0,56 |
| Шатлыкское | 95,58 | 1,99 | 0,35 | 0,15 | 0,78 | 1,15 | 0,58 |
| Медвежье | 98,78 | 0,1 | 0,02 | – | 1,0 | 0,1 | 0,56 |
| Заполярное | 98,6 | 0,17 | 0,02 | 0,013 | 1,1 | 0,18 | 0,56 |
Тяжёлым нефтям свойственны сухиепопутные газы с преобладанием метана в их составе. Например, содержание метана в составе попутного газа Русского месторождения Западной Сибири (плотность нефти более 920 кг/м 3 ) аналогично содержанию метана в составе газа газового Уренгойского месторождения и составляет около 98,8 об. %.
Содержание метана в газах газоконденсатных месторождений колеблется в интервале 75–95 % (табл. 2.3). Попутный газ газоконденсатных месторождений и лёгких нефтей достаточно жирный.
| Месторождение | СН4 | С2Н6 | С3Н8 | С4Н10 | С5Н12 | N2 | СО2 | Отност. плотность |
| Вуктыльское | 74,80 | 8,70 | 3,90 | 1,80 | 6,40 | 4,30 | 0,10 | 0,882 |
| Оренбургское | 84,00 | 5,00 | 1,60 | 0,70 | 1,80 | 3,5 | 0,5 | 0,680 |
| Ямбургское | 89,67 | 4,39 | 1,64 | 0,74 | 2,36 | 0,26 | 0,94 | 0,713 |
| Уренгойское (БУ–8, БУ–14) | 88,28 | 5,29 | 2,42 | 1,00 | 2,52 | 0,48 | 0,01 | 0,707 |
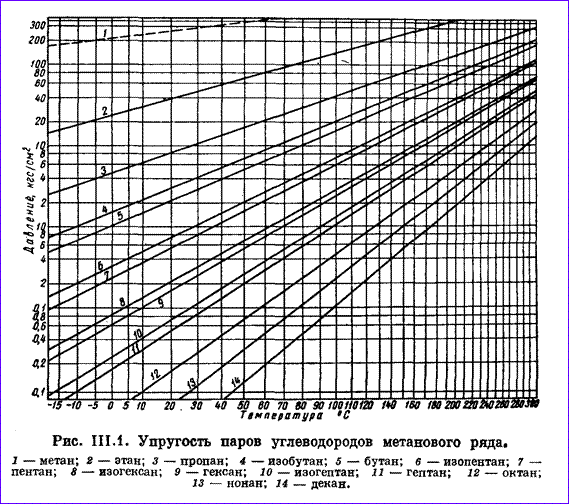
Газы, добываемые вместе с нефтью из нефтяных месторождений (попутные газы) представляют собой смесь метана, этана, пропан-бутановой фракции, газового бензина. При повышенном давлении углеводороды состава С3, С4 легко сжижаются. В пластовых условиях в газообразном состоянии находится практически один метан. При нормальных условиях углеводороды от метана СН4 до бутана С4Н10 находятся в газообразном состоянии. Остальные углеводороды при этих условиях — жидкости. Пропан и бутан при повышении давления легко переходят в жидкое состояние. Упругость насыщенных паров углеводородов, т. е. то давление, при котором газ начинает конденсироваться и переходить в жидкое состояние, повышается с ростом температуры и она тем выше, чем ниже плотность углеводорода. Упругость пара — нелинейная функция температуры. Графики на рис. 2.9 построены так, чтобы получить линейную зависимость между упругостью паров углеводородов и температурой: шкала упругости пара принята логарифмической, а температурная шкала (в °С) принята произвольной.
Удобство таких графиков заключается в том, что они позволяют легко и быстро определять по известной упругости пара при некоторой температуре упругость его паров при других температурах. Для этого проводят прямую линию через, известную точку и общую точку пересечения прямых упругостей паров (находящуюся вне графика на продолжении правой верхней части диаграммы).
Из рис. 2.9 следует, что давление паров метана наибольшее; при нормальных условиях его нельзя превратить в жидкость (пунктирная линия 1 давления ненасыщенного пара метана), так как его критическая температура t = -82,95° С. Давление насыщенных паров других углеводородов намного ниже. Например, бутан при t = — 20° С имеет упругость паров, равную 0,22 Мн/м 2 (2,2 кГ/см 2 ).
К расчёту физико-химических свойств газа как многокомпонентной смеси можно применять принцип аддитивности.
Аддитивный подход к расчёту физико-химических и технологических параметров означает, что каждый компонент газа в смеси ведёт себя так, как если бы он в данной смеси был один.
Следовательно, для оценки макроскопических свойств нефтяного газа (при н.у. и с.у.) применимы аддитивные методы расчётов физико-химических и технологических параметров (Псмеси):

где где Ni – мольная доля; gi – весовая доля; Vi – объёмная доля; Пi – физико-химическое свойство i-го компонента.
Для идеальных газов общее давление в системе (смеси газов) равно сумме парциальных давлений компонентов (закон Дальтона):

где Р – общее давление смеси газов; рi – парциальное давление i-го компонента в смеси. Откуда
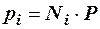

То есть, парциальное давление компонента в газовой смеси равно произведению его молярной доли на общее давление смеси газов.
Аддитивность парциальных объёмов (Vi) компонентов газовой смеси выражается законом Амага:

где V – общий объём смеси газов; Vi – мольный объём i-го компонента газа в смеси.
По аналогии с уравнениями (2.22–2.23) мольный объём компонента в газе можно оценить:

Как аддитивные величины рассчитывают все физико-химические свойства газа, например, плотность смеси газов:
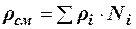
где ρi – плотность i–го компонента; Ni – мольная доля i–го компонента.
Уравнения состояния природных газов
Наука о веществе основывается на современных знаниях об атомах – мельчайших частицах элементов и молекулах – мельчайших частицах химических соединений. Атомы имеют размер порядка 10
8 см (одного ангстрема). Крупные молекулы, содержащие тысячи атомов, имеют размер около 10
6 см. Характер движения молекул и атомов, их взаимодействие определяют, в каком агрегатном состоянии находится вещество – в твердом, жидком или газообразном.
Молекулы могут совершать поступательное, вращательное и колебательное движение. Если вещество находится в газообразном или жидком состоянии, то возможны все три вида этих движений. Если же вещество затвердевает, преобладающей формой движения молекул и атомов становятся колебания.
При изучении состояния вещества стремятся найти взаимосвязь между давлением, при котором находится вещество, его плотностью и температурой. Если обозначить давление p, плотность ρ, а обратную ей величину – удельный объем вещества V и температуру Т, то состояние вещества будет характеризоваться соотношением р, V и Т или, как принято в термодинамике, 
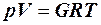

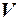

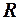

Газовая постоянная численно равна работе расширения 1 кг идеального газа в изобарическом процессе при увеличении температуры газа на 1 К.
При высоком сжатии газа его параметры уже не будут описываться уравнением состояния идеального газа. Ван-дер-Ваальсом были введены в уравнение состояния идеального газа (2.27) поправки: величина b, учитывающая объем самих молекул, и величина a/v 2 , учитывающая взаимодействие между молекулами. В результате было получено уравнение состояния «реального газа» (уравнение Ван-дер-Ваальса) в следующем виде:

Сложность применения уравнения (2.28) для практических расчетов заключается в том, что в газонефтепромысловом деле встречаются, как правило, смеси газов, для которых уравнение Ван-дер-Ваальса применимо с трудом.
Хорошее согласование с экспериментальными данными для газов, плотность которых не превышает двух третей от плотности газа при критических условиях, получают по уравнению Битти-Бриджмена
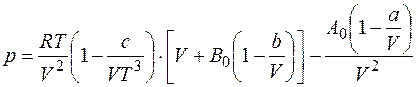
где а, Ь, с, Ао и Во — постоянные для данных компонентов природного газа, которые вычисляются на основании экспериментальных данных.
Коэффициент сверхсжимаемости. При большом числе компонентов расчеты по приведенным формулам становятся трудоемкими. Поэтому для расчета состояния реальных газов обычно пользуются обобщенным газовым законом в виде уравнения Клапейрона, в которое вводится поправка (коэффициент сверхсжимаемости), учитывающая отклонение реальных газов от законов сжатия и расширения идеальных газов.

где z – коэффициент сверхсжимаемости; 
Характер изменения коэффициента сверхсжимаемости z, который показывает отношение объема реального газа к объему идеального при одних и тех же условиях, с изменением температуры и давления можно установить, учитывая отличия реальных газов от идеальных. В последних молекулы занимают незначительный объем (по сравнению с объемом газа) и не испытывают сил притяжения друг к другу. Молекулы же реальных газов обладают определенными размерами, массой и взаимодействуют друг с другом. Поэтому реальный газ приближается к идеальным при низких давлениях, когда число молекул в единице объема невелико. Следовательно, при низких давлениях величина коэффициента сжимаемости должна быть близка к единице. С повышением давления молекулы газа сближаются и силы притяжения между молекулами начинают помогать внешним силам, сжимающим газ. Вследствие этого реальные газы должны сжиматься сильнее, чем при тех же условиях сжимаются идеальные газы. Следовательно, с ростом давления коэффициент сжимаемости z должен вначале уменьшаться. Когда углеводородный газ сжат до такой степени, что он приближается по свойствам к жидкостям, межмолекулярные расстояния уменьшаются настолько, что начинают проявляться взаимоотталкивающие силы между молекулами, препятствующие дальнейшему уменьшению объема газа. В этих условиях углеводородный газ должен сжиматься меньше, чем при малых давлениях, т. е. значения z вновь возрастают при увеличении давления.
С приближением давления и температуры к их критическим значениям свойства газовой и жидких фаз становятся одинаковыми, поверхность раздела между ними исчезает и плотности их уравниваются.
Критическая температура (Ткр) – максимальная температура, при которой газ и жидкость могут ещё сосуществовать в равновесии (табл. 2.4).
Критическое давление – давление паров вещества при критической температуре (табл. 2.3), а объём вещества при данных Ткр и pкр, отнесённый к 1 молю или к единице массы вещества, называется критическим удельным объёмом.
Упругость насыщенных паров углеводородов, это давление, при котором газ начинает конденсироваться и переходить в жидкое состояние, повышается с ростом температуры и она тем выше, чем ниже плотность углеводорода.
Таблица 2.4 Критические давления и температуры компонентов нефтяных газов
| № п./п. | Компонент | Относит. моляр. масса | РКРi, МПа | ТКРi, К |
| Метан, СН4 | 16,04 | 4,63 | 190,55 | |
| Этан, С2Н6 | 30,07 | 4,87 | 305,45 | |
| Пропан, С3Н8 | 44,09 | 4,26 | 369,82 | |
| изо-Бутан, i-С4Н10 | 58,12 | 3,65 | 408,13 | |
| н-Бутан, n-С4Н10 | 58,12 | 3,797 | 425,16 | |
| изо-Пентан, i-С5Н12 | 72,15 | 3,381 | 460,4 | |
| н-Пентан, n-С5Н12 | 72,15 | 3,369 | 469,6 | |
| н-Гексан, С6Н14 | 86,17 | 3,031 | 507,4 | |
| н-Гептан, С7Н16 | 100,20 | 2,736 | 640,61 | |
| Азот, N2 | 28,02 | 3,399 | 126,25 | |
| Двуокись углерода, СО2 | 44,01 | 7,387 | 304,15 | |
| Сероводород, Н2S | 34,08 | 9,01 | 373,55 |
Приведенные параметры газов.Коэффициент сжимаемости газов z, обычно определяют по экспериментальным графикам. Чтобы избежать построения графиков для каждого газа или их смесей, на основе экспериментальных данных составлен график изменения коэффициента z в зависимости от приведенной температуры и приведенного давления для метана (рис.2.2), который на основании закона соответственных состояний с достаточной точностью может быть использован для определения z, всех газов, состоящих на 95—96% из метана. Коэффициенты сжимаемости на этом графике поставлены в зависимость от приведенного давления p пр и приведенной температуры Tпр, которые определяются по формулам
 |  |
где р и Т — давление и температура газа; рКрi и Tкрi — критические давление и абсолютная температура i-го компонента; 
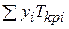

Таким образом, рпр и Tпр выражают давление и абсолютную температуру в долях от соответствующих критических величин.
http://www.bestreferat.ru/referat-178271.html
http://poisk-ru.ru/s32782t11.html


 ,
, ,
, ,
, ;
;  ;
;