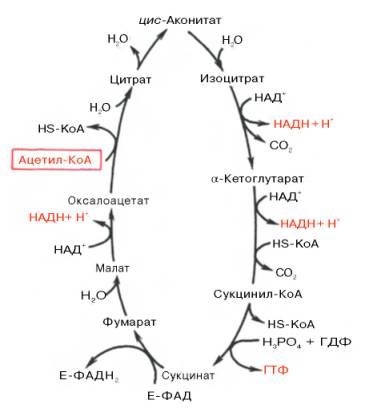
Цикл трикарбоновых кислот Кребса реакции (Схема)
Цикл трикарбоновых кислот (Цикл Кребса или цикл лимонной кислоты) — центральный процесс метаболизма. Суть процесса состоит в том, что первоначально пировиноградная кислота соединяется со сложным органическим веществом — коэнзимом А. При этом сразу отщепляется СО2, образуется НАД • Н и комплекс СН3СО—5—коэнзим А (ацетил-коэнзим А). Этот комплекс реагирует со щавелево-уксусной кислотой с образованием кислоты лимонной. Коэнзим А освобождается, а лимонная кислота подвергается последовательным превращениям в цикле Кребса (8 реакций). При этом получается 2 молекулы СО2, восстанавливается молекула щавелево-уксусной кислоты, а выделяющаяся энергия запасается в виде АТФ. В пересчете на одну молекулу глюкозы энергетический выход цикла Кребса составляет 30 молекул АТФ. Таким образом, суммарный энергетический выход всего процесса дыхания составляет 38 молекул АТФ на одну молекулу глюкозы. Часть образующейся энергии выделяется в виде тепла (44,6%). Цикл Кребса идет только в присутствии необходимого количества кислорода. Этот цикл открыл Г. Кребс, за которое он в 1953 году получил Нобелевскую премию.
Схема цикл трикарбоновых кислот, цикл Кребса
ATP (АТФ) — это аденозинтрифосфорная кислота, универсальный источник и переносчик энергии
NAD (НАД) — никотинамидадениндинуклеотидфосфата, кофермент
NADH (НАД•Н) — востановленная форма NAD
Ацетил-КоА — сложное органическое вещество ацетил-коэнзим А (СН3СО—S)
Пируват — это соли пировиноградной кислоты
Таблица реакции цикла трикарбоновых кислот Кребса
Цикл Кребса это аэробный процесс (проходит с участием кислорода) и состоит из восьми стадий (процессов).
Реакции цикла трикарбоновых кислот (цикла Кребса)
Описание и ход реакция цикла
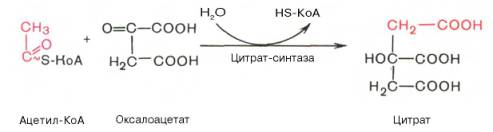
Конденсация ацетил-КоА с оксалоацетатом
Конденсация ацетил-СоА с оксалоацетатом, в результате чего образуется цитрат (лимонная кислота), а кофермент А освобождается. Реакция катализируется цитратсинтазой, которая является одним из регуляторных ферментов, лимитирующих скорость цикла Кребса.
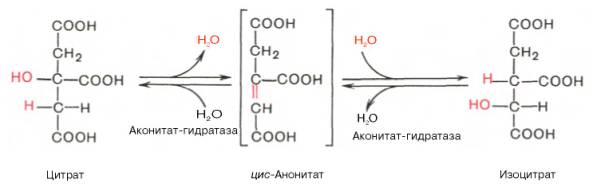
Изомеризация цитрата в изоцитрат
Превращение цитрата в изоцитрат (изолимонная кислота) с участием аконитат-гидратазы (сложного фермента, содержащего Fe 2+ и кислотолабильные атомы серы, образующие железо-серные центры) через промежуточную стадию цис-аконитата, связанного с ферментом.
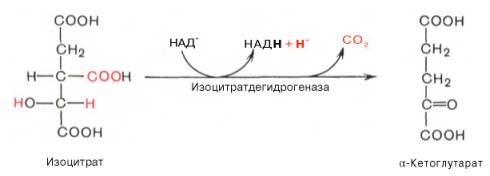
Окислительное декарбоксилирование изоцитрата
Дегидрирование (так называется удаление из молекулы атомов водорода) цитрата с образованием a-кетоглутарата и СO2 при участии изоцитратдегидрогеназы, которая функционирует при наличии Mg 2+ и Мn 2+ .
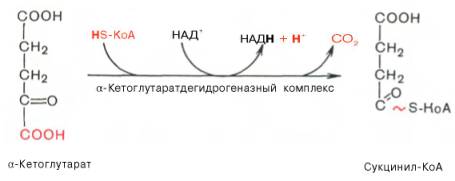
Окислительное декарбоксилирование а-кетоглутарата
Реакция окислительного декарбоксилирования a-кетоглутарата до высокоэнергетического сукцинил-СоА. Реакция катализируется a-кетоглутаратдегидрогеназным комплексом (Mg 2+ ), который похож на пируватдегидрогеназный комплекс.
коферменты: ТПФ, липоевая кислота, ФАД, HS-KoA, НАД+
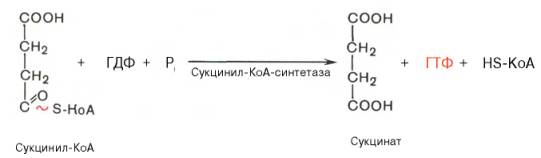
На этом этапе цикла Кребса происходит превращение сукцинил-СоА под влиянием сукцинил-СоА-синтетазы в сукцинат (янтарная кислота) с отщеплением СоА. Эта реакция сопряжена с образованием гуанозинтрифосфата (GTP) из GDP и фосфата и также катализируется указанным ферментом.
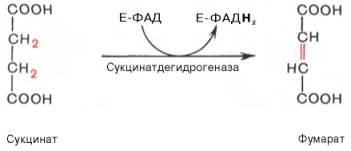
Катализируемое сукцинатдегидрогеназой, содержащей ковалентно связанный FAD и два железо-серных центра, дегидрирование сукцината с образованием фумарата (фумаровая кислота).
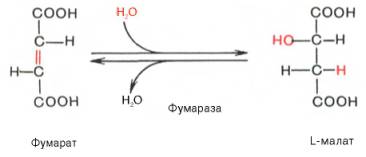
Эта реакция цикла трикарбоновых кислот представляет обратимую гидратацию фумарата с образованием L-малата (яблочная кислота), катализируемая фумарат-гидратазой или фумаразой.
Катализируемое NAD-зависимой L-малатдегидрогеназой дегидрирование L-малата с образованием оксалоацетата. Эта реакция замыкает цикл Кребса и поставляет оксалоацетат (щавелевоянтарная кислота) для нового цикла. Большинство реакций цикла Кребса обратимы.
_______________
Источник информации:
1. Биология для поступающих в вузы / Г.Л. Билич, В.А. Крыжановский. — 2008.
2. Биохимия в схемах и таблицах / И. В. Семак — Минск — 2011.
ЦИКЛ ТРИКАРБОНОВЫХ КИСЛОТ (ЦИКЛ КРЕБСА)
Цикл трикарбоновых кислот впервые был открыт английским биохимиком Г. Кребсом. Он первым постулировал значение данного цикла для полного сгорания пирувата, главным источником которого является гликолитическое превращение углеводов. В дальнейшем было показано, что цикл трикарбо-новых кислот является тем центром, в котором сходятся практически все метаболические пути. Таким образом, цикл Кребса – общий конечный путь окисления ацетильных групп (в виде ацетил-КоА), в которые превращается в процессе катаболизма большая часть органических молекул, играющих роль «клеточного топлива»: углеводов, жирных кислот и аминокислот.
Образовавшийся в результате окислительного декарбоксилирования пирувата в митохондриях ацетил-КоА вступает в цикл Кребса. Данный цикл происходит в матриксе митохондрий и состоит из восьми последовательных реакций (рис. 10.9). Начинается цикл с присоединения ацетил-КоА к оксалоацетату и образования лимонной кислоты (цитрата). Затем лимонная кислота (шестиуглеродное соединение) путем ряда дегидрирований (отнятие водорода) и двух декарбоксилирований (отщепление СО2) теряет два углеродных атома и снова в цикле Кребса превращается в оксалоацетат (четырехуглеродное соединение), т.е. в результате полного оборота цикла одна молекула ацетил-КоА сгорает до СО2 и Н2О, а молекула окса-лоацетата регенерируется. Рассмотрим все восемь последовательных реакций (этапов) цикла Кребса.
Первая реакция катализируется ферментом цит-рат-синтазой, при этом ацетильная группа ацетил-КоА конденсируется с оксалоацетатом, в результате чего образуется лимонная кислота:
По-видимому, в данной реакции в качестве промежуточного продукта образуется связанный с ферментом цитрил-КоА. Затем последний самопроизвольно и необратимо гидролизуется с образованием цитрата и HS-KoA.
В результате второй реакции образовавшаяся лимонная кислота подвергается дегидратированию с образованием цис-аконитовой кислоты, которая, присоединяя молекулу воды, переходит в изолимонную кислоту (изоцитрат). Катализирует эти обратимые реакции гидратации–дегидратации фермент аконитатгидратаза (аконитаза). В результате происходит взаимоперемещение Н и ОН в молекуле цитрата:
Третья реакция, по-видимому, лимитирует скорость цикла Кребса. Изолимонная кислота дегидрируется в присутствии НАД-зависимой изо-цитратдегидрогеназы.
В ходе изоцитратдегидрогеназной реакции изолимонная кислота одновременно декарбоксилируется. НАД-зависимая изоцитратдегидрогеназа является аллостерическим ферментом, которому в качестве специфического активатора необходим АДФ. Кроме того, фермент для проявления своей активности нуждается в ионах Mg 2+ или Мn 2+ .
Во время четвертой реакции происходит окислительное декарбокси-лирование α-кетоглутаровой кислоты с образованием высокоэнергетического соединения сукцинил-КоА. Механизм этой реакции сходен с таковым реакции окислительного декарбоксилирования пирувата до ацетил-КоА, α-кетоглутаратдегидрогеназный комплекс напоминает по своей структуре пируватдегидрогеназный комплекс. Как в одном, так и в другом случае в реакции принимают участие 5 коферментов: ТПФ, амид липоевой кислоты, HS-KoA, ФАД и НАД + .
Пятая реакция катализируется ферментом сукцинил-КоА-синтета-зой. В ходе этой реакции сукцинил-КоА при участии ГТФ и неорганического фосфата превращается в янтарную кислоту (сукцинат). Одновременно происходит образование высокоэргической фосфатной связи ГТФ за счет высокоэргической тиоэфирной связи сукцинил-КоА:
В результате шестой реакции сукцинат дегидрируется в фумаровую кислоту. Окисление сукцината катализируется сукцинатдегидрогеназой, в молекуле которой с белком прочно (ковалентно) связан кофермент ФАД. В свою очередь сукцинатдегидрогеназа прочно связана с внутренней ми-тохондриальной мембраной:
Седьмая реакция осуществляется под влиянием фермента фума-ратгидратазы (фумаразы). Образовавшаяся при этом фумаровая кислота гидратируется, продуктом реакции является яблочная кислота (малат). Следует отметить, что фумаратгидратаза обладает стереоспецифичностью (см. главу 4) – в ходе реакции образуется L-яблочная кислота:
Наконец, в ходе восьмой реакции цикла трикарбоновых кислот под влиянием митохондриальной НАД-зависимой малатдегидрогеназы происходит окисление L-малата в оксалоацетат:
Как видно, за один оборот цикла, состоящего из восьми ферментативных реакций, происходит полное окисление («сгорание») одной молекулы ацетил-КоА. Для непрерывной работы цикла необходимо постоянное поступление в систему ацетил-КоА, а коферменты (НАД + и ФАД), перешедшие в восстановленное состояние, должны снова и снова окисляться. Это окисление осуществляется в системе переносчиков электронов в дыхательной цепи (в цепи дыхательных ферментов), локализованной в мембране митохондрий. Образовавшийся ФАДН2 прочно связан с СДГ, поэтому он передает атомы водорода через KoQ. Освобождающаяся в результате окисления ацетил-КоА энергия в значительной мере сосредоточивается в макроэргических фосфатных связях АТФ. Из 4 пар атомов водорода 3 пары переносят НАДН на систему транспорта электронов; при этом в расчете на каждую пару в системе биологического окисления образуется 3 молекулы АТФ (в процессе сопряженного окислительного фосфорилирования), а всего, следовательно, 9 молекул АТФ (см. главу 9). Одна пара атомов от сукцинатдегидрогеназы-ФАДН2 попадает в систему транспорта электронов через KoQ, в результате образуется только 2 молекулы АТФ. В ходе цикла Кребса синтезируется также одна молекула ГТФ (субстратное фосфорилирование), что равносильно одной молекуле АТФ. Итак, при окислении одной молекулы ацетил-КоА в цикле Кребса и системе окислительного фосфорилирования может образоваться 12 молекул АТФ.
Если подсчитать полный энергетический эффект гликолитического расщепления глюкозы и последующего окисления двух образовавшихся молекул пирувата до СО2 и Н2О, то он окажется значительно большим.
Как отмечалось, одна молекула НАДН (3 молекулы АТФ) образуется при окислительном декарбоксилировании пирувата в ацетил-КоА. При расщеплении одной молекулы глюкозы образуется 2 молекулы пирувата, а при окислении их до 2 молекул ацетил-КоА и последующих 2 оборотов цикла трикарбоновых кислот синтезируется 30 молекул АТФ (следовательно, окисление молекулы пирувата до СО2 и Н2О дает 15 молекул АТФ). К этому количеству надо добавить 2 молекулы АТФ, образующиеся при аэробном гликолизе, и 6 молекул АТФ, синтезирующихся за счет окисления 2 молекул внемитохондриального НАДН, которые образуются при окислении 2 молекул глицеральдегид-3-фосфата в дегидрогеназной реакции гликолиза. Следовательно, при расщеплении в тканях одной молекулы глюкозы по уравнению С6Н12О6 + 6О2 —> 6СО2 + 6Н2О синтезируется 38 молекул АТФ. Несомненно, что в энергетическом отношении полное расщепление глюкозы является более эффективным процессом, чем анаэробный гликолиз.
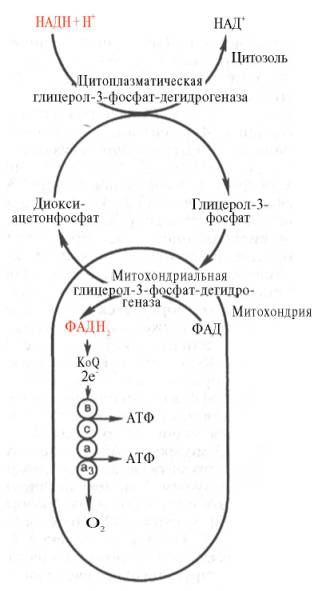
Необходимо отметить, что образовавшиеся в процессе превращения глицеральдегид-3-фосфата 2 молекулы НАДН в дальнейшем при окислении могут давать не 6 молекул АТФ, а только 4. Дело в том, что сами молекулы внемитохондриального НАДН не способны проникать через мембрану внутрь митохондрий. Однако отдаваемые ими электроны могут включаться в митохондриальную цепь биологического окисления с помощью так называемого глицеролфосфатного челночного механизма (рис. 10.10). Ци-топлазматический НАДН сначала реагирует с цитоплазматическим ди-гидроксиацетонфосфатом, образуя глицерол-3-фосфат. Реакция катализи-
Рис. 10.10. Глицеролфосфатный челночный механизм. Объяснение в тексте.
руется НАД-зависимой цитоплазматической глицерол-3-фосфат-дегидроге-назой:
Дигидроксиацетонфосфат + НАДН + Н + Глицерол-3-фосфат + НАД + .
Образовавшийся глицерол-3-фосфат легко проникает через митохонд-риальную мембрану. Внутри митохондрии другая (митохондриальная) глицерол-3-фосфат-дегидрогеназа (флавиновый фермент) снова окисляет глицерол-3-фосфат до диоксиацетонфосфата:
Глицерол-3-фосфат + ФАД Диоксиацетонфосфат + ФАДН2.
Восстановленный флавопротеин (фермент-ФАДН2) вводит на уровне KoQ приобретенные им электроны в цепь биологического окисления и сопряженного с ним окислительного фосфорилирования, а диоксиаце-тонфосфат выходит из митохондрий в цитоплазму и может вновь взаимодействовать с цитоплазматическим НАДН + Н + . Таким образом, пара электронов (из одной молекулы цитоплазматического НАДН + Н + ), вводимая в дыхательную цепь с помощью глицеролфосфатного челночного механизма, дает не 3, а 2 АТФ.
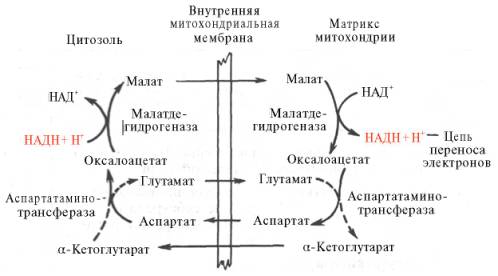
Рис. 10.11. Малат-аспартатная челночная система для переноса восстанавливающих эквивалентов от цитозольного НАДН в митохондриальный матрикс. Объяснение в тексте.
В дальнейшем было показано, что с помощью данного челночного механизма лишь в скелетных мышцах и мозге осуществляется перенос восстановленных эквивалентов от цитозольного НАДН + Н + в митохондрии.
В клетках печени, почек и сердца действует более сложная малат-ас-партатная челночная система. Действие такого челночного механизма становится возможным благодаря присутствию малатдегидрогеназы и ас-партатаминотрансферазы как в цитозоле, так и в митохондриях.
Установлено, что от цитозольного НАДН + Н + восстановленные эквиваленты сначала при участии фермента малатдегидрогеназы (рис. 10.11) переносятся на цитозольный оксалоацетат. В результате образуется малат, который с помощью системы, транспортирующей дикарбоновые кислоты, проходит через внутреннюю мембрану митохондрии в матрикс. Здесь малат окисляется в оксалоацетат, а матриксный НАД + восстанавливается в НАДН + Н + , который может теперь передавать свои электроны в цепь дыхательных ферментов, локализованную на внутренней мембране митохондрии. В свою очередь образовавшийся оксалоацетат в присутствии глутамата и фермента АсАТ вступает в реакцию трансаминирования. Образующиеся аспарат и α-кетоглутарат с помощью специальных транспортных систем способны проходить через мембрану митохондрий.
Транспортирование в цитозоле регенерирует оксалоацетат, что вызывает к действию следующий цикл. В целом процесс включает легкообратимые реакции, происходит без потребления энергии, «движущей силой» его является постоянное восстановление НАД + в цитозоле гли-церальдегид-3-фосфатом, образующимся при катаболизме глюкозы.
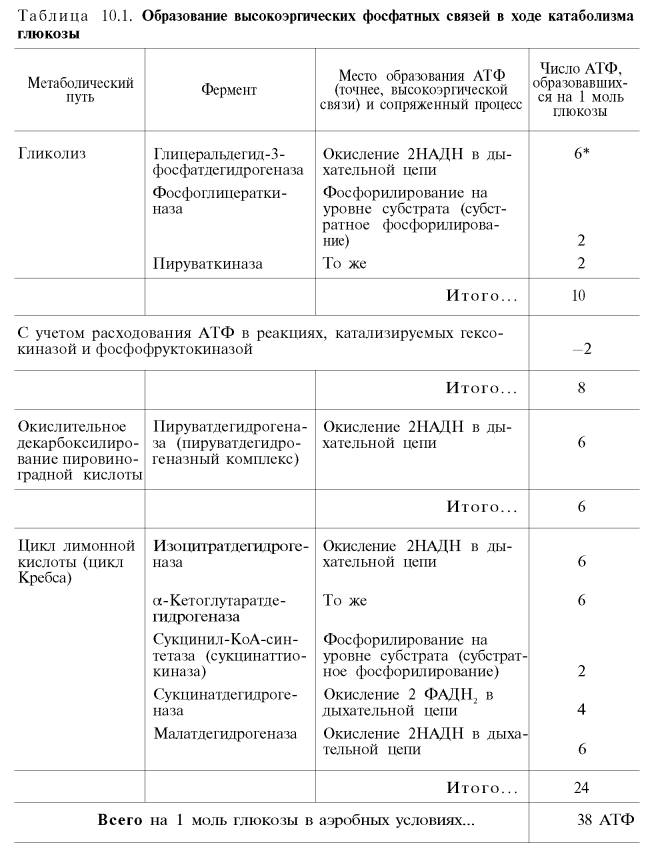
Итак, если функционирует малат-аспартатный механизм, то в результате полного окисления одной молекулы глюкозы может образоваться не 36, а 38 молекул АТФ (табл. 10.1).
В табл. 10.1 приведены реакции, в которых происходит образование высокоэргических фосфатных связей в ходе катаболизма глюкозы, с указанием эффективности процесса в аэробных и анаэробных условиях.
Гликолиз и его субстраты
Гликолиз — это катаболизм глюкозы до двух молекул пировиноградной кислоты. Не слишком понятное определение, но сейчас попытаемся прояснить его.
Катаболизм — это окисление молекулы до более простой/простых с выделением энергии. Наша молекула — глюкоза. А энергия выделяется в виде АТФ и тепла. В химических связях глюкозы запасено много энергии, которая может быть использована организмом. Если мы будем окислять глюкозу до талого, то получим углекислый газ и воду. И кучу энергии! Но это нужно сделать с умом.
Представьте, что мы просто спалим глюкозу в один этап. Так мы получим углекислый газ и воду, да ещё вот такое количество энергии. Это горение молекулы.
В нашем организме такой реакции нет. Это экзотермическая реакция. В ней вся энергия выделяется в виде тепла, а не идёт на синтез полезной батарейки — молекулы АТФ. Если бы так было в организме, то вряд ли наши клетки долго прожили. У них бы быстро случилось профессиональное выгорание.
Организм делает умнее и удобнее. Он постепенно окисляет молекулу глюкозы до углекислого газа и воды — делит окисление на несколько стадий. А стадии делит на реакции. Так молекула глюкозы окисляется до промежуточных продуктов. В ходе этого выделяется энергия, которая запасается в виде АТФ. Часть энергии рассеивается — выделяется тепло.
Весь этот процесс называется катаболизмом глюкозы. Он состоит из гликолиза и общего пути катаболизма.
Гликолиз это первая стадия катаболизма. В ходе него выделяется немного энергии в виде АТФ, но что важнее — мы получаем две молекулы пирувата. Пируват та же пировиноградная кислота. Просто в растворе кислота диссоциирует, а название её иона — пируват.
Почему пируват, а не другая молекула?
Наш организм получает энергию из белков, жиров и углеводов. Можно подумать, что для каждого класса молекул существует отдельный способ вытащить из него энергию. Но это не так. Зачем делать печку для каждого вида дров, если можно сделать одну общую для всех? Таким вопросом задались клетки нашего организма и решили, что лучше сделать одну печь. Эта печь — общий путь катаболизма.
Общий путь катаболизма включает превращение пирувата в ацетил-коэнзим А, цикл трикарбоновых кислот и окислительное фосфорилирование. Видите? Он начинается с пирувата. Потому что:
Пируват объединяет катаболизм белков, жиров и углеводов.
Клетки умнее, чем кажутся. Они решили, что можно сделать не только одну печь, но и один вид дров. Они окисляют белки, жиры и углеводы до одной молекулы — ацетил-коэнзим А. И пируват — это его предшественник. Их отделяет всего одна реакция, поэтому если мы посмотрим на все виды обмена, то увидим такое.
В ходе общего пути катаболизма образуется огромное количество молекул АТФ. Куда больше, чем при гликолизе.
Теперь мы поняли, что гликолиз — это первый этап катаболизма глюкозы. В ходе него образуется немного энергии в виде АТФ. Но что важнее — гликолиз готовит дрова для печи. Или пируват для общего пути катаболизма, как тебе больше нравится.
Гликолиз — это первый этап катаболизма глюкозы
У гликолиза есть и другое название — дихотомическое расщепление глюкозы. Это название заключает главный смысл гликолиза: в ходе него происходит деление молекулы глюкозы надвое.
Этапы гликолиза
Гликолиз идёт в цитоплазме всех клеток нашего организма. Прочитай это ещё раз. Он состоит из двух этапов: подготовительного и энергетического. Мне кажется, что подготовительный этап можно разделить на два шага. Так будет удобнее для понимания.
- Первый шаг. Глюкоза фосфорилируется с затратами двух молекул АТФ — образуется фруктозо-1,6-бисфосфат.
- Второй шаг. Расщепление фруктозо-1,6-бисфосфата с образованием двух молекул фосфотриоз.
На энергетическом этапе из каждой фосфотриозы образуется пируват. На этом этапе образуются 4 молекулы АТФ и 2 молекулы НАДH.
Кажется, что я вас слишком быстро окунул в тему. Не бойтесь, дальше всё будет понятнее. Если что, то нам даже не придётся зубрить все десять реакций. Да-да, их всего десять. Мы выведем всё логически. Нам нужно знать только формулу молекулы глюкозы и пирувата. С чего начинаем и к чему идём. В глюкозе шесть атомов углерода, а в пирувате всего три. Поэтому сначала нужно превратить глюкозу (гексозу) в триозу. За этим и нужен подготовительный этап.
У большинства ферментов название будет по субстратам. Знаем субстрат и продукт реакции — можем назвать фермент. Если хорошо знаем их классы.
Подготовительный этап гликолиза
В нём пять реакций. В процессе поймёте, почему лучше разделить его на два шага.
Первый шаг подготовительного этапа
Наша задача на этом шаге — получить фруктозо-1,6-фосфат.
Первая реакция. Мы начинаем с глюкозы. Она попадает в клетку с помощью глюкозного транспортёра (ГЛЮТ). Проблема в том, что этот транспортёр работает в обе стороны. ГЛЮТ может загонять глюкозу в клетку, а может выкидывать её. Всё зависит от градиента концентрации между кровью и клеткой. Так не пойдёт!
Ещё нам нужно увеличить реакционную способность глюкозы, потому что ей дальше придётся вступать в реакции. Убьём двух зайцев с помощью фосфорилирования! Для этого нам понадобится фермент — гексокиназа/глюкокиназа и молекула АТФ. Глюкокиназа действует в печени, а гексокиназа в других тканях — это изоферменты. Между ними есть отличия, о которых можно прочитать здесь.
В ходе реакции мы получаем глюкозо-6-фосфат. У него больше реакционная способность, чем у глюкозы. А ещё он не может вылететь из клетки — для него нет переносчика в клеточной мембране. Мы загнали глюкозу в ловушку и сделали её менее стабильной.
Для этой реакции нужен кофактор — ион магния. У АТФ огромный отрицательный заряд -4. Из-за этого её трудно загнать в активный центр фермента. Но при присоединении магния заряд уменьшается до -2. Теперь ей легче попасть в активный центр.
Эта реакция необратима, потому что мы затратили энергию макроэргической связи АТФ.
Вторая реакция. Мы превратим глюкозо-6-фосфат в фруктозо-6-фосфат. Зачем? Это пока секрет, но доверьтесь мне — дальше всё станет ясно! Фосфогексоизомераза катализирует эту реакцию.
Реакция идёт в несколько этапов. Сначала фосфогексоизомераза раскрывает циклическую форму глюкозо-6-фосфата — переводит его в линейную. Далее образуется линейная форма фруктозо-6-фосфата. Линейная форма фруктозо-6-фосфата быстро переходит циклическую. Такая форма более стабильна.
Эта реакция обратима
Третья реакция. Из-за того, что прошлая реакция обратима, мы можем опять получить глюкозо-6-фосфат. А он отправится на другие процессы — пентозофосфатный путь, синтез гликогена и всё такое. Нужно закрепить наш успех — отделить молекулу от других процессов. Прицепим ещё одну фосфатную группу к молекуле. Для этого нужна киназа — фосфофруктокиназа — и молекула АТФ. Получаем фруктозо-1,6-бисфосфат.
Клетка опять убила двух зайцев. Отделила гликолиз от других процессов через необратимую реакцию фосфорилирования. И увеличила реакционную способность молекулы. На фруктозо-1,6-бисфосфате суммарный заряд -4. Это слишком много — такая молекула не сможет долго оставаться без изменений.
Этим заканчивается первый шаг подготовительного этапа. В нём произошло несколько важных вещей. Клетка поймала глюкозу в ловушку — теперь она не сможет пройти через биологическую мембрану. С помощью образования фруктозо-1,6-бисфосфата гликолиз отделился от других клеточных процессов. Клетка увеличила реакционную способность глюкозы, превратив её в нестабильный фруктозо-1,6-бисфосфат. На эти важные процессы клетка не поскупилась и потратила две молекулы АТФ.
Как-то даже парадоксально: клетка хочет получить энергию, но при этом тратит её.
Второй шаг подготовительного этапа
Наша задача на этом шаге — получить фосфотриозы.
Четвёртая реакция. Начнём двигаться к образованию пирувата. А в нём все-таки три углеродных атома, а не шесть. Для этого расщепим фруктозо-1,6-бисфосфат с помощью фермента альдолазы. Этот фермент относится к классу лиаз.
Альдолаза раскрывает циклическую форму фруктозо-1,6-бисфосфата. Она действует на середину молекулы — образуется две триозы: дигидроксиацетонфосфат и глицеральдегид-3-фосфат. Если мы знаем формулу фруктозы, то легко можем написать эти продукты. Одна триоза будет кетонной, а другая альдегидной.
В этой реакции кроется причина превращения глюкозо-6-фосфата в фруктозо-6-фосфат. Это тот, который образовался во время второй реакции. Представьте, что мы забили на превращение глюкозо-6-фосфата. И просто отправили его на альдолазную реакцию. Мы бы не получили две триозы. Дело в том, что альдолаза действует через один атом углерода, у которого находится двойная связь.
Все реакции начиная с четвёртой и до десятой будут обратимые. Поэтому я дальше не буду заострять на этом внимание. А может и буду, кто знает)))
Пятая реакция. Хоть мы и получили две триозы, но не каждая может пойти дальше по пути гликолиза. Глицеральдегид-3-фосфат может, а вот дигидроксиацетонфосфат — нет. Нам нужна альдегидная группа для следующих реакций гликолиза. Если внимательно посмотреть на эти молекулы, то можно сказать: «Да они почти одинаковые, может превратим одну в другую?»
Это можно сделать! С помощью фермента триозофосфатизомеразы. Он переводит дигидроксиацетонфосфат в глицеральдегид-3-фосфат. Давайте я переверну молекулу дигидроксиацетонфосфата. Так будет понятнее.
При этой реакции устанавливается константа равновесия. Возьмём за сто процентов количество молекул дигидроксиацетонфосфата (ДГАФ) и глицеральдегид-3-фосфата. 96 % молекул будут в виде ДГАФ, и только 4 % виде глицеральдегид-3-фосфата. Но это не проблема, потому что глицеральдегид-3-фосфат постепенно тратится на реакции гликолиза. Количество его молекул уменьшается. Нужно поддержать константу равновесия, поэтому ДГАФ изомеризуется. Так постепенно ДГАФ превращается в глицеральдегид-3-фосфат.
Смысл второго шага подготовительного этапа — образовать две молекулы глицеральдегид-3-фосфата. Он может превратиться в пируват — нашу конечную цель.
Получается, что в ходе подготовительного этапа клетка затратила две молекулы АТФ, но при этом получила две молекулы глицеральдегид-3-фосфата. На следующем этапе из глицеральдегид-3-фосфата будет образовываться АТФ. Ведь клетка не глупышка. Она не будет тратить энергию просто так.
Энергетический этап гликолиза
Время получать молекулы АТФ из наших глицеральдегид-3-фосфатов. Дальше будут реакции с одним глицеральдегид-3-фосфатом. Но помните о том, что их два. Позже мы всё удвоим, но не стоит выбрасывать это из головы.
Откуда взять энергию для получения АТФ в этой молекуле?
Можно подумать, что фосфатная группа у третьего атома будет участвовать в синтезе АТФ. Но это не так — пока не так. Для того, чтобы синтезировать АТФ из АДФ нужно разрушить ковалентную связь, но необычную. Она должна быть макроэргической.
Макроэргическая связь — это связь, при гидролизе которой выделяется большое количество энергии. Эта энергия используется для присоединения фосфатной группы к молекуле АДФ — мы получаем АТФ. Этот процесс называется субстратное фосфорилирование.
Есть и другое фосфорилирование — окислительное. Там для синтеза АТФ будет использоваться градиент концентрации протонов. Но мы поговорим об этом подробнее, когда доберёмся до дыхательной цепи. Пока что остановимся на субстратном.
Не каждая связь будет макроэргической. Чаще всего эти связи есть в ангидридах фосфорных и карбоновых кислот. Ангидрид состоит из двух кислотных остатков, которые соединены через атом кислорода. Давайте посмотрим на молекулу АТФ — в ней две макроэргических связи.
И это как раз фосфорный ангидрид — в нём соединены три фосфорных остатка. Два из них — это ангидриды. Теперь вы догадались, что мы сделаем с глицеральдегид-3-фосфатом. Превратим его в ангидрид!
Шестая реакция. Ангидридная группа будет на первом атоме углерода, а не на третьем. Катализирует реакцию — глицеральдегидфосфатдегидрогеназа. Раз это дегидрогеназа, то нам понадобится кофермент. Здесь им будет НАД + . Он будет присоединять протон водорода и электроны от альдегидной группы. Альдегидная группа окисляется до карбоновой кислоты, но к ней тут же присоединяется неорганический фосфат.
Получился смешанный ангидрид фосфорной и карбоновой кислот — 1,3-бисфосфоглицерат. Ура, у нас есть макроэргическая связь.
У этой реакции есть плюсы и минусы. Плюсы:
- На синтез макроэргической связи затрачивается неорганический фосфат. А не молекула АТФ.
- В ходе реакции мы получаем восстановленный кофермент — НАДH.
А о минусе мы поговорим ниже.
Седьмая реакция. Время получить молекулу АТФ. В этом нам поможет фермент — фосфоглицераткиназа. Она катализирует разрыв макроэргической связи в 1,3-бисфосфоглицерате. Энергия разрыва этой связи идёт на присоединение фосфорной группы к АДФ — образованию макроэргической связи. Получаем АТФ и 3-фосфоглицерат. Это и есть субстратное фосфорилирование.
Фермент назван по обратной реакции. Потому что АТФ находится справа. Все киназы получают название в зависимости от того, где находится АТФ. Эта реакция обратима, потому что с двух сторон есть макроэргические связи — нет резкого изменения свободной энергии. Такое изменение было в первой и третьей реакциях, но не здесь.
Восьмая реакция. В 3-фосфоглицерате ещё остаётся фосфатная группа. Она связана с третим атомом углерода с помощью ковалентной связи. Попробуем превратить эту связь в макроэргическую. Для этого придётся перенести фосфатную группу на второй атом углерода. Катализирует реакцию фосфоглицератмутаза.
Реакция протекает в два этапа: вначале фосфоглицератмутаза отдаёт фосфатную группу 3-фосфоглицерату — образуется 2,3-бисфофоглицерат. Потом фосфоглицератмутаза забирает фосфатную группу с третьего атома углерода. В клетке образуется 2-фосфоглицерат. Зачем я про это рассказываю? Потому что вы уже встречались с этой молекулой. 2,3-бисфосфоглицерат снижает сродство гемоглобина к кислороду. Вспомнили? Ну да ладно, сейчас не об этом.
Девятая реакция. У нас не получится превратить 2-фосфоглицерат в ангидрид, но есть другой вариант. Для этого нам понадобится фермент — енолаза. Она занимается отщеплением воды от молекулы с образованием двойной связи по месту разрыва — класс лиазы. Образуется фосфоенолпируват.
Эта реакция увеличивает энергетический потенциал молекулы — в ней появляется енолфосфатная связь. Это макроэргическая связь. Фосфоенолпируват теперь может отдать фосфорную группу молекуле АДФ в следующей реакции.
Десятая реакция. Её катализирует фермент пируваткиназа. Гидролиз макроэргической связи приводит к высвобождению энергии, которая идёт на присоединение фосфорной группы к АДФ. Образуется АТФ и пируват. И снова субстратное фосфорилирование.
Опять фермент назван по обратной реакции. Но есть ли вообще тут обратная реакция? Если есть, то почему я нарисовал стрелочку в одну сторону. Дело в том, что пируват может находиться в енольной или кетонной формах. Это зависит от положения двойной связи.
После отщепления фосфорной группы образуется енольная форма. Но эта форма менее стабильна, чем кетонная. Поэтому быстро происходит таутомерия — переход изомеров друг в друга. Образуется стабильная кето-форма пирувата. За счёт этого реакция становится необратимой!
На этом энергетический этап гликолиза заканчивается. Да и сам гликолиз тоже.
Сделаем выводы
Давайте посмотрим на общую схему гликолиза. Всего три реакции из десяти необратимы: первая, третья и десятая.
Почему они необратимы? В этих трёх реакциях происходит значительное изменение свободной энергии. Если сказать проще, то при первой, третьей и десятой реакции выделяется большое количество энергии. Это экзотермические реакции. Поэтому для того, чтобы повернуть эти реакции в обратную сторону нужно затратить энергию. Это невозможно при физиологических клеточных условиях.
Другие семь реакций обратимы. В них свободная энергия меняется незначительно. Некоторые из этих реакций экзотермические, а некоторые эндотермические. При физиологических условиях в клетке можно легко провести реакции в другую сторону. Достаточно ферментов, которые снизят энергию активации этой реакции.
Это полезно, потому что иногда клетка хочет синтезировать глюкозу из продуктов гликолиза. Всё зависит от условий внутри клетки. Катаболизм глюкозы и её синтез работают по типу выключателя. Когда клетка включает синтез, то отключается распад. И наоборот. Синтез глюкозы из продуктов гликолиза и других молекул — это глюконеогенез. Но я отвлёкся, давайте вернёмся к гликолизу.
На подготовительном этапе мы затратили две молекулы АТФ для активации глюкозы — первая и третья реакция. В конце этапа у нас есть две молекулы глицеральдегид-3-фосфата. Дальше эти две молекулы вступят в энергетический этап.
В энергетическом этапе из каждой молекулы глицеральдегид-3-фосфата мы получили две молекулы АТФ. Первую в седьмой реакции, а вторую в десятой реакции. Обе были получены с помощью субстратного фосфорилирования. Так как молекул глицеральдегид-3-фосфата две, то всего мы получили четыре молекулы АТФ.
Общий выхлоп гликолиза (пока что) = получено на энергетическом этапе (АТФ) — затрачено на подготовительном этапе (АТФ) = 4-2 = 2 молекулы АТФ. Как то не густо….
Но ещё мы получили две молекулы пирувата, которые отправятся в цикл трикарбоновых кислот (ЦТК). А потом и в дыхательную цепь. Для этого две молекулы пирувата переносятся в митохондрию, где находятся ЦТК и дыхательная цепь. Там из пирувата, через серию реакций, образуются молекулы АТФ.
Ах да, есть ещё две важные молекулы, которые были получены в ходе гликолиза. Это 2 НАДH. Они образовались в шестой реакции, и я обещал вам рассказать про её минусы. Время выполнять обещание.
Значение НАДH для гликолиза
Эту реакцию катализирует глицеральдегидфосфатдегидрогеназа. Она может работать только при условии, что в её активном центре находится НАД + . НАД + принимает на себя два электрона и протон водорода от глицеральдегид-3-фосфата. После этого НАДH покидает активный центр фермента вместе со своей добычей. В активный центр фермента попадает следующий НАД + . И тут возможны два варианта:
- В цитоплазме есть НАД + . Он залетает в активный центр фермента и реакция идёт снова. И так по кругу.
- В цитоплазме нет НАД + , но избыток НАДH. Из-за этого шестая реакция останавливается, а с ней и весь гликолиз. Клетка не может получить пируват, ей такое не нравится.
Но у клетки есть выход из этой ситуации. Нужно просто восстановить количество НАД + . А для этого нужно окислить НАДH. И это можно сделать двумя способами. Перенести его протон водорода и электроны в митохондрию, где они отправятся в дыхательную цепь. Либо же оставить протон и электроны в цитоплазме, но для этого придётся пожертвовать молекулами пирувата — превратить его в лактат.
Тут нужно поговорить об аэробном и анаэробном гликолизе. Я не стал пихать их в начало статьи для того, чтобы разобраться с ними сейчас.
Аэробный гликолиз
Дыхательная цепь находится в митохондриях. НАДH не может проникнуть через двойную биологическую мембрану. Это можно сделать с помощью челночных механизмов (подробнее здесь). Челночные механизмы окисляют НАДH до НАД + — при этом он остаётся в цитоплазме. А его протон и два электрона переносятся внутрь митохондрии. Ещё для этого используется протон водорода из цитоплазмы, но их там не мало — от цитоплазмы не убудет. После этого НАД + присоединяется к активному центру глицеральдегидфосфатдегидрогеназы.
Челночные механизмы нужны не только для того, чтобы окислить НАДH. После того, как протоны и электроны были перенесены в митохондрию, они попадают в дыхательную цепь. Там из них синтезируется три или пять молекул АТФ. Это зависит от челночного механизма, который был использован клеткой.
Вы можете найти инфу, что в в ходе гликолиза синтезируется восемь молекул АТФ. Потому что каждый НАДH идёт на образование трёх молекул АТФ. Но если говорить строго, то из каждого НАДH может синтезироваться только 2,5 молекулы. Наверное, они округляют или пользуются старыми данными. Так что тут вам решать. Я считаю по 2,5 молекулы, поэтому:
Общий выход аэробного гликолиза: пять или семь молекул АТФ и две молекулы пирувата. Количество АТФ зависит от челночного механизма
Уравнение аэробного гликолиза:
Но что случится, если дыхательная цепь прекратит свою работу?
Анаэробный гликолиз
При анаэробном гликолизе челночные механизмы останавливаются. Это случается при недостатке кислорода (ого!) — дыхательная цепь перестает работать. В митохондрии накапливаются протоны и электроны. Для наших уже просто не хватает места.
Но клетка делает кое-что интересное. Она превращает пируват в лактат с помощью лактатдегидрогеназы. Фермент использует НАДH и протон водорода на эту реакцию. Далее он присоединяет их к пирувату. Та-дам! Клетка получает НАД + и лактат. НАД + снова идёт в шестую реакцию.
Выхлоп энергии здесь намного меньше — всего две молекулы АТФ. Протон и электроны с НАДН не отправляются в митохондрию, а значит мы не получим дополнительные три или пять молекул АТФ. Пируват не отправляется в ЦТК, а превращается в лактат. В общем, невыгодно как-то. Клетка слишком много теряет на этом.
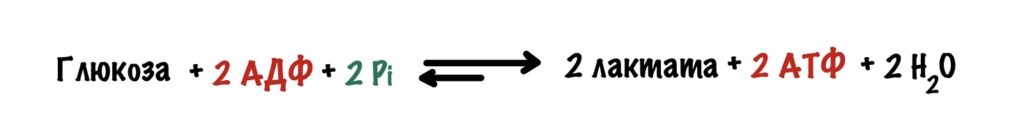
Общий выход анаэробного гликолиза: две молекулы АТФ и две молекулы лактата
Уравнение анаэробного гликолиза:
Зачем тогда нужен анаэробный гликолиз? Некоторые клетки не могут получать энергию по-другому. Вот у эритроцитов просто нет митохондрий, поэтому единственный вариант получить энергию — анаэробный гликолиз.
Ещё он протекает в мышцах при резкой физической нагрузке. Представьте, что мы побежали за автобусом. У нас небольшой запас кислорода в мышцах — в виде миоглобина. Он сгорит очень быстро, а мышцам нужна энергия. Запускается анаэробный гликолиз с образованием лактата. Потом к мышцам увеличивается кровоток — переход на аэробный гликолиз.
С мышцами бывает и другая ситуация. Они частенько сокращаются, а это иногда приводит к сдавлению сосудов. Кровоток снижается, а энергию на сокращения где-то брать нужно. Снова включается анаэробный гликолиз. Так что анаэробный гликолиз незаменимая штука для эритроцитов и мышц.
Опухоли тоже пользуются гликолизом, но это не хорошая инфа. А так анаэробный гликолиз больше характерен для бактерий: клостридий и других облигатных анаэробов.
Но вернёмся к нашему организму. В мышцах лактат не лежит просто так, а отправляется в кровь. Там он циркулирует, пока не попадёт в печень или почки. Зачем? Эти органы могут превратить лактат в глюкозу с помощью глюконеогенеза. В них идёт обратная реакция, которую катализирует лактатдегидрогеназа — образование пирувата из лактата. Далее пируват вступает в глюконеогенез — через серию реакций образуется глюкоза. Печень/почки отправляют её в кровь. Дальше глюкоза попадёт в другие клетки, где будет использована на их нужды. Часть глюкозы снова окажется в мышцах, где из неё опять образуется лактат. Цикличненько. У этого цикла есть своё название — цикл Кори.
Другие субстраты гликолиза
Только что мы разобрали гликолиз на примере глюкозы. Она попадает в клетку из крови, а потом фосфорилируется. И так далее. Но откуда она там взялась? Есть два варианта:
Мы сытно поели, и в ЖКТ началось пищеварение. Большая часть полисахаридов и дисахаридов состоит из глюкозы. Глюкоза попадёт из кишечника в кровь, а потом в клетку. Там глюкоза будет использоваться для синтеза АТФ — гликолиза, либо запасаться в виде гликогена. Она может использоваться и для других процессов, но пока не будем запариваться.
Второй вариант — образование глюкозы из гликогена.
Гликоген
В мышцах и печени можно получить молекулу глюкозо-6-фосфата, продукт первой реакции, по-другому. Через разрушение гликогена — гликогенолиз. Под действием гликогенфосфорилазы от гликогена отщепляется молекула глюкозы. Эта реакция идёт с помощью фосфоролизиса — альфа-1-4-гликозидная связь разрушается с участием неорганического фосфата. Клетка получает глюкозо-1-фосфат и гликоген, в котором меньше на одну молекулу глюкозы.
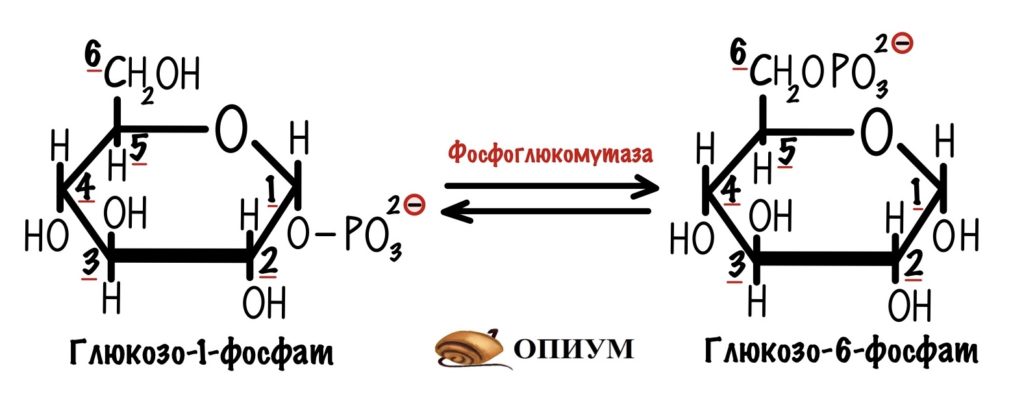
Далее глюкозо-1-фосфат превращается в глюкозо-6-фосфат с помощью фермента фосфоглюкомутазы. А вот и наш глюкозо-6-фосфат, который можно запихнуть в гликолиз.
Но такая тема работает только в мышечной ткани — глюкозо-6-фосфат идёт на гликолиз. В печени глюкозо-6-фосфат превратится в глюкозу с помощью глюкозо-6-фосфатазы. Из клеток печени она пойдёт в кровь. Так происходит между приёмами пищи, когда падает уровень глюкозы в крови. Печень заботится об уровне глюкозы в крови между приёмами пищи, поэтому она не использует глюкозу самостоятельно. Но давайте вернёмся к пищеварению.
При пищеварении мы получали не только глюкозу, но и другие моносахариды: фруктозу и галактозу. Можно ли их отправить в гликолиз? А давайте посмотрим.
Фруктоза
Фруктоза образуется при гидролизе сахарозы во время пищеварения. Сахароза — это дисахарид, который состоит из глюкозы и фруктозы. В начале пути глюкозы и фруктозы схожи. Фруктоза тоже всасывается в кишечнике, а потом попадает в кровь. Оттуда фруктоза захватывается клетками. А дальше начинаются отличия. Фруктоза может вступать в гликолиз двумя разными путями.
Первый путь. Фруктоза фосфорилируется с помощью гексокиназы. Фосфорная группа присоединяется к шестому атому углерода. При этом затрачивается молекула АТФ.
Удобно, клетка получила продукт второй реакции гликолиза. Даже не нужно проводить изомеризацию. Можно сразу фосфорилировать фруктозо-6-фосфат фосфофруктокиназой.
Второй путь. Фруктоза фосфорилируется с помощью фруктокиназы. Фосфорилирование идёт по первому атому углерода, а не шестому. Уже можно не писать, что на это тратится молекула АТФ?
Дальше клетка превращает фруктоза-6-фосфат в две триозы. Очень похоже на четвертую реакцию гликолиза, но только одна будет фосфотриозой. Фермент тоже называется альдолазой, но с приставкой — фруктозо-1-фосфатальдолаза.
Дигидроксиацетонфосфат может пойти на гликолиз через изомерию. Триозофосфатизомераза превращает его в глицеральдегид-3-фосфат. Далее он вступает в гликолиз.
Глицеральдегид в гликолиз не отправить. Сначала нужно прицепить к нему фосфатную группу. Катализирует реакцию — триозокиназа. Получаем ещё один глицеральдегид-3-фосфат.
Оба глицеральдегид-3-фосфата попадают на энергетический этап гликолиза. Очень похоже на классический гликолиз. Просто он идёт немного в обход. При этом оба пути одинаковы в энергетическом плане — клетка тратит на них две молекулы АТФ.
Галактоза
Галактоза образуется при гидролизе лактозы. Лактоза — это дисахарид, который состоит из галактозы и глюкозы. Галактоза всасывается из кишечника, а потом попадает в клетку. Ну и куда же без фосфорилирования. Ведь нужно загнать галактозу в ловушку и увеличить её реакционную способность. Фермент галактозокиназа фософрилирует первый атом углерода.
Дальше идёт вот такой интересный цикл:
В итоге мы получаем глюкозо-1-фосфат, который можно превратить в глюкозо-6-фосфат с помощью фосфоглюкомутазы. Где мы уже встречались с УДФ-глюкозой? Да, в синтезе гликогена.
Вот общая табличка со всеми субстратами гликолиза.
Регуляцию гликолиза и глюконеогенеза разбираем здесь.
Хочешь задать вопрос, похвалить или наговорить гадостей? Тогда залетай в телегу. Там ты сможешь предложить новый формат или разбор темы. А если серьёзно, то эти статьи пишутся для вас, поэтому мне важна обратная связь.
http://xumuk.ru/biologhim/151.html
http://opiumedu.ru/bihomiya/glikoliz-substraty-dlya-glikoliza/