Теория электролитической диссоциации
О чем эта статья:
Что такое электролитическая диссоциация
Как известно, электрический ток — это направленное движение свободных электронов или ионов, т. е. заряженных частиц. В растворах электролитов, проводящих ток, за это отвечают свободные ионы.
В 1882 году шведский химик С. Аррениус при изучении свойств растворов электролитов обратил внимание, что они содержат больше частиц, чем было в сухом веществе. Например, в растворе хлорида натрия 2 моля частиц, а NaCl в сухом виде содержит лишь 1 моль.
Это позволило ученому сделать вывод, что при растворении таких веществ в воде в них появляются свободные ионы. Так были заложены основы теории электролитической диссоциации (ТЭД) — в химии она стала одним из важнейших открытий.
Электролитическая диссоциация — это процесс, в ходе которого молекулы электролитов взаимодействуют с водой или другим растворителем и распадаются на ионы. Она может иметь обратимый или необратимый характер. Обратный процесс называется моляризацией.
Благодаря диссоциации растворы электролитов обретают способность проводить ток. Сванте Аррениус не смог объяснить, почему разные вещества сильно отличаются по электропроводности, но это сделал Д. И. Менделеев. Он подробно описал процесс распада электролита на ионы, который объясняется его взаимодействием с молекулами воды (или другого растворителя).
Схема электролитической диссоциации: KA ⇄ K + (катион) + A — (анион).
Уравнение диссоциации на примере хлорида натрия: NaCl ⇄ Na + + Cl — .
Механизм электролитической диссоциации
При контакте с водой или другими растворителями диссоциации подвержены все вещества с ионной связью. Также распадаться на ионы могут вещества с ковалентной полярной связью, которая под действием воды переходит в ионную, а после разрушается.
Механизм диссоциации электролитов удобно рассматривать на примере хлорида натрия NaCl. Его кристаллическая решетка образована катионами натрия Na + и анионами хлора Cl — , которые удерживаются вместе благодаря ионной связи. При растворении в воде каждый кристалл хлорида натрия окружают ее молекулы.
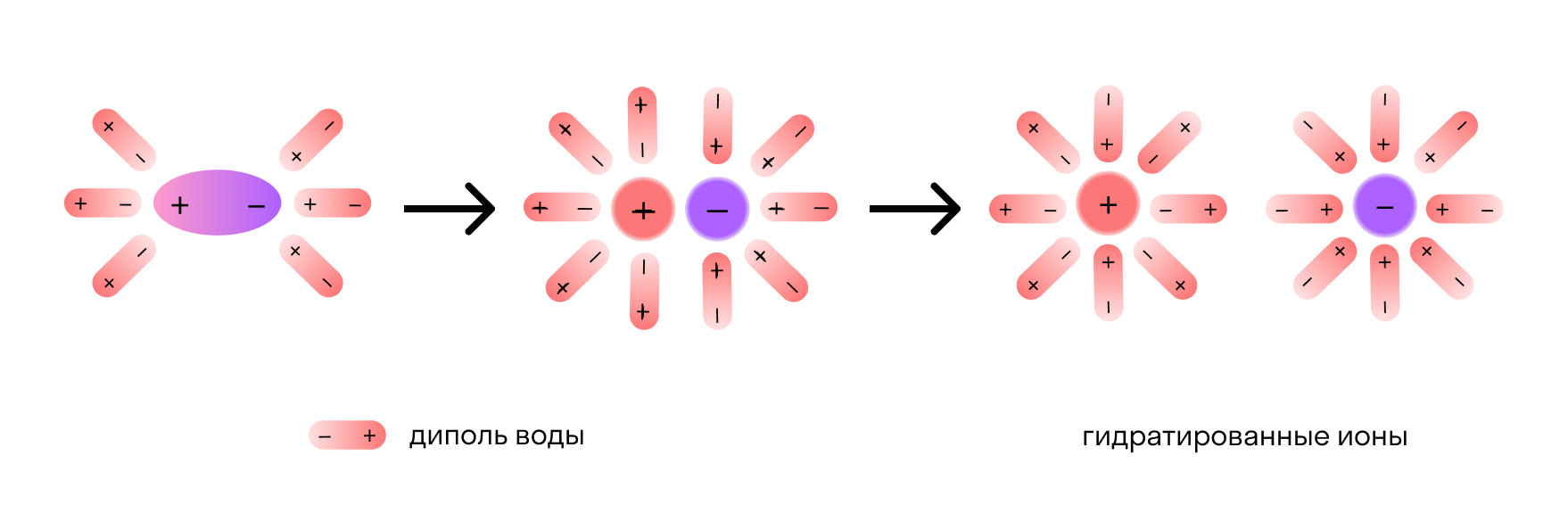
Отметим, что молекулы воды — это диполи. На одном конце они несут атомы водорода с частичным положительным зарядом, а на другом — атомы кислорода с частичным отрицательным. Соответственно, атомы кислорода притягиваются к катионам натрия, а атомы водорода — к анионам хлора. Эта сила электростатического притяжения ослабляет и в итоге разрывает ионную связь между натрием и хлором. Вещество диссоциирует на ионы.
После распада хлорида натрия образовавшиеся ионы Na + и Cl — окружают молекулы воды, создавая гидратную оболочку. Ионы с такой оболочкой называют гидратированными.
Если вместо воды был использован другой растворитель — например, этанол, его молекулы создают сольватную оболочку. В этом случае ионы называются сольватированными.
Сущность процесса электролитической диссоциации передает схема:
Электролиты и неэлектролиты
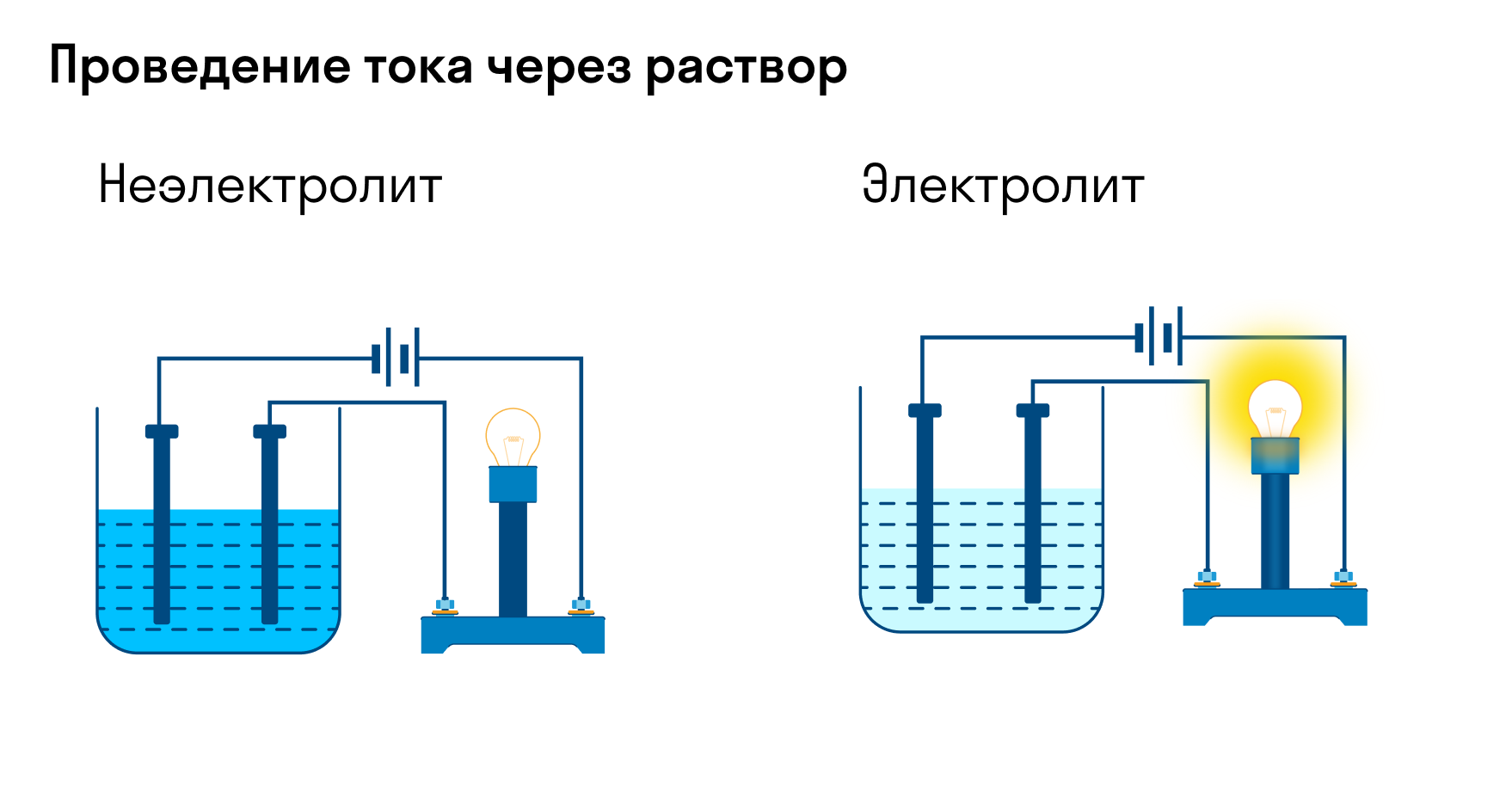
Хотя электролитическая диссоциация происходит независимо от действия электротока, между этими явлениями есть связь. Чем выше способность вещества распадаться на ионы при взаимодействии с растворителем, тем лучше оно проводит электроток. По такому критерию известный физико-химик М. Фарадей выделил электролиты и неэлектролиты.
Электролиты — это вещества, которые после диссоциации на ионы в растворах и расплавах проводят электроток. Обычно в их молекулах ионные или полярные ковалентные связи.
Неэлектролиты — это вещества, которые не распадаются на ионы в растворах и расплавах, а значит, не обладают проводимостью в растворенном виде. Для них характерны ковалентные неполярные или слабополярные связи.
Степень диссоциации
В зависимости от того, сколько молекул диссоциировало на ионы, вещество может быть сильным или слабым электролитом. Этот показатель называется степенью диссоциации, его измеряют от 0 до 1 либо в процентах.
Степень диссоциации — это отношение количества распавшихся на ионы молей вещества к исходному количеству молей.
Если в растворе на ионы распадаются все 100% электролита, .
По силе электролиты делятся на следующие группы:
Обобщение знаний по теме «Теория электролитической диссоциации»
методическая разработка по химии (9 класс) на тему
Данный урок проводился после изучения темы ТЭД в качестве закрепления темы, а также для подготовки к практической и контрольной работе.
Цель: Обобщение, систематизация и совершенствование знаний по теме «Теория электролитической диссоциации.
Задачи:
Ø Закрепить и углубить знания учащихся об основных понятиях теории электролитической диссоциации, совершенствовать умение учащихся составлять уравнения диссоциации и реакций ионного обмена в молекулярном и ионном виде.
Ø Развивать логическое мышление, память, внимание, умение сравнивать и анализировать, умение применять полученные знания и навыки при выполнении практических упражнений.
Ø Воспитывать трудолюбие, целеустремленность, культуру речи и общения.
Скачать:
| Вложение | Размер |
|---|---|
| konspekt_uroka.docx | 40.12 КБ |
| rabochiy_list_1gr_1_v.docx | 18.69 КБ |
| rabochiy_list_1gr_2_v.docx | 18.64 КБ |
| rabochiy_list_2_gr_1_v.docx | 18.88 КБ |
| rabochiy_list_2_gr_2_v.docx | 18.97 КБ |
| rabochiy_list_3_gr_1_v.docx | 18.74 КБ |
| rabochiy_list_3_gr_2_v.docx | 18.96 КБ |
| ted_obobshchenie.pptm | 681.99 КБ |
Предварительный просмотр:
Разработка открытого урока по химии в 9 классе.
Тема: Обобщение знаний по теме «Теория электролитической диссоциации».
Цель: Обобщение, систематизация и совершенствование знаний по теме «Теория электролитической диссоциации.
Закрепить и углубить знания учащихся об основных понятиях теории электролитической диссоциации, совершенствовать умение учащихся составлять уравнения диссоциации и реакций ионного обмена в молекулярном и ионном виде.
Развивать логическое мышление, память, внимание, умение сравнивать и анализировать, умение применять полученные знания и навыки при выполнении практических упражнений.
Воспитывать трудолюбие, целеустремленность, культуру речи и общения.
Формы работы: коллективно-групповая, парная, индивидуальная, дифференцированная.
Тип урока: обобщение и систематизация знаний.
Оборудование: презентация к уроку, материалы Виртуальной Химической лаборатории, универсальный электронный датчик Pasco, раздаточный материал.
Реактивы: растворы: серной и соляной кислот, хлорида бария, карбоната натрия; универсальный индикатор, стаканы с водой, пипетки.
1. Организационный момент.
2. Подготовка учащихся к активному и сознательному усвоению знаний.
3. Всесторонняя проверка знаний учащихся – опрос.
4. Проверка понимания изученного материала.
5. Домашнее задание и инструктаж по его выполнению.
Проверка посещаемости, наличие дежурных, журнала, готовность к уроку.
Подготовка учащихся к активному и сознательному усвоению знаний.
«Сами трудясь, вы многое сделаете для себя и для близких,
а если при труде успеха не будет,
будет неудача, не беда – попробуйте ещё».
Д.И. Менделеев
На предыдущих уроках мы познакомились с одной из величайших теорий, на которую опирается химическая наука, – это теория электролитической диссоциации. Теория электролитической диссоциации широко применяется для объяснения многообразных физических и химических явлений в растворах, установления между ними тесной связи. Она, по словам Аррениуса, “оказалась применимой и полезной во всех областях современной науки”.
А сегодня на уроке мы должны обобщить и систематизировать знания по этой теории и закрепить умения составлять уравнения диссоциации и реакций ионного обмена. (цели урока на слайде)
В течение урока будем выполнять разнообразные задания, для этого у вас на столах лежат рабочие листы с заданиями и таблица, в которую вы будете вносить результаты. В конце урока вы сможете самостоятельно оценить свои знания по пройденной теме.
Заполните рабочие листы (ФИ и класс) и подготовьте их к работе.
Всесторонняя проверка знаний – письменный опрос.
Начнем наш урок с повторения теоретических знаний, т.е. с опроса.
Закончи предложение одним словом. (4 минуты)
Направленное движение заряженных частиц……
Отрицательно заряженные частицы………..
Вещества, водные растворы которых не проводят электрический ток…….
Процесс распада электролита на ионы называется……….
Электролиты, при диссоциации которых в качестве анионов образуются гидроксид- ионы — ……..
Отрицательно заряженный электрод — ……
Положительно заряженные частицы — ………
Процесс распада электролита на ионы — …….
Вещества, водные растворы которых проводят электрический ток — ……..
Основоположник теории электролитической диссоциации — ……..
Электролиты, при диссоциации которых в качестве катионов образуются ионы водорода — ……..
После окончания работы учащиеся проводят взаимопроверку. За каждый правильный ответ – 1 балл, максимальное кол-во баллов — 6. (ответы на слайдах).
Проверка понимания изученного материала.
Гемфри Деви и Майкл Фарадей проводили опыты по изучению электропроводности растворов используя специальный прибор, которым мы также пользовались на первом уроке при изучении электролитической диссоциации. С помощью этого прибора мы распознавали вещества электролиты и неэлектролиты. Рассмотри принцип работы этого прибора с помощью ВХЛ. (демонстрация материала из ВХЛ и комментарии ученика)
1.Экспериментально было установлено, что растворы солей, щелочей и кислот способны проводить электрический ток. Такие вещества были названы электролитами. Растворы же сахара, спирта, глюкозы и некоторых других веществ не проводят электрический ток и называются неэлектролитами.
2. Распад молекул на ионы в растворе называется электролитической диссоциацией. Ассоциация — обратный процесс.
3. Диссоциация веществ в растворе представляет ряд последовательных процессов:
1) Ориентация молекул воды вокруг ионов или молекул;
2) Гидратация молекул воды с ионами или молекулами;
3) Для веществ с полярной ковалентной связью характерна дополнительная стадия — ионизация молекул (превращение ковалентных полярных связей в ионные);
4) Диссоциация кристаллов или молекул на гидратированные молекулы.
В дальнейшем мы научились без прибора распознавать вещества электролиты и неэлектролиты. Для этого выполним следующие задание: (ученик у доски)
Из предложенных веществ выбрать неэлектролиты.
(на слайде исчезают формулы неэлектролитов)
Задание № 2. Для оставшихся веществ составить уравнения диссоциации. (работа по 4 вариантам на 5 минут)
Электролитическая диссоциация
Электролитической диссоциацией называют процесс, в ходе которого молекулы растворенного вещества распадаются на ионы в результате взаимодействия с растворителем (воды). Диссоциация является обратимым процессом.
Диссоциация обуславливает ионную проводимость растворов электролитов. Чем больше молекул вещества распадается на ионы, тем лучше оно проводит электрический ток и является более сильным электролитом.
В общем виде процесс электролитической диссоциации можно представить так:
KA ⇄ K + (катион) + A — (анион)
Замечу, что сила кислоты определяется способностью отщеплять протон. Чем легче кислота его отщепляет, тем она сильнее.
У HF крайне затруднен процесс диссоциации из-за образования водородных связей между F (самым электроотрицательным элементом) одной молекулы и H другой молекулы.
Ступени диссоциации
Некоторые вещества диссоциируют на ионы не в одну стадию (как NaCl), а ступенчато. Это характерно для многоосновных кислот: H2SO4, H3PO4.
Посмотрите на ступенчатую диссоциацию ортофосфорной кислоты:
Важно заметить, что концентрация ионов на разных ступенях разная. На первых ступенях ионов всегда много, а до последних доходят не все молекулы. Поэтому в растворе ортофосфорной кислоты концентрация дигидрофосфат-анионов будет больше, чем фосфат-анионов.
Для серной кислоты диссоциация будет выглядеть так:
Для средних солей диссоциация чаще всего происходит в одну ступень:
Из одной молекулы ортофосфата натрия образовалось 4 иона.
Из одной молекулы сульфата калия образовалось 3 иона.
Электролиты и неэлектролиты
Химические вещества отличаются друг от друга по способности проводить электрический ток. Исходя из этой способности, вещества делятся на электролиты и неэлектролиты.
Электролиты — жидкие или твердые вещества, в которых присутствуют ионы, способные перемещаться и проводить электрический ток. Связи в их молекулах обычно ионные или ковалентные сильнополярные.
К ним относятся соли, сильные кислоты и щелочи (растворимые основания).
Степень диссоциации сильных электролитов составляет от 0,3 до 1, что означает 30-100% распад молекул, попавших в раствор, на ионы.
Неэлектролиты — вещества недиссоциирующие в растворах на ионы. В молекулах эти веществ связи ковалентные неполярные или слабополярные.
К неэлектролитам относятся многие органические вещества, слабые кислоты, нерастворимые в воде основания и гидроксид аммония.
Степень их диссоциации до 0 до 0.3, то есть в растворе неэлектролита на ионы распадается до 30% молекул. Они плохо или вообще не проводят электрический ток.
Молекулярное, полное и сокращенное ионные уравнения
Молекулярное уравнение представляет собой запись реакции с использованием молекул. Это те уравнения, к которым мы привыкли и которыми наиболее часто пользуемся. Примеры молекулярных уравнений:
Полные ионные уравнения записываются путем разложения молекул на ионы. Запомните, что нельзя раскладывать на ионы:
- Слабые электролиты (в их числе вода)
- Осадки
- Газы
Сокращенное ионное уравнение записывается путем сокращения одинаковых ионов из левой и правой части. Просто, как в математике — остается только то, что сократить нельзя.
© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Блиц-опрос по теме Электролитическая диссоциация
http://nsportal.ru/shkola/khimiya/library/2012/10/09/obobshchenie-znaniy-po-teme-teoriya-elektroliticheskoy
http://studarium.ru/article/159