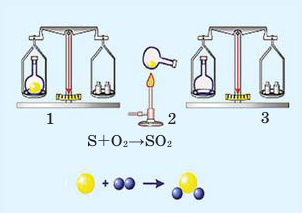
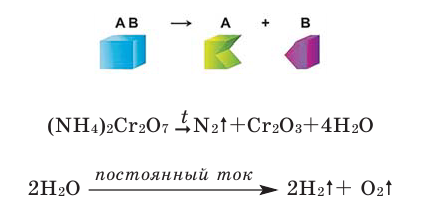
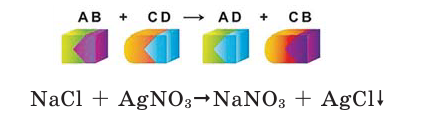
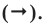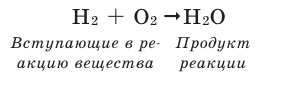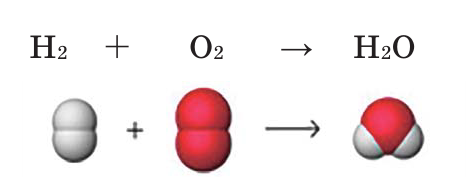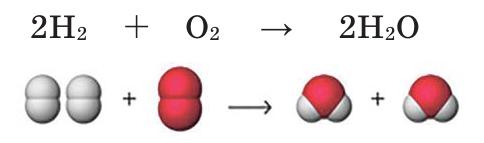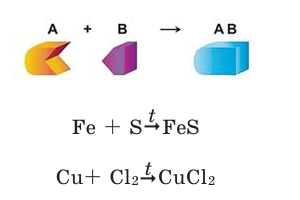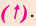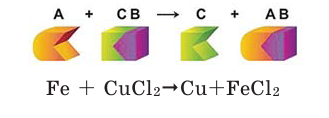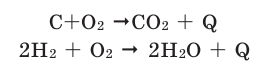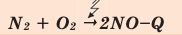Математика помогает физике и химии
Введение
На сегодняшний день нужны такие программы и учебники по математике, которые позволили бы более эффективно усваивать материал. Не секрет, что сегодня программы различных дисциплин школьного курса не учитывают особенности друг друга. Связь — это взаимообусловленность существования явлений, разделённых в пространстве и (или) во времени.
Межпредметные связи играют существенную роль в обеспечении единства обучения и воспитания. Они выступают как средство усиления этого единства комплексного подхода к обучению. Совокупность функций межпредметных связей реализуется в процессе обучения тогда, когда учитель математики осуществляет все их многообразие.
Например: в курсе географии масштаб изучается в начале 6 класса, а в курсе математики на несколько месяцев позже, поэтому у учеников и учителей географии возникают сложности. Хорошо, если учитель географии договорится с учителем математики и тот чуть изменит свое планирование, а если нет?
Еще пример: в курсе алгебры изучаются графики и свойства линейной функции. Учителя физики жалуются, что учащиеся не могут проанализировать график той же линейной функции, а ученики говорят, учителя физики «пользуются иным языком». Проблема решается, если учитель математики, берет сборник задач по физике и учит видеть физический смысл процесса при анализе графика, пользуясь привычными на уроках алгебры понятиями. А если нет?
Давно известно, что усиление межпредметных связей следует рассматривать как одно из важнейших направлений дидактического совершенствования школьного курса математики. Учет межпредметных связей при обучении способствует систематизации и углублению знаний учащихся, формированию у них навыков и умений самостоятельной познавательной деятельности, переносу знаний, полученных на более низких ступенях обучения, на более высокие ступени.
1. Математика помогает химии
Расстановка коэффициентов в уравнениях химических реакций доставляет немало хлопот, если делать это методом «тыка». Если же к решению этой проблемы применить математические знания и составить небольшой алгоритм, основанный на решении системы уравнений, то пошаговое его выполнение позволит расставлять коэффициенты в химических уравнениях любой сложности. Итак:
- Обозначим неизвестные коэффициенты x, y, z, и т. д.
- Составим уравнения, определяющие количество атомов каждого химического элемента, входящего в состав реагирующих веществ до и после реакции. Для этого перемножим соответствующие коэффициенты и индексы.
- Выберем переменную, которая в составленной системе принимает наименьшее значение, и приравняем ее единице.
- Вычислим значения остальных переменных. Если хотя бы одно из полученных значений окажется дробным, необходимо вернуться к предыдущему пункту и увеличить значение выбранной переменной на единицу.
Расчет будет закончен, если все полученные значения коэффициентов — целые числа. Покажем выполнение алгоритма на примере.
Пусть требуется расставить коэффициенты в следующем уравнении:
1. Введем обозначения для неизвестных коэффициентов:
2. Составляем уравнение для каждого химического элемента:
Получаем систему уравнений:
4. Тогда, решая систему уравнений, получим: x = 3, y = 1. Так как все полученные значения — целые, расчет прекращается.
Приведем пример, где в процессе выполнения алгоритма получаются дробные коэффициенты.
1. х КСl О3 = у КСl + z О2
Получаем систему уравнений:
4. Решая систему уравнений, получим: y = 1, z = 1,5. Так как одно из значений дробное число, то вернемся к пункту 3 и увеличим значение х на единицу.
Если х=2, то у=2, z=3.
Таким образом, решая задачи по химии, пользуемся привычным языком математики. И поскольку математику ребята начинают изучать раньше, то такой метод поможет в успешном усвоении некоторых тем курса химии.
2. Математика помогает физике.
2.1. Мощный аппарат современного школьного курса математики должен быть максимально использован в физике, а богатый фактический материал курса физики должен служить одним из рычагов формирования математических представлений. Понятие функции играет в физике исключительно важную роль. Эйнштейн писал: «Чтобы сделать количественные выводы мы должны использовать математический язык… и если мы хотим сделать выводы, которые можно сравнить с результатами экспериментов, нам необходима математика как орудие исследования».
Некоторые математические функции в курсе физики
Математическая функция
Физические формулы
вида этой функции
2.2. Рассмотрим тему курса физики: «Изучение уравнений графиков равноускоренного движения» на конкретных задачах.
Формула для нахождения скорости: 
Если начальная скорость равна 0, то : 
Анализируя формулу зависимости скорости от ускорения, следует заметить, что это формула линейной функции:
Формулы для нахождения скорости:



Рис. 1. Графики скорости различных равномерно-ускоренных движений.
Поэтому учащиеся легко делают вывод, что график скорости равноускоренного движения — всегда прямая линия; и обратно, если график скорости какого-либо движения есть прямая, то движение равномерно-ускоренное .
Построим, пользуясь формулами (1) и (2), график зависимости скорости равноускоренного движения от времени. Пусть, например, ускорение равно 2 м/сек 2 и в начальный момент скорость равна нулю. Выполняя построение, увидим, что график скорости представит собой прямую линию (рис. 1, линия I), проходящую через точку пересечения оси времени и оси скорости. При большем ускорении график скорости изображается прямой, наклоненной к оси времени под большим углом (линия II на рис. 1).
Если в начальный момент скорость не равняется нулю, а имеет значение v0, то график скорости по-прежнему представляет прямую линию, но не проходит через начало координат, а пересекает ось скоростей (ось у) в точке v0. Например, на рис. 1 приведен график равноускоренного движения с тем же ускорением 2 м/сек 2 , но с начальной скоростью 5 м/сек (прямая III). Угол наклона графика тот же, что и для прямой I, так как ускорение одинаково для обоих движений 
Иными словами, угловые коэффициенты обеих функций равны, следовательно, графики функции параллельны. Угол наклона графика скорости зависит от выбора масштабов времени и скорости. Поэтому для возможности сравнения различных движений по виду графиков скорости необходимо чертить все графики в одном и том же масштабе.
При отрицательном ускорении (равнозамедленное движение) график скорости также изображается прямой линией, однако прямая наклонена в этом случае вниз или, как говорят на уроках математики, угловой коэффициент отрицателен, т.е. функция убывает.
На графиках скорости можно проиллюстрировать все изменения скорости с течением времени при произвольном знаке начальной скорости и произвольном знаке ускорения.
Так, на рис. 2 прямая I соответствует положительной начальной скорости и положительному ускорению: 


II — положительной начальной скорости и отрицательному ускорению: 


IV —отрицательной начальной скорости и отрицательному ускорению: 


Физические и химические явления. Химические уравнения
Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
Описание презентации по отдельным слайдам:
Составил: учитель химии
МОУ «Бурханкульская ООШ»
Кулешова С.Е.
Физические и
химические
явления.
Химические уравнения
Содержание
1. Химические и физические явления
2. Признаки протекания химических реакций
3. Условия протекания химических реакций
4. Закон сохранения масс
5. Уравнения химических реакций
«Ах сколько нам
открытий чудных
готовит просвещенья дух»
А.С.Пушкин
Задачи :
Повторить признаки и условия течения химических реакций
Выяснить , что называется химическим уравнением
Научить составлять химические уравнения
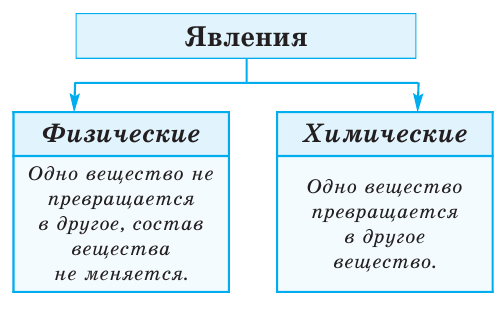
Химические и физические явления
Физические явления
Химический состав молекул не меняется
Кристаллизация
Плавление
Фильтрация
Отстаивание
Перегонка
Химические явления
Химический состав молекул изменяется
Изменяются
физические свойства веществ ( цвет, запах, агрегатное состояние, электропроводность, теплопроводность, упругость, пластичность и т.д.)
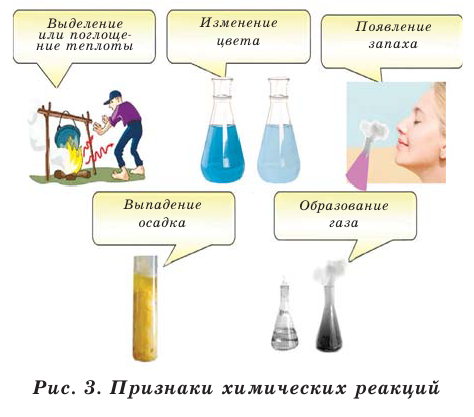
Признаки протекания
химической реакции
Появление запаха
Выделение осадка
Выделение газа
Изменение цвета
Выделение тепла
(экзотермическая реакция)
Поглощение тепла
(эндотермическая реакция)
Проверь себя!
В каком случае произошла химическая реакция? Почему вы так думаете?
В крепко заваренный чай добавили дольку лимона
Осадок в ведре с водой
В негашеную известь добавили воды
В печке сгорел уголь
Условия протекания химических реакций
Чистота веществ (минимум примесей)
Пропорциональность веществ по массе
Пример:Ar (S)=32, Ar (Fe) = 56
S : Fe = 32 : 56 = 4 : 7
Для проведения реакции между серой и
железом надо взять четыре части серы и семь частей железа ( 12г серы и 21г железа)
Задание : В какой пропорциональности надо взять углерод и кислород для протекания химической реакции?
Решение : Ar (O) = 16, Ar (C)= 12,
О : С = 16 : 12 = 4 : 3
Ответ : в отношении 4:3
3. Тщательное перемешивание
4. Применение катализатора
Катализатор — Вещества, которые изменяют скорость химической реакции, оставаясь к концу её неизменными
5. Площадь соприкосновения реагирующих веществ
Михаил Васильевич Ломоносов
1711-1765 гг.
Создатель многих химических производств в России (неорганических пигментов, глазурей, стекла, фарфора). Изложил в 1741-1750 гг. основы своего атомно-корпускулярного учения, выдвинул кинетическую теорию теплоты. Первым из русских академиков написал учебники по химии и металлургии. Основатель Московского Университета
Антуан Лоран Лавуазье
1743-1794 гг.
Французский химик. Один из основоположников классической химии. Ввел в химию строгие количественные методы исследования. Доказал сложный состав атмосферного воздуха. Правильно объяснив процессы горения и окисления, создал основы кислородной теории. Заложил основы органического анализа.
В 1756 г М.В. Ломоносов открыл закон сохранения масс. Позднее А.Л. Лавуазье подтвердил правильность этого закона
Масса веществ, вступивших в реакцию, равна массе веществ , получившихся в результате её
Антуан Лоран Лавуазье
Суть закона сохранения веществ
Атомы двух веществ встречаются и взаимодействуют между собой. В данном случае по две молекулы каждого вещества, всего четыре атома одного вещества и четыре атома другого
После протекания химической реакции образуется новое вещество, состоящее из четырех молекул , в состав которых входят по четыре атома исходных веществ. Число атомов после химической реакции не изменилось.
Проверь себя!
Сколько атомов каждого элемента потребовалось для получения молекулы оксида алюминия и трех молекул сернистой кислоты.
Молекула оксида алюминия : 2 атома алюминия и 3 атома кислорода
3 атома серы, 6 атомов водорода и 9 атомов кислорода
Для получения сульфида железа смешали 36 г серы и железо, в результате реакции получили 99 г соли . Сколько грамм железа взяли для этой реакции?
63г железа
Химические уравнения
Химическим уравнением называется условная запись химической реакции с помощью химических формул и математических знаков
2 Н2О = 2Н2 + О2
4Al + 3O2 = 2Al2O3
Алгоритм составления
химического уравнения
В левой части уравнения записывают формулы веществ, вступивших в реакцию, соединяют их знаком «+», в правой части уравнения записывают формулы(формулу) образующихся веществ, также с помощью знака «+». Между уравнениями ставят стрелку
CuCl2 + Al AlCl3 + Cu
Находим и расставляем коэффициенты к формулам так, чтобы число атомов одинаковых элементов в левой и правой частях уравнения были одинаковы. Заменяем стрелку знаком «=» .
3CuCl2 + 2Al = 2 AlCl3 + 3Cu
Меди : с правой стороны 3 и с левой 3
хлора : 6 и 6
Алюминия: 2 и 2
Попробуйте свои силы
Расставьте коэффициенты в уравнениях
P+O2 P2O5
4P + 5O2 = 2P2O5
Al + H2SO4 Al2(SO4)3 + H2
2Al + 3H2SO4 = Al2(SO4)3 + 3H2
САМОСТОЯТЕЛЬНО
S + O2 SO3
Na + H2O NaOH + H2
MgCO3 + Al Al2(CO3)3 + Mg
Проверь !
2S +3O2 = 2SO3
2Na + 2H2O = 2NaOH + H2
3MgCO3 + 2Al = Al2(CO3)3 + 3Mg
Физические и химические явления в химии — формулы и определения с примерами
Содержание:
Физические и химические явления:
Сравните картинки. В результате какого явления гвозди ржавеют, черешня сгнивает, а вода превращается из жидкого состояния в твёрдое или газообразное состояния. Чем отличаются эти явления друг от друга? Как это можно объяснить? Какие признаки имеют химические реакции?
Каждому из нас в повседневной жизни доводилось наблюдать, как нагретая вода, превратившись в пар, «исчезает» (переходит в состояние невидимого газа), и как этот пар при соприкосновении с холодной поверхностью предмета вновь превращается в капельки воды. Точно так же все видели превращение воды в лед в выставленной наружу в холодный морозный день посуде и обратный переход его в жидкое состояние при внесении в помещение. Образуется ли новое вещество при этих превращениях?
Возьмите две миски небольшой ёмкости. В одной из мисок смешайте небольшое количество соли с водой, а в другой — сахара с водой и поставьте на слабый огонь. Что вы наблюдаете? Запишите свои мысли в тетради.
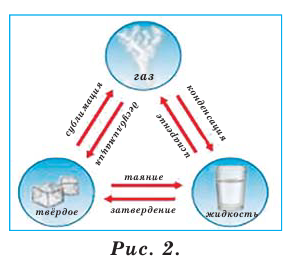
Из курса физики нам известно, что все происходящие в природе изменения называются явлением. Например, выпадение дождя, восход солнца, удар грома, землетрясение, таяние ледников и др. (рис.1).
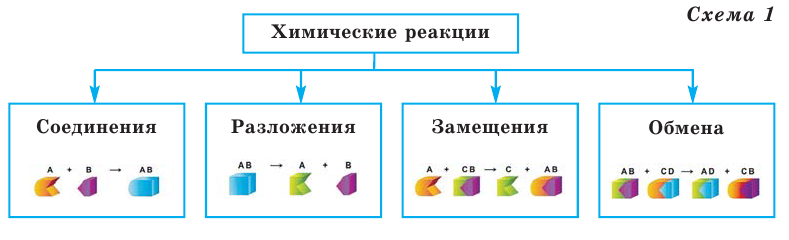
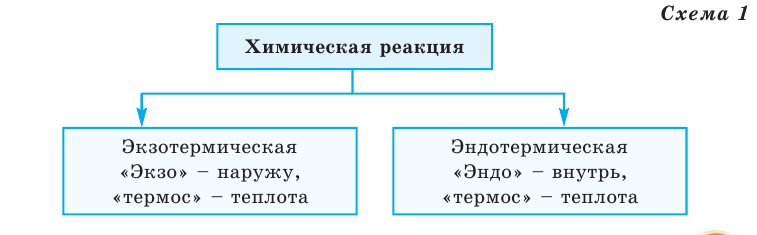
Все происходящие в природе явления делятся на 2 группы (схема 1)
Схема 1
Во время физических явлений изменяются лишь агрегатное состояние, форма, размеры, объём, давление, температура и скорочть движения вещества (рис.2). Например, замерзание воды, таяние льда, кипение воды и др.
1. Нагрейте медную проволку. 2. В отстоявшуюся известковую воду с помощью трубочки вдуньте воздух или же добавьте немного раствора соды. 3. Подожгите кусочек серы размером с горошину. Что вы наблюдаете в каждом случае?
Во время химических явлений из исходного вещества образуются новые вещества. Например, такие химические явления, как горение, брожение, гниение, электролиз, разложение на составные части, ржавление (коррозия) и др. называют химическими реакциями.
Химические реакции имеют несколько признаков. Эти признаки показывают протекание химических реакций (рис. 3).
Химические явления всегда сопровождаются физическими явлениями. Например, при горении природного газа, наряду с образованием углекислого газа и воды (химическое явление), также выделяются свет и теплота (физическое явление).
Значение физических и химических явлений
Из курса «Познание мира» вам известно, какое значение имеют физические явления, происходящие вокруг нас. Так, например, испарение воды, конденсация водяных паров и выпадение дождя составляют круговорот воды в природе. В промышленном производстве, придавая металлам, пластмассам и другим материалам определенную форму (штамповка, прокатка), получают разнообразные предметы.
Химические реакции имеют огромное значение. Ими пользуются для получения различных металлов (железа, алюминия, меди, цинка, свинца, олова и др.), а также пластмасс, минеральных удобрений, лекарственных препаратов и т.д. Выделяемая при сгорании топлива энергия используется в быту и в промышленности.
Условия начала и хода химических реакций бывают разными. Для протекания ряда реакций (например, реакций горения) достаточно соприкосновения (трения) частиц веществ и подогревания до определенной температуры. Доведение реакции до конца обеспечивается за счет выделяемой тепловой энергии.
Некоторые же реакции (например, разложение воды на кислород и водород) требуют подачи дополнительной энергии до конца.
В природе физические и химические явления (реакции) протекают непрерывно, постоянно, обеспечивая этим циркуляцию веществ, климатические изменения, условия жизни для живых организмов.
Химические уравнения. Знаки сохранения массы веществ
Смочите в пробирке около 2-х г хлорида натрия небольшим количеством воды. Влив в пробирку до четверти её объёма концентрированной серной кислоты, закройте её горлышко пробкой, через которую проходит газоотводная трубка. При этом кислота должна быть концентрированной, а соль — в виде кристаллов. Пробирку с содержащимися в ней солью и серной кислотой слегка подогрейте. Что вы наблюдаете? Происходят ли изменения в массах веществ в результате реакции? Запишите уравнение реакции.
Происходящие в природе химические превращения в письменном виде выражают посредством химических уравнений. Условная запись химической реакции посредством формул, знаков и коэффициентов называется химическим уравнением.
Химическое уравнение составляется на основе нижеприведённых правил:
- Записываются химические формулы веществ, вступающих в реакцию.
- Если число вступающих в реакцию веществ два и больше, между ними ставится знак « + ».
- Затем ставится знак
- После знака стрелки записываются химические формулы полученных веществ.
- При получении двух и более продуктов между ними ставится знак
Например, составим уравнение реакции горения водорода в кислороде:
Здесь количество атомов в правой и левой частях неодинаковое. Такую запись называют схемой реакции. Для того, чтобы превратить данную схему в уравнение, следует уравнять число атомов в левой и правой частях уравнения.
Уравнивание количества атомов элементов в правой и левой частях уравнения называют коэффицированием уравнения. Определим число атомов элементов, входящих в состав веществ в реакции образования воды.
Если обратим внимание на реакцию, то увидим, что количество атомов водорода в обеих частях одинаковое. А количество атомов кислорода в правой части на единицу меньше количества атомов кислорода в левой части. Вследствие этого, вначале уравним число атомов кислорода. Для этого число атомов в правой части реакции умножается на 2, и на основе этого определяется коэффициент веществ на левой стороне.
В результате количество атомов водорода и кислорода в левой и правой частях уравнивается и получается уравнение химической реакции. 2 молекулы водорода, вступая в реакцию с 1 молекулой кислорода, образуют 2 молекулы воды.
Впервые в 1748-ом году знаменитым русским учёным М.В.Ломоносовым, и независимо от него, в 1789-ом году французским учёным А.Лавуазье был открыт закон о том, что во время химических реакций сумма масс, вступающих в реакцию веществ, равна сумме масс, полученных в результате реакции веществ.
Закон сохранения массы веществ выражается следующим образом: Сумма масс веществ, вступивших в химическую реакцию, равна сумме масс веществ, полученных в результате реакции.
В колбу насыпают небольшое количество серы, после этого её закупоривают пробкой и взвешивают на весах (1). Затем колбу вместе с серой осторожно нагревают (2). На основе появления в колбе дыма, состоящего из частиц оксида серы (IV), можно определить протекание химической реакции.
При повторном взвешивании обнаруживается, что в результате реакции масса вещества осталась неизменной (3).
Типы химических реакций
Поместите в керамический тигель немного бихромата аммония 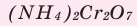
Что вы видите? Изложите свои соображения относительно происходящего процесса и запишите уравнение реакции. Почему эту реакцию называют «химическим вулканом»?
Химические реакции классифицируются по различным признакам. По количеству веществ, вступивших в реакцию и полученных в результате реакции, химические реакции подразделяются на 4 типа (схема 1):
Реакции соединения
Реакции, при которых из двух и более простых или сложных веществ получают одно сложное вещество, называют реакциями соединения.
Для протекания химических реакций иногда требуется нагревание. В таком случае в уравнениях реакций над стрелкой ставится
знак t.
Реакции разложения
Реакции, при которых из одного сложного вещества получают два и более простых или сложных веществ, называют реакциями разложения.
Если во время реакции выделяется газ, в таком случае, рядом с её химической формулой проставляется стрелка, направленная вверх
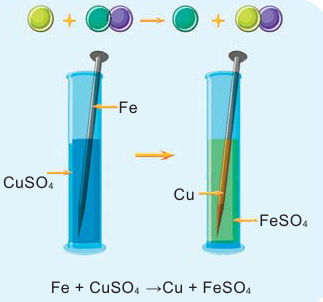
Реакции замещения
Если в реакциях, протекающих между простым и сложным веществом, атомы одного из элементов сложного вещества замещаются атомами простого вещества, то такие реакции называются реакциями замещения.
Опустите в раствор сульфата меди (II) 
Если во время реакции выпадает осадок, в таком случае, рядом с химической формулой полученного вещества проставляется стрелка, направленная вниз
Реакции обмена
Если в реакциях, протекающих между двумя сложными веществами, составные части сложных веществ, меняясь местами, образуют новые сложные вещества, то такие реакции называются реакциями обмена.
Тепловой эффект химических реакций
Наблюдаете ли вы за тем, какие изменения происходят в вашем организме во время занятий спортом, приготовления уроков и приёма пищи? Как в это время изменяется ваша энергия?
В жизни мы постоянно принимаем пищу, а также занимаемся определённой деятельностью (умственной и физической). Вначале мы, приняв пищу, увеличиваем свою энергию, а занимаясь различной деятельностью, тратим ту энергию, которую получили благодаря приёму пищи (т.е. наша энергия уменьшается), и в результате мы чувствуем себя усталыми и утомлёнными. Как и человек, каждое химическое вещество обладает определённым запасом энергии. Химические реакции веществ сопровождаются выделением или поглощением теплоты.
Количество выделяемой или поглощаемой в ходе химической реакции теплоты называется тепловым эффектом.
Тепловой эффект обозначается буквой Q, а единица его измерения — кДж. В зависимости от выделения или поглощения теплоты химические реакции делятся на 2 группы (схема 1)
Химические реакции, протекающие с выделением теплоты, называются экзотермическими реакциями. В уравнениях экзотермических реакций выделяемая теплота (Q) указывается в правой стороне реакции знаком «+» (Q>0).
Все реакции горения — экзотермические. Реакция между азотом и кислородом — эндотермическая. (Это не реакция горения).
Химические реакции, протекающие с поглощением теплоты, называются эндотермическими реакциями. В уравнениях эндотермических реакций поглощённая теплота указывается в правой стороне реакции знаком «— ». То есть Q
При копировании любых материалов с сайта evkova.org обязательна активная ссылка на сайт www.evkova.org
Сайт создан коллективом преподавателей на некоммерческой основе для дополнительного образования молодежи
Сайт пишется, поддерживается и управляется коллективом преподавателей
Whatsapp и логотип whatsapp являются товарными знаками корпорации WhatsApp LLC.
Cайт носит информационный характер и ни при каких условиях не является публичной офертой, которая определяется положениями статьи 437 Гражданского кодекса РФ. Анна Евкова не оказывает никаких услуг.
http://infourok.ru/fizicheskie-i-himicheskie-yavleniya-himicheskie-uravneniya-4764869.html
http://www.evkova.org/fizicheskie-i-himicheskie-yavleniya-v-himii