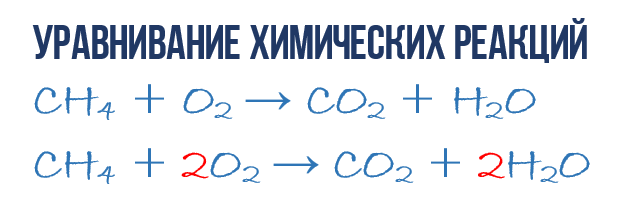Дифференциальные уравнения в медицине
Автор работы: Пользователь скрыл имя, 17 Сентября 2013 в 19:44, реферат
Краткое описание
Исследование многих физических и технических задач, а так же задач медицины, сводится к решению дифференциальных уравнений. С их помощью описывают волновые процессы и колебания, поэтому практическое применение дифференциальных уравнений очень разнообразно. В медицине дифференциальные уравнения используются, например: для определения скорости кровотока, скорости движения клапанов и стенок сердца (эхокардиография), определения вязкости крови и других параметров гемодинамики; для описания медико-биологических приложений ультразвука: эхоэнцефалограмма, УЗИ, ультразвуковая физиотерапия, ультразвуковая локация и кардиография; .
Прикрепленные файлы: 1 файл
реферат информатика.docx
Позволив говорить о половине собаки, мы допустили некоторую вольность, в дальнейшем мы усугубим эту вольность, используя такие понятия, как –3 кошки.
У. Сойер. Путь в современную математику
Исследование многих физических и технических задач, а так же задач медицины, сводится к решению дифференциальных уравнений. С их помощью описывают волновые процессы и колебания, поэтому практическое применение дифференциальных уравнений очень разнообразно.
В медицине дифференциальные уравнения используются, например:
- для определения скорости кровотока, скорости движения клапанов и стенок сердца (эхокардиография), определения вязкости крови и других параметров гемодинамики;
- для описания медико-биологических приложений ультразвука: эхоэнцефалограмма, УЗИ, ультразвуковая физиотерапия, ультразвуковая локация и кардиография;
- для описания процессов физиологической акустики, которая изучает устройство и работу звуковоспринимающих и звуковоспроизводящих органов человека и животных;
- для определения функции изменения численности популяции микроорганизмов в зависимости от времени.
Эти и другие области применения дифференциальных уравнений делают их одной из самых актуальных и важных разделов математики.
Первой содержательной математической моделью, описывающей биологические сообщества (если не считать исследований Фибоначчи популяции кроликов, приведших его к знаменитым числам, носящим его имя, а также исследований Мальтуса, приведших впоследствии к известному уравнению xy’ = ax (a > 0) мальтузианского роста) была модель Лотки — Вольтерры. Она описывает популяцию, состоящую из двух взаимодействующих видов. Первый из них, именуемый хищниками, при отсутствии второго вымирает по закону
а второй — жертвы — при отсутствии хищников неограниченно размножается в соответствии с законом Мальтуса. Взаимодействие двух этих видов моделируется так. Жертвы вымирают со скоростью, равной числу встреч хищников и жертв, которое в данной модели предполагается пропорциональным численности обеих популяций, т. е. равной dxy (d > 0). Поэтому
Хищники же размножаются со скоростью, пропорциональной числу съеденных жертв:
(c > 0). Система уравнений
описывающая такую популяцию хищник — жертва и называется системой (или моделью) Лотки — Вольтерры.
Таким образом, численности популяций хищников и жертв совершают рассогласованные по фазе автоколебания (см. рис.1). Такое поведение часто наблюдается в природе (классическая ссылка здесь на отчет Компании Гудзонова залива, которая в течение долгих лет наблюдала за численностью популяций зайцев и рысей в Канаде). Однако, система Лотки — Вольтерры обладает одним существенным недостатком: она неустойчива по отношению к малым возмущениям самой модели, точнее, не является грубой.
Поскольку в реальных популяциях присутствует много возмущающих факторов, не учтенных в модели Лотки — Вольтерры, эта модель вряд ли может претендовать на адекватное описание реальности. Этого недостатка лишена модель Холлинга — Тэннера, учитывающая большее число реальных факторов. В этой модели скорость изменения популяции хищников задается выражением ax – bx2/y = x(a – bx/y). Оно выбрано из следующих соображений. Когда пищи (жертв) много (y » +Ґ), популяция хищников растет по правилу Мальтуса с показателем a. С уменьшением числа жертв скорость роста популяции хищников падает и при y 0). Это выражение правдоподобнее описывает межвидовое взаимодействие, нежели соответствующий член –dxy модели Лотки — Вольтерры. В последней число жертв, убиваемых одним хищником за единицу времени, равно dy и растет пропорционально числу жертв, что неправдоподобно. В модели Холлинга — Тэннера коэффициент хищничества равен py/(q + y). Он не может превышать величины p/q и при неограниченном росте популяции жертв стремится, монотонно возрастая, к числу p/q, выражающему естественную потребность хищников в пище. В результате получается следующая система уравнений (модель Холлинга — Тэннера)
yy’ = [c – dy – px/(q + y)]y.
Системы уравнений, возникающие при описании биологических популяций, во многом близки к системам дифференциальных уравнений, описывающих кинетику химических реакций. К слову сказать, система Лотки — Вольтерры была первоначально выведена Лоткой как система, описывающая некоторую гипотетическую химическую реакцию (см. реакцию (6) ниже), и лишь позже Вольтерра вывел ее как систему, описывающую популяцию хищник — жертва.
Химическая кинетика описывает химические реакции с помощью так называемых стехиометрических уравнений. Простейший пример такого уравнения — это известное уравнение горения водорода: H2 + O2 = H2O. Общий вид стехиометрического уравнения химической реакции таков:
(натуральные числа ml и nl называются стехиометрическими коэффициентами). Это символическая запись химической реакции, в которой m1 молекул реагента X1, m2 молекул реагента X2, . mp молекул реагента Xp, вступив в реакцию образуют n1 молекул вещества Y1, n2 молекул вещества Y2, . nq молекул вещества Yq. Основной закон, выражающий скорость протекания реакции (5) — закон действующих масс — гласит: скорость протекания реакции пропорциональна концентрациям реагентов. Поэтому, если обозначить буквами xl, концентрации соответствующих веществ, то
здесь K — константа скорости протекания реакции (она обычно пишется в уравнении (5) над стрелкой и измеряется в моль–1·с–1).
Система Лотки — Вольтерры описывает гипотетическую трехстадийную реакцию вида
в которой концентрации a и b исходного реагента A и продукта реакции B поддерживаются постоянными (эта реакция является открытой в том смысле, что реактор обменивается веществами A и B с окружающей средой). Тогда в силу закона действующих масс
Последняя система с точностью до коэффициентов совпадает с моделью Лотки — Вольтерры (a = const). Несколько слов о том, как получается система (7) – (8). В первой реакции «со скоростью K1ax» исчезает одна молекула вещества X и с этой же скоростью появляются две молекулы этого вещества. Суммарная скорость изменения концентрации реагента X в результате первой реакции следовательно равна –K1ax + 2K1ax = K1ax. Во второй реакции, очевидно, концентрация X убывает со скоростью –K2xy. Наконец, в третьей реакции X не участвует. В итоге получается уравнение (7). Уравнение (8) выводится аналогично.
Системы уравнений химической кинетики, описывающие реакции, представляющие практических интерес, обычно имеют большие размерности, сильные нелинейности и малые сингулярно возмущающие параметры. Их численное исследование осложняется еще и тем, что эти системы, как правило, жесткие, что вынуждает разрабатывать специальные методы приближенного исследования.
Математическая модель эпидемии
Применение дифференциальных уравнений в медицине мы продемонстрируем на примере простейшей математической модели эпидемии. Отметим здесь же, что вышеописанные приложения дифференциальных уравнений в биологии и химии тоже имеют медицинский оттенок, поскольку в медицине важную роль играет исследование различных биологических популяций (например, популяции болезнетворных бактерий) и исследование химических реакций в организме (например, ферментативных).
В модели описывается распространение инфекционного заболевания в изолированной популяции. Особи популяции делятся на три класса. Инфицированный класс численностью x(t) (t — время) состоит из инфицированных (заболевших) особей, каждая из этих особей заразна (предполагается, что инкубационный период заболевания пренебрежимо короток). Второй класс численностью y(t) составляют восприимчивые особи, т. е. особи, которые могут заразиться при контакте с инфицированными особями. И, наконец, третий класс состоит из невосприимчивых особей (приобретших иммунитет или погибших в результате заболевания). Его численность обозначается z(t). Предполагается также, что общая численность популяции n постоянна (т. е. не учитываются рождения, естественные смерти и миграция). Две гипотезы, лежащие в основе модели таковы:
1) заболеваемость в момент времени t равна x(t)y(t) (эта гипотеза основывается на правдоподобном предположении, что число заболевающих пропорционально числу встреч между больными и восприимчивыми особями, которое в свою очередь в первом приближении пропорционально x( t)y(t)); таким образом численность класса x растет, а численность класса y убывает со скоростью ax(t)y(t) (a > 0);
2) численность становящихся невосприимчивыми особей (приобретших иммунитет или погибших) растет со скоростью, пропорциональной численности заболевших, т. е. со скоростью bx(t) (b > 0). В результате мы получаем систему уравнения:
Урок 13. Составление химических уравнений
В уроке 13 «Составление химических уравнений» из курса «Химия для чайников» рассмотрим для чего нужны химические уравнения; научимся уравнивать химические реакции, путем правильной расстановки коэффициентов. Данный урок потребует от вас знания химических основ из прошлых уроков. Обязательно прочитайте об элементном анализе, где подробно рассмотрены эмпирические формулы и анализ химических веществ.
Химическое уравнение
В результате реакции горения метана CH4 в кислороде O2 образуются диоксид углерода CO2 и вода H2O. Эта реакция может быть описана химическим уравнением:
Попробуем извлечь из химического уравнения больше сведений, чем просто указание продуктов и реагентов реакции. Химичекое уравнение (1) является НЕполным и потому не дает никаких сведений о том, сколько молекул O2 расходуется в расчете на 1 молекулу CH4 и сколько молекул CO2 и H 2 O получается в результате. Но если записать перед соответствующими молекулярными формулами численные коэффициенты, которые укажут сколько молекул каждого сорта принимает участие в реакции, то мы получим полное химическое уравнение реакции.
Для того, чтобы завершить составление химического уравнения (1), нужно помнить одно простое правило: в левой и правой частях уравнения должно присутствовать одинаковое число атомов каждого сорта, поскольку в ходе химической реакции не возникает новых атомов и не происходит уничтожение имевшихся. Данное правило основывается на законе сохранения массы, который мы рассмотрели в начале главы.
Уравнивание химических реакций
Уравнивание химических реакций нужно для того, чтобы из простого химического уравнения получить полное. Итак, перейдем к непосредственному уравниванию реакции (1): еще раз взгляните на химическое уравнение, в точности на атомы и молекулы в правой и левой части. Нетрудно заметить, что в реакции участвуют атомы трех сортов: углерод C, водород H и кислород O. Давайте подсчитаем и сравним количество атомов каждого сорта в правой и левой части химического уравнения.
Начнем с углерода. В левой части один атом С входит в состав молекулы CH4, а в правой части один атом С входит в состав CO2. Таким образом в левой и в правой части количество атомов углерода совпадает, поэтому его мы оставляем в покое. Но для наглядности поставим коэффициент 1 перед молекулами с углеродом, хоть это и не обязательно:
Затем переходим к подсчету атомов водорода H. В левой части присутствуют 4 атома H (в количественном смысле H4 = 4H) в составе молекулы CH4, а в правой – всего 2 атома H в составе молекулы H2O, что в два раза меньше чем в левой части химического уравнения (2). Будем уравнивать! Для этого поставим коэффициент 2 перед молекулой H2O. Вот теперь у нас и в реагентах и в продуктах будет по 4 молекулы водорода H:
Обратите свое внимание, что коэффициент 2, который мы записали перед молекулой воды H2O для уравнивания водорода H, увеличивает в 2 раза все атомы, входящие в ее состав, т.е 2H2O означает 4H и 2O. Ладно, с этим вроде бы разобрались, осталось подсчитать и сравнить количество атомов кислорода O в химическом уравнении (3). Сразу бросается в глаза, что в левой части атомов O ровно в 2 раза меньше чем в правой. Теперь-то вы уже и сами умеете уравнивать химические уравнения, поэтому сразу запишу финальный результат:
Как видите, уравнивание химических реакций не такая уж и мудреная штука, и важна здесь не химия, а математика. Уравнение (4) называется полным уравнением химической реакции, потому что в нем соблюдается закон сохранения массы, т.е. число атомов каждого сорта, вступающих в реакцию, точно совпадает с числом атомов данного сорта по завершении реакции. В каждой части этого полного химического уравнения содержится по 1 атому углерода, по 4 атома водорода и по 4 атома кислорода. Однако стоит понимать пару важных моментов: химическая реакция — это сложная последовательность отдельных промежуточных стадий, и потому нельзя к примеру истолковывать уравнение (4) в том смысле, что 1 молекула метана должна одновременно столкнуться с 2 молекулами кислорода. Процессы происходящие при образовании продуктов реакции гораздо сложнее. Второй момент: полное уравнение реакции ничего не говорит нам о ее молекулярном механизме, т.е о последовательности событий, которые происходят на молекулярном уровне при ее протекании.
Коэффициенты в уравнениях химических реакций
Еще один наглядный пример того, как правильно расставить коэффициенты в уравнениях химических реакций: Тринитротолуол (ТНТ) C7H5N3O6 энергично соединяется с кислородом, образуя H2O, CO2 и N2. Запишем уравнение реакции, которое будем уравнивать:
Проще составлять полное уравнение, исходя из двух молекул ТНТ, так как в левой части содержится нечетное число атомов водорода и азота, а в правой — четное:
- 2C7H5N3O6 + O2 → CO2 + H2O + N2 (6)
Тогда ясно, что 14 атомов углерода, 10 атомов водорода и 6 атомов азота должны превратиться в 14 молекул диоксида углерода, 5 молекул воды и 3 молекулы азота:
Теперь в обеих частях содержится одинаковое число всех атомов, кроме кислорода. Из 33 атомов кислорода, имеющихся в правой части уравнения, 12 поставляются двумя исходными молекулами ТНТ, а остальные 21 должны быть поставлены 10,5 молекулами O2. Таким образом полное химическое уравнение будет иметь вид:
Можно умножить обе части на 2 и избавиться от нецелочисленного коэффициента 10,5:
Но этого можно и не делать, поскольку все коэффициенты уравнения не обязательно должны быть целочисленными. Правильнее даже составить уравнение, исходя из одной молекулы ТНТ:
Полное химическое уравнение (9) несет в себе много информации. Прежде всего оно указывает исходные вещества — реагенты, а также продукты реакции. Кроме того, оно показывает, что в ходе реакции индивидуально сохраняются все атомы каждого сорта. Если умножить обе части уравнения (9) на число Авогадро NA=6,022·10 23 , мы сможем утверждать, что 4 моля ТНТ реагируют с 21 молями O2 с образованием 28 молей CO2, 10 молей H2O и 6 молей N2.
Есть еще одна фишка. При помощи таблицы Менделеева определяем молекулярные массы всех этих веществ:
- C 7 H 5 N 3 O 6 = 227,13 г/моль
- O 2 = 31,999 г/моль
- CO 2 = 44,010 г/моль
- H 2 O = 18,015 г/моль
- N 2 = 28,013 г/моль
Теперь уравнение 9 укажет еще, что 4·227,13 г = 908,52 г ТНТ требуют для осуществления полной реакции 21·31,999 г = 671,98 г кислорода и в результате образуется 28·44,010 г = 1232,3 г CO2, 10·18,015 г = 180,15 г H2O и 6·28,013 г = 168,08 г N2. Проверим, выполняется ли в этой реакции закон сохранения массы:
| Реагенты | Продукты | |
| 908,52 г ТНТ | 1232,3 г CO 2 | |
| 671,98 г CO 2 | 180,15 г H 2 O | |
| 168,08 г N 2 | ||
| Итого | 1580,5 г | 1580,5 г |
Но необязательно в химической реакции должны участвовать индивидуальные молекулы. Например, реакция известняка CaCO 3 и соляной кислоты HCl, с образованием водного раствора хлорида кальция CaCl 2 и диоксида углерода CO 2 :
Химическое уравнение (11) описывает реакцию карбоната кальция CaCO3 (известняка) и хлористоводородной кислоты HCl с образованием водного раствора хлорида кальция CaCl2 и диоксида углерода CO2. Это уравнение полное, так как число атомов каждого сорта в его левой и правой частях одинаково.
Смысл этого уравнения на макроскопическом (молярном) уровне таков: 1 моль или 100,09 г CaCO3 требует для осуществления полной реакции 2 моля или 72,92 г HCl, в результате чего получается по 1 молю CaCl2 (110,99 г/моль), CO2 (44,01 г/моль) и H2O (18,02 г/моль). По этим численным данным нетрудно убедиться, что в данной реакции выполняется закон сохранения массы.
Интерпретация уравнения (11) на микроскопическом (молекулярном) уровне не столь очевидна, поскольку карбонат кальция представляет собой соль, а не молекулярное соединение, а потому нельзя понимать химическое уравнение (11) в том смысле, что 1 молекула карбоната кальция CaCO3 реагирует с 2 молекулами HCl. Тем более молекула HCl в растворе вообще диссоциирует (распадается) на ионы H + и Cl — . Таким образом более правильным описанием того, что происходит в этой реакции на молекулярном уровне, дает уравнение:
Здесь в скобках сокращенно указано физическое состояние каждого сорта частиц (тв. — твердое, водн. — гидратированный ион в водном растворе, г. — газ, ж. — жидкость).
Уравнение (12) показывает, что твердый CaCO3 реагирует с двумя гидратированными ионами H + , образуя при этом положительный ион Ca 2+ , CO2 и H2O. Уравнение (12) как и другие полные химические уравнения не дает представления о молекулярном механизме реакции и менее удобно для подсчета количества веществ, однако, оно дает лучшее описание происходящего на микроскопическом уровне.
Закрепите полученные знания о составлении химических уравнений, самостоятельно разобрав пример с решением:
Надеюсь из урока 13 «Составление химических уравнений» вы узнали для себя что-то новое. Если у вас возникли вопросы, пишите их в комментарии.
Как расставлять коэффициенты в химических уравнениях
Содержание:
Все химические реакции, проходящие в окружающем мире можно описать при помощи специальных уравнений, представляющих собой химические формулы и математические знаки с коэффициентами. И от правильно расставленных коэффициентов в химических уравнениях порой зависит не много не мало, а то какой собственно и будет химическая реакция и будет ли она вообще. В нашей статье мы расскажем о том, как правильно расставлять коэффициенты в химии, чтобы химические уравнения были записаны верно.
Пример разбора простых реакций
Главное правило, которым следует руководствоваться при составлении химических уравнений – принцип сохранения энергии вещества, то есть, сколько есть атомов каждого химического элемента в левой части уравнения, столько должно быть и в правой части того же уравнения.
Для примера возьмем химическую реакцию взаимодействия кальция (Ca) с кислородом (O2). Но для начала объясним, почему вообще кислород (как и некоторые другие химических элементы) в химических уравнениях записывается с индексом «2». Дело в том, что одна молекула кислорода имеет 2 атома, поэтому его записывают как O2. В свою очередь, к примеру, одна молекула воды, состоящая из кислорода и водорода, имеет всем известную формулу H2O. Это означает, что каждая молекула воды состоит из двух атомов водорода и одного атома кислорода. Заметьте, что по своему усмотрению индексы в химических уравнениях и формулах менять нельзя, так как они изначально должны быть написаны правильно.
Теперь вернемся к нашему простому примеру реакции взаимодействия кальция и кислорода. Ее можно записать следующим образом:
О чем говорит эта запись? О том, что в результате химической реакции взаимодействия кальция с кислородом образуется оксид кальция, который записан формулой CaO. Но также обратите внимание, что в правой части оксид кальция мы записали с коэффициентом 2 – 2CaO. Это значит, что каждый из двух атомов кислорода сцепился со своим атомом кальция, но тогда происходит несоответствие – в правой стороне у нас два атома кальция, в то время как в левой только лишь один. А значит, чтобы запись была правильной в левой части мы должны перед кальцием поставить коэффициент 2:
Теперь мы можем проверить наше уравнение – с левой стороны у нас два атома кальция и с правой тоже два, а значит между обеими частями можно вполне справедливо поставить знак равенства:
Разберем еще один простой пример, из взаимодействия кислорода и водорода как мы знаем, рождается одно из самых ценным и необычных веществ во Вселенной (и это без преувеличения) – вода, основа жизни на нашей планете. Образование воды можно записать следующим уравнением:
Но где же здесь закралась ошибка? Давайте разберем: в левой части у нас два атома кислорода, а в правой только один. Значит перед формулой воды необходимо поставить коэффициент 2:
Умножение 2 молекул воды на 2 атома водорода даст нам 4 атома водорода с правой стороны, но ведь с левой стороны атомов водорода лишь два! Значить перед водородом в уравнении мы также должны поставить коэффициент 2 и теперь получим правильное химическое уравнение, где вместо стрелочки → можно уже смело поставить знак равенства.
Пример разбора сложной реакции
Теперь давайте разберем то, как проставлять коэффициенты в более сложных химических уравнениях:
Перед вами запись так званой реакции нейтрализации – взаимодействие кислоты и основания, в результате которого образуются соли и вода.
Что же мы имеем тут: с левой стороны у нас один атом натрия (Na), а с правой индекс говорит, что атомов натрия уже стало два. Значит логично, что химическую формулу основания гидроксида натрия NaOH надо умножить на 2. Или другими словами поставить перед ней коэффициент 2:
Количество серы в серной кислоте (H2SO4) и соли сульфате натрия (Na2SO4) у нас одинаковое, тут все хорошо, а вот с количеством кислорода и водорода опять несоответствие, с левой стороны кислорода 6, а с правой 5. Водорода с правой стороны 4, а с левой только 2, непорядок. Чтобы правильно записать это химическое уравнение надо сравнять количество кислорода и водорода в левой и правой части уравнения, к счастью тут сделать это просто, надо перед H2O поставить коэффициент 2.
Таким образом, количество всех химических элементов в правой и левой части уравнения у нас сравнялись, а значит, мы неспроста поставили знак равенства.
Для закрепления материала разберем еще один пример сложного уравнения.
Это уравнение отображает химическую реакцию гидроксида бария (Ba(OH)2) с азотной кислотой (HNO3) в результате которой образуется нитрат бария (Ba(NO3)2) и вода.
Пример этот нам интересен тем, что тут используются скобки. Они означают, что если множитель стоит за скобками, то каждый элемент умножается на него. Начнем же разбирать это уравнение, первое, что бросается в глаза, несоответствие азота N, слева он один, а вот справа, если принимать во внимание скобки, его уже два. Получим следующее:
Теперь у нас слева стало 4 атома водорода, а справа только 2. Значит, перед формулой воды также ставим коэффициент 2.
Теперь все элементы уравнены, и мы справедливо поставили знак равенства.
Видео
И чтобы окончательно закрепить материал, рекомендуем посмотреть это образовательное видео.
http://himi4ka.ru/arhiv-urokov/urok-13-sostavlenie-himicheskih-uravnenij.html
http://www.poznavayka.org/himiya/kak-rasstavlyat-koefficzienty-v-himicheskih-uravneniyah/