Задание 4
Составьте уравнения реакций, в результате которых можно получить водород. Укажите, к какому типу относятся эти реакции.
Разложение воды при действии постоянного электрического тока:
2H2O постоянный ток ⟶ 2H2↑ + O2↑ – реакция разложения.
При взаимодействии некоторых металлов с кислотами, например при взаимодействии цинка с раствором соляной кислоты:
Zn + 2HCl ⟶ ZnCl2 + H2↑ – реакция замещения.
При взаимодействии активных металлов (например, Na) с водой:
2Na + 2HOH ⟶ 2NaOH + H2↑ – реакция замещения.
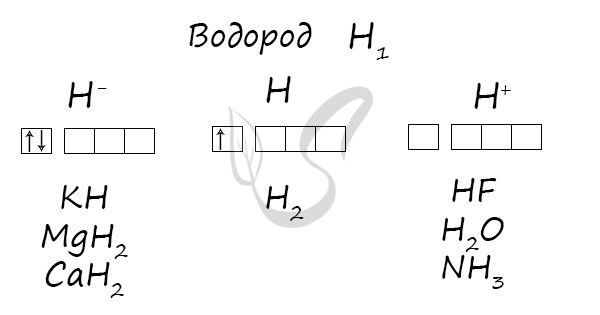
Водород
Водород (лат. hydrogenium = греч. ὕδωρ — вода + γεννάω — рождаю) — самый легкий химический элемент, при обычных условиях — газ без цвета, запаха и вкуса. В соединении с кислородом образует воду.
Водород — самый распространенный элемент Вселенной, входит в состав всего живого и небесных тел (73% массы Солнца).
Степени окисления
Проявляет степени окисления: -1, 0, +1.
Получение
В промышленности водород получают различными методами:
- Конверсия с водяным паром при t = 1000 °C
Методом газификации угля, торфа, сланца
Электролизом водных растворов щелочей
Каталитическим окислением кислородом (неполное окисление)
Лабораторные методы традиционно отличаются от промышленных своей простотой. В лаборатории водород получают:
- Вытеснением водорода из кислот
Взаимодействием активных металлов с водой
Реакцией цинка или алюминия с раствором щелочи
Химические свойства
В реакциях водород проявляет себя как восстановитель и окислитель. Как восстановитель реагирует с элементами, электроотрицательность которых выше, чем у водорода:
Как восстановитель реагирует с кислородом, галогенами, азотом, серой, оксидами металлов. При комнатной температуре из перечисленных реакция идет только со фтором.
H2 + F2 → HF (со взрывом в темноте)
H2 + Cl2 → (t) HCl (со взрывом только на свету)
Na + H2 → NaH (гидрид натрия)
Химические свойства:
- Реакция с металлами
Металлы, стоящие в ряду активности до водорода, вытесняют водород из воды.
Реакции с основными и кислотными оксидами
Реагирует с основными оксидами — с образованием оснований (реакция идет, если основание растворимо), и с кислотными оксидами — с образованием соответствующих кислот. Не забывайте сохранять степени окисления!
Отмечу здесь реакцию двойного гидролиза, которая заключается в гидролизе одной соли по катиону (CrBr3), а другой — по аниону (Na2CO3).
Реакция с гидридами активных металлов
Реакции с C, CO, CH4
Cl2 + H2O → HCl + HClO (соляная и хлорноватистая кислоты — без нагревания)
Cl2 + H2O → HCl + HClO3 (соляная и хлорноватая кислоты — при нагревании)
Кристаллогидраты
Кристаллогидраты — кристаллические соединения, содержащие молекулы воды как самостоятельные структурные единицы. Вода, входящая в состав кристаллогидратов, называется кристаллической. Примеры: CaSO4*2H2O, Na2SO4*10H2O.
При нагревании кристаллогидраты теряют воду. Одним из наиболее известных кристаллогидратов является медный купорос: CuSO4*5H2O. Медный купорос имеет характерный голубой цвет, а безводный сульфат меди — белый.
В задачах бывает дана масса медного купороса. Надо помнить о том, что часто в реакции не участвует кристаллическая вода. В таком случае следует вычесть кристаллизационную воду и найти массу безводного сульфата калия.
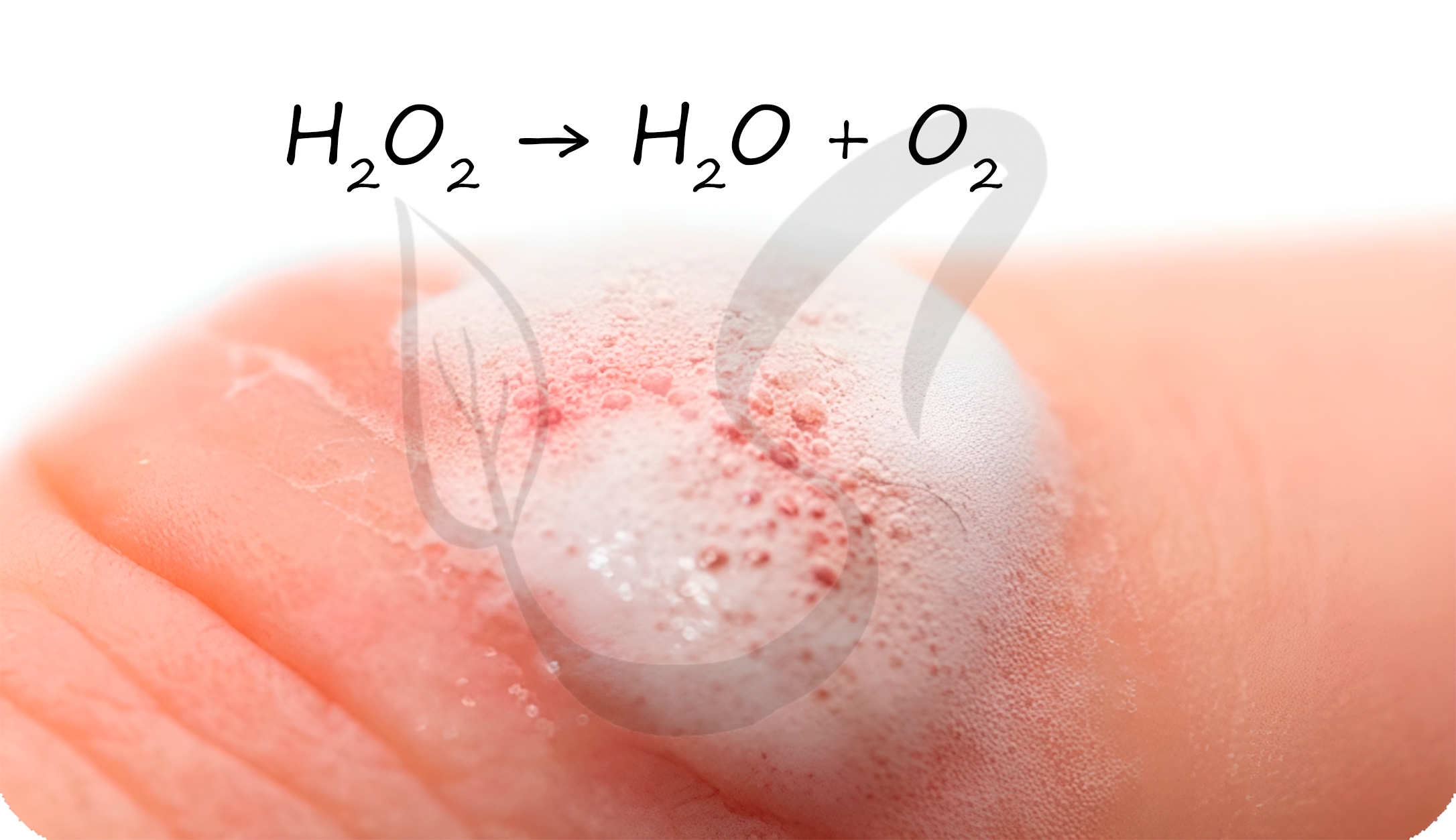
Пероксид водорода
Представляет собой бесцветную жидкость с металлическим вкусом. Концентрированные растворы пероксида водорода взрывоопасны.
Получают пероксид водорода в реакции с пероксидами и супероксидами металлов.
В разбавленных растворах пероксид водорода легко разлагается:
Также перекись проявляет окислительные свойства:
Перекисью водорода обрабатывают раневую поверхность. Выделяющийся при разложении атомарный кислород разрушает бактериальные клетки, предотвращая осложнение в виде бактериальной инфекции.
© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Получение водорода и изучение его свойств
Этот видеоурок доступен по абонементу
У вас уже есть абонемент? Войти
Данный урок является практическим занятием в рамках изучения темы «Вещества и их свойства». В ходе занятия проводятся опыты по получению водорода и проверке его на чистоту, а также рассматривается реакция горения водорода и его взаимодействие с оксидом меди (II).
http://studarium.ru/article/162
http://interneturok.ru/lesson/chemistry/8-klass/bvewestva-i-ih-prevraweniyab/poluchenie-vodoroda-i-izuchenie-ego-svoystv