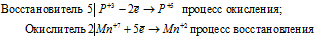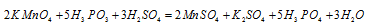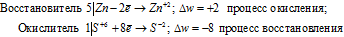Биология. Химия.
ОВР
Скачать полную версию
Уравнению окислительно-восстановительной экзотермической реакции соответствует запись
1)
2)
3)
4)
Уравнению эндотермической реакции, протекающей без изменения степени окисления, соответствует запись
1)
2)
3)
4)
В реакции, схема которой
1)
2)
3)
4)
Элемент углерод является восстановителем в реакции
1)
2)
3)
4)
Элемент азот является окислителем в реакции
1)
2)
3)
4)
Сумма коэффициентов в уравнении реакции между алюминием и соляной кислотой равна
1)
2)
3)
4)
При взаимодействии с каким из указанных веществ аммиак является восстановителем?
1)
2)
3)
4)
При взаимодействии с каким из указанных веществ сера является восстановителем?
1)
2)
3)
4)
Коэффициент перед алюминием в уравнении реакции алюминия с раствором серной кислоты равен
1)
2)
3)
4)
В реакции, схема которой
1)
2)
3)
4)
Какое уравнение соответствует окислительно-восстановительной реакции?
1)
2)
3)
4)
Какая из перечисленных реакций являяется окислительно-восстановительной?
1)
2)
3)
NaOH + HI = NaI + H2O
4)
В уравнении химической реакции, схема которой
сумма всех коэффициентов
1)
2)
3)
4)
Взаимодействию сульфата меди (II) и гидроксида натрия соответствует сокращённое ионное уравнение
Классификация реакций
Существует несколько классификаций реакций, протекающих в неорганической и органической химии.
По характеру процесса
- Соединения
Так называют химические реакции, где из нескольких простых или сложных веществ получается одно сложное вещество. Примеры:
В результате реакции разложения сложное вещество распадается на несколько сложных или простых веществ. Примеры:
В ходе реакций замещения атом или группа атомов в молекуле замещаются на другой атом или группу атомов. Примеры:
К реакциям обмена относятся те, которые протекают без изменения степеней окисления и выражаются в обмене компонентов между веществами. Часто обмен происходит анионами/катионами:
AgF + NaCl = AgCl↓ + NaF
Окислительно-восстановительные реакции (ОВР)
Это те химические реакции, в процессе которых происходит изменение степеней окисления химических элементов, входящих в состав исходных веществ. ОВР подразделяются на:
- Межмолекулярные — атомы окислителя и восстановителя входят в состав разных молекул. Примеры:
Внутримолекулярные — атомы окислителя и восстановителя в составе одного сложного вещества. Примеры:
Диспропорционирование — один и тот же атом является и окислителем, и восстановителем
Замечу, что окислителем и восстановителем могут являться только исходные вещества (а не продукты!) Окислитель всегда понижает свою СО, принимая электроны в процессе восстановления. Восстановитель всегда повышает свою СО, отдавая электроны в процессе окисления.
От обилия информации можно запутаться. Я рекомендую сформулировать четко: «Окислитель — понижает СО, восстановитель — повышает СО». Запомнив эту информацию таким образом, вы не будете путаться.
ОВР уравнивают методом электронного баланса, с которым мы подробно познакомимся в разделе «Решения задач».
Обратимые и необратимые реакции
Обратимые реакции — такие химические реакции, которые протекают одновременно в двух противоположных направлениях: прямом и обратном. При записи реакции в таких случаях вместо знака «=» ставят знак обратимости «⇆».
Классическим примером обратимой реакции является синтез аммиака и реакция этерификации (из органической химии):
Необратимые реакции протекают только в одном направлении, до полного расходования одного из исходных веществ. Главное отличие их от обратимых реакций в том, что образовавшиеся продукты реакции не взаимодействуют между собой с образованием исходных веществ.
Иногда сложно бывает отличить обратимую реакцию от необратимой, однако я дам несколько советов, которые советую взять на вооружение. В результате необратимых реакций:
- Образуются малодиссоциирующие вещества (например — вода, однако есть исключения — реакция этерификации)
- Реакция сопровождается выделение большого количества тепла
- В ходе реакции образуется газ или выпадает осадок
Примеры необратимых реакций:
NaOH + HCl = NaCl + H2O (образуется вода)
2Na + 2H2O = 2NaOH + H2 (сопровождается выделением большого количества тепла)
Реакции и агрегатное состояние фаз
Фазой в химии называют часть объема равновесной системы, однородную во всех своих точках по химическому составу и физическим свойствам и отделенную от других частей того же объема поверхностью раздела. Фаза бывает жидкой, твердой и газообразной.
Все реакции можно разделить на гетеро- и гомогенные. Гетерогенные реакции (греч. heterogenes — разнородный) — реакции, протекающие на границе раздела фаз, в неоднородной среде. Скорость таких реакций зависит от площади соприкосновения реагирующих веществ.
К гетерогенным реакциям относятся следующие реакции (примеры): жидкость + газ, газ + твердое вещество, твердое вещество + жидкость. Примером такой реакции может послужить взаимодействие твердого цинка и раствора соляной кислоты:
Гомогенные реакции (греч. homogenes — однородный) — реакции, протекающие между веществами, находящимися в одной фазе.
К гомогенным реакциям относятся (примеры): жидкость + жидкость, газ + газ. Примером такой реакции может служить взаимодействие между растворами уксусной кислоты и едкого натра.
Реакции и их тепловой эффект
Все реакции можно разделить на те, в ходе которых тепло поглощается, или, наоборот, тепло выделяется. Представьте пробирку, охлаждающуюся или нагревающуюся в вашей руке — это и есть тот самый тепловой эффект. Иногда тепла выделяется так много, что реакции сопровождаются воспламенением или взрывом (натрий с водой).
Экзотермические реакции (греч. exo — вне) — химические реакции, сопровождающиеся потерей энергии системой и выделением тепла (той самой энергии) во внешнюю среду. При написании химических реакций в конце экзотермических ставят «+ Q» (Q — тепло), иногда бывает указано точное количество выделяющегося тепла. Например:
2Mg + O2 = 2MgO + Q
NaOH + HCl = NaCl + H2O + 56 кДж
К экзотермическим реакциям часто относятся реакции горения, соединения.
Исключением является взаимодействие азота и кислорода, при котором тепло поглощается:
Как уже было отмечено выше, если тепло выделяется во внешнюю среду, значит, система реагирующих веществ потеряло это тепло. Поэтому не должно казаться противоречием, что внутренняя энергия веществ в результате экзотермической реакции уменьшается.
Энтальпией называют (обозначение Н), количество термодинамической (тепловой) энергии, содержащееся в веществе. Иногда с целью «запутывания» в реакции вместо явного +Q при экзотермической реакции могут написать ΔH 0, так как внутренняя энергия веществ увеличивается. Например:
CaCO3 = CaO + CO2↑ ; ΔH > 0 (значит реакция эндотермическая, так как внутренняя энергия увеличивается)
Замечу, что не все реакции разложения являются эндотермическими. Широко известная реакция разложения дихромата аммония («вулканчик») является примером экзотермического разложения, при котором тепло выделяется.
© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Методы составления уравнений окислительно-восстановительных реакций (овр)
Окислительно-восстановительными (ОВР) называются реакции, сопровождающиеся изменением степени окисления атомов, входящих в состав реагирующих веществ. Под степенью окисления (О) понимают стехиометрическую валентность со знаком (+) или (-). Знак (+) приписывают более электроположительному элементу (металлу), а (–) более электроотрицательному (неметаллу). Окисление-восстановление — это единый, взаимосвязанный процесс.
Окисление соответствует увеличению степени окисления элемента, а восстановление — ее уменьшению.
Степень окисления простых ионов совпадает с их зарядом: Fe 3+ , K + , Cl — и т. д. Степень окисления сложного нона совпадает с его зарядом (NH4 + ), (SO4 2— ), (PO4 3— ) и. т. д.
Степень окисления атома внутри сложного иона или молекулы прямо не связана с зарядом на этом атоме. Например, заряд атома Сr в молекулах CrCl2, CrCl3, K2CrO4 равен 1,9; 1,3 и 0,2 заряда электрона (со знаком ‘+‘), а степени окисления — +2, +3 и +6 соответственно. Нахождение степени окисления основывается на следующем правиле: сумма степеней окисления атомов в молекуле равна нулю, а в сложном ионе равна заряду этого иона. Атом, находящийся в высшей степени окисления, может быть только окислителем, если он находится в низшей степени окисления — только восстановителем, а если он обладает промежуточной степенью окисления, то может быть и окислителем и восстановителем. Например: N +5 (HNO3), S +6 (H2SO4) — проявляют только окислительные свойства (высшая степень окисления); N +4 (NO2), S +4 (SO2) — проявляют окислительные и восстановительные свойства (промежуточные степени окисления); N -3 (NH3), S -2 (H2S) — проявляют только восстановительные свойства (низшие степени окисления).
Для реакций окисления-восстановления применяют два метода составления уравнений: метод баланса степеней окисления и метод полуреакций.
Метод баланса степеней окисления
При этом методе для нахождения коэффициентов учитывают правило, согласно которому общее изменение степеней окисления в реакции равно нулю, то есть повышение степени окисления восстановителя равно ее понижению у окислителя.
Пример 1. Составьте уравнение окислительно-восстановительной реакции, идущей по схеме: 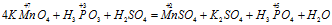
Решение.
Вычисляем, как изменяют свою степень окисления восстановитель и окислитель, и отражаем это в уравнениях:
Уравнения электронного баланса:
Изменение степеней окисления ( 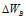
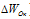
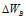
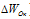
В данной реакции окислителем является KMnO 4 , в котором атом марганца уменьшает свою степень окисленности от +7 до +2, а восстановителем является Н 3 PO 3 , в котором фосфор увеличивает свою степень окисленности от +3 до +5. Таким образом, атомы, изменяющие свои степени окисленности, находятся в молекулах разных веществ, значит, данная реакция относится к реакциям межмолекулярного окисления-восстановления.
Пример 2. Составьте уравнение реакции взаимодействия цинка с концентрированной серной кислотой, принимая максимальное восстановление последней.
Решение.
Цинк (как любой металл) проявляет только восстановительные свойства. В концентрированной серной кислоте окислительную функцию несет сера (+6). Максимальное восстановление серы означает, что она приобретает минимальную степень окисления. Минимальная степень окисления серы как р- элемента VI А группы равна -2. Цинк как металл II В группы имеет постоянную степень окисления +2. Отражаем сказанное в уравнениях:
Уравнения электронного баланса:
Составляем уравнение реакции :
Перед H2SO4 стоит коэффициент 5, а не 1, так как четыре молекулы кислоты идут на связывание четырех ионов Zn 2+ (то есть H2SO4 — и окислитель, и среда реакции).
При повышении степени окисления протекает процесс окисления, а само вещество является восстановителем. При понижении степени окисления протекает процесс восстановления, а само вещество является окислителем. Далее по балансу атомов водорода определяют число молей воды, Для проверки правильности подобранных коэффициентов подсчитывают баланс кислорода.
В данной реакции окислителем является H2SO4 , в котором атом серы уменьшает свою степень окисленности от +6 до -2, а восстановителем является Zn, в котором он увеличивает свою степень окисленности от 0 до +2. Таким образом, атомы, изменяющие свои степени окисленности, находятся в молекулах разных веществ, значит, данная реакция относится к реакциям межмолекулярного окисления-восстановления.
Метод полуреакций
В тех случаях, когда реакция протекает в водном растворе (расплаве), при составлении уравнений исходят не из изменения степени окисления атомов, входящих в состав реагирующих веществ, а учитывают форму существования веществ в растворе (простой или сложный ион, атом или молекула нерастворенного или слабодиссоциирующего в воде вещества). В этом случае при составлении ионных уравнений окислительно- восстановительных реакций следует придерживаться той же формы записи, которая принята для ионных уравнений обменного характера, а именно: малорастворимые, малодиссоциированные и газообразные соединения следует писать в молекулярной форме, а ноны, не изменяющие своего состояния, — исключать из уравнения.
Метод полуреакций точнее отражает истинные изменения веществ в процессе окислительно-восстановительных реакций и облегчает составление уравнений этих процессов в ионно-молекулярной форме. Поскольку из одних и тех же реагентов могут быть получены разные продукты в зависимости от характера среды (кислотного, щелочного, нейтрального) для таких реакций в ионной схеме кроме частиц, выполняющих функции окислителя и восстановителя, обязательно указывается частица, характеризующая реакцию среды (то есть ионы Н + или ион ОН — , или молекула Н20).
Пример 3. Используя метод полуреакций, расставьте коэффициенты в реакции:
КMnO4 + КNO2 + Н2SO4 → МnSO4 + KNO2 + K2SO4 + Н2O.
Решение.
Записываем реакцию в ионном виде:
K + и SO4 2— остаются без изменения, поэтому в ионной схеме их не указывают). Из ионной схемы видно, что перманганат-ион MnO4 — превращается в Мn 2+ и при этом освобождаются четыре частицы кислорода.
В кислой среде каждая освобождающаяся частица кислорода связывается с 2H + с образованием молекулы воды.
Отсюда следует: MnO4 — + 8Н + → Mn 2+ + 4Н20.
Находим разницу зарядов 
Для второго процесса, превращения NO2 — в NO3 — , недостающий кислород берется из воды, и в результате образуется избыток ионов H + :
NO2 — + Н20; 
Таким образом, получаем:
Уравнения ионно-молекулярного баланса:
Восстановитель 2 


Окислитель 5 


Умножая члены первого уравнения на 2. а второго — на 5 и складывая их, получим ионно-молекулярное уравнение данной реакции:
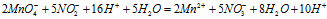
Сократив одинаковые частицы в левой и правой части уравнения, получаем окончательно ионно-молекулярное уравнение:
По ионному уравнению составляем молекулярное уравнение:
В щелочной и нейтральных средах можно руководствоваться следующими правилами.
В щелочной среде каждая освобождающаяся частица кислорода соединяется с одной молекулой воды, образуя два гидроксид-иона (2ОН — ), а каждая недостающая — берется из 2ОН — — ионов с образованием одной молекулы воды.
В нейтральной среде каждая освобождающаяся частица кислорода соединяется с одной молекулой Н20, образуя 2ОН — — нона, а каждая недостающая берется из воды с освобождением двух ионов водорода (2Н + ).
Если в окислительно-восстановительной реакции участвует перекись водорода (Н2О2), надо учитывать роль Н2О2 в конкретной реакции. В Н2О2 кислород находится в промежуточной степени окисления (-1), поэтому перекись водорода в окислительно-восстановительных реакциях проявляет окислительно-восстановительную двойственность. В тех случаях, когда Н2О2 является окислителем, полуреакции имеют следующий вид:
Н2О2 + 2H + —2 

Н2О2 —2 

Если перекись водорода является восстановителем:
Н2О2 + 2 

Н2О2 + 2ОН — + 2 

Типы окислительно-восстановительных реакций
Различают три типа окислительно-восстановительных реакций:
1. Межмолекулярные окислительно-восстановительные реакции, при которых изменяются степени окисления атомов элементов, входящих в состав разных веществ. Реакции, рассмотренные в примерах 1-3, относится к этому типу. Например:
Пример 4. Составьте уравнение окислительно-восстановительной реакции, идущей по схеме: 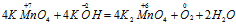
Решение.
Составляем уравнения ионно-молекулярного баланса, получим:
Восстановитель 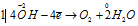
Окислитель 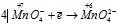
В данной реакции окислителем является KMnO4, в котором атом марганца уменьшает свою степень окисленности от +7 до +6, а восстановителем является КОН, в котором кислород увеличивает свою степень окисленности от -2 до 0. Таким образом, атомы, изменяющие свои степени окисленности, находятся в молекулах разных веществ, значит, данная реакция относится к реакциям межмолекулярного окисления-восстановления.
2. Реакции самоокисления-самовосстановления (диспропорционирования, дисмутации).
В этом случае степень окисления одного и того же элемента и повышается, и понижается. Реакции диспропорционировация характерны для соединений или элементов веществ, соответствующих одной из промежуточных степеней окисления элемента. Например:
Пример 5. Составьте уравнение окислительно-восстановительной реакции, идущей по схеме:
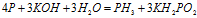
Решение.
Уравнения электронного баланса:
Восстановитель 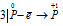
Окислитель 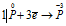
Данная реакция относится к реакции диспропорционирования, потому что сопровождается одновременным увеличением и уменьшением степени окисленности атомов одного и того же элемента (фосфора), находящегося в одном веществе (Р).
Пример 6. Составьте уравнение окислительно-восстановительной реакции, идущей по схеме: 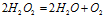
Решение.
Уравнения электронного баланса:
Восстановитель 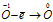
Окислитель 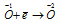
Данная реакция относится к реакции диспропорционирования, потому что сопровождается одновременным увеличением и уменьшением степени окисленности атомов одного и того же элемента (кислорода), находящегося в одном веществе (пероксид водорода Н2О2).
3. Реакции внутримолекулярного окисления-восстановления, при котором происходит выравнивание степеней окисленности атомов элемента, находящихся в одном и том же веществе, называется внутримолекулярным окислением-восстановлением (реакция конпропорционирования). Например:
Пример 7. Составьте уравнение окислительно-восстановительной реакции, идущей по схеме:
NH4NO2 = N2 + H2O
Решение.
N -3 H4N +3 O2 = N2 0 + H2O
Уравнения ионно-молекулярного баланса:
Восстановитель 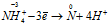
Окислитель 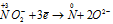
Ионно-молекулярная форма процесса:
молекулярная форма процесса:
В данной реакции атомы азота, находящиеся в нитрите аммония NH4NO2, изменяют свои степени окисленности один с -3 до 0, другой с +3 до 0. Процесс, в результате которого происходит выравнивание степеней окисленности атомов элемента, находящихся в одном и том же веществе, называется внутримолекулярным окислением-восстановлением (реакция конпропорционирования).
http://studarium.ru/article/160
http://buzani.ru/raznoe/metodika/677-okislitelno-vosstanovitelnye-reaktsii