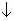План-конспект урока химии в 8-м классе по теме «Ионные уравнения»
Разделы: Химия
Тип урока: изучение нового материала
Дидактическая цель: показать суть химических реакций, протекающих в растворах
Цели по содержанию:
- на основе усвоенных понятий о реакциях обмена и электролитической диссоциации веществ разных классов сформировать понятие «реакции ионного обмена», закрепить понятие «реакции нейтрализации»;
- экспериментально доказать, что реакции в растворах электролитов являются реакциями между ионами; выявить условия, при которых они идут практически до конца;
- дать первоначальные представления о качественных реакциях;
- научить школьников применять знания о диссоциации кислот, оснований, солей при написании ионных уравнений реакций;
- научить составлять эмпирические, полные и сокращённые ионные уравнения; по сокращённому ионному уравнению определять продукты реакции.
- совершенствовать учебные умения школьников при составлении химических уравнений, при выполнении лабораторных опытов;
- продолжить формирование химической речи учащихся, творческого мышления, правил научного общения, умения прогнозировать результат деятельности;
- воспитывать культуру интеллектуального труда; чувство ответственности, уверенности в себе, требовательности к себе; умение работать в парах
Основные понятия темы: реакции ионного обмена, ионные реакции, ионные уравнения, молекулярные (эмпирические) уравнения реакций, полные и сокращённые ионные уравнения реакций, реакции нейтрализации
Методы обучения: репродуктивный, частично-поисковый
Формы организации познавательной деятельности: фронтальная, парная
- Габриелян О.С. Химия. 8 класс: Учеб. для общеобразоват. учеб. заведений. – 3-е изд. – М.: Дрофа, 1999. – 208 с.: ил.
- Габриелян О.С. Настольная книга учителя. Химия. 8 класс/ О.С. Габриелян, Н.П. Воскобойникова, А.В. Яшукова. – 2-е изд., стереотип. – М.: Дрофа, 2003. – 416 с.
- Горковенко М.Ю. Химия. 8 класс: Поурочные разработки к учебникам О.С. Габриеляна; Л.С. Гузея, В.В. Сорокина, Р.П. Суровцевой; Г.Е. Рудзитиса, Ф.Г. Фельдмана. – М.: ВАКО, 2004. – 284 с.
- Савинкина Е.В. Сборник задач и упражнений по химии: 8-й кл. к учебнику О.С. Габриеляна «Химия. 8 класс»/ Е.В. Савинкина, Н.Д. Свердлова. – М.: Экзамен, 2006. – 191 с.
- Габриелян О.С. Химический эксперимент в школе. 8 класс: учебно-метод. пособие/ О.С. Габриелян, Н.Н. Рунов, В.И. Толкунов. – М.: Дрофа, 2005. – 304 с.
- Габриелян О.С. Химия. 8 кл.: тетрадь для лабораторных опытов и практических работ к учебнику О.С. Габриеляна «Химия. 8 класс»/ О.С. Габриелян, А.В. Яшукова. – М.: Дрофа, 2006. – 96 с.: ил.
- Ходаков Ю.В. и др. Неорганическая химия: Учеб. для 9 кл. сред. шк./ Ю.В. Ходаков, Д.А. Эпштейн, П.А. Глориозов. – 17-е изд. – М.: Просвещение, 1988. – 176 с., 2 л. ил.: ил.
- Занимательная химия на уроках в 8-11 классах: тематические кроссворды/ сост. О.В. Галичкина. – Волгоград: Учитель, 2007. – 119 с.
- Карты с лабораторными работами, «лабиринтом букв», задачами, домашним заданием.
- Растворы CaCl2, AgNO3, BaCl2 и Na2SO4, K2CO3 и H2SO4, NaOH и H2SO4, CuSO4 ,KNO3 и NaCl, пипетка, пробиркодержатель, чистые пробирки, фенолфталеин.
Ход урока
I. Организационное начало урока.
II. Мобилизующий этап. Актуализация знаний учащихся.
Ц И И С Р О А Н К А И О О Г М Е Р Е Б Н Н О Б К
- Определите ключевое понятие сегодняшнего урока, используя «лабиринт букв» («реакции ионного обмена»)
- Какие уже известные вам понятия включает это, пока ещё новое для вас, понятие? («реакции обмена», «ионы»)
- Что такое ионы? Какие вещества и при каких условиях образуют ионы? Как называется процесс распада вещества на ионы при растворении в воде? На какие ионы при растворении в воде диссоциируют кислоты, соли, основания? (схемы диссоциации кислот, оснований, солей, см. приложение 1)
- Какие реакции мы называем реакциями обмена? (общая схема, см. приложение 2)
- Найдите среди предложенных реакций реакции обмена:
- K2CO3 + H2SO4 ?
- Mg + HCl ?
- Na2SO4 + Ba(NO3)2?
- Zn(OH)2 ?
- NaOH + HCl ?
- SO3 + MgO ?
- Перечислите условия протекания реакций обмена до конца (схема, см. приложение 3)
- Какая из реакций протекает с образованием осадка, газа, воды?
III. Целеполагание и мотивация.
— Итак, опираясь на знания о реакциях обмена и условиях их протекания до конца, а также электролитической диссоциации кислот, солей, оснований при растворении в воде, на сегодняшнем уроке мы должны выяснить, какие реакции называются реакциями ионного обмена и научиться составлять ионные уравнения.
— Запишите тему урока
IV. Изучение нового материала. Первичное закрепление.
1) Вступительное слово
— Каждое химическое свойство, проявляемое сильными электролитами в растворах, — это свойство ионов, на которые электролит распался: либо катионов, либо анионов. Между тем, реакции обмена между электролитами в водных растворах мы раньше изображали молекулярными уравнениями, не учитывая, что в этих реакциях участвуют не молекулы электролита, а ионы, на которые он диссоциирован.
— Итак, реакции, осуществляемые в растворах между ионами, называются ионными, а уравнения таких реакций – ионными уравнениями
— Как такие реакции происходят в действительности, рассмотрим сначала на примере реакций, сопровождающихся выделением осадка.
2) Лабораторная работа № 1 «Реакции, идущие с образованием нерастворимых (малорастворимых) веществ»
Оборудование и реактивы: растворы CaCl2, AgNO3, BaCl2 и Na2SO4, пипетка, пробиркодержатель, чистые пробирки.
а) В пробирку с раствором CaCl2, закреплённую в пробиркодержателе, добавьте несколько капель AgNO3.
Что наблюдаете? Запишите молекулярное уравнение химической реакции
(см. приложение 4)
— При выполнении лабораторных опытов соблюдайте основные правила техники безопасности
(см. приложение 5)
— Сливая растворы CaCl2 и AgNO3, мы наблюдаем образование осадка AgCl, в растворе остаётся Ca(NO3)2
2AgNO3 + CaCl2 = Ca(NO3)2 + 2AgCl ?
Полекулярное (эмпирическое) уравнение
— Обе исходные соли – сильные электролиты, полностью диссоциирующие в воде
 |  |  |  |  |  |  |
|---|---|---|---|---|---|---|
| 2Ag+ | 2NO3— | Ca2+ | 2Cl- | Ca2+ | 2NO3— | 2AgCl ? |
— Одна из полученных солей также остаётся в растворе диссоциированной на ионы Ca2+ и NO3-, а вот AgCl – нерастворимое соединение, не диссоциирующее в воде, поэтому его переписываем в молекулярном виде.
— Итак, уравнение реакции между CaCl2 и AgNO3 можно записать так:
2Ag+ + 2NO3 — + Ca2 + + 2Cl- = Ca2 + + 2NO3 — + 2AgCl ?
Полное ионное уравнение
— Что же произошло при сливании растворов? Ионы Ag + и Cl- соединились и образовали AgCl, выпавший в осадок.
— Ионы же Ca2 + и NO3 — в реакции не участвовали, они остались такими, какими были и до сливания растворов, следовательно, мы можем исключить их обозначение из левой и правой частей полного ионного уравнения. Что осталось?
2Ag + + 2Cl — = 2AgCl ?
— Или, сокращая коэффициенты,
Ag + + Cl — = AgCl ?
Сокращённое ионное уравнение
— Это уравнение показывает, что суть данной реакции сводится к взаимодействию Ag + и Cl — , в результате которого образуется осадок AgCl. При этом совершенно не важно, в состав каких электролитов входили эти ионы до реакции: аналогичное взаимодействие можно наблюдать и между NaCl и AgNO3, AgNO3 и AlCl3 и так далее – суть всех этих реакций будет сводиться к взаимодействию Ag + и Cl — c образованием AgCl?
б) Рассмотрите реакцию ионного обмена между BaCl2 и Na2SO4
(см. приложение 4)
— Предложите, пользуясь таблицей растворимости, формулы электролитов, реакции между которыми сводятся к взаимодействию Ba2 + + SO4 — = BaSO4?
в) растворы каких веществ нужно взять, чтобы в растворе осуществилась реакция между Ca2 + + CO3 — = CaCO3?
(см. приложение 4)
— Составьте молекулярные уравнения предложенных реакций, запишите сокращённое ионное уравнение, отражающее их суть.
— Образование при реакции нерастворимого или малорастворимого соединения используют для обнаружения в растворе того или иного иона: так растворимые соли серебра используют для обнаружения Cl — , Br — , I — … — ионов, так как с этими анионами Ag + образует нерастворимые осадки, и, наоборот, растворимые соли, содержащие Cl — , Br — , I — … — ионы, используют для распознавания Ag + в растворе.
— Такие реакции принято называть качественными, т.е. реакциями, с помощью которых можно обнаружить тот или иной ион.
(таблица «Качественные реакции на ионы», см. приложение 6)
3) Лабораторный опыт № 2 «Реакции с образованием газообразных веществ»
Оборудование и реактивы: растворы K2CO3 и H2SO4, пипетка, пробиркодержатель, чистые пробирки.
а) Видеоопыт «Реакции ионного обмена, протекающие с выделением газа»
Посмотрите видеоопыт, составьте и запишите молекулярное, полное и сокращённое ионное уравнения реакции.
Можно ли считать данную реакцию качественной? Почему?
б) Проведите аналогичную реакцию между K2CO3 и H2SO4, составьте и запишите молекулярное и сокращённое ионное уравнения реакции.
в) Предложите вещества, растворы которых можно взять для осуществления реакции между 2H + + SO32 — = H2O + SO2?
(см. приложение 4)
4) Лабораторный опыт № 3 «Реакции, идущие с образованием слабого электролита»
Оборудование и реактивы: растворы NaOH и H2SO4, CuSO4, пипетка, пробиркодержатель, чистые пробирки, фенолфталеин
а) В пробирку прилейте 1-2 мл раствора NaOH, добавьте 2-3 капли фенолфталеина. Прилейте H2SO4 до полного обесцвечивания раствора.
Почему раствор обесцветился? Как называются реакции между кислотами и основаниями, в результате которых образуется соль и вода?
б) Посмотрите видеоопыт «Реакция нейтрализации», составьте молекулярное и сокращённое ионное уравнение для продемонстрированной вам реакции
— Реакция нейтрализации может протекать не только между кислотами и щелочами, но и между кислотами и нерастворимыми основаниями. Для доказательства проведём следующий опыт.
в) Получите свежеосаждённый Cu(OH)2, используя выданные вам реактивы. Какие? Разделите полученный осадок на 3 равные пробирки, в каждую добавьте по 1-2 мл разных кислот. Что наблюдаете?
Составьте и запишите молекулярное, полное и сокращённое ионное уравнение одной из проведённых реакций. В чём её суть? Можно утверждать, что сокращённая запись отражает суть всех трёх реакций, независимо от того, какая кислота вступала в реакцию?
5) Лабораторный опыт № 4 «Обратимое взаимодействие между ионами»
Оборудование и реактивы: растворы KNO3 и NaCl, пипетка, пробиркодержатель, чистые пробирки, фенолфталеин
В пробирку с KNO3 добавьте 2-3 капли фенолфталеина, прилейте 1-2 мл раствора NaCl. Что наблюдаете? Составьте молекулярное и полное ионное уравнения реакции.
Какие ионы находились в растворе? Какие ионы находятся в полученном растворе? О чём свидетельствует отсутствие видимых эффектов реакции?
Как называются такие реакции?
V. Обобщение
— Итак, мы рассмотрели реакции, протекающие в растворах электролитов с образованием осадка, газа или малодиссоциирующего вещества: растворы электролитов содержат ионы, следовательно, реакции в растворах электролитов сводятся к реакциям между ионами. Сформулируйте определение понятия «реакции ионного обмена» (реакции между ионами в растворах электролитов, протекающие с выделением осадка, газа или воды)
VI. Значение реакций ионного обмена
— Реакции ионного обмена широко распространены в живой и неживой природе, например, образование осадочных пород (гипс, известняк, другие соли), появление камней в почках животных и человека.
Широко используются реакции ионного обмена и в практических целях, например, для осаждения ионов, приносящих существенный вред людям и животным. К таким относят, в первую очередь, катионы тяжёлых металлов.
Тяжелые металлы — это элементы периодической системы с относительной молекулярной массой больше 40. Так сложилось, что термины «тяжелые металлы» и «токсичные металлы» стали синонимами.
На сегодняшний день безоговорочно к числу токсичных относят кадмий, ртуть, свинец, сурьму. Деятельность значительной части остальных в живых организмах можно оценить только на «отлично». Действительно, металлы в ионной форме входят в состав витаминов, гормонов, регулируют активность ферментов.
Установлено, что для белкового, углеводного и жирового обмена веществ необходимы Mo, Fe, V, Co, W, B, Mn, Zn; в синтезе белков участвуют Mg, Fe, Cu, Zn, Mn, Co; в кроветворении — Co, Cu, Mn, Ni, Zn; в дыхании — Mg, Fe, Cu, Zn, Mn, Co. Справедливо утверждение о том, что нет вредных веществ, есть вредные концентрации. Поэтому ионы меди, кобальта или даже хрома, если их содержание в живом организме не превышает естественного, можно именовать микроэлементами, если же они генеалогически связаны с заводской трубой, то это уже тяжелые металлы. Тяжелые металлы (ртуть, свинец, кадмий, цинк, медь, мышьяк,) относятся к числу распространенных и весьма токсичных загрязняющих веществ. Они широко применяются в различных промышленных производствах, поэтому, несмотря на очистные мероприятия, содержание соединения тяжелых металлов в промышленных сточных водах довольно высокое. Большие массы этих соединений поступают в океан через атмосферу. Для морских биоценозов наиболее опасны ртуть, свинец и кадмий. Ртуть переносится в океан с материковым стоком и через атмосферу.
— Предложите решение следующей задачи:
Задача 1.
В сточных водах гальванического цеха химического завода обнаружены катионы Fe3 + , Fe2 + , Ni 2+ и анионы Cl — , SO4 2- . Как с помощью реакций ионного обмена можно очистить эти стоки?
— Поработайте в парах над решением подобных задач:
Задача 2.
Предложите ионные реакции для очистки сточных вод автотранспортного предприятия от катионов Pb 2+ и Cu 2+ , оказывающих токсическое действие на живые организмы.
Задача 3.
В сточных водах животноводческих ферм отмечено повышенное содержание катионов Ca 2+ и Zn 2+ . Предложите реактивы, с помощью которых можно очистить воду от этих ионов.
VII. Домашнее задание
С какими веществами может реагировать фосфорная кислота, образуя а) газ; б) воду; в) осадок?
Запишите уравнения реакций в молекулярном, полном и сокращённом ионном видах.
Урок «Ионные уравнения»
методическая разработка по химии (8 класс) по теме
Методическая разработка урока по химии «Ионные уравнения» в 8 классе. Методическая разработка включает в себя пояснительную записку, технологическую карту урока, приложения.
Скачать:
| Вложение | Размер |
|---|---|
| urok_ionnye_uravneniya.docx | 48.5 КБ |
Предварительный просмотр:
Муниципальное бюджетное образовательное учреждение «Школа №3»
г.Богородска Нижегородской области
Составитель: Попадинец Наталья Вячеславовна,
учитель химии I категории
г. Богородск, 2016г
Тема Ионные уравнения
УМК 1)О.С.Габриелян Программа курса химии для 8 – 11 классов для общеобразовательных учреждений. – М.: Дрофа, 2010
2) О.С.Габриелян Химия 8 класс. – М.: Дрофа, 2010
3) О.С.Габриелян Химия. 8-9 классы: методическое пособие.- М.:Дрофа,2011
4) О.С.Габриелян, Н.П. Воскобойникова, А.В.Яшукова Химия. 8 класс. Настольная книга учителя. М.:Дрофа.
Цель формирование представлений о реакциях ионного обмена.
Образовательные: познакомить учащихся с реакциями ионного обмена и условиями их протекания; научиться составлять ионные уравнения; закрепить умение пользоваться таблицей растворимости для прогнозирования возможных химических реакций; совершенствование химического языка учащихся;
Воспитательные: формирование тактичного и бережного отношения друг к другу, уважение мнения одноклассника и высказывание своего; формирование научной картины мира, воспитание бережного отношения к окружающей среде;
Развивающие: развитие памяти, мышления, познавательного интереса к предмету, активное включение учащихся в самостоятельный поиск знаний; проводить анализ и синтез учебного материала, делать умозаключения и выводы, развитие практических умений и навыков при выполнении лабораторных опытов, развитие умений работать в группе.
Личностные: понимание единства естественнонаучной картины мира, устойчивый познавательный интерес.
Регулятивные: слушать в соответствии с целевой установкой; преобразовывать практическую задачу в познавательную, планировать собственную деятельность, планировать учебную деятельность при выполнении эксперимента в рамках предложенных условий, дополнять, уточнять ответы одноклассников по существу поставленного задания, осуществлять взаимоконтроль процесса и результата выполнения задания, волевая саморегуляция в ситуации затруднения, адекватное понимание причин успеха, неуспеха в учебной деятельности.
Познавательные: осуществлять классификацию, устанавливать причинно-следственные связи, проводить наблюдение, обобщать и интерпретировать информацию, объяснять явления, выявленные в ходе эксперимента, строить логические рассуждения, делать выводы, понимать и интерпретировать информацию, представленную в схемах (аспект смыслового чтения), умение осуществлять идентификацию объектов с выделением необходимых признаков.
Коммуникативные: воспринимать на слух вопросы учителя и ответы учащихся, строить понятные для собеседника речевые высказывания, адекватно использовать устную и письменную речь, строить продуктивное взаимодействие со сверстниками, устанавливать рабочие отношения в группе, формулирование и аргументация своего мнения, учет разных мнений.
Предметные: давать определение понятиям, описывать самостоятельно проведенные эксперименты, используя язык химии, освоение алгоритма написания реакций ионного обмена.
Тип урока урок изучения нового материала.
Методы обучения: словесные (беседа), наглядные (просмотр слайдов презентации), практические (эксперимент).
Формы работы: индивидуальная, фронтальная, работа в группах.
Способы оценки: взаимооценка, оценка учителя.
Материально – техническое обеспечение:
Реактивы: растворы гидроксида калия, гидроксида натрия, соляной кислоты, серной кислоты, хлорида железа(III), карбоната натрия, хлорида натрия, сульфата меди (II), фенолфталеин.
Пробирки (ПХ-14), штатив для пробирок.
Компьютер, проектор, экран, презентация.
Таблицы «Периодическая система Д.И.Менделеева», «Растворимость кислот, оснований, солей в воде».
Планируемые результаты (личностные, метапредметные, предметные)
Учитель проверяет, насколько комфортно чувствуют себя ученики, готовность рабочего места, создает ситуацию успеха: предлагает назвать любое слово из изучаемой темы и подобрать к каждой букве прилагательное, характеризующее их настроение.
Ученики готовят рабочее место, повторяют пройденный материал, настраиваются на работу.
2.Актуализация знаний и постановка целей урока
— понимать единство естественнонаучной картины мира,
— понимать границы собственного знания и «незнания».
— слушать в соответствии с целевой установкой;
— преобразовывать практическую задачу в познавательную,
— планировать собственную деятельность,
— дополнять, уточнять ответы одноклассников по существу поставленного задания,
— осуществлять взаимоконтроль процесса и результата выполнения задания.
— воспринимать на слух вопросы учителя и ответы учащихся,
— строить понятные для собеседника речевые высказывания.
— устанавливать причинно-следственные связи,
— давать определение понятиям.
Цитирует высказывание Конфуция: «Три пути ведут к знанию: путь размышления — это самый благородный; путь подражания — это путь самый лёгкий и путь опыта — это путь самый горький».
Выберите путь, по которому сегодня мы с вами пойдем?
— Раздает троим ученикам карточки с заданиями, проверяющими знания по пройденному материалу (Приложение 1).
— Формулирует вопросы, позволяющие возбудить мыслительную деятельность учащихся по теме:
-дайте определения понятиям «Электролиты» и «Неэлектролиты»
— Что такое сильные, слабые электролиты? Примеры.
— Организует работу по выполнению задания (на интерактивной доске):
— предлагает нескольким ученикам по очереди выходить к доске для выполнения задания: перечисленные вещества разделите на 2 столбика: в один запишите – электролиты, в другой – неэлектролиты: NaCl(раствор), NaCl(кристаллы), Ba(OH) 2 , H 2 SO 4 (конц.), H 2 SO 4 (раствор).
— контролирует процесс выполнения задания.
Задает вопрос: какой процесс происходит с электролитами в растворах или расплавах?
Напишите уравнения диссоциации, выбранных вами электролитов.
Вызывает одного ученика на доске выполнить это задание.
Организует работу по анализу выполнения задания:
— предлагает осуществить взаимопроверку;
— предлагает учащимся, допустившим ошибки, установить их причины.
— Проводит демонстрационный эксперимент: Что будет, если смешать растворы двух электролитов? Учитель смешивает растворы хлорида натрия и серной кислоты. Что происходит?
Учащиеся выбирают путь работы на уроке.
Трое учеников работают на месте по карточкам.
Остальные слушают вопросы учителя, во фронтальном режиме отвечают на вопросы учителя: вещества, растворы которых проводят электрический ток, относятся к электролитам .
Вещества, растворы которых не проводят электрический ток, называют неэлектролитами .
Сильные электролиты при растворении в воде практически полностью диссоциируют на ионы. У них степень диссоциации стремится к 1. Пример: все растворимые соли, H 2 SO 4 , KOH и др.
Слабые электролиты при растворении в воде почти не диссоциируют на ионы. У них степень диссоциации стремится к 0. Пример: H 2 СO 3 , водный раствор аммиака и др.
Выполняют задания, контролируют правильность ответов учащихся. В первом столбике – электролиты:
NaCl(раствор), Ba(OH) 2 , H 2 SO 4 (раствор). Во втором столбике – неэлектролиты: NaCl(кристаллы), H 2 SO 4 (конц.)
Отвечают на вопросы:
Электролиты в растворах или расплавах диссоциируют на ионы.
Учащиеся у себя в тетради пишут уравнения диссоциации электролитов.
Ученик на доске записывает уравнения диссоциации
Осуществляют взаимопроверку в парах.
Наблюдают и делают вывод , что
реакция не прошла. Вместе с учителем ставят проблему: при каких условиях протекают ионные реакции до конца?
Осознают недостаточнсть знаний по теме, формулируют тему и цель урока.
3. Изучение нового материала.
— понимать значимость реакций ионного обмена для формирования целостной естественнонаучной картины мира.
— понимать значимость химических знаний в практической жизни.
— принимать и сохранять учебную задачу,
— слушать в соответствии с целевой установкой; дополнять, уточнять ответы одноклассников по существу поставленного задания,
— осуществлять взаимоконтроль процесса и результата выполнения задания,
— планировать общие способы работы,
— планировать учебную деятельность при выполнении эксперимента в рамках предложенных условий, — работа с текстом.
— осознанно строить речевое высказывание, уметь слушать собеседника; адекватно использовать устную и письменную речь,
— строить продуктивное взаимодействие со сверстниками, устанавливать рабочие отношения в группе.
— обобщать и интерпретировать информацию,
— объяснять явления, выявленные в ходе эксперимента, строить логические рассуждения, создавать обобщения, делать выводы,
— понимать и интерпретировать информацию, представленную в схемах (аспект смыслового чтения),
— умение осуществлять идентификацию объектов с выделением необходимых признаков.
— давать определение понятиям,
— описывать самостоятельно проведенные эксперименты, используя язык химии,
— освоение алгоритма написания реакций ионного обмена.
— Делит класс на 6 групп, дает групповые задания (Приложение 2) и алгоритм составления ионных уравнений реакций (Приложение 3). Проверяет знания ТБ при выполнении опытов, навыки и умения экспериментальной работы.
Продолжительность работы групп – 7 мин.
— Вызывает учащихся группы №2 и №3 записать уравнения реакции. Тем временем обращается к группе №1, задавая вопросы: что такое реакции ионного обмена?
В каких случаях реакции ионного обмена практически необратимы?
— Вызывает учащихся группы №2 и №3 рассказать, что наблюдали.
Задает вопрос группе №1: почему наблюдаем появление газа, при образовании в продуктах реакции угольной кислоты?
— Вызывает учащихся группы №4,5 записать уравнение реакции.
Тем временем обращается к группе № 6, предлагая рассказать о значение реакций ионного обмена в жизни человека.
— Вызывает учащихся группы №4 и №5 рассказать, что наблюдали.
— Задает вопрос группе №1: что такое реакции нейтрализации? Почему в результате реакции нейтрализации раствор гидроксида натрия, окрашенный фенолфталеином в малиновый цвет, обесцветился?
Вспоминают и озвучивают правила безопасной работы в химической лаборатории.
В группах изучают материал, проводят эксперимент, формулируют ответ.
Делают необходимые записи.
Учащиеся от группы выходят к доске, записывают уравнения реакций.
Слушают вопросы учителя, во фронтальном режиме отвечают на вопросы учителя.
Учащиеся от группы выходят к доске, комментируют эксперимент, делают вывод, что реакции ионного обмена протекают до конца, если образуется осадок или газ.
Остальные учащиеся делают записи в тетрадь.
Учащиеся группы №1 отвечают на вопрос.
Учащиеся от группы №4,5 выходят к доске, записывают уравнения реакций.
Учащиеся от группы №6 рассказывают о значении реакций ионного обмена.
Учащиеся от группы №4 комментируют эксперимент, делают вывод, что реакции ионного обмена протекают до конца, если образуется малодиссоциирующее вещество (вода).
Учащиеся делают записи в тетрадь.
Учащиеся от группы №5 комментируют эксперимент. Учащиеся делают записи в тетрадь.
Учащиеся группы №1 отвечают на вопрос.
4. Закрепление знаний.
— понимать значимость реакций ионного обмена для формирования целостной естественнонаучной картины мира.
— понимать значимость химических знаний в практической жизни.
— принимать и сохранять учебную задачу.
— волевая саморегуляция в ситуации затруднения
— понимать и интерпретировать информацию, представленную в схемах,
— осуществлять сравнение, создавать обобщения, устанавливать аналогии.
Предметные: освоение алгоритма написания реакций ионного обмена.
— Предлагает учащимся самостоятельно решить разноуровневые задания на карточках (Приложение 4). Если кто-то из учеников справился раньше остальных, учитель дает дополнительные задания на карточках по данной теме.
— Собирает задания на проверку.
Выбирают себе задание, соответствующего уровня, и письменно выполняют его.
— понимать значимость реакций ионного обмена для формирования целостной естественнонаучной картины мира,
— осознание ответственности за общее дело.
— контроль и оценка процесса и результатов деятельности,
— адекватное понимание причин успеха, неуспеха в учебной деятельности,
— выражение своих мыслей с достаточной полнотой и точностью,
— формулирование и аргументация своего
мнения, учет разных мнений.
Предлагает вспомнить тему и цель урока, оценить меру своего личного продвижения к цели и успехи класса в целом:
— Какой ответ на основной вопрос урока мы можем дать? Как оцените свою работу?
Подводит итог урока, отмечает наиболее активных учащихся.
Определяют степень соответствия поставленной цели и результатов деятельности: называют тему и цели урока, отмечают наиболее трудные и наиболее понравившиеся эпизоды урока, высказывают оценочные суждения. Определяют степень своего продвижения к цели.
6. Домашнее задание
Организует объяснение выполнения домашнего задания:
2. Выполнить задания 4 или 5 (по выбору учащегося)
Записывают домашнее задание
Карточки — задания Приложение 1.
К электролитам относится
Электрический ток не проводит
расплав красного фосфора
раствор азотной кислоты
расплав сульфата натрия
Электрический ток проводит
Сульфид-ион образуется при электролитической диссоциации
При полной диссоциации 1 моль нитрата цинка в растворе образуется
3 моль катионов цинка и 1 моль нитрат-ионов
2 моль катионов цинка и 3 моль нитрат-ионов
1 моль катионов цинка и 3 моль нитрат-ионов
1 моль катионов цинка и 2 моль нитрат-ионов
Правой частью уравнения диссоциации сульфата натрия является
Задания для рабочих групп Приложение 2.
Найдите ответы на вопросы:
1. Что такое реакции ионного обмена?
2. Что такое полное и сокращенное ионные уравнения?
3. В каких случаях реакции ионного обмена практически необратимы?
4.Почему наблюдаем появление газа, при образовании в продуктах реакции угольной и сернистой кислот?
5. Что такое реакции нейтрализации? Почему в результате реакции нейтрализации раствор гидроксида натрия, окрашенный фенолфталеином в малиновый цвет, обесцветится?
Опыт: Взаимодействие сульфата меди(II) с гидроксидом натрия.
Проделайте опыт: к 1 мл. раствору сульфата меди(II) добавьте 1 мл. раствора гидроксида натрия. Что наблюдаете? Запишите уравнение реакции. По алгоритму составьте полное и сокращенное ионные уравнения.
Опыт: Взаимодействие карбоната натрия с соляной кислотой.
Проделайте опыт: к 1 мл. раствору карбоната натрия добавьте 1мл. раствора соляной кислоты. Что наблюдаете? Запишите уравнение реакции. По алгоритму составьте полное и сокращенное ионные уравнения.
Опыт: Взаимодействие гидроксида железа(III) с соляной кислотой.
Проделайте опыт: к 1 мл. раствору хлорида железа (III) добавьте 1 мл. раствора гидроксида натрия. Что наблюдаете? Добавьте 1мл. раствора соляной кислоты. Что наблюдаете? Запишите уравнение реакции. По алгоритму составьте полное и сокращенное ионные уравнения.
Опыт: Взаимодействие гидроксида калия с серной кислотой.
Проделайте опыт: к 1 мл. раствору гидроксида натрия добавьте несколько капель фенолфталеина, затем 1мл. раствора соляной кислоты. Что наблюдаете? Запишите уравнение реакции. По алгоритму составьте полное и сокращенное ионные уравнения.
Значение реакций ионного обмена
Реакции ионного обмена широко распространены в живой и неживой природе, например, образование осадочных пород (гипс, известняк, другие соли), появление камней в почках животных и человека.
Широко используются реакции ионного обмена и в практических целях, например для осаждения ионов, приносящий существенный вред людям и животным. К таким относят, в первую очередь, катионы тяжелых металлов.
Тяжелые металлы – это элементы периодической системы с относительной молекулярной массой больше 40. Так сложилось, что термины «тяжелые металлы» и «токсичный металлы» стали синонимами.
На сегодняшний день безоговорочно к числу токсичных относят кадмий, ртуть, свинец, сурьму. Деятельность значительной части остальных в живых организмах можно оценить только на «отлично». Действительно, металлы в ионной форме входят в состав витаминов, гормонов, регулируют активность ферментов.
Установлено, что для белкового, углеводного и жирового обмена веществ необходимы Mo, Fe, V, Co, W, B, Mn, Ni, Zn; в синтезе белков участвуют Mg, Fe, Cu, Zn, Mn, Co; в кроветворении – Co, Cu, Mn, Ni, Zn; в дыхании – Mg, Fe, Cu, Zn, Mn,Co. Справедливо утверждение о том, что нет вредных веществ, есть вредные концентрации. Поэтому ионы меди, кобальта или даже хрома, если их содержание в живом организме не превышает естественного, можно именовать микроэлементами, если же они генеалогически связаны с заводской трубой, то это уже тяжелые металлы. Тяжелые металлы (ртуть, свинец, кадмий, цинк, мель, мышьяк) относятся к числу распространенных и весьма токсичных загрязняющих веществ. Они широко применяются в различных промышленных производствах, поэтому, не смотря на очистные мероприятия, содержания соединения тяжелых металлов в промышленных сточных водах довольно высокое. Большие массы этих соединений поступают в океан через атмосферу. Для морских биоценозов наиболее опасны ртуть, свинец и кадмий. Ртуть переносится в океан с материковым стоком и через атмосферу.
Алгоритм составления ионных уравнений реакций Приложение 3.
1. Запишите (составьте) формулы исходных веществ и продуктов реакции. Расставьте коэффициенты.
Молекулярное уравнение реакции:
MgCI 2 +2AgNO 3 =Mg(NO 3 ) 2 +2AgCI ↓
2. Напишите под каждой формулой растворимого вещества ионы, на которые оно диссоциирует, учитывая коэффициенты, пользуясь таблицей растворимости.
Полное ионное уравнение реакции:
Mg 2+ + 2CI — +2Ag + + 2NO 3 — = Mg 2+ +2NO 3 — + 2AgCl ↓
3. Зачеркните формулы одинаковых ионов (до и после реакции), которые не участвуют в реакции
Полное ионное уравнение реакции:
Mg 2+ +2CI — +2Ag + + 2NO 3 — = Mg 2+ + 2NO 3 — +2AgCl ↓
4.Выпишите формулы оставшихся ионов и веществ
Краткое (сокращенное) ионное уравнение реакции:
2Ag + +2Cl — = 2AgCl ↓
5. Сделайте вывод на основе сокращенного уравнения
В реакции участвовали ионы серебра и хлорид-ионы. В результате образуется осадок хлорида серебра.
Разноуровневые задания Приложение 4.
Напишите полное и сокращенное ионные уравнения. Назовите вещества.
Na 2 SO 4 + BaCl 2 = BaSO 4 ↓+ 2NaCI
Допишите уравнение реакции. Напишите полное и сокращенное ионные уравнения. Назовите вещества.
Na 2 SiO 3 + HCl =
В сточных водах животноводческих ферм отмечено повышенное содержание катионов Са 2+ . Предложите реактивы, с помощью которых можно очистить воду от этих ионов. Напишите уравнение реакции.
Вместо знака «?» вставьте формулу вещества. Укажите, к какому типу относятся реакции. Для реакций ионного обмена составьте полное и сокращённое ионные уравнения.
1) ? + HCI = CuCI 2 + H 2 O
3) Mg + HBr = ? + H 2
4) CaO + H 3 PO 4 = ? + H 2 O
5) H 2 SO 4 + ? = K 2 SO 4 + ?
По теме: методические разработки, презентации и конспекты
Иррациональные уравнения. Показательные уравнения.Логарифмические уравнения.
Тип урока: Урок повторения. Форма урока – мастерская (групповая работа)Форма урока работа в группах. Коллективная форма работы, которая позволяет создать ситуацию взаимообучения учащихся и сущест.
Итоговый контроль по темам № 1, 2, 3, 4: «Рациональные уравнения. Иррациональные уравнения. Квадратное уравнение и приложения теоремы Виета. Исследование квадратного трехчлена»
Уважаемые коллеги!Актуальной задачей на сегодняшний день является качественная подготовка учащихся к государственной итоговой аттестации (ГИА) и единому государственному экзамену (ЕГЭ) по математике, .
Тема 15. ИТОГОВЫЙ КОНТРОЛЬ ПО ТЕМАМ 9-14: «Показательные уравнения. Показательно-степенные уравнения. Показательные неравенства. Преобразования и вычисления логарифмических выражений. Логарифмические уравнения. Логарифмические неравенства».
Уважаемые коллеги!Актуальной задачей на сегодняшний день является качественная подготовка учащихся к единому государственному экзамену (ЕГЭ) по математике, а также абитуриентов к вступител.
Тема 18. ТРИГОНОМЕТРИЧЕСКИЕ УРАВНЕНИЯ. Уравнения, решаемые понижением степени. Однородные уравнения и приводимые к ним. Универсальная подстановка.
Уважаемые коллеги!Актуальной задачей на сегодняшний день является качественная подготовка учащихся к единому государственному экзамену (ЕГЭ) по математике, а также абитуриентов к вступительным э.
Методические рекомендации к изучению темы: « Решение квадратных уравнений» с применением теоремы Виета для решения приведенного квадратного уравнения и полного квадратного уравнени
Решать квадратные уравнения учащимся приходится часто в старших классах, Решение иррациональных, показательных , логарифмических ,тригонометрических уравнений часто сводится к решени.
Учебный модуль по теме » Уравнение. Решение уравнений.Решение текстовых задач с помощью уравнений.»
Данный учебный модуль разработан в рамках персонализированного обучения .Модуль расчитан на 12 часов. Содержитз адания для прохождения уровней цели 2.0,,3.0 и 4.0.В модуле представле.
Презентации по теме «Системы двух линейных уравнений», «Метод подстановки для решения систем уравнений», «Метод сложения для решения систем уравнений» .
Презентации проедполагает использование при проведении онлайн урока по теме «Системы двух линейных уравнений», «Метод подстановки для решения систем уравнений», «Метод сложени.
«Ионные уравнения» открытый урок
Конспект урока по химии, для 8 классов. Тема урока ионные уравнения. Интересное и увлекательное занятие.
Просмотр содержимого документа
«»Ионные уравнения» открытый урок»
Тема урока: «Ионные уравнения»
Цель: сформировать представление учащихся о реакциях, протекающих межу ионами, условий протекания реакций ионного обмена до конца, обратимых реакциях, полных и сокращенных ионных уравнениях.
способствовать систематизации понятийного аппарата: ион, растворы, электролиты и неэлектролиты, основные типы реакций в неорганической химии, обратимые реакции, условия протекания реакций ионного обмена до конца
“5” — обосновать, доказать;
“4” — характеризовать, применить;
способствовать совершенствованию специальных предметных умений: составлять полные и сокращенные ионные уравнения;
способствовать формированию общеучебных умений:
а) учебно-интеллектуальных (анализировать факты, устанавливать причинно-следственные связи; выдвигать гипотезу; сравнивать соли и химические реакции, классифицировать, делать выводы);
б) учебно-информационных (работать с текстом);
в) учебно–организационных (понимать смысл задания, распределять время для выполнения заданий планировать работу по организации работы, осуществлять самоконтроль);
способствовать формированию критического мышления учащихся (критически оценивать собственные знания по теме и сопоставлять их с научными);
Форма проведения: урок с использованием ИКТ, включением парных, индивидуальных форм организации учебно-познавательной деятельности учащихся.
Продолжительность учебного занятия: 45 минут.
Использование педагогических технологий: метод эвристического обучения, обучение в сотрудничестве
I. Организационный момент – 1 мин: мобилизующее начало (приветствие, проверка готовности к уроку, организация внимания учащихся), информация о цели и ходе урока, мотивация
Фронтальная беседа (3 мин)
Что такое реакции обмена? (это реакции между двумя сложными веществами, при которых они обмениваются своими составными частями).
Что такое ионы? (это заряженные частицы, которые отличаются от атомов числом электронов)
На какие группы делятся ионы? (катионы – положительные ионы; анионы – отрицательные ионы)
Что такое электролитическая диссоциация? (процесс распада молекул электролитов на ионы при растворении в воде или расплавлении)
На какие ионы распадаются при электролитической диссоциации кислоты (ионы водорода и ионы кислотного остатка)
На какие ионы распадаются при электролитической диссоциации растворимые основания? (ионы металла и ионы ОН -1 групп)
На какие ионы распадаются при электролитической диссоциации соли? (ионы металла и ионы кислотного остатка)
Таким образом, какие ионы выделяют при электролитической диссоциации? (Н +1 , ОН -1 , Ме +n , кислотный остаток -n )
Именно эти ионы находятся в таблице растворимости: (Работа с таблицей растворимости – определение растворимых и нерастворимых веществ)
II. Изучение нового материала. Объяснение учителя. 15 мин.
Реакции обмена протекают между ионами, поэтому называются реакции ионного обмена Выводится определение (слайд 2):
Реакции ионного обмена идут до конца в трех случаях:
если образуется осадок – нерастворимое вещество после реакции)
если выделяется газ
если образуется вода
В остальных случаях реакции обмена являются обратимыми
Разберем эти случаи поподробнее (случаи разбираются на слайдах и на доске, проводится фронтальная беседа: почему реакция идет, что и почему образуется, как определить образование осадка, газа, воды и т.п.):
1) Если образуется осадок (слайд 3):
а) CuSO4 + 2NaOH 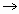
б) 2AgNO3 + CaCl2 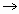
в) Na2CO3 + Ca(NO3)2 
г) BaCl2 + K2SO4 
2) Если выделяется газ (слайд 4):
а) CaCO3 + 2HNO3 
б) Na2SO3 + 2HCl 
в) CuS + 2HCl 
3) Если образуется вода (слайд 5):
а) CuO + H2SO4 
б) Fe(OH)3 + 3HCl 
в) NaOH + HNO3 
4) Если НЕ образуются осадок, газ и вода, то реакции являются обратимыми (слайд 6):
Обратимые реакции – это реакции, которые при одних и тех же условиях протекают в двух противоположных направлениях
а) 2NaNO3 + CaCl2 
б) K3PO4 + 3NaCl 
в) CuCl2 + Na2SO4 
Ионные уравнения (слайды 7, 8, 9):
Для реакций ионного обмена составляют полные и сокращенные ионные уравнения. При этом на ионы никогда не раскладывают :
нерастворимые вещества (см. таблицу растворимости);
1) Запишем молекулярное уравнение и уравняем его:
CuSO4 + 2NaOH 
2) Разложим на ионы все, что возможно и затем сократим одинаковые ионы в обоих частях уравнения:
Cu +2 + SO4 -2 + 2Na +1 + 2OH -1 
3) Запишем то, что получилось:
Cu +2 + 2OH -1 
Другие примеры составления ионных уравнений (разбираются с пояснениями):
CaCO3 + 2HNO3 
CaCO3 + 2H +1 + 2NO3 -1 
CaCO3 + 2H +1 
CuS + 2HCl 
CuS + 2H +1 + 2Cl -1 
CuS + 2H +1 
NaOH + HNO3 
Na +1 + OH -1 + H +1 + NO3 -1 
OH -1 + H +1 
K3PO4 + 3NaCl 
3K +1 + PO4 -3 + 3Na +1 + 3Cl -1 
Вывод: сокращенного ионного уравнения нет, следовательно, у обратимых реакций нет сокращенных ионных уравнений
III. Закрепление изученного материала (20 мин)
Учащимся предлагается выполнить задания в парах. Каждое задание предлагается на слайде и проверяется на следующем слайде (слайдах).
Саша и Алеша делали домашнее задание. Они составили уравнения реакций, но случайно на лист бумаги пролили чернила. Помогите ученикам восстановить запись. Составьте к восстановленным
Проверка задания 1 (слайды 11, 12).
1) NaOH + HCl 
Na +1 + OH -1 + H +1 + Cl -1 
OH -1 + H +1 
2) MgCl2 + Na2SO3 
Mg +2 + 2Cl -1 + 2Na +1 + SO3 -2 
Mg +2 + SO3 -2 
3) K2SO3 + 2HNO3 
2K +1 + SO3 -2 + 2H +1 + 2NO3 -1 
SO3 -2 + 2H +1 
4) ZnSO4 + 2NaOH 
Zn +2 + SO4 -2 + 2Na +1 + 2OH -1 
Zn +2 + 2OH -1 
5) Al(OH)3 + 3HNO3 
Al(OH)3 + 3H +1 + 3NO3 -1 
Al(OH)3 + 3H +1 
6) CaCO3 + 2 HCl 
CaCO3 + 2H +1 + 2Cl -1 
CaCO3 + 2H +1 
Задание 2. (слайд 13):
Полные и сокращенные ионные уравнения к заданиям 2,3,4,5 дети должны будут сделать дома)
Колдунья с вороном отравили лечебный колодец, в котором был раствор хлористого кальция, который помогал целому городу. Он использовался горожанами при отравлениях, кровотечениях, аллергиях. Они превратили раствор СaCl2 в нерастворимый известняк CaCO3. Помогите жителям “расколдовать” колодец, если в вашем распоряжении есть растворы NaCl, Na2CO3, HCl, H2SO4, Zn(NO3)2.
Проверка задания 2 (слайд 14):
СаСО3 + 2HCl 
Задание 3 (слайд 15):
Олененок спешит к друзьям. Он шел долгих 3 дня. Ему осталось только перейти реку, но река оказалась испорчена – она наполнена раствором серной кислоты. Помогите Олененку воссоединиться с друзьями, если в вашем распоряжении есть растворы NaCl, Ba(OH)2 HCl, CuSO4, Ba(NO3)2.
Проверка задания 3 (слайд 16):
H2SO4 + Ba(OH)2 
Задание 4 (слайд 17)
Проверка задания 4 (слайд 18):
Cu(OH)2 + H2SO4 
Задание 5 (слайд 19)
Проверка задания 5 (слайд 20):
BаСО3 + 2HCl 
Домашнее задание (слайд 21):Параграф 37. не забудьте составить полные и сокращенные ионные уравнения к заданиям 2, 3, 4, 5, решенным в классе, иначе Ваша помощь сказочным персонажам не будет полной.
1. К неэлектролитам относится:
1) NaCI; 2) MgCI₂ ; 3) Na₂SiO₃ ; 4) SiO₂;
2. С выделением газа протекает реакция между:
1) карбонатом натрия и нитратом магния
2) фосфорной кислотой и нитратом бария
3) хлоридом аммония и гидроксидом кальция
4) хлоридом калия и нитратом серебра
3. Установите соответствие между исходными веществами и продуктами реакции.
http://nsportal.ru/shkola/khimiya/library/2016/03/31/urok-ionnye-uravneniya
http://kopilkaurokov.ru/himiya/uroki/ionnyie_uravnieniia_otkrytyi_urok