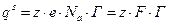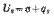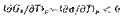Лекция №5
План лекции:
ДВОЙНОЙ ЭЛЕКТРИЧЕСКИЙ СЛОЙ
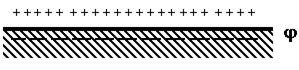
На поверхности твердого тела при его контакте с жидкостью самопроизвольно возникает избыточный электрический заряд, который компенсируется противоионами. В результате, на границе Ж-Т возникает ДЭС. Образование ДЭС происходит самопроизвольно, вследствие стремления поверхностной энергии к минимуму и в связи с особыми свойствами границы раздела.
Возникновение на границе электрических зарядов характерно, прежде всего, для золей и суспензий, дисперсная фаза которых формируется из твердых частиц.
При погружении металла в раствор электролита, содержащего ионы этого металла, устанавливается электрохимическое равновесие. Если химический потенциал ионов металла m М больше химического потенциала этих же ионов в растворе m р , то ионы переходят из металла в раствор, и поверхность металла заряжается отрицательно. И, наоборот, при помещении медной пластинки в раствор сульфата меди с достаточно высокой концентрацией соли, металлическая поверхность заряжается положительно.
Возникновение зарядов на твердом теле приводит к тому, что на границе раздела фаз возникает электрический потенциал, обозначаемый через j .
Если j -потенциал определяется активностью ионов в растворе, то есть твердое тело играет роль электрода, то для выражения его можно воспользоваться уравнением Нернста:


где n — заряд иона, F — число Фарадея, ап и ар -активности ионов у поверхности и в растворе.
ОБРАЗОВАНИЕ ДЭС
Поверхность твердого тела приобретает ионы определенного знака. Эти ионы называют потенциалоопределяющими. К твердой поверхности из жидкой среды притягиваются ионы противоположного знака, их называют противоионами. Возникает ДЭС.
Было предложено несколько теорий образования ДЭС.
Простейшей из них является модель плоского конденсатора Гельмгольца (5.1.а), согласно которой потенциалоопределяющие ионы и противоионы находятся на молекулярном расстоянии друг от друга, взаимодействие между ними осуществляется только за счет электростатических сил, а падение потенциала между слоями происходит линейно.
Дальнейшее развитие теория ДЭС получила в работах Гуи и Чепмена на основе сопоставления электростатического взаимодействия противоионов с энергией их теплового движения. Согласно модели Гуи и Чепмена противоионы рассматриваются как точечные заряды, не имеющие собственных размеров, расположенные в диффузном слое (5.1.б), а потенциал экспотенциально снижается по мере удаления от поверхности.
Согласно теории Штерна , которую можно рассматривать как основу современного представления о структуре ДЭС (5.1.в), противоионы находятся в двух положениях: одна их часть образует адсорбционный слой (иногда его называют плотным слоем или слоем Гельмгольца).Другая часть противоионов находится в диффузном слое. В отличии от адсорбционного слоя противоионы диффузного слоя не закреплены, в результате диффузии и взаимного отталкивания они способны перемещаться в пределах диффузного слоя в глубь жидкости.
ДЭС может возникнуть на частицах, находящихся в полярной среде, и в отсутствии электролитов, вследствие ориентации диполей, а также частичной поверхностной диссоциации полярных частиц, если в жидкой среде присутствуют хотя бы следы воды.
Потенциал, возникающий на границе между адсорбционным и диффузным слоем, называется потенциалом диффузного слоя j д .
Толщина адсорбционного слоя d определяется размерами противоионов, обычно она незначительна и не превышает 1 нм. В диффузном слое противоионы движутся хаотично, их положение изменяется. По этой причине толщина диффузного слоя будет величиной приведенной l .
ТЕРМОДИНАМИЧЕСКИЕ СООТНОШЕНИЯ МЕЖДУ ПОВЕРХНОСТНЫМ НАТЯЖЕНИЕМ И ЭЛЕКТРИЧЕСКИМ ПОТЕНЦИАЛОМ ДЭС.
Образование ДЭС происходит самопроизвольно, в результате стремления
системы уменьшить энергию Гиббса поверхностного слоя.
Обозначим изменение электрической энергии через j d q ( j — электрический потенциал ДЭС, q — заряд поверхности).
Тогда, в соответствии с обобщенным уравнением первого и второго начал термодинамики (без учета химической энергии), изменение энергии Гиббса на поверхности можно записать следующим образом:
dG = — S dT + s dS + j d q (5.2)
s dS — изменение поверхностной энергии
dG = s dS + j d q (5.3)
Полный дифференциал энергии Гиббса :
dG = s dS +S d s + j d q + q d j
Вычитая это уравнение из 5.3, получим:
S d s + q d j = 0 (5.4)
Разделим 5.4 на S (площадь межфазной поверхности) и обозначим q / S через qS (плотность заряда), получим:

I уравнение Липпмана
Если знаки потенциала и заряда совпадают, то поверхностное натяжение уменьшается с увеличением потенциала, если их знаки противоположны, то с увеличением потенциала увеличивается поверхностное натяжение.
Дифференциальная емкость ДЭС, как и любого конденсатора, определяется соотношением:

Дифференцируем 5.5 по j и подставляем в него соотношение 5.6, получаем второе уравнение Липпмана:

II уравнение Липпмана
Это уравнение показывает возможность определения емкости ДЭС, если известна зависимость поверхностного натяжения от потенциала.
Если ДЭС возникает вследствие перераспределения ионов, то для описания адсорбции ионов можно воспользоваться адсорбционным уравнением Гиббса. Если на поверхности адсорбируется катионы:
Г+ — гиббсовская адсорбция потенциалоопределяющих катионов.
Поверхностная плотность заряда:
Подставляем это выражение в уравнение Липпмана:
сравниваем 5.8 и 5.9:

a o и ap — активности иона на поверхности и в растворе
Полученное уравнение называется уравнением электродного потенциала Нернста. Приведенный вывод указывает на связь между уравнениями Гиббса и Липпмана и показывает, что потенциалоопределяющие ионы, адсорбируясь, изменяют поверхностное натяжение.
СПЕЦИФИЧЕСКАЯ АДСОРБЦИЯ ИОНОВ
Штерн попытался учесть влияние специфической адсорбции ионов на электрический потенциал, обусловленный действием ковалентных сил дополнительно к электростатическим силам. Так как радиус действия сил такой адсорбции соизмерим с размером ионов, это дает основание учитывать ковалентные силы только для ионов, входящих в плотный слой Гельмгольца.
Плотность поверхностного заряда противоионов можно разделить на две части: плотность заряда qr, обусловленную слоем Гельмгольца и q d диффузного слоя Гуи.
Общая поверхностная плотность заряда ДЭС:
Штерн предположил, что поверхность имеет определенное число адсорбционных центров, каждый из которых взаимодействует с одним противоионом.
Константа такой квазихимической реакции равна фактору Больцмана, в котором общий адсорбционный потенциал составляет сумму адсорбционных потенциалов электростатического и специфического взаимодействия:

F n j — электростатический адсорбционный потенциал,
F — потенциал специфической адсорбции.
Такой подход позволил Штерну получить уравнение для плотности поверхностного заряда в слое Гельмгольца:

где q ¥ — предельно возможная плотность поверхностного заряда
xo — мольная доля противоионов в растворе.
При малых концентрациях электролита можно пренебречь единицей в знаменателе.
Теория Штерна позволяет рассчитать заряд в плотном и диффузном слоях.
Из теории Ш. следует, что лучше адсорбируются и ближе подходят к Пв менее гидратированные ионы.
Специфическая адсорбция зависит от сродства адсорбируемых ионов к поверхности, их способности образовывать недиссоциирующие поверхностные соединения. Большими адсорбционными потенциалами обладают многозарядные ионы (Al 3+ , Th 4+ и др.), органические ионы.
Сильно адсорбирующиеся ионы в плотном слое способны создать избыточный заряд со знаком заряда противоионов. Это явление называется перезарядкой. (рис. 5.2)
Рис. 5.2. Изменение потенциала поверхности при ее перезарядке.
При перезарядке j o и j d имеют разные знаки. Общую поверхностную плотность заряда можно представить в виде разности между величинами адсорбции потенциалоопределяющих ионов разного знака :
Пример:
1) водный р-р — поверхность AgI. При избытке в растворе Ag + (при добавлении AgNO3 ) эти ионы являются потенциалоопределяющими
В роли противоионов выступают NO3 — , часть которых, находится в плотном слое, часть — в диффузном.
Ф — ла ДЭС :[AgI]m · nAg + |(n — x)NO3 — |x NO 3 —
n-число потенциалопределяющих ионов
x-число противоионов в диффузной части
Если в систему с AgI добавить KNO3 , то потенциалопределяющими станут иодид — ионы:
[ AgI ] m · nI — |( n — x ) K + | x K +
2) В ДЭС на поверхности оксидов в растворе в качестве потенциалопределяющих ионов выступают Н + или OH — (в зависимости от среды).
В результате преобладающей адсорбции одного и этих ионов поверхность оксида приобретает соответствующий знак заряда поверхности. Например: SiO2 обладает кислотными свойствами, поэтому его поверхность заряжена отрицательно:
[SiO2]m · nOH — |(n — x)H + |x H +
FeO имеет основные свойства, его поверхность будет заряжена положительно:
[FeO]m · nH + |(n — x)OH — |x OH —
Al2O3 — в кислой среде поверхность заряжена положительно, в щелочной — отрицательно.
В дисперсионных системах ДЭС возникает на поверхности частиц.
Частицу дисперсной фазы в гетерогенно-дисперсной системе вместе с ДЭС называют мицеллой.
Строение мицеллы можно показать той же формулой, что и строение ДЭС.
Внутренняя части мицеллы — агрегат основного вещества, на поверхности агрегата — потенциалопределяющие ионы:
Агрегат + потенциалопределяющие ионы = ядро.
Ядро + противоионы = гранула.
Гранулу окружают противоионы диффузного слоя. Вся мицелла электронейтральна.
Мицеллы создают в дисперсионной системе соответствующую противоионам ионную среду — суспензионный эффект. Если противоионами являются Н + и ОН — — ионы, то среда приобретает соответственно кислый или щелочной характер. При удалении частиц, например, фильтрацией, противоионы уходят вместе с ними в количествах, эквивалентных заряду частиц. Отсюда суспензионный эффект количественно можно определить как разность между концентрационными характеристиками противоионов в суспензии (дисперсионной системе) и в фильтрате. При определении кислотно-основных свойств дисперсной фазы суспензионный эффект рассчитывается по соотношению:
рНсэ = рНс — рНф, то есть по разности значений рН суспензии и фильтрата. Суспензионный эффект возрастает с увеличением концентрации дисперсной фазы, с увеличением ее дисперсности, и уменьшается с повышением концентрации электролита (это связано со сжатием ДЭС).
Связь поверхностного натяжения с электрическим потенциалом. Уравнение Липпмана.
Поверхностная энергия характеризуется поверхностным натяжением 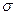
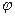
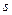
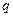
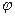
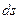
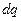
Рис. 10.2. К выводу уравнения Липпмана.
Максимальная изотермическая работа процесса равна изменению свободной энергии:
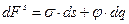
где произведение 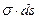
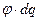
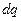
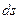
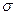
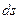
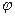
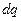
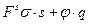
Рассмотрим любые возможные изменения системы, то есть получим полный дифференциал 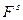
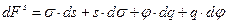
Уравнение (10.1) и (10.3) получены независимо и справедливы при условии, что
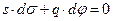
Или

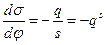
Величина 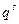
Где 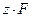
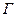
Рис. 10.3. Действие сил поверхностного натяжения и электрических сил на поверхность.
Из этого уравнения следует, что с увеличением потенциала поверхности поверхностное натяжение уменьшается. Физическая сущность этого уравнения заключается в том, что уменьшение свободной поверхностной энергии системы приводит к увеличению электрической энергии. Одноименные заряды стремятся растянуть поверхность, то есть препятствуют поверхностному натяжению, сжимающему поверхность (Рис. 10.3).
Дата добавления: 2020-11-18 ; просмотров: 315 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Экзаменационный билет № 2
Есть несколько определений поверхностного натяжения:
1. Поверхностное натяжение – работа образования новой поверхности в изотермическом процессе
2. Поверхностное натяжение – сила, действующая по периметру данной поверхности, отнесенная к единице длины.
3. Поверхностное натяжение – работа переноса молекул из объема тела на поверхность.
4. Термодинамическое определение поверхностного натяжения:
Термодинамическое определение поверхностного натяжения вытекает из объединенного уравнения первого и второго начал термодинамики. Запишем его для гетерогенной системы относительно изменения внутренней энергии U:
При постоянных S, V, ni и q имеем:
т. е. поверхностное натяжение есть частная производная от внутренней энергии по площади поверхности раздела фаз при постоянных энтропии, объеме, числе молей компонентов и заряде.
Так как объединенное уравнение первого и второго начал термодинамики может быть записано и относительно других термодинамических потенциалов, а именно энергии Гиббса G, энергии Гельмгольца F и энтальпии Я, то при соответствующих постоянных параметрах получим:
Таким образом, поверхностное натяжение есть частная производная от любого термодинамического потенциала по площади межфазной поверхности при постоянных соответствующих параметрах.
Физический смысл поверхностного натяжения можно представить так: поверхностное натяжение на границе жидкости с газовой фазой – работа, расходуемая на обратимый разрыв столбика этой жидкости с поперечным сечением в 0,5 единицы площади, так как при разрыве образуется новая поверхность, равная единице площади.
Чем сильнее межмолекулярные связи в данном теле, тем больше его поверхностное натяжение на границе с газовой фазой.
В соответствии со вторым началом термодинамики избыточная энтропия равна
Учитывая, что Gs = σ, получим следующее выражение:
Из этого уравнения следует, что внутренняя энергия поверхности складывается из энергии Гиббса и теплоты образования поверхности. Для индивидуальных веществ теплота qs всегда положительна, так как при образовании поверхности теплота поглощается. Из уравнения объединенных первого и второго начала термодинамики при постоянстве всех параметров, кроме температуры, имеем:
Подставлям это выражение в полученные уравнения:
Это уравнение называется уравнением Гиббса — Гельмгольца. Оно связывает полную поверхностную энергию с энергией Гиббса (поверхностным натяжением). Из этого уравнения следует, что для определения полной поверхностной энергии необходимо знать зависимость поверхностного натяжения от температуры. Для индивидуальных веществ теплота qs всегда положительна, а это значит, что температурный коэффициент поверхностного натяжения отрицателен:
Таким образом, поверхностное натяжение индивидуальных веществ на границе с газом (воздухом) снижается с повышением температуры. Для большинства неполярных жидкостей эта зависимость линейная.
- Механизмы образования ДЭС. Соотношение между электрическим потенциалом и поверхностным натяжением (уравнение Липпмана). Электрокапиллярные кривые и определение параметров ДЭС.
Различают три возможных механизма образования двойного электрического слоя:
1. Двойной электрический слой образуется в результате перехода ионов или электронов из одной фазы в другую (поверхностная ионизация). Например, с поверхности металла в газовую фазу переходят электроны, создавая электронное облако со стороны газовой фазы.
2. Образование двойного электрического слоя происходит в результате адсорбции. Двойной электрический слой может образоваться при избирательной адсорбции в межфазном слое ионов электролитов, не входящих в состав веществ, образующих фазы, т. е. в результате адсорбции примесей.
3. Если вещества, составляющие фазы системы, не способны обмениваться зарядами, то двойной электрический слой может образоваться благодаря ориентированию полярных молекул сопряженных фаз в результате их взаимодействия.
Из объединенных первого и второго начал термодинамики, а также полного дифференциала энергии Гиббса выводится первое уравнение Липпмана, связывающее электрический потенциал с поверхностным натяжением:
Если знаки потенциала и заряда совпадают, то поверхностное натяжение снижается с ростом потенциала. Если же их знаки противоположны, то увеличение потенциала ведет к росту поверхностного натяжения. Эти зависимости тем сильнее,чем больше абсолютное значение плотности заряда. При минимальной плотности заряда поверхностное натяжение слабо зависит от потенциала.
Дифференциальная емкость двойного электрического слоя, как н любого конденсатора, определяется соотношением:
После дифференцирования первого уравнения Липмана по φ и подстановки в него данного соотношения получим второе уравнение Липпмана:
Это уравнение показывает возможность определения емкости двойного электрического слоя, если известна зависимость σ от φ.
Это уравнение называют уравнением электрокапиллярной кривой. Из него следует, что поверхностное натяжение при условии постоянства емкости двойного электрического слоя изменяется в соответствии с уравнением параболы.
Вершина параболы отвечает максимальному поверхностному натяжению σмакс. Парабола симметрична, что по физическому смыслу означает равное сродство катионов и анионов, выступающих в роли противоионов, к поверхности, имеющей соответственно отрицательный и положительный потенциал. Уменьшение положительного потенциала, как и отрицательного, ведет к увеличению поверхностного натяжения. Однако в реальных системах емкость двойного электрического слоя несколько изменяется с изменением потенциала, и поэтому экспериментальные электрокапиллярные кривые обычно не являются симметричными.
Вершина параболы соответствует точке нулевого заряда. В этой точке поверхностное натяжение не зависит от потенциала, так как производная dσ/dφ равна нулю, т. е. поверхностный слой имеет нулевой заряд, что означает отсутствие двойного электрического слоя. Потенциал же поверхности в этой, точке не равен нулю.
http://poznayka.org/s53981t2.html
http://poisk-ru.ru/s43996t1.html