Please wait.
We are checking your browser. gomolog.ru
Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6e0f8d918e291610 • Your IP : 85.95.188.35 • Performance & security by Cloudflare
Школе NET
Register
Do you already have an account? Login
Login
Don’t you have an account yet? Register
Newsletter
Submit to our newsletter to receive exclusive stories delivered to you inbox!
- Главная
- Вопросы & Ответы
- Вопрос 7407013
Васян Коваль
В химической реакции, протекающей по уравнению 2H2S + Cl2 = 2S + 2HCl, концентрация газообразного хлора за 3 минуты уменьшилась с 0,063 моль/л до 0,027 моль/л. Рассчитайте скорость химической реакции в данный промежуток времени
Примеры решения типовых задач
Глава I. Химическая термодинамика
1. Определить тепловой эффект химической реакции в стандартных условиях при 500 К: СН3ОН + 3/2 О2(г) = СO2(г) + 2Н2O
Из справочника [8] выпишем необходимые для расчёта термодинамические величины
| Вещество | СO2 (г) | Н2O (г) | O2 (г) | СН3ОH (г) |
| ΔН 0 f, 298 кДж/моль | -393,51 | -241,84 | -201,20 | |
| С 0 р, 298 Дж/мольК | 37,13 | 33,56 | 29,36 | 43,90 |
Для расчёта теплового эффекта и изменения теплоёмкости применим следствие из закона Гесса, при этом учитываем, что для простых веществ стандартная теплота образования равна нулю.
ΔH 0 298, х.р. = ΔН 0 298, f ( 


= (– 393,51) + 2(–241,84) – (–201,2) = – 675,99 кДж.
Знак минус перед тепловым эффектом означает, что теплота выделяется в результате реакции.
ΔС 0 р, 298 = (Ср( 



= ( 37,13 + 2·33,56 ) – ( 43,9 + 3/2·29,36) = 16,31 Дж/К
Тепловой эффект при 500 К находим по уравнению Кирхгофа (второе приближение), при условии, что средняя изобарная теплоемкость постоянна
ΔН 0 500 х.р. = 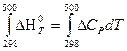

= – 675,99·10 3 + 16,31(500 – 298) = 672,70·10 3 Дж = 672,7 кДж
2. Рассчитать (по теплотам сгорания) стандартную теплоту образования глицерина С3Н8О3 (ж).
Из определения теплоты образования следует, что H298, f ( 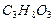
используя следствие из закона Гесса, можно записать:
Δ H298, f ( 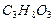
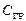
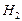
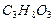
Теплоты сгорания простых веществ при стандартных условиях численно равны стандартным теплотам образования продуктов сгорания, т.е. для реакций
из справочника [8] определяем:
ΔН298, сгор ( 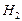

ΔН298, сгор ( 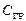

ΔН298, сгор ( 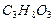
ΔНf, 298 ( 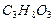
По справочным данным эта величина равна – 668,6 Кдж/моль.
3. Дайте заключение о возможности самопроизвольного протекания химической реакции при Т = 298 К
молочная кислота пировиноградная к-та
| Вещество | ΔH298, f кДж/моль | S298, f, Дж/моль·К |
| молочная кислота | -673 | |
| пировиноградная к-та | -586 | |
| Н2 |
Рассчитаем по следствию из закона Гесса:
1. Изменение энтальпии: ΔН 0 298, р = (– 586 + 0) – (– 673) = 87 (кДж)
2. Изменение энтропии: ΔS 0 298, p = (179 + 130) – 192 =117 (Дж/К)
3. Изменение энергии Гиббса по уравнению Гиббса-Гельмгольца (первое приближение):
ΔG 0 298 = ΔH 0 298 – TΔS = 87·10 3 – 298·117 = 52134 (Дж)
реакция самопроизвольно протекать не может, т.к. ΔG 0 298 > 0
4. При 1000 К и 1,013·10 5 Па из исходной смеси, содержащей 1 моль SО2 и 0,6 моль О2 при достижении равновесия образовалось 0,22 моль SО3. Определить Кр для реакции
2SО2 + О2 
На образование 0,22 моль SО3, согласно уравнению реакции израсходовано 0,22 моль SО2 и 0,11 моль кислорода. Запишем число молей
| SО2 | О2 | SО3 | |
| В исходной смеси | 0,6 | ||
| Прореагировало/образовалось | 0,22 | 0,11 | 0,22 |
| В равновесной смеси | 1 – 0,22 = 0,78 | 0,6 – 0,11 = 0,49 | 0,22 |
| Συi | 0,78 + 0,49 + 0,22 = 1,49 |
P( 

Р( 

P( 

5. Для реакции: СО + Cl2 
а) 1моль СО; 1 моль Cl2; 4 моль COCl2
б) 1моль СО; 1 моль Сl; 8 моль COCl2
в) 1моль СО; 1,565 моль Cl2; 10 моль COCl2
Воспользуемся уравнением изотермы химической реакции.
а) ΔG = – RTln·6,386 + RT·ln 4
He производя вычислений, а лишь сравнивая величины, стоящие за знаком логарифма, можно сделать вывод, что G 0. Это значит, что при смешивании реагирующих веществ в указанных соотношениях реакция пойдёт в сторону образования СО и Cl2;
в) ΔG = – RTln 6,386 + RTln 6,386
Сравнив оба слагаемых, можно сделать вывод, что ΔG = 0. В этом случае система находится в состоянии химического равновесия.
6. Рассчитать значение константы равновесия для реакции при стандартных условиях и 1000 К, если изменение энергии Гиббса равно – 100,79 кДж.
Воспользуемся уравнением изотермы при стандартных условиях.
lgKp = (– ΔG 0 T) / (2,3·RT) = (–100,79) / (2,3·8,31·1000) = 5,27
http://shkolenet.ru/QA/7407013/
http://poisk-ru.ru/s45501t2.html



