Реакции ионного обмена — Химическая реакция — ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ХИМИИ
Тесты с выбором ответа с решениями
1. В ионном уравнении реакции записываем в виде ионов
2. В ионном уравнении реакции записываем в виде молекул
3. Гидроксид цинка реагирует с раствором гидроксида натрия, поскольку в ходе этой реакции образуется
1) сильный электролит
4) комплексное соединение
4. Реакция в растворе не идет между
5. Какие ионы реагируют при сливании растворов К2СO3 и НСl?
6. Какая пара ионов участвует в химической реакции при сливании растворов хлорида кальция и фосфата натрия?
7. Для реакции Ва(ОН)2 + H2SO4 = BaSO4 + 2Н2O сумма коэффициентов в сокращенном ионном уравнении равна
8. Сумма коэффициентов в сокращенном ионном уравнении взаимодействия 1 моль гидроксида алюминия с 1 моль гидроксида натрия в водном растворе равна
9. Уравнению 
10. Уравнению 
2) Na[Al(OH)4] с недостатком НСl
4) Na[Al(OH)4] с избытком НСl
Тесты с выбором ответа для самостоятельного решения
11. В ионном уравнении реакции записываем в виде ионов
12. В ионном уравнении реакции записываем в виде молекул
13. Гидроксид алюминия реагирует с раствором соляной кислоты, поскольку в ходе этой реакции образуется
2) слабый электролит
4) комплексное соединение
14. Реакция в растворе не идет между
15. Какие ионы реагируют при сливании растворов (NH4)2SO4 И КОН?
16. Какая пара ионов участвует в химической реакции при сливании растворов сульфита натрия и азотной кислоты?
17. Для реакции FeS + 2НСl = FeCl2 + H2S сумма коэффициентов в сокращенном ионном уравнении равна
18. Сумма коэффициентов в сокращенном ионном уравнении взаимодействия гидроксида цинка с избытком раствора гидроксида натрия равна
19. Уравнению 
20. Уравнению 
2) ZnSO4 с недостатком NaOH
Ответы на тесты раздела 1.4.6
1. 2 2. 1 3. 4 4. 3 5. 1 6. 2 7. 3 8. 4 9. 4 10. 2 11. 3 12. 1 13. 2 14. 4 15. 3 16. 4 17. 3 18. 1 19. 3 20. 4
Решения тестов раздела 1.4.6
Решение 1. В ионных уравнениях реакций соединения записываются в том виде, в каком они присутствуют в растворе. Сильные электролиты записываются в виде ионов, а слабые электролиты, малорастворимые вещества и газы — в виде молекул. Например, для уравнения реакции 



Сокращая хлорид-ионы, получаем сокращенное ионное уравнение:
Среди перечисленных в задании соединений в виде молекул записываются в ионных уравнениях: осадки Mg(OH)2и BaSO4, а также слабый электролит H2S. Растворимая соль CuSO4 является сильным электролитом и записывается в виде ионов.
Решение 2. Среди перечисленных в задании соединений в виде молекул в ионных уравнениях записывается слабый электролит Н2О. Растворимые соли FeCb и Na2CO3, а также растворимое основание NaOH являются сильными электролитами и записываются в виде ионов.
Решение 3. Ионные реакции идут в сторону образования осадков, газов, слабых электролитов или комплексных ионов. Гидроксид цинка реагирует с раствором гидроксида натрия, поскольку в ходе этой реакции образуется комплексное соединение тетрагидроксоцинкат натрия Na2[Zn(OH)4]. Это видно из соответствующих уравнений реакции:
Решение 4. Если в ходе реакции между ионами не образуется осадков, газов, слабых электролитов или комплексных ионов, то эти ионы не взаимодействуют между собой.
Вещества КОН и FeCl3 взаимодействуют, поскольку образуется осадок 

Решение 5. Реакция между растворами К2СО3 и НСl идет в соответствии с уравнениями:
Из сокращенного ионного уравнения видно, что взаимодействуют ионы СO3 2- и 2Н + .
Решение 6. Реакция между растворами хлорида кальция СаСl2 и фосфата натрия Na3PO4 идет в соответствии с уравнениями:
Из сокращенного ионного уравнения видно, что взаимодействуют ионы Са 2+ и РO4 3- .
Решение 7. Напишем уравнения реакции:
Полное и сокращенное ионные уравнения совпадают друг с другом. Сумма коэффициентов в этом уравнении равна 9.
Решение 8. Запишем молекулярное и ионные уравнения реакции:
Сумма коэффициентов в сокращенном ионном уравнении равна 3.
Решение 9. Наличие в сокращенном ионном уравнении ионов Н + и ОН — указывает, что исходные кислота и основание являются сильными электролитами. Соединения КОН и HNO2 не подходят, поскольку HNO2 является слабым электролитом и в ионном уравнении записывается в виде молекулы HNO2, которой нет в сокращенном ионном уравнении. Аналогично не подходят ни соединения H2SO4 и Fe(OH)3, ни соединения HF и NaOH, поскольку Fe(OH)3и HF являются слабыми электролитами и записываются в ионных уравнениях в виде молекул. Соединения КОН и HNO3 являются сильными электролитами. Запишем уравнения реакции между ними и убедимся, что действительно получается требуемое сокращенное ионное уравнение:
Решение 10. Амфотерным гидроксидам соответствуют два ряда солей. Так, гидроксиду алюминия Аl(ОН)3 соответствуют соли АlСl3 и Na[Al(OH)4].
В ряду соединений 
При добавлении к Na[Al(OH)4] избытка HCl реакция идет следующим образом:
Библиотека образовательных материалов для студентов, учителей, учеников и их родителей.
Наш сайт не претендует на авторство размещенных материалов. Мы только конвертируем в удобный формат материалы из сети Интернет, которые находятся в открытом доступе и присланные нашими посетителями.
Если вы являетесь обладателем авторского права на любой размещенный у нас материал и намерены удалить его или получить ссылки на место коммерческого размещения материалов, обратитесь для согласования к администратору сайта.
Разрешается копировать материалы с обязательной гипертекстовой ссылкой на сайт, будьте благодарными мы затратили много усилий чтобы привести информацию в удобный вид.
© 2014-2022 Все права на дизайн сайта принадлежат С.Є.А.
Как составлять уравнения ионных реакций
Знания, необходимые для составления уравнений ионных реакций:
- умение отличать электролит от неэлектролита;
- умение составлять уравнения диссоциации электролитов;
- умение устанавливать значение зарядов ионов.
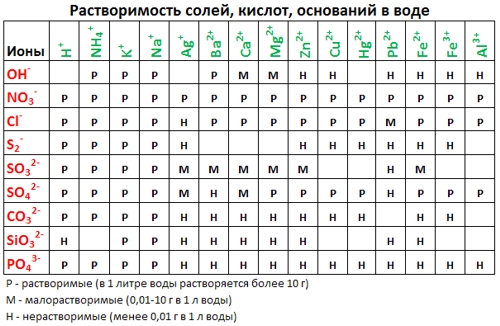
Таблица растворимости:
Таблица электрохимического ряда напряжений металлов:
В ионных уравнениях химические формулы веществ записывают в двух видах — в виде ионов, либо в виде молекул. Возникает естественный вопрос, — когда то или иное вещество надо записывать в виде иона или молекулы?
В виде ионов записывают формулы следующих веществ:
- сильные кислоты: H2SO4, HNO3, HI. ;
- сильные основания: KOH, NaOH, Ba(OH)2. ;
- растворимые в воде соли: KNO3, BaCl2, NaBr.
В виде молекул записывают формулы следующих веществ:
В случае, если среди продуктов реакции имеются нерастворимые или малорастворимые вещества (осадок), возле таких веществ ставят стрелку вниз (↓). Газообразные и летучие соединения соответственно обозначаются стрелкой, направленной вверх (↑).
Алгоритм составления уравнения ионных реакций
- Записать уравнение в молекулярной форме:
- В тех случаях, когда реакция идет не до конца, у продуктов реакции, выпадающих в осадок или выделяющихся в виде газа, ставят стрелку:
- Записывают уравнение в ионном виде для тех веществ, которые диссоциируют на ионы, с указанием их зарядов:
- Определяют наличие одинаковых ионов в левой и правой части уравнения — это ионы, не принимающие участия в реакции, поэтому, их можно убрать, такая форма записи ионного уравнения называется сокращенной:
- ионы водорода и металлов имеют положительный заряд;
- ионы гидроксония и кислотных остатков — отрицательный заряд;
- как правило, заряд иона численно равен валентности атома.
Составление молекулярных уравнений по ионным
Теперь рассмотрим обратную задачу — как составить молекулярное уравнение, если известно сокращенное ионное уравнение.
- Дано сокращенное ионное уравнение взаимодействия между фосфором и хлором:
- По таблице Растворимостей (см. выше) подбираем соответствующие вещества, содержащие нужный катион и анион — хлорид натрия (NaCl) и нитрат свинца (II) (Pb(NO3)2);
- Пишем формулы выбранных веществ, которые должны прореагировать:
- Пишем формулы получившихся в результате реакции веществ:
- Осталось расставить стехиометрические коэффициенты, чтобы уравнять кол-во вещества в левой и правой части уравнения:
Реакции обмена в водных растворах электролитов могут протекать до конца (необратимые реакции)) или же одновременно протекать в противоположных направлениях (обратимые реакции).
Условия протекания необратимых реакций:
- образование осадка;
- выделение газа;
- образование малодиссоциирующего вещества (например, воды).
В случае, если в растворе нет ионов, способных связаться между собой, реакция является обратимой, т.е., не протекает до конца.
Пример необратимой реакции с выпадением осадка был приведен выше — взаимодействие хлорида натрия и нитрата свинца (II).
Пример необратимой реакции с выделением газа — взаимодействие карбоната натрия и соляной кислоты:
Пример необратимой реакции с образованием воды — взаимодействие гидроксида калия и азотной кислоты:
Пример обратимой реакции взаимодействия слабого электролита (CH3COOH) и нерастворимого основания (Cu(OH)2):
Если в реакцию вступают сильные электролиты, не дающие в результате взаимодействия малорастворимых или малодиссоциирующих веществ, то такие реакции не протекают — в растворе образуется смесь ионов, которые никак не взаимодействуют друг с другом:
Левая и правая части уравнения содержат абсолютные одинаковые ионы, которые можно сократить, поэтому никакой реакции не происходит.
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
Реакции ионного обмена
Реакции ионного обмена – это реакции между сложными веществами в растворах, в результате которых реагирующие вещества обмениваются своими составными частями. Так как в этих реакциях происходит обмен ионами – они называются ионными.
| Правило Бертолле: Реакции обмена в растворах электролитов протекают до конца (возможны) только тогда, когда в результате реакции образуется либо твердое малорастворимое вещество (осадок), либо газ, либо вода или любой другой слабый электролит. |
| Например, нитрат серебра взаимодействует с бромидом калия |
AgNО3 + КВr = АgВr↓ + КNО3
Правила составления уравнений реакций ионного обмена
1. Записываем молекулярное уравнение реакции, не забывая расставить коэффициенты:
3KOH +FeCl3 = Fe(OH)3 + 3KCl
2. С помощью таблицы растворимости определяем растворимость каждого вещества. Подчеркнем вещества, которые мы не будем представлять в виде ионов.
р р н р
3KOH + FeCl3 = Fe(OH)3 + 3KCl
3. Составляем полное ионное уравнение. Сильные электролиты записываем в виде ионов, а слабые электролиты, малорастворимые вещества и газообразные вещества записываем в виде молекул.
3K + + 3OH — + Fe 3+ + 3Cl — = Fe(OH)3 + 3K + + 3Cl —
4. Находим одинаковые ионы (они не приняли участия в реакции в левой и правой частях уравнения реакции) и сокращаем их слева и справа.
3K + + 3OH — + Fe 3+ + 3Cl — = Fe(OH)3 + 3K + + 3Cl —
5. Составляем итоговое сокращенное ионное уравнение (выписываем формулы ионов или веществ, которые приняли участие в реакции).
Fe 3+ + 3OH — = Fe(OH)3
На ионы мы не разбиваем:
- Оксиды; осадки; газы; воду; слабые электролиты (кислоты и основания)
- Анионы кислотных остатков кислых солей слабых кислот (НСО3 — , Н2РО4 — и т.п.) и катионы основных солей слабых оснований Al(OH) 2+
- Комплексные катионы и анионы: [Al(OH)4] —
| Например, взаимодействие сульфида цинка и серной кислоты |
Составляем уравнение реакции и проверяем растворимость всех веществ. Сульфид цинка нерастворим.
ZnS + H2SO4 = ZnSO4 + H2S
Реакция протекает до конца, т.к. выделяется газ сероводород, который является слабым электролитом. Полное ионно-молекулярное уравнение:
ZnS + 2H + + SO4 2 — = Zn 2+ + SO4 2 — + H2S
Сокращаем ионы, которые не изменились в процессе реакции – в данном случае это только сульфат-ионы, получаем сокращенное ионное уравнение:
ZnS + 2H + = Zn 2+ + H2S
| Например, взаимодействие гидрокарбоната натрия и гидроксида натрия |
Составляем уравнение реакции и проверяем растворимость всех веществ:
NaHCO3 + NaOH = Na2CO3 + H2O
Кислые анионы слабых кислот являются слабыми электролитами и на ионы не разбиваются:
Na + + НСО3 — + Na + + ОН — = 2Na + + CO3 2- + H2O
Сокращаем одинаковые ионы, получаем сокращенное ионное уравнение:
НСО3 — + ОН — = CO3 2- + H2O
| Например, взаимодействие тетрагидроксоалюмината натрия и соляной кислоты |
Составляем уравнение реакции и проверяем растворимость всех веществ:
Na[Al(OH)4] + 4HCl = NaCl + AlCl3 + H2O
Комплексные ионы являются слабыми электролитами и на ионы не разбиваются:
Na + + [Al(OH)4] — + 4H + + 4Cl — = Na + + Cl — + Al 3+ + 3Cl — + H2O
Сокращаем одинаковые ионы, получаем сокращенное ионное уравнение:
[Al(OH)4] — + 4H + = Al 3+ + 4H2O
http://prosto-o-slognom.ru/chimia/04_uravnenie_ionnoj_reaktsii.html
http://chemege.ru/reakcii-ionnogo-obmena/