Потенциометрические методы анализа и их типы
Чтобы получить более полное представление о том, что такое потенциометрические методы анализа, зачем они существуют, и каково их предназначение, необходимо начать разбираться с самой потенциометрии. Этим мы сейчас и займемся.
Потенциометрия
Начать объяснение стоит с того, что же такое потенциометрия. Это не какая-то отдельная область науки или что-то в этом роде. Данный подраздел включает в себя совокупность всех физико-химических методов проведения исследований, которые существуют, но с одним небольшим условием. Сюда входят лишь те их них, которые базируются на измерении электродвижущей силы цепей.
Данные цепи состоят из двух основных элементов:
- индикаторного электрода;
- электрода сравнения.
Для того чтобы использовать потенциометрический метод анализа, необходимо найти зависимость электрохимического электрода, а точнее, его потенциала от концентрации ионов или же от их активности. Есть еще одно положение, и оно говорит о том, что потенциометрия — это раздел, который включает в себя электрохимические способы анализа, основывающиеся на возбуждении вещества электрическим полем и необходимость проводить измерения равновесного электрода.
Основы потенциометрии
Основоположником такого раздела анализа как потенциометрия является В. Нернст. В основе потенциометрического метода анализа лежит уравнение, которое в 1889 году вывел именно этот человек. Полученное Нернстом уравнение служило для равновесных электродных потенциалов, для их нахождения. Но вскоре после этого, потенциометрия стала получать более широкое распространение и начала использоваться в таком разделе как аналитическая химия.
В 1893 г. ученый Р. Беренд провел первое в истории человека потенциометрическое титрование. А в настоящее время такой раздел как потенциометрия довольно широко применяется в аналитической и физической химии. Кроме того, существует еще несколько областей применения потенциометрического метода анализа.
Области использования потенциометрии
Аналитическая и физическая химия — это, как мы говорили, не единственные области, где потенциометрия нашла свое применение. Данный метод анализа также широко используется в редокосометрии. Названный раздел объединяет в себе несколько методов, которые основываются на измерении окислительно-восстановительных потенциалов в исследуемом растворе.
Потенциометрические методы анализа также используются и в ионометрии. Так именуют ответвление прямой потенциометрии, суть которого заключается в определении концентрации или активности ионов в их различных фазах. Для этого применяется ионселективный электрод. Кроме того, ионометрия объединяет в себе все методы анализа, относящиеся к определению концентрации. Также стоит добавить, что к данному разделу принадлежит еще и рН-метрия, катионо- и анионометрия.
Еще одно использование потенциометрического метода анализа — это потенциометрическое титрование. Суть титрования заключается в необходимости наблюдения за ходом реакции титрования и последующего нахождения точек эквивалентности.
Сущность метода потенциометрического метода анализа
Сущность потенциометрии, а также методов анализа этой области заключается в проведении измерения разности электродвижущей силы двух электродов. Один из них является измерительным, а другой — вспомогательным. К тому же оба эти электрода должны быть помещены в исследуемый раствор.
Очень важно отметить, что величина электродвижущей силы сильно зависит от температуры. По этой причине все приборы, которые используются для проведения анализа, в частности рН-метры и ионометры дополнительно комплектуются температурными компенсаторами, которые могут управляться как в ручном режиме, так и в автоматическом.
Если говорить коротко, то потенциометрический метод анализа основан на измерении ЭДС гальванических элементов. Под этими элементами как раз и понимают соединение двух электродов, один из которых, как говорилось ранее, индикатор, а другой необходим для сравнения.
Прямая потенциометрия
Классификация методов потенциометрического анализа довольно проста и имеет всего 2 пункта. И первая подгруппа — это прямая потенциометрия. Суть данного метода заключается в том, что необходимо измерять точную величину электродного потенциала, а после этого находить по уравнению Нернста активность потенциалоопределяющего иона в растворе. Данный метод используют для того, чтобы находить рН водных и неводных растворов. К тому же, этим способом можно находить и рН для производственных растворов олигомеров.
Кроме этого, потенциометрические методы анализа прямой потенциометрии используют для того, чтобы проводить анализ кислых и основных примесей в диметилформамиде. Также данный метод можно использовать для определения хлорид-ионов и кислотных компонентов в различных производственных растворах.
На вопрос о том, на чем основан потенциометрический метод анализа этой группы, можно ответить так — на измерении точных величин. А отсюда становится ясным, почему данный способ анализа нашел свое широкое применение и в таких областях как термодинамика, электрохимические, а также химические реакции.
Титрование
Сущность метода потенциометрического метода анализа в данной области потенциометрического титрования основывается на необходимости определения точки эквивалентности в реакции нейтрализации, а также в реакции осаждения и комплексообразования, которые будут известны по итогам проведения потенциометрических измерений. После того как в результате проведения анализа станет точно известна эта самая точка эквивалентности, которая является и точкой окончания реакции, окажется возможным нахождение неизвестного количества вещества в растворе, за которым ведется контроль. Определить это можно по расходу титранта, концентрация которого известна в точных числах.
Принципы титрования
Принцип работы потенциометрического метода анализа — титрования — заключается в следующем. Вблизи от точки эквивалентности обычно происходит сильное изменение или даже скачок потенциала от индикаторного электрода. Сила данного скачка будет зависеть от силы титруемого раствора кислоты или же основания, а также от концентрации самого раствора. Если же проводить титрование смесей различных кислот, то можно наблюдать несколько скачков за одну реакцию.
Использование данного метода осуществляется в чисто прикладных целях, когда необходимо обнаружить конечную точку титрования, с помощью которой есть возможность определить принадлежность анализируемого вещества в растворе к какой-либо группе. Однако, несмотря на это, данный способ получил довольно широкое распространение, а также имеет свои преимущества, которые выгодно выделяют его среди других методов анализа.
Преимущества потенциометрии
Среди преимуществ потенциометрии, в целом, можно выделить следующие пункты:
- Высокая точность проводимых анализов.
- Высокая чувствительность измерений.
- Если говорить о титровании, то метод можно использовать в мутных или разноцветных растворах.
- Использование прямого потенциометрического метода анализа — быстрота и простота, проводимых измерений.
- Одно из больших преимуществ — это возможность автоматизации процесса титрования. Некоторые промышленные объекты занимаются производством автоматических автотитраторов, которые комплектуются потенциометрами. В итоге получается небольшой автономный комплекс для проведения анализа.
Также выгодно отличает этот метод от других то, что есть возможность определения нескольких веществ в одном и том же растворе без их предварительного разделения.
Особенности и недостатки потенциометрии
Если говорить о потенциометрии, а также о ее методах анализа, то можно выделить несколько особенностей. К примеру, потенциометрическое титрование сильно расширяет возможность практического применения данной области проведения анализа среди неводных растворителей. Данные методы позволяют людям находить содержание различных компонентов, которые в отдельности невозможно титровать, а также появляется возможность проведения анализа вещества, которое не растворяется или, наоборот, разлагается в воде.
Также важной особенностью потенциометрических методов является то, что их относят к неразрущающей группе. Другими словами, проведение анализа одним из потенциометрических способов не влияет на состав анализируемого раствора и не разрушает его, вследствие чего смесь можно использовать в дальнейшем без каких-либо проблем. Погрешность измерений при использовании прямого потенциометрического метода составляет всего от 2 до 10%. А если использовать потенциометрическое титрование, то погрешность и вовсе составляет от 0,5 до 1%.
Недостатком метода можно считать то, что невозможно его применять для непрерывного контроля, а также в некоторых случаях им невозможно определить слишком малые концентрации в растворе.
Преимущества потенциометрического метода анализа
Ученые выделяют основным преимуществом этого метода его быстроту, а также простоту, с которой проводится анализ. Именно эти два качества выгодно выделяют потенциометрию и методы ее анализа среди других.
Время, которое требуется, чтобы установилось равновесие потенциалов индикаторного электрода, довольно маленькое, что, в свою очередь, позволяет с удобством изучать кинетические реакции и реакции автоматического контроля различных технологических процессов.
Если использовать в качестве электродов микроэлектроды, то становится доступным проведение измерений в пробах, объем которых равен десятым долям см³. Кроме того, есть несколько различных растворов, в которых измерения могут быть проведены при помощи потенциометрии.
Существует потенциометрический метод анализа воды, различных мутных и окрашенных растворов, а также различных вязких паст. Огромным его преимуществом является то, что при использовании названного метода нет необходимости в перегонке или фильтрации раствора. А это в некоторых случаях экономит очень много времени.
Преимущества потенциометрического титрования
Использование потенциометрического метода анализа титрования выделяется такими преимуществами:
- Данным метод позволяет полностью исключить субъективные ошибки, которые часто связаны с визуальным наблюдением за раствором.
- Данный метод считается более чувствительным. Другими словами при тех же манипуляциях титрование позволяет определять менее концентрированные вещества.
- Кроме того, метод позволяет без проблем проводить титрование в замутненных или цветных растворах. Это очень удобно, так как применять цветные индикаторы в таких растворах, допустим, невозможно вовсе.
- Также данный метод анализа позволяет человеку последовательно определить смесь веществ из одной и той же порции раствора.
Данные преимущества выгодно выделяют титрование на фоне других потенциометрических методов, а потому используется он довольно широко.
Тема: Потенциометрический метод анализа.
Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
Тема: Потенциометрический метод анализа.
Теоретические основы потенциометрического метода анализа
Потенциометрический анализ — метод определения концентрации ионов, основанный на измерении электрохимического потенциала индикаторного электрода, погруженного в исследуемый раствор.
Впервые Нернст вывел уравнение, связывающее электродный потенциал с активностью (концентрацией) компонентов обратимой окислительно-восстановительной системы. В разбавленных растворах коэффициенты активности ионов близки к единице, а активность близка к концентрации, поэтому можно пользоваться уравнениями Нернста в концентрационной форме:
Если измерения проводят в растворах, содержащих ионы одного и того же металла в различных степенях окисления, то:
В первом случае применяют электрод из вещества, ионы которого содержаться в растворе. Во втором случае применяют инертный металлический электрод, чаще всего платиновый, потенциал которого зависит от соотношения концентраций окисленной и восстановленной форм ионов.
Возможны два варианта использования этих уравнений в аналитической химии.
Первый — это измерение потенциала электрода, погруженного в исследуемый раствор, и вычисление концентрации определяемых ионов по уравнению (1). Можно также пользоваться мембранными ионоселективными электродами. Этот метод получил название прямой потенциометрии.
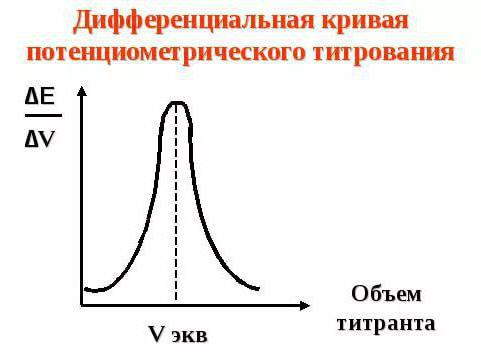
Второй вариант — это метод потенциометрического титрования. Сущность метода заключается в том, что в исследуемый раствор погружают индикаторный электрод и титруют раствор, определяя в процессе титрования потенциал электрода (разность потенциалов между индикаторным электродом и электродом сравнения). В процессе титрования концентрация определяемых ионов изменяется в зависимости от объема прибавленного рабочего раствора неравномерно: сначала это изменение невелико, затем становится более заметным и, наконец, в точке эквивалентности достигает наибольшего значения. При этом потенциал электрода, зависящий от концентрации ионов в растворе, также изменяется, причем максимальное изменение соответствует эквивалентному отношению реагирующих веществ. Зависимость потенциала от объема рабочего раствора выражается кривой титрования (рис. 1). По кривой титрования можно установить точку эквивалентности как точку перегиба кривой. Ордината точки перегиба соответствует потенциалу электрода в конце титрования, а абсцисса — объему рабочего раствора, израсходованного на определение.
Рис. 1. Кривая потенциометрического титрования
Рис. 2. Кривая титрования смеси хлорида и йодида калия раствором нитрата серебра.
Таким образом, потенциометрическое титрование представляет собой обычный титриметрический метод анализа; разница заключается в том, что точку эквивалентности определяют по характерному изменению потенциала электрода в процессе титрования, а не при помощи цветных индикаторов.
Потенциометрическое титрование применяют главным образом для определения сравнительно больших количеств вещества. Его преимущества по сравнению с обычным титрованием следующие.
— Можно титровать окрашенные растворы, когда цветные индикаторы не применимы.
— Легко можно определить, не прибегая к предварительному разделению, несколько веществ в смеси. На кривой титрования получается несколько скачков потенциала, по которым находят объем рабочего раствора, израсходованного на взаимодействие с каждым компонентом сложного раствора. Пример — рис. 2, где приведена кривая титрования смеси растворов хлорида и йодида калия раствором нитрата серебра.
Для потенциометрического анализа требуется специальная аппаратура. Поэтому его имеет смысл применять только в тех случаях, когда задача не решается посредством обычных титриметрических методов.
Классификация потенциометрических методов анализа такая же, как и обычных титриметрических методов: в ее основе лежат различные типы химических реакций:
1 . Методы осаждения и комплексообразования . Примеры: титрование галогенидов нитратом серебра; титрование катионов меди, цинка, кадмия, свинца, серебра раствором гексацианоферрата (11); титрование катионов алюминия, бериллия, магния раствором фторида натрия по реакции комплексообразования и др.
2. Методы окисления-восстановления . Примеры: титрование растворами окислителей или восстановителей. Перманаганатометрия, хроматометрия, йодометрия и др.
3. Методы кислотно-основного титрования. Определение слабых и сильных кислот и их солей, когда нельзя применять цветные индикаторы.
В основе метода потенциометрии лежит уравнение
ЭЛЕКТРОХИМИЧЕСКИЕ МЕТОДЫ АНАЛИЗА, ИХ КЛАССИФИКАЦИЯ. ПОТЕНЦИОМЕТРИЧЕСКИЙ МЕТОД АНАЛИЗА. КУЛОНОМЕТРИЯ.
В соответствии с рекомендациями ИЮПАК все электрохимические методы анализа подразделяются на две большие группы:
— методы без протекания электрохимических реакций на электродах электрохимической ячейки (кондуктометрия с использованием токов низких 50-10000 Гц и высоких частот более 1 МГЦ);
— методы с протеканием электрохимических реакций на электродах электрохимической ячейки. К ним относятся потенциометрия, кулонометрия, полярография и другие методы анализа.
Потенциометрический метод анализа основан на использовании зависимости электродвижущей силы (ЭДС) электрохимической цепи от активности (концентрации) анализируемого иона.
Зависимость электродвижущей силы Е электрохимической цепи от активности анализируемого иона описывают уравнением Нернста для цепи:
гдe Е 0 — стандартная ЭДС цепи; п — заряд анализируемого иона с соответствующим знаком; S — крутизна электродной функции индикаторного электрода, селективного к однозарядному иону; аан — активность анализируемого иона.
Для идеального индикаторного электрода:
где R — универсальная газовая постоянная, равная 8,312 Дж/(моль · К); Т — абсолютная температура раствора, К; F — число Фарадея, равное 96500 Кл/моль; S= 0,0591 В при 25°С.
Для потенциометрических измерений применяют электрохимические цепи, содержащие два электрода: индикаторный и электрод сравнения. Если оба электрода погружены в анализируемый раствор, то такая цепь называется цепью без переноса. Если электрод сравнения соединяют с анализируемым раствором через жидкостный контакт (солевой мостик), то цепь называется цепью с переносом.
В потенциометрическом анализе используют преимущественно цепи с переносом. Схематически такую цепь изображают следующим образом:
электрод
раствор
мостик
сравнения
Индикаторным называют электрод, потенциал которого определяет активность анализируемого иона в соответствии с уравнением Нернста. Электродом сравнения называют электрод, потенциал которого постоянен и не зависит от концентрации ионов в растворе. Солевой мостик служит для предотвращения смешивания анализируемого раствора и раствора электрода сравнения.
В качестве солевого мостика используют насыщенные растворы солей KCl, КNО3 и других с близкими значениями подвижностей катиона и аниона. Это позволяет снизить диффузионный потенциал Едиф жидкостного соединения практически до нуля.
Электродвижущую силу Е электрохимической цепи, приведенной выше, определяют по уравнению:
где Едиф — диффузионный (жидкостный) потенциал, В; Еср — потенциал электрода сравнения, В; Еив — потенциал индикаторного электрода, В.
Подставим в это уравнение значение Еин выраженное через уравнение Нернста, с учетом соотношения
где fан и Сан — коэффициент активности и аналитическая концентрация анализируемого иона соответственно.
Получаем уравнение, лежащее в основе всех потенциометрических методов анализа:
где Е 0 = Еср – Е 0 ин — стандартная ЭДС цепи, В; E 0 ин — стандартный потенциал индикаторного электрода.
Электроды для потенциометрического анализа
В качестве индикаторных в потенциометрическом анализе применяют:
1. Электроды, на поверхности которых протекают реакции с обменом электронов. Их называют электронообменными, или окислительно-восстановительными. В качестве таких электродов применяют электроды из химически инертных металлов — платины, золота и др. В аналитической практике находит применение выпускаемый промышленностью точечный платиновый электрод ЭПВ-1-100 и изготовленный из специального стекла мембранный окислительно-восстановительный электрод ЭО — 1.
2. Электроды, на поверхности которых протекают реакции обмена иона. Их называют ионообменными, или ионоселективными электродами. Основным элементом ионоселективных электродов является ионочувствительная мембрана. Поэтому их также иногда называют мембранными.
Ионоселективные электроды изготавливают:
— с твердыми мембранами;
— со стеклянными мембранами;
— с жидкостными мембранами.
Электроды с твердыми мембранами. В таких электродах мембрана изготовлена из малорастворимого кристаллического вещества с ионным типом электрической проводимости. Конструктивно электрод представляет собой трубку диаметром около 1 см из инертного полимера (обычно поливинилхлорида), к торцу которой приклеена тонкая (
0,5 мм) мембрана. В трубку заливают внутренний раствор сравнения, в который погружают электрод сравнения. В настоящее время промышленностью выпускаются электроды с твердыми мембранами, селективные к F — -ионам (мембрана на основе монокристалла LаF3), к CI — -, Br — и I — -ионам (мембраны на основе смеси серебра сульфида и соответствующего серебра галогенида).
Электроды со стеклянными мембранами. Их изготавливают из специального электродного стекла, в состав которого входят оксиды алюминия, натрия, калия, бора и др. Мембрана таких электродов представляет собой тонкостенный шарик (
0,1 мм) диаметром 5 — 8 мм.
В настоящее время промышленность выпускает стеклянные электроды, селективные только к катионам Н + , Na + , К + , Аg + , NH4 + . В этих электродах не только мембрана, но и сам корпус изготовлены из стекла.
Электроды с жидкостными мембранами. В таких электродах жидкие мембраны, представляющие собой растворенные в органических растворителях ионообменные вещества, отделяют от анализируемого раствора гидрофобными мелкопористыми пленками, пористыми дисками или гидрофобизированными керамическими диафрагмами. Их основным недостатком является постепенное вымывание анализируемым раствором ионообменника, что сокращает срок работы электрода.
Этих трудностей удалось избежать после разработки электродов с пленочными мембранами. В таких электродах в тонкую мембрану из гидрофобного полимера (поливинилхлорида) вводят пластификатор и растворенное в нем электродоактивное вещество, вступающее в ионообменную реакцию с анализируемым ионом в растворе. В настоящее время промышленность выпускает пленочные ионоселективные электроды на катионы Na + , К + , NH4 + , Са 2+ , Mg 2+ ; электроды для определения общей жесткости воды; на анионы галогенидов, NCS — , NО3 — . Существуют электроды и на другие ионы.
В качестве электродов сравнения в настоящее время используют хлорсеребряные электроды. Хлорсеребряный электрод представляет собой серебряную проволоку, покрытую слоем АgСl и погруженную в насыщенный раствор КС1. Современная конструкция электродов сравнения совмещает с собой и солевой мостик.
Измерение ЭДС электрохимических цепей
При измерении ЭДС электрохимических цепей, применяемых в потенциометрии, необходимо снимать ничтожно малые токи (10 -13 — 10 -14 А ), чтобы не вызвать поляризацию электродов. Это возможно лишь при использовании компенсационного способа измерения ЭДС. В настоящее время промышленность выпускает для этих целей специальные приборы: рН — метры и иономеры, позволяющие измерять ЭДС в интервале ± 1900 мВ. Наиболее распространенными являются иономер ЭВ-74 со стрелочной индикацией, а также иономеры И -130 и И -140 с цифровой индикацией. На этих приборах возможно измерение не только ЭДС, но и рН или рХ растворов, где Х — катион или анион, к которому селективен применяемый ионоселективный электрод.
ВИДЫ ПОТЕНЦИОМЕТРИЧЕСКОГО АНАЛИЗА
Потенциометрические методы анализа подразделяются на два вида:
— прямая потенциометрия, или ионометрия;
Метод прямой потенциометрии основан на определении концентрации иона непосредственно по измеренной ЭДС электрохимической цепи, содержащей соответствующий ионоселективный электрод.
Расчет может быть выполнен по указанному выше уравнению Нернста, известны все параметры, входящие в это уравнение. Однако величины fан и Едиф заранее неизвестны, поэтому используют приемы, позволяющие обойти эти трудности (метод градуировочного графика и метод добавок).
Метод градуировочного графика. Для этого заранее строят градуировочный график в координатах ЭДС — lgСан с использованием стандартных растворов анализируемого иона, имеющих одинаковую ионную силу paствора.
В этом случае fан и Едиф остаются постоянными и график становится линейным. Затем по той же ионной силе измеряют ЭДС цепи с анализируемым раствором и по графику определяют концентрацию раствора. Пример определения приведен на рис. 1.
Рис.1. Градуировочный график для определения концентрации методом прямой потенциометрии
Это группа методов, основанная на введении в анализируемый раствор добавки раствора анализируемого иона с известной концентрацией. Добавка может быть одноразовой — метод единичной добавки; двухразовой — метод двойной добавки; многоразовой — метод многократных добавок.
Рассмотрим принцип этого метода на примере единичной добавки. Для этого предварительно определяют крутизну S электродной функции применяемого ионоселективного электрода. Затем измеряют ЭДС и Ех в точно отмеренном объеме Vaн анализируемого раствора. После этого в раствор вводят точно отмеренный объем добавки Vдоб с концентрацией Сан анализируемого иона и измеряют изменение ЭДС ∆E. Если Vан >> Vдоб, то разведением раствора пренебрегают и концентрацию анализируемого раствора Сан рассчитывают по формуле:
Введение добавки при указанных условиях существенно не изменяет ионную силу раствора. Следовательно, величины Едоб и fан остаются прежними при нахождении ∆E сокращаются. Поэтому при применении метода добавок нет необходимости регулировать ионную силу раствора для поддержан постоянства Едоб и fан. Метод добавок в ионометрии используют наиболее часто и в различных его вариантах.
Ионометрия характеризуется высокой экспрессностью, достаточно высокой точностью и селективностью.
Метод нашел применение в различных областях химии, в биохимии, медицине и фармации. Этот метод рекомендуется для фармацевтического анализа Европейской фармакопеей и Государственной фармакопеей Украины.
Метод потенциометрического титрования основан на определении точки эквивалентности по резкому изменению в ней ЭДС электрохимической цепи, содержащей индикаторный электрод.
Как следует из основного уравнения потенциометрии, при резком изменении концентрации иона в точке эквивалентности происходит и резкое изменение ЭДС.
Из этого следует, что индикаторный электрод должен быть селективным к одному из реагирующих ионов титруемой системы.
Например, при кислотно-основном титровании в качестве индикаторного электрода может быть использован Н + -ионоселективный (стеклянный) электрод; при аргентометрических титрованиях — селективный либо к иону серебра, либо к соответствующему галогенид-иону. При окислительно-восстановительном титровании необходимо использовать окислительно-восстановительный электрод, способный реагировать на изменение окислительно-восстановительного потенциала в титруемой системе (например платиновый).
В потенциометрическом титровании можно использовать все виды титрования: кислотно-основное, осадительное, комплексиметрическое и окислительно-восстановительное.
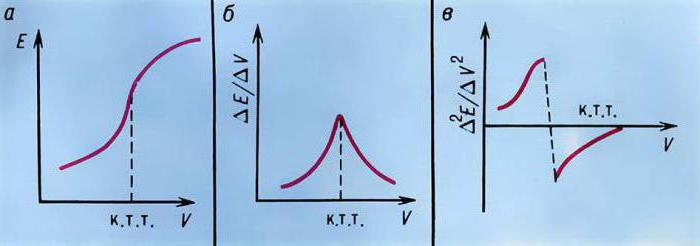
Точку эквивалентности при потенциометрических титрованиях определяют графическим методом на кривой титрования. Обычно используют одну из следующих видов кривых титрования: интегральную, дифференциальную или кривую Грана, вид которых приведен на рис. 2.
Рис. 2. Кривые потенциометрического титрования:
а — интегральная кривая титрования; б — дифференциальная кривая титрования; в — кривая титрования Грана
Интегральная кривая титрования (рис. 2, а) строится в координатах E — VТ. Точка эквивалентности находится в середине скачка титрования.
Дифференциальная кривая титрования (рис. 2, б) строится в координатах:
∆Е / ∆V- VT . Точка эквивалентности находится в вершине кривой титрования. Дифференциальная кривая титрования дает более точное определение точки эквивалентности, чем интегральная.
Кривая титрования в методе Грана (рис. 2, в) строится в координатах: ∆V / ∆Е —VT. Точка эквивалентности находится на пересечении двух прямых линий. Этой кривой удобно пользоваться для определения точки эквивалентности при титровании разбавленных растворов.
Метод потенциометрического титрования более точен, чем ионометрия. Его возможности существенно расширились с разработкой новых ионоселективных электродов как индикаторных. Метод применяют при анализе мутных, загрязненных и окрашенных растворов в смешанных и неводных растворителях.
Все методы потенциометрии могут быть легко автоматизированы. Промышленность выпускает ряд автоматических потенциометрических титраторов как лабораторного, так и промышленного назначений.
Кулонометрия — электрохимический метод анализа, который основан на, измерении количества электричества (кулонов), затраченного на электроокисление или восстановление анализируемого вещества. Количество вещества, содержащееся в анализируемой пробе, рассчитывают по уравнению:
где m — количество вещества в анализируемом растворе, г;
ММ – молярная масса анализируемого компонента (вещества или иона); Q — количество электричества, затраченное на электрохимическое окисление или восстановление анализируемого компонента, Кл; F — число Фарадея, равное 96 500 Кл/моль; п — количество электронов, участвующих в электрохимическом процессе.
Количество электричества рассчитывается по формуле:
где I — сила тока, А; t — продолжительность электролиза, с.
В кулонометрии различают два вида анализа:
1) прямую кулонометрию;
2) кулонометрическое титрование.
Для обоих видов кулонометрии должно выполняться условие: электрохимическому восстановлению или окислению должно подвергаться только анализируемое вещество со 100 % — ным выходом по току.
Метод прямой кулонометрии основан на непосредственном окислении или восстановлении анализируемого вещества на рабочем электроде, исключающем прохождение побочных электрохимических реакций.
Прямая кулонометрия может быть выполнена в одном из следующих режимов:
Ø при постоянном потенциале рабочего электрода в течение всего времени электролиза — такой режим называют потенциостатическим;
Ø при постоянной силе тока в течение всего времени электролиза — режим называют амперостатическим.
В методе прямой кулонометрии в потенциостатическом режиме сила тока в течение всего времени электролиза непрерывно уменьшается, так как происходит уменьшение концентрации анализируемого вещества. Электролиз заканчивают при уменьшении силы тока практически до нуля.
Количество электричества, затраченное на анализ, измеряют либо с помощью кулонометров, либо графически, по построенной диаграмме в координатах время электролиза — сила тока.
При выполнении кулонометрического анализа в амперометрическом режиме сила тока на протяжении всего времени электролиза поддерживается постоянной. Количество электричества в этом случае легко рассчитывается по уравнению:
Этот режим более экспрессный, чем потенциостатический, но его можно менять лишь в том случае, если есть возможность установить момент, а электролиз анализируемого вещества полностью завершен.
Методом прямой кулонометрии определяют ионы меди, свинца, висмута, мышьяка, урана и других металлов. Этот метод нашел применение также анализа органических соединений, в том числе и лекарственных препаратов (аскорбиновой кислоты, новокаина, пикриновой кислоты, оксихинолина и пр.).
Метод прямой кулонометрии очень чувствителен. Им можно определить до 10 -9 г вещества в пробе. Ошибка определений не превышает 0,02 %.
Кулонометрическое титрование основано на электрохимическом получении титранта (электрогенерировании титранта) с последующей реакцией его с анализируемым веществом. Если титрант электрогенерируется непосредственно в растворе анализируемого вещества, то такое титрование называется кулонометрическим титрованием с внутренней генерацией. Если титрант получают электрогенерированием в отдельном сосуде, а затем подают его в анализируемый раствор, такое титрование называют кулонометрическим титрованием с внешней генерацией. Этот вид титрования используется очень редко.
Кулонометрическое титрование всегда проводят в амперостатическом режиме и применяют большие токи для электролиза, что позволяет выполнять кулонометрическое титрование экспрессно. Затраченное количество электричества на генерацию титранта будет эквивалентно содержанию анализируемого вещества в анализируемой пробе.
Рассмотрим процесс кулонометрического титрования на примере определения церия (IV). В ячейку для титрования помещают точный объем раствора церия и вводят избыток соли железа (III). В раствор погружают два плановых электрода и подсоединяют их к источнику постоянного тока.
После подачи на электроды напряжения на катоде начнут восстанавливаться ионы железа (III):
Ионы Се 4+ при этом восстанавливаться не будут, так как в растворе находится большой избыток ионов Fe 3+
Образовавшиеся ионы Fe 2+ сейчас же вступают в титриметрическую peaкцию с Се 4+ :
Се 4+ + Fe 2+ → Fe 3+ + Се 3+
Этот процесс будет продолжаться до тех пор, пока все ионы церия ( IV ) не будут оттитрованы. Момент эквивалентности определяют обычными индикаторным, потенциометрическим, амперометрическим методами.
Количество электричества, затраченное на электрогенерирование титранта в виде ионов Fe 2+ будет эквивалентно содержанию ионов церия ( IV ) в анализируемой пробе.
Кулонометрическое титрование имеет существенное преимущество перед обычным титрованием. Его применение исключает необходимость приготовления и стандартизации титранта, становится возможным применение нестойких титрантов: серебра ( I ), олова ( I I), меди ( I I), титана ( I II) и др.
Кулонометрически может быть выполнен любой вид титрования: кислотно-основное, осадительное, комплексонометрическое, окислительно-восстановительное. Метод кулонометрического титрования по точности и чувствительности превосходит другие методы титрования. Он пригоден для титрования очень разбавленных растворов концентрацией до 10 -6 моль/дм 3 , а погрешность определений не превышает 0,1-0,05 %.
http://infourok.ru/tema-potenciometricheskiy-metod-analiza-3088213.html
http://chemistry.dnmu.ru/ana_him/lek_14.html