Потенциометрические методы анализа и их типы
Чтобы получить более полное представление о том, что такое потенциометрические методы анализа, зачем они существуют, и каково их предназначение, необходимо начать разбираться с самой потенциометрии. Этим мы сейчас и займемся.
Потенциометрия
Начать объяснение стоит с того, что же такое потенциометрия. Это не какая-то отдельная область науки или что-то в этом роде. Данный подраздел включает в себя совокупность всех физико-химических методов проведения исследований, которые существуют, но с одним небольшим условием. Сюда входят лишь те их них, которые базируются на измерении электродвижущей силы цепей.
Данные цепи состоят из двух основных элементов:
- индикаторного электрода;
- электрода сравнения.
Для того чтобы использовать потенциометрический метод анализа, необходимо найти зависимость электрохимического электрода, а точнее, его потенциала от концентрации ионов или же от их активности. Есть еще одно положение, и оно говорит о том, что потенциометрия — это раздел, который включает в себя электрохимические способы анализа, основывающиеся на возбуждении вещества электрическим полем и необходимость проводить измерения равновесного электрода.
Основы потенциометрии
Основоположником такого раздела анализа как потенциометрия является В. Нернст. В основе потенциометрического метода анализа лежит уравнение, которое в 1889 году вывел именно этот человек. Полученное Нернстом уравнение служило для равновесных электродных потенциалов, для их нахождения. Но вскоре после этого, потенциометрия стала получать более широкое распространение и начала использоваться в таком разделе как аналитическая химия.
В 1893 г. ученый Р. Беренд провел первое в истории человека потенциометрическое титрование. А в настоящее время такой раздел как потенциометрия довольно широко применяется в аналитической и физической химии. Кроме того, существует еще несколько областей применения потенциометрического метода анализа.
Области использования потенциометрии
Аналитическая и физическая химия — это, как мы говорили, не единственные области, где потенциометрия нашла свое применение. Данный метод анализа также широко используется в редокосометрии. Названный раздел объединяет в себе несколько методов, которые основываются на измерении окислительно-восстановительных потенциалов в исследуемом растворе.
Потенциометрические методы анализа также используются и в ионометрии. Так именуют ответвление прямой потенциометрии, суть которого заключается в определении концентрации или активности ионов в их различных фазах. Для этого применяется ионселективный электрод. Кроме того, ионометрия объединяет в себе все методы анализа, относящиеся к определению концентрации. Также стоит добавить, что к данному разделу принадлежит еще и рН-метрия, катионо- и анионометрия.
Еще одно использование потенциометрического метода анализа — это потенциометрическое титрование. Суть титрования заключается в необходимости наблюдения за ходом реакции титрования и последующего нахождения точек эквивалентности.
Сущность метода потенциометрического метода анализа
Сущность потенциометрии, а также методов анализа этой области заключается в проведении измерения разности электродвижущей силы двух электродов. Один из них является измерительным, а другой — вспомогательным. К тому же оба эти электрода должны быть помещены в исследуемый раствор.
Очень важно отметить, что величина электродвижущей силы сильно зависит от температуры. По этой причине все приборы, которые используются для проведения анализа, в частности рН-метры и ионометры дополнительно комплектуются температурными компенсаторами, которые могут управляться как в ручном режиме, так и в автоматическом.
Если говорить коротко, то потенциометрический метод анализа основан на измерении ЭДС гальванических элементов. Под этими элементами как раз и понимают соединение двух электродов, один из которых, как говорилось ранее, индикатор, а другой необходим для сравнения.
Прямая потенциометрия
Классификация методов потенциометрического анализа довольно проста и имеет всего 2 пункта. И первая подгруппа — это прямая потенциометрия. Суть данного метода заключается в том, что необходимо измерять точную величину электродного потенциала, а после этого находить по уравнению Нернста активность потенциалоопределяющего иона в растворе. Данный метод используют для того, чтобы находить рН водных и неводных растворов. К тому же, этим способом можно находить и рН для производственных растворов олигомеров.
Кроме этого, потенциометрические методы анализа прямой потенциометрии используют для того, чтобы проводить анализ кислых и основных примесей в диметилформамиде. Также данный метод можно использовать для определения хлорид-ионов и кислотных компонентов в различных производственных растворах.
На вопрос о том, на чем основан потенциометрический метод анализа этой группы, можно ответить так — на измерении точных величин. А отсюда становится ясным, почему данный способ анализа нашел свое широкое применение и в таких областях как термодинамика, электрохимические, а также химические реакции.
Титрование
Сущность метода потенциометрического метода анализа в данной области потенциометрического титрования основывается на необходимости определения точки эквивалентности в реакции нейтрализации, а также в реакции осаждения и комплексообразования, которые будут известны по итогам проведения потенциометрических измерений. После того как в результате проведения анализа станет точно известна эта самая точка эквивалентности, которая является и точкой окончания реакции, окажется возможным нахождение неизвестного количества вещества в растворе, за которым ведется контроль. Определить это можно по расходу титранта, концентрация которого известна в точных числах.
Принципы титрования
Принцип работы потенциометрического метода анализа — титрования — заключается в следующем. Вблизи от точки эквивалентности обычно происходит сильное изменение или даже скачок потенциала от индикаторного электрода. Сила данного скачка будет зависеть от силы титруемого раствора кислоты или же основания, а также от концентрации самого раствора. Если же проводить титрование смесей различных кислот, то можно наблюдать несколько скачков за одну реакцию.
Использование данного метода осуществляется в чисто прикладных целях, когда необходимо обнаружить конечную точку титрования, с помощью которой есть возможность определить принадлежность анализируемого вещества в растворе к какой-либо группе. Однако, несмотря на это, данный способ получил довольно широкое распространение, а также имеет свои преимущества, которые выгодно выделяют его среди других методов анализа.
Преимущества потенциометрии
Среди преимуществ потенциометрии, в целом, можно выделить следующие пункты:
- Высокая точность проводимых анализов.
- Высокая чувствительность измерений.
- Если говорить о титровании, то метод можно использовать в мутных или разноцветных растворах.
- Использование прямого потенциометрического метода анализа — быстрота и простота, проводимых измерений.
- Одно из больших преимуществ — это возможность автоматизации процесса титрования. Некоторые промышленные объекты занимаются производством автоматических автотитраторов, которые комплектуются потенциометрами. В итоге получается небольшой автономный комплекс для проведения анализа.
Также выгодно отличает этот метод от других то, что есть возможность определения нескольких веществ в одном и том же растворе без их предварительного разделения.
Особенности и недостатки потенциометрии
Если говорить о потенциометрии, а также о ее методах анализа, то можно выделить несколько особенностей. К примеру, потенциометрическое титрование сильно расширяет возможность практического применения данной области проведения анализа среди неводных растворителей. Данные методы позволяют людям находить содержание различных компонентов, которые в отдельности невозможно титровать, а также появляется возможность проведения анализа вещества, которое не растворяется или, наоборот, разлагается в воде.
Также важной особенностью потенциометрических методов является то, что их относят к неразрущающей группе. Другими словами, проведение анализа одним из потенциометрических способов не влияет на состав анализируемого раствора и не разрушает его, вследствие чего смесь можно использовать в дальнейшем без каких-либо проблем. Погрешность измерений при использовании прямого потенциометрического метода составляет всего от 2 до 10%. А если использовать потенциометрическое титрование, то погрешность и вовсе составляет от 0,5 до 1%.
Недостатком метода можно считать то, что невозможно его применять для непрерывного контроля, а также в некоторых случаях им невозможно определить слишком малые концентрации в растворе.
Преимущества потенциометрического метода анализа
Ученые выделяют основным преимуществом этого метода его быстроту, а также простоту, с которой проводится анализ. Именно эти два качества выгодно выделяют потенциометрию и методы ее анализа среди других.
Время, которое требуется, чтобы установилось равновесие потенциалов индикаторного электрода, довольно маленькое, что, в свою очередь, позволяет с удобством изучать кинетические реакции и реакции автоматического контроля различных технологических процессов.
Если использовать в качестве электродов микроэлектроды, то становится доступным проведение измерений в пробах, объем которых равен десятым долям см³. Кроме того, есть несколько различных растворов, в которых измерения могут быть проведены при помощи потенциометрии.
Существует потенциометрический метод анализа воды, различных мутных и окрашенных растворов, а также различных вязких паст. Огромным его преимуществом является то, что при использовании названного метода нет необходимости в перегонке или фильтрации раствора. А это в некоторых случаях экономит очень много времени.
Преимущества потенциометрического титрования
Использование потенциометрического метода анализа титрования выделяется такими преимуществами:
- Данным метод позволяет полностью исключить субъективные ошибки, которые часто связаны с визуальным наблюдением за раствором.
- Данный метод считается более чувствительным. Другими словами при тех же манипуляциях титрование позволяет определять менее концентрированные вещества.
- Кроме того, метод позволяет без проблем проводить титрование в замутненных или цветных растворах. Это очень удобно, так как применять цветные индикаторы в таких растворах, допустим, невозможно вовсе.
- Также данный метод анализа позволяет человеку последовательно определить смесь веществ из одной и той же порции раствора.
Данные преимущества выгодно выделяют титрование на фоне других потенциометрических методов, а потому используется он довольно широко.
Тема: Потенциометрический метод анализа.
Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
Тема: Потенциометрический метод анализа.
Теоретические основы потенциометрического метода анализа
Потенциометрический анализ — метод определения концентрации ионов, основанный на измерении электрохимического потенциала индикаторного электрода, погруженного в исследуемый раствор.
Впервые Нернст вывел уравнение, связывающее электродный потенциал с активностью (концентрацией) компонентов обратимой окислительно-восстановительной системы. В разбавленных растворах коэффициенты активности ионов близки к единице, а активность близка к концентрации, поэтому можно пользоваться уравнениями Нернста в концентрационной форме:
Если измерения проводят в растворах, содержащих ионы одного и того же металла в различных степенях окисления, то:
В первом случае применяют электрод из вещества, ионы которого содержаться в растворе. Во втором случае применяют инертный металлический электрод, чаще всего платиновый, потенциал которого зависит от соотношения концентраций окисленной и восстановленной форм ионов.
Возможны два варианта использования этих уравнений в аналитической химии.
Первый — это измерение потенциала электрода, погруженного в исследуемый раствор, и вычисление концентрации определяемых ионов по уравнению (1). Можно также пользоваться мембранными ионоселективными электродами. Этот метод получил название прямой потенциометрии.
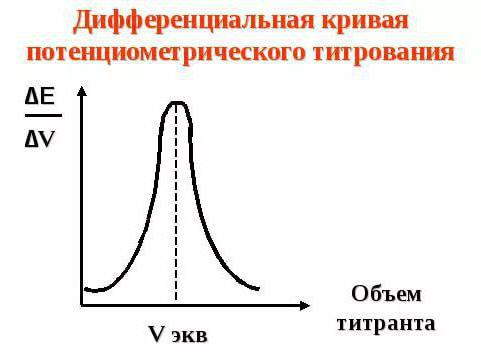
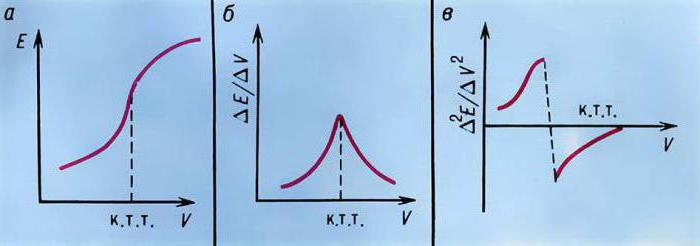
Второй вариант — это метод потенциометрического титрования. Сущность метода заключается в том, что в исследуемый раствор погружают индикаторный электрод и титруют раствор, определяя в процессе титрования потенциал электрода (разность потенциалов между индикаторным электродом и электродом сравнения). В процессе титрования концентрация определяемых ионов изменяется в зависимости от объема прибавленного рабочего раствора неравномерно: сначала это изменение невелико, затем становится более заметным и, наконец, в точке эквивалентности достигает наибольшего значения. При этом потенциал электрода, зависящий от концентрации ионов в растворе, также изменяется, причем максимальное изменение соответствует эквивалентному отношению реагирующих веществ. Зависимость потенциала от объема рабочего раствора выражается кривой титрования (рис. 1). По кривой титрования можно установить точку эквивалентности как точку перегиба кривой. Ордината точки перегиба соответствует потенциалу электрода в конце титрования, а абсцисса — объему рабочего раствора, израсходованного на определение.
Рис. 1. Кривая потенциометрического титрования
Рис. 2. Кривая титрования смеси хлорида и йодида калия раствором нитрата серебра.
Таким образом, потенциометрическое титрование представляет собой обычный титриметрический метод анализа; разница заключается в том, что точку эквивалентности определяют по характерному изменению потенциала электрода в процессе титрования, а не при помощи цветных индикаторов.
Потенциометрическое титрование применяют главным образом для определения сравнительно больших количеств вещества. Его преимущества по сравнению с обычным титрованием следующие.
— Можно титровать окрашенные растворы, когда цветные индикаторы не применимы.
— Легко можно определить, не прибегая к предварительному разделению, несколько веществ в смеси. На кривой титрования получается несколько скачков потенциала, по которым находят объем рабочего раствора, израсходованного на взаимодействие с каждым компонентом сложного раствора. Пример — рис. 2, где приведена кривая титрования смеси растворов хлорида и йодида калия раствором нитрата серебра.
Для потенциометрического анализа требуется специальная аппаратура. Поэтому его имеет смысл применять только в тех случаях, когда задача не решается посредством обычных титриметрических методов.
Классификация потенциометрических методов анализа такая же, как и обычных титриметрических методов: в ее основе лежат различные типы химических реакций:
1 . Методы осаждения и комплексообразования . Примеры: титрование галогенидов нитратом серебра; титрование катионов меди, цинка, кадмия, свинца, серебра раствором гексацианоферрата (11); титрование катионов алюминия, бериллия, магния раствором фторида натрия по реакции комплексообразования и др.
2. Методы окисления-восстановления . Примеры: титрование растворами окислителей или восстановителей. Перманаганатометрия, хроматометрия, йодометрия и др.
3. Методы кислотно-основного титрования. Определение слабых и сильных кислот и их солей, когда нельзя применять цветные индикаторы.
Потенциометрия. Методические указания к лабораторным работам по аналитической химии
Министерство образования и науки Российской Федерации
Федеральное агентство по образованию
Саратовский государственный технический университет
по аналитической химии
для студентов направления 550800
всех форм обучения
ВВЕДЕНИЕ
Современная аналитическая химия широко использует физические
и физико-химические методы анализа. К ним относятся электрохимические методы анализа, в том числе потенциометрия и потенциометрическое титрование.
Потенциометрические методы анализа основаны на измерении электродвижущих сил (ЭДС) обратимых электрохимических цепей, когда потенциал рабочего электрода близок к равновесному значению. Теоретические основы потенциометрии были заложены В. Нернстом [1].
Потенциометрия широко применяется в лабораторной
практике для определения концентрации ионов в растворе, точки эквивалентности в объемном анализе, в автоматических непрерывных методах контроля различных технологических процессов, а также для изучения химических реакций и для определения различных физико-химических величин. Все методы потенциометрии можно разделить на следующие группы: прямая потенциометрия, потенциометрическое титрование, определение термодинамических величин [2].
Метод, используемый для определения концентраций или активностей ионов в различных фазах с помощью ионоселективных электродов, называется прямой потенциометрией или ионометрией К ионометрии относятся рН-метрия, катионометрия и анионометрия. РН-метрия используется для определения концентраций ионов водорода в растворах. Катионометрия и анионометрия объединяют методы прямого определения концентраций или активностей ионов Na+, K+, Ca2+, Hg2+, Zn2+, Pb2+, Mg2+, F-, Cl-, Br-, S2-, ClO4-, NO3- и т. д. [3].
Потенциометрическое титрование основано на резком изменении потенциала электрода в точке эквивалентности. При потенциометрическом титровании используются реакции нейтрализации, комплексообразования (комплексометрия), окисления — восстановления (редоксометрия), осаждения (седиметрия).
СУЩНОСТЬ ПОТЕНЦИОМЕТРИЧЕСКОГО АНАЛИЗА
Потенциометрия основана на зависимости электродного потенциала от состава раствора. В этом методе измеряют величины потенциалов различных электродов, точнее, ЭДС различных цепей в зависимости от физических или физико-химических процессов, происходящих в растворе.
где Е – электродвижущая сила;
e1,e2 – потенциалы электродов.
В потенциометрии определяют активность определенного типа ионов. Например, металлическая пластинка, опущенная в раствор соли данного металла, приобретает потенциал вполне определенной величины. Величина этого потенциала зависит от природы электрода и связана с активностью и концентрацией ионов уравнением Нернста:

где e − потенциал электрода;
e0 – стандартный потенциал редокс-системы;
R – универсальная газовая постоянная;
Т – температура, К;
n – число электронов, участвующих в электрохимической реакции;
аокисл. и авосст. – активности окисленной и восстановленной форм редокс-системы; Сокисл. и Свосст. – концентрации окисленной и восстановленной форм редокс-системы; gокисл. и gвосст. – коэффициенты активностей окисленной и восстановленной форм редокс-системы.
Если принять Т=298 К (25оС) и заменить натуральный логарифм десятичным, то получим

Прямо измерить величину потенциала невозможно. Ее определение основано на сравнении величины потенциала одного электрода с величиной потенциала другого электрода. Два электрода, погруженные в соответствующие растворы и соединенные проводником электрического тока, образуют гальванический элемент, напряжение которого равно алгебраической разности этих потенциалов. Методом потенциометрии можно определить не только активность ионов, присутствующих в растворе, но и общее содержание этих ионов, независимо от того, находятся ли они в свободном виде или входят в состав соответствующих соединений. В первом случае говорят об ионометрии, во втором ─ о потенциометрическом титровании.
ЭЛЕКТРОДЫ В ПОТЕНЦИОМЕТРИИ
При измерении ЭДС абсолютные значения потенциалов этих электродов остаются неизвестными. Поэтому условно в качестве эталона выбран электрод, с потенциалом которого можно сравнить потенциалы других электродов. Таким стандартным электродом является нормальный водородный электрод, потенциал которого условно принят за нуль. Однако, в потенциометрии водородный электрод используется довольно pедко; более удобны в работе специальные электроды сравнения, например, каломельный.
Стандартными электродами сравнения называются электроды, которые используются при измерении электродных потенциалов в качестве их эталонов. Стандартные электроды должны удовлетворять следующим требованиям:
1) потенциалопределяющая электродная реакция должна быть термодинамически обратимой;
2) электроды должны быть мало поляризуемы, то есть не изменять потенциал при прохождении электрического тока;
3) электроды должны обладать высокой воспроизводимостью.
Второй электрод электрохимической цепи называется индикаторным или рабочим электродом. Выбор индикаторного электрода зависит от природы исследуемого раствора.
Таким образом, в потенциометрии используется пара электродов [4] (индикаторный и сравнения), составляющих гальванический элемент, ЭДС которого измеряется или контролируется в процессе определения.
Насыщенный каломельный электрод
Насыщенный каломельный электрод представляет собой ртуть, покрытую пастой из каломели Hg2Cl2 и ртути, помещенных в насыщенный раствор хлорида калия. Каломельный электрод – типичный электрод второго рода, обратимый относительно аниона.
Каломельный электрод обладает высокой воспроизводимостью и обратимостью. Насыщенный каломельный электрод представляет систему:
Электродная реакция сводится к восстановлению каломели до металлической ртути и аниона хлора:
Hg2Cl2 + 2е — = 2Hg + 2Cl — .
Потенциал каломельного электрода обратим по отношению к ионам хлора. Применим уравнение Нернста к этой системе:
где b=2,3RT/F; aHg = const; аHg2Cl2 = const,
Можно записать: 
Насыщенный каломельной электрод удобен тем, что при использовании величина диффузионного потенциала, возникающая в электрохимической ячейке на границе «насыщенный раствор KCI-данный раство» не значительна и во многих случаях ей можно пренебречь. Каломельный электрод промышленного изготовления представляет собой стеклянную трубку, заполненную ртутью и каломелью. Эта трубка закреплена в стеклянный цилиндр с раствором хлорида калия. Соединение между растворами осуществляется с помощью капиллярного отверстия или пористой перегородки.
Хлорсеребряный электрод является электродом второго рода и служит электродом сравнения. Он получил чрезвычайно широкое применение в потенциометрии. Хлорсеребряный электрод обладает высокой воспроизводимостью, может применяться как в водных, так и неводных растворах. Хлорсеребряный электрод состоит из серебряной проволоки,
погруженной в насыщенный раствор хлорида калия, содержащий
хлорид серебра, то есть хлорсеребряный электрод представляет собой
систему
Электродная реакция сводится к восстановлению AgCl до Ag и Cl-:
AgCl + е — = Ag + Cl — ;


Индикаторный электрод выбирают в зависимости от типа реакции. Потенциал индикаторного электрода должен устанавливаться практически мгновенно в соответствии с концентрацией определяемых ионов и не должен зависеть от присутствия других ионов.
Индикаторные электроды для метода нейтрализации
В методе нейтрализации используются электроды которые являются индикаторными по отношению к концентрации ионов водорода. Наибольшее распространение получили при определении концентрации водородных и гидроксильных ионов хингидронный, стеклянный и сурьмяный электроды.
Индикаторные электроды методов осаждения и комплексообразования
В качестве индикаторных электродов применяются в этом случае электроды второго рода: хлорсеребряный, каломельный, сернисто-серебряный, сернистортутный:
Cl-½ AgCl, Ag; Cl-½ Hg2Cl2, Hg; S2-, Ag2S½Ag; S2-, НgS½Нg.
Потенциал электрода такого типa зависит от концентрации аниона в растворе, поэтому такие электроды могут быть использованы для определения концентрации анионов : Cl-, Br-, I-, S2-. В этом случае с успехом можно применить также металлические электроды: серебряный и ртутный, с помощью которых можно определить концентрацию ионов серебра и ртути в растворе.
Индикаторные электроды метода окисления – восстановления
Если мы имеем дело с окислительно-восстановительной системой, то в этом случае индикаторными электродами служат индифферентные металлы: платина, золото, палладий. Наибольшее применение в потенциометрии нашел гладкий платиновый электрод в виде проволоки. При любом окислительно-восстановительном титровании платиновый электрод принимает потенциал любой окислительно-восстановительной системы, то есть он является просто передатчиком электронов.
Стеклянный электрод представляет собой шарообразный или плоский сосуд, изготовленный из стеклянной пленки толщиной несколько микрон. Внутрь электрода заливают 0,1 н раствор соляной кислоты и помещают хлорсеребряный электрод. При измерениях стеклянный электрод помещают в исследуемый раствор, содержащий ионы водорода, концентрацию которых следует определить. Стеклянный электрод перед его применением специально вымачивают в слабом растворе кислоты. При этом из поверхностного слоя стекла выщелачиваются ионы щелочного металла и на поверхности образуется гелеобразная пленка из набухшего SiO2. Такая гелеобразная пленка действует как твердый буферный раствор, содержащий постоянное количество ионов водорода, а потенциал такого стекла обратим по отношению к ионам водорода. Набухшая пленка на поверхности стекла содержит анионы кремневой кислоты, связанные со скелетом стекла, и ионы водорода. Ионов водорода очень мало, так как кремневая кислота очень слабая (К=10-12).
Если поместить такой электрод в раствор, содержащий ионы
водорода, то будет происходить обмен ионами водорода между двумя фазами — раствором и стеклом:
Переход иона водорода из одной фазы в другую эквивалентен перемещению единичного заряда, то есть в уравнении для потенциала стеклянного электрода n= 1.

Но фактически обмен происходит не только между ионами водорода, но и щелочного металла. При этом они частично заменяются ионами водорода, а сами переходят в раствор:
ллН+ + М+ст. ↔ М+ + Н+ст ;.

Величина константы обмена Коб. зависит от сорта стекла и температуры и колеблется в пределах от 10-10 до 10-14. Можно принять, что 

Решение этого уравнения относительно 

Подставим выражение (7) в уравнение (6):
Это выражение можно переписать так:

где величина 


Уравнение (9) справедливо для кислых или нейтральных растворов, поскольку в этих растворах 






где слагаемое 

Таким образом, и в кислой среде, и в щелочной среде, потенциал стеклянного электрода является функцией активности ионов водорода, причем в каждой области рН растворов существует свое значение стандартного потенциала стеклянного электрода 

Рис.1. Завимость потенциала стеклянного электрода от рН среды
Термин ионоселективные электроды применяется для обозначения таких электродов, в основе работы которых лежат ионообменные реакции, протекающие на границах мембран с растворами электролитов, ионоселективные электроды могут быть обратимы как по катиону, так и по аниону.
Известно несколько разновидностей ионоселективных электродов: стеклянные, солевые, ионитовые. По своему химическому составу иониты– это полиэлектролиты, имеющие в своем составе полярные кислотные (катиониты) или основные (аниониты) группы (≡SiOH; — SO3H;
Различие значений химического потенциала противоионов в мембране и электролите, находящемся в соприкосновении с ее поверхностью в начальный момент их контакта, обусловливает переход ионов из раствора на поверхность ионита или в обратном направлении. Через небольшой промежуток времени после начала контакта устанавливается равновесие, характеризующееся равенством значений электрохимических потенциалов в ионите и в растворе. Скачок устанавливающегося потенциала зависит от активности противоионов в растворе в соответствии с уравнением Нернста. Если потенциал мембраны зависит от активности ионов только одного вида, то такую мембрану и соответствующий мембранный электрод называют ионоселективным по отношению к ионам данного вида [5].
Ионоселективный электрод может функционировать как
электрод, обратимый по катионам щелочных металлов. Количественной мерой специфичности электрода является константа КНМ из уравнения ионообменной теории стеклянного электрода :

Стеклянные электроды с высокой КHM () могут функционировать как обратимые по катионам. Стеклянные электроды, обладающие высокой селективностью по отношению к каким-либо ионам называют электродами с электродной функцией по данному виду ионов. Для электродов с нерезко выраженной специфичностью потенциал определяется уравнением:
Для потенциометрического определения активности катионов 





Потенциометрическое титрование основано на резком изменении потенциала электрода в точке эквивалентности. Дня потенциометрического титрования собирают цепь из индикаторного электрода и электрода сравнения, которые находятся в исследуемом растворе. Таким образом, в потенциометрическом титровании индикатор, который применяется при обычном титровании, заменяется рабочим электродом, поскольку существует линейная зависимость между электродным потенциалом и логарифмом концентрации (активности) ионов. О процессах, происходящих в растворе, судят не по изменению цвета индикатора, а по изменению потенциала рабочего электрода.
Основными достоинствами метода потенциометрического титрования являются высокая точность, чувствительность, возможность проводить определения в более разбавленных растворах, чем это позволяют визуальные методы, а также определение нескольких веществ в одном растворе без предварительного разделения и титрование мутных и окрашенных растворов. В зависимости от типа реакции методы потенциометрического титрования делятся на методы осаждения, комплексообразования, нейтрализации, окисления-восстановления [5].
При помощи потенциометрического титрования можно решать следующие задачи
1. Определить концентрации одного или нескольких веществ,
присутствующих в растворе.
2. Определить кажущиеся константы диссоциаций слабых кислот
и оснований.
3. Определить произведение растворимости труднорастворимых
электролитов.
4. Определить константу нестойкости комплексов.
5. Определить нормальный окислительно-восстановительный потенциал.
6. Определить константу равновесия окислительно-восстановительного процесса.
При потенциометрическом титровании концентрация (активность) ионов в растворе все время изменяется, следовательно, изменяется и равновесный потенциал. Если вычислить значения равновесного потенциала электрода Ех по уравнению Нернста в зависимости от количества добавленного титранта и построить график в координатах Ех — V (где V объем добавленного титранта, мл), то получим кривую титрования с резким изменением потенциала в точке эквивалентности (рис. 2 а). Часто график строят в координатах ΔЕ/ΔV – V, где ΔЕ изменение потенциала электрода между двумя порциями титранта, ΔV порция добавленного титранта. Точка эквивалентности определяется как максимум на кривой титрования (рис. 2 б).
Потенциометрическое титрование кислот
Рассмотрим потенциометрическое титрование на примере титрования кислот и оснований. При титровании кислот и слабощелочных растворов на практике часто используется стеклянный электрод. Все титрования такого типа, а также определения концентрации ионов водорода исследуемых растворов проводят, применяя гальваническую ячейку вида:

стеклянный исследуемый каломельный
электрод раствор электрод
Рис 2. Интегральная (а) и дифференциальная (б) кривая титрования.
Потенциометрическое титрование, основанное на реакциях нейтрализации, в широкой области значений рН проводится с помощью водородного электрода, в кислой среде можно проводить также с помощыо хингидронного и сурьмяного электродов. Выбор индикаторного электрода зависит от наличия или отсутствия в растворе окислителей и восстановителей, загрязнений, а также от поставленной задачи. Стеклянный электрод имеет ряд преимуществ перед водородным и хингидронным электродами: он может работать в присутствии окислителей и восстановителей, поверхностно-активных веществ, растворенных газов, сероводорода.
Поскольку между потенциалом стеклянного электрода Е и величиной рН существует линейная зависимость, строят кривые изменения величины рН от V (объем добавленного титранта), либо зависимость
Е от V. Значение рН в точке эквивалентности зависит от природы соли, образующейся в процессе титрования. При титровании сильной кислоты сильным основанием рН в точке эквивалентности будет определяться ионным произведением воды, то есть будет около 7. В точке эквивалентности происходит резкое изменение рН примерно от 4 до 10. Величина скачка зависит от концентрации. С увеличением концентрации скачок возрастает. Если титруются растворы концентрацией меньше, чем 10-4 н, то скачок рН будет очень незначительным и точное определение затруднено.
При титровании слабой кислоты сильным основанием величина рН в точке эквивалентности будет в щелочной области, так как образующаяся соль в процессе титрования подвергается гидролизу. Значение рН в точке эквивалентности будет равно:
рН = 7 + 1/2 рКа + 1/2 lgСс,
где рКа отрицательный логарифм константы диссоциации слабой кислоты;
Сс концентрация гидролизующейся соли.
В эквивалентной точке скачок рН небольшой. При титровании слабой кислоты сильным основанием удовлетворительные результаты можно получить, если константа диссоциации кислоты не ниже 10-8. В случае титрования слабых кислот слабыми основаниями возможность определения зависит от значения констант диссоциации кислот и оснований (табл. 1).
+ титрование возможно; — титрование не возможно.
При титровании смеси кислот удовлетворительные результаты можно получить если Кдисс последовательно оттитрованных кислот отличаются друг от друга по крайней мере на 3-4 порядка. Кривая титрования в этом случае имеет два перегиба, причем первый отвечает нейтрализации более сильной кислоты. Аналогично при титровании многоосновных кислот перегибы соответствуют ступеням диссоциации. Однако и в этом случае соответствующие константы диссоциации по соответствующим ступеням должны отличаться на 3-4 порядка. В противном случае перегибов на кривой титрования наблюдаться не будет
Лабораторная работа 1
Цель работы: построение калибровочных кривых для серийного определения содержания ионов Na+ в исследуемых объектах.
В растворах сильного электролита имеет место взаимодействие между ионами, в результате которого физико-химические характеристики раствора не соответствуют истинной концентрации электролита.
Под активностью понимают мнимую концентрацию, в соответствии с которой электролит ведет себя в различных физико-химических процессах. Активность связана с концентрацией уравнением:
где С концентрация электролита, моль/л;
f коэффициент активности.
Коэффициенты активности распространенных электролитов собраны в специальные таблицы и могут быть найдены в справочной литературе. Поэтому, если известна концентрация раствора, можно рассчитать активность по формуле (11) и показатель активности электролита по формуле (12):
Moжнo построить калибровочные графики для определения концентрации, активности и показателя активности электролита.
Приборы и реактивы: рН-метр рН-340, стеклянный электрод для измерения активности ионов Na+ ЭСNа-51-07, хлорсеребряный электрод сравнения ЭВЛ-1МЗ, 8 мерных колб вместимостью 50 мл, пипетки вместимостью 10, 20 и 25 мл. , 1,0 М раствор NаС1.
1. Приготовление стандартных растворов NаCl.
Стандартные растворы с заданной концентрацией 1,0; 0,5; 0,25; 0,10; 0,05; 0,01; 0,005 и 0001 моль/л NaCl готовят методом последовательного разбавления исходного 1,0 М раствора NaCl. При разбавлении растворов используют формулу (13)[1]:
где V1 объем исходного раствора;
С1 молярная концентрация исходного раствора;
V2 объем разбавленного раствора (50 мл);
С2 молярная концентрация разбавленного раствора.
По формуле (13) находят объем раствора, который необходимо отобрать пипеткой из неразбавленного раствора, перенести в следующую колбу и довести объем в рабочей колбе до метки дистиллированной водой. Первую колбу заполняют исходным 1,0 М раствором.
2. Измерение ЭДС гальванического элемента.
Погружают электроды в анализируемые растворы и измеряют ЭДС элемента, составленного из стеклянного ионоселективного электрода ЭСNа-51-07 и хлорсеребряного электрода сравнения ЭВЛ-1МЗ. Перед началом измерений электроды промывают несколько раз дистиллированной водой. При использовании стандартных растворов измерения проводят, переходя от разбавленных к концентрированным растворам. Полученные результаты заносят в табл. 2.
3. Расчет активности и показателя активности ионов Na+ в приготовленных растворах.
По таблицам находят коэффициенты активности ионов Na+ в растворах с концентрациями, отвечающими концентрациям, приготовленных растворов. Зная коэффициент активности, рассчитывают по формулам (12) и (13) активность и показатель активности ионов Na+.
4. Построение калибровочных кривых.
Для построения калибровочных кривых Е – f (С) концентрационный интервал 1,0 моль/л ¸ 0,001 моль/л делят на три части:
1,0 моль/л ¸ 0,1 моль/л;
0,1 моль/л ¸ 0,01 моль/л;
0,01 моль/л ¸ 0,001 моль/л
и строят три калибровочных кривых для более точной интерпретации экспериментальных данных для контрольного раствора. Затем строят общий калибровочный график в координатах Е – f (paNa) .
5. Контрольный анализ.
В мерную колбу на 50 мл получить у лаборанта определенный объем исследуемого раствора. Довести объем в колбе до метки дистиллированной водой и измерить ЭДС исследуемого раствора. По построенным графикам определить «С», aNa+, paNa исследуемого раствора NaCl.
1.Принцип потенциометрического определения активности ионов.
2.Основы теории сильных электролитов. Активность, коэффициент активности.
Лабораторная работа 2
ОПРЕДЕЛЕНИЕ НИТРАТА В ТЕХНИЧЕСКОМ ОБРАЗЦЕ
Цель работы: построение калибровочной кривой для определения нитрата.
Определение нитрата в технических объектах представляет собой сложную аналитическую задачу, требующую значительного количества времени. Применение ионоселективных пластифицированных электродов, чувствительным элементом которых является мембрана, содержащая нитрат четвертичного аммониевого основания, позволяет, при наличии калибровочной кривой, значительно сократить время на проведение анализа.
Приборы и реактивы: рН-метр рН-340, нитратселективный пластифицированный электрод, хлорсеребряный электрод сравнения ЭВЛ-1МЗ, магнитная мешалка, 8 мерных колб вместимостью 50 мл, пипетка вместимостью 25 мл., 0,1 М раствор нитрата калия, 1,0 М раствор сульфата калия.
1. Приготовление стандартных растворов нитрата калия.
В восемь мерных колб на 50 мл наливают по 10 мл 1,0 М раствора сульфата калия в каждую. Так как нитратселективный электрод реагирует на изменение активности ионов NO3- , а не концентрации, то более правильно готовить растворы с постоянной ионной силой, создаваемой
1,0 М раствором сульфата калия. Поэтому, стандартные растворы КNO3 готовят на фоне сульфата калия. В первую колбу до метки наливают 0,1 М раствор КNO3, затем проводят последовательное разбавление, каждый раз отбирая из предыдущей колбы в последующую по 25 мл раствора. Для вычисления концентрации раствора в каждой колбе пользуются формулой 13.
2. Измерение ЭДС гальванического элемента.
Погружают электроды в исследуемые растворы и измеряют ЭДС элемента, составленного из нитратселективного электрода и хлорсеребряного электрода сравнения ЭВЛ-1МЗ. Перед началом измерений электроды промывают несколько раз дистиллированной водой. Измерения ЭДС стандартных растворов проводят, переходя от меньших концентраций к большим. Полученные результаты заносят в табл. 3.
По полученным данным строят график в координатах Е – f (-lgC).
3. Контрольный анализ.
Навеску технического образца, в котором необходимо определить содержание нитрата (»0,1000 г), взвешенную на аналитических весах, переносят в мерную колбу вместимостью 100 мл и доливают до метки дистиллированную воду. Измеряют ЭДС элемента в исследуемом растворе. Используя калибровочный график, определяют содержание нитрата в анализируемом растворе. Содержание нитрата X (в % ) в техническом образце рассчитывают по формуле:

где С концентрация NO3- , определяемая из графика, моль/л;
V вместимость мерной колбы;
М молярная масса нитрата;
m навеска технического образца, г.
1. Ионометрия. Ионоселективные электроды.
2. Основные положения теории сильных электролитов. Ионная
ПОТЕНЦИОМЕТРИЧЕСКОЕ ОПРЕДЕЛЕНИЕ КОНСТАНТЫ ДИССОЦИАЦИИ УКСУСНОЙ КИСЛОТЫ
Константа диссоциации кислоты в водном растворе показывает, что в состоянии равновесия произведение активностей ионов кислоты деленное на активность недиссоциированных молекул, есть величина постоянная. Выражая активность через коэффициент активности и концентрацию получаем:

Прологарифмируем выражение (15):

При ионной силе J → 0 отношение коэффициентов активности 

Измерив рН при разных значениях ионной силы и экстраполируя
полученные результаты к J=0, можно определить показатель константы диссоциации слабой кислоты.
Приборы и реактивы: рН-метр рН-340, индикаторный стеклянный электрод ЭСЛ-11Г-05, хлорсеребряный электрод сравнения ЭВЛ-1МЗ,
0,02 н раствор уксусной кислоты и 0,02 н раствор уксусно-кислого натрия, мерная колба вместимостью 100 мл, измерительная пипетка вместимостью 50 мл.
1. Приготовление раствора для измерения.
Константу диссоциации СН3СООН можно определить, используя растворы с различным содержанием уксусной кислоты и ацетата натрия. По указанию преподавателя отмеряют определенное количество 0,02 н раствора ацетата натрия измерительной пипеткой и переносят в мерную колбу, затем объем в колбе доводят до метки 0,02 н раствором уксусной кислоты (Получают раствор А). Рассчитывают концентрацию кислоты и соли в приготовленном растворе, зная концентрацию исходных растворов, по формуле 13..
Рассчитывают 
2. Измерение рН растворов с различной ионной силой.
В ячейку для измерения рН отбирают измерительной пипеткой 30 мл приготовленного раствора А и добавляют последовательно 0, 1, 1, 2, 2, 2, 2, 3, 5, 7 мл раствора В. После каждого прибавления измеряют рН. Таким образом, в измерительной ячейке будет содержаться при каждом последовательном измерении 0, 1, 2, 4, 6, 8, 10, 13, 18, 25 мл раствора Б. Перед измерением электроды промывают несколько раз дистиллированной водой. Измерения при каждой концентрации раствора Б проводят не менее 3 раз, полученные результаты заносят в табл. 4.
3. Вычисление концентрации СН3СООNa, KCl (раствор Б), ионной силы растворов и константы диссоциации уксусной кислоты.
Ионную силу рассчитывают пo формуле:
J = 1/2 [CH3COO-] + [Na+] + [Cl-] + [K+] @ CKCl + CCH3COONa (18)
Концентрации СН3СООNa и KCl по формулам:


где V1 объем добавленного раствора Б.
Полученные результаты заносят в табл. 4.

Строят зависимость 
1. Сильные электролиты. Ионная сила растворов электролитов.
3. Ионные равновесия в растворах слабых электролитов. Константа диссоциации.
Лабораторная работа 4.
ПОТЕНЦИОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ КИСЛОТ
Цель работы: построить кривые титрования кислот (не менее трех) различной силы и основности, определить точку эквивалентности и концентрацию кислот.
В процессе нейтрализации кислоты щелочью рН раствора изменяется вначале медленно, а затем при приближении к точке эквивалентности скачком. Точка эквивалентности может лежать в нейтральной, кислой или щелочной средах. Если в результате нейтрализации образуется соль сильной кислоты и сильного основания, среда будет нейтральной; соль слабой кислоты и сильного основания – щелочной; сильной кислоты и слабого основания – кислотной. Многоосновные кислоты имеют многоступенчатую кривую титрования, которая отвечает всем возможным переходам в растворе. При выполнении данной работы необходимо познакомиться с различными вариантами кривых титрования, различными способами нахождения точки эквивалентности и освоить методику потенциометрического титрования.
Приборы и реактивы: рН-метр рН-340, индикаторный стеклянный электрод ЭСЛ-11Г-05, хлорсеребряный электрод сравнения ЭВЛ-1МЗ,
0,1 н раствор NaOH, магнитная мешалка, бюретка вместимостью 25 мл, растворы соляной, азотной, серной, фосфорной, щавелевой, янтарной, уксусной, яблочной и др. кислот с неизвестной концентрацией, пипетка вместимостью 10 мл.
1. Потенциометрическое титрование кислот.
Получают у преподавателя перечень кислот для анализа.
Отмеряют 10 мл кислоты пипеткой и переносят в стаканчик для
титрования. Электроды несколько раз промывают дистиллированной
водой и погружают в исследуемый раствор, включают мешалку и
замеряют начальное значение ЭДС исследуемого раствора. Затем приступают к титрованию, прибавляя из бюретки к исследуемому раствору по 0,5 мл 0,1 н раствора щелочи, тщательно перемешивают и записывают показания гальванометра в табл. 5. При приближении к точке эквивалентности, когда ЭДС начинает изменяться резко, добавляют по 0,1 мл щёлочи. Титрование проводят до установления постоянного значения ЭДС.
2. Построение кривых титрования
На миллиметровой бумаге строят графики в координатах Е – f(V) и DЕ/DV – f(V) для каждой кислоты, определяют точку эквивалентности графическим способом и по пику на дифференциальной кривой. Рассчитывают нормальность кислоты по формуле 13, титр и содержание кислоты в 1 л раствора по формулам :
ТК = СK. Мэ К/1000; (21)
mК = СK. М э К (22)
1. Сущность потенциометрического тирования.
2. Уравнение Нернста для рН-метрии.
3. Разновидности кривых титрования.
Лабораторная работа № 5
ОПРЕДЕЛЕНИЕ СОДЕРЖАНИЯ ЖЕЛЕЗА (II)
Цель работы: методом окислительно-восстановительного потенциометрического титрования определить содержание Fe+2 в исследуемом растворе.
В окислительно-восстановительных реакциях в качестве индикаторных электродов применяют инертные металлы, например, платину и золото. Потенциал, возникающий на платиновом электроде, зависит от отношения концентраций окисленной и восстановленной форм. Так при титровании раствора железа (II) бихроматом калия
6FeSO4 + K2Cr2O7 + 7H2SO4 → 3Fe2(SO4)3 + Cr2(SO4)3 + K2SO4 + 7H2O
6Fe2+ + Cr2O72- + 14H+ → 6Fe3+ + 2Cr3+ + 7H2O
концентрация ионов Fe2+ уменьшается, а концентрация ионов Fe3+ возрастает. После эквивалентной точки в растворе практически отсутствует ионы железа (II), но введенный избыток бихромата калия создает окислительно-восстановительную систему хрома 
Потенциал в точке эквивалентности можно рассчитать по формуле:

где n1 и n2 число электронов, участвующих в реакции;


Приборы и оборудование: рН-метр рН-340, тонкослойный платиновый электрод ЭТПЛ-01М, хлорсеребряный электрод сравнения ЭВЛ-1МЗ, магнитная мешалка, 0,05 н раствор бихромата калия, 2 н раствор серной кислоты, исследуемый раствор соли Мора с неизвестной концентрацией, пипетки вместимостью 5 мл и 15 мл.
1. Потенциометрическое титрование соли Мора бихроматом калия.
В ячейку для титрования пипеткой вносят 5 мл исследуемого раствора, добавляют 15 мл дистиллированной воды и 5 мл раствора серной кислоты, погружают электроды, включают магнитную мешалку и титруют 0,05 н стандартным раствором бихромата калия. Первое титрование является ориентировочным, титрант (бихромат калия) добавляют порциями по 1 мл. Титрование заканчивают, когда показания прибора перестают изменяться. Следующее титрование является точным: титрант добавляют порциями по 0,5 мл, вблизи точки эквивалентности — по 0,1 мл. Результаты первого и второго титрования заносят в табл. 6.
Объем титранта V, мл
2. Расчет содержания Fe2+ в исследуемом растворе соли Мора.
По данным титрования строят кривые титрования в координатах
Е – V и DE/DV – V. Определяют точку эквивалентности графическим способом и по пику на дифференциальной кривой и нормальность титруемого раствора по формуле:
V(соли Мора)Сн( соли Мора) = V ( K2Cr2O7) · Cн ( К2Cr2O
Рассчитывают содержание Fe2+ в исследуемом растворе, г/л по формуле:
а ( Fe2+) = Сн..Мэ (Fe2+). (25) и потенциал в точке эквивалентности по формуле 23.
1. Сущность потенциометрического титрования по методу окисления-восстановления.
2. Определение потенциала в точке эквивалентности при титровании по методу окисления-восстановления.
Лабораторная работа 6
ОПРЕДЕЛЕНИЕ СОДЕРЖАНИЯ АЦЕТАТА ЦИНКА
Цель работы: определение содержания ацетата цинка с помощью потенциометрического титрования по методу осаждения.
Потенциометрическое титрование по методу осаждения состоит в переводе определяемых ионов в труднорастворимое соединение. Для определения ацетата цинка используется реакция:
3Zn2++6CH3COO-+2K++ 2[Fe(CN)6]4- +6H+ → Zn3K2[Fe(CN)6]2 + 6CH3COOH
При титровании с платиновым электродом потенциал индикаторного электрода определяется соотношением концентраций (активностей) ферро [Fe(CN)6]3- — и ферри [Fe(CN)6]2- — цианид ионов. При этом концентрация феррицианид ионов зависит от произведения растворимости труднорастворимой соли

отсюда 
а потенциал платинового электрода при 25°С можно определить по формуле:

Приборы и оборудование: рН-метр рН-340, тонкослойный платиновый электрод ЭТПЛ-01М, хлорсеребряный электрод сравнения ЭВЛ-1МЗ, магнитная мешалка, 0,1 М раствор K3[Fe(CN)6] , 0,5 н раствор серной кислоты, 0,025 М раствор K4[Fe(CN)6], исследуемый раствор ацетата цинка с неизвестной концентрацией, пипетки вместимостью 5 мл и 25 мл.
1. Потенциометрическое титрование ацетата цинка 0,025 М раствором феррицианида калия K4[Fe(CN)6].
В потенциометрическую ячейку вносят 5 мл исследуемого раствора Zn(СН3СООН)2 добавляют 25 мл дистиллированной воды, 0,5 мл 0,1 М раствора K3[Fe(CN)6] и 10 мл 0,5 н раствора H2SО4. В ячейку опускают платиновый и хлорсеребряный электроды, включают мешалку и титруют 0,025 М раствором K4[Fe(CN)6]. Проводят пробное титрование, добавляя титрант по 0,5 мл. Затем проводят точное титрование, при котором вблизи точки эквивалентности титрант добавляют по 0,1 мл. Полученные результаты заносят в табл. 7.
Объем титранта V, мл
2.Расчет содержания ацетата цинка в исследуемом растворе.
По данным таблицы строят графики в координатах Е — V и
DE/DV — V, определяют точку эквивалентности и рассчитывают нормальность исследуемого раствора Zn(Cu3COO)2 no формуле Cм(Zn(СН3СООН)2)∙V(Zn(СН3СООН)2)=Cм(K4[Fe(CN)6])∙V(K4[Fe(CN6)]) (28
и содержание ацетата цинка в 1 л исследуемого раствора по формуле:
а (Zn(СН3СООН)2 ) = Сн(Zn(СН3СООН)2) ∙ М (Zn(СН3СООН)2 ),г/л (29)
1. На чем основано потенциометрическое титрование по методу комплексооброзования?
2. Опишите электрод сравнения.
3. Вычислите потенциал в точке эквивалентности.
4. Дайте определение величины ПР.
Лабораторная работа №7
КОМПЛЕКСОНОМЕТРИЧЕСКОЕ ОПРЕДЕЛЕНИЕ ЖЕЛЕЗ(III)
Цель работы: определение ионов железа (III) с помощью потенциометрического титрования по методу комплексообразования.
Для определения катионов при потенциометрическом титровании по методу комплексообразования используют в качестве лигандов цианиды, галогениды, комплексоны. На поверхности электродов происходит окислительно-восстановительная реакция, константа равновесия которой определяет величину устойчивого равновесного потенциала. Так, ЭДТА — динатриевая соль этилендиаминтетрауксусной кислоты Н2Y-2 — образует с Fe3+ прочный комплекс:
Fe3+ + H2Y-2 → FeY — + 2H+ .
Константа равновесия реакции равна:

При титровании с платиновым и хлорсеребряным электродами скачок потенциала в точке эквивалентности связан с практическим исчезновением окисленной формы окислительно-восстановительной системы Fe3+/Fe2+ .
Приборы и рективы: рН-метр рН-340, платиновый электрод, хлорсеребряный электрод сравнения ЭВЛ-1МЗ, исследуемый раствор соли железа (III), 10%-ный раствор ацетата аммония, 0,05 М раствор ЭДТА,
1%-ный раствор соли Мора.
Исследуемый раствор железа (Ш) в количестве 5 мл вносят в потенциометрическую ячейку, разбавляют водой (50 мл) и прибавляют по каплям 10%-ный раствор ацетата аммония до момента, пока раствор не окрасится в желто-оранжевый цвет вследствие гидролиза соли Fe (Ш). Добавляют 5-10 капель 1%-ного раствора соли Мора и титруют на рН-340 с платиновым и хлорсеребряным электродами 0,05 М раствором ЭДТА. Вблизи точки эквивалентности потенциал устанавливается медленно, перед записью результатов измерения ЭДС ожидают установления равновесия. Титруют до постоянного значения ЭДС.
Содержание железа а вычисляют по формуле:

1. Напишите выражение для константы равновесия реакции динатриевой соли этилендиаминтетрауксусной кислоты с ионами трехвалентного железа.
2. Какие электроды применяются при титровании по методу
комплексообразования?
ЛИТЕРАТУРА
1.Крешков аналитической химии: в 3 т. / . М.: Химия, 1977. Тс.
2. Аналитическая химия: в 2 т. / . М.: Высшая школа, 1989, Т 2, 320 с.
3. C. Физико-химические метода анализа/ Ю. C. Ляликов. М.: Химия, 1974, 350 с.
4. Лопатин основы электрохимических методов анализа. М.: Высшая школа, 19с.
5. Основы аналитической химии: в 2 т. / Д. Скут, Д. Уэст. / М.: Мир, 1979. Тс.
рН-метр — милливольтметр рН-340 является лабораторным прибором, предназначенным для определения величины рН, рNa и окислительно-восстановительных потенциалов, а также для использования в качестве высокоомного нуль-индикатора.
1. Включить прибор в сеть.
2. Ручки переключателей «Род работы» и «Размах» установить
соответственно в положение «Н» «15рН».
3. Ручку на лицевой панели «Температура» установить на
значении температуры контролируемого раствора.
4. Измерительный и вспомогательный электроды должны быть
подключены в соответствии с выбранной схемой измерения.
5. Перед каждым погружением электрода в контролируемый
раствор, особенно при измерении рН растворов, обладающих малой
буферной емкостью, электроды необходимо тщательно промывать
дистиллированной водой и удалять с поверхности избыток воды фильтровальной бумагой.
6. С целью обеспечения наибольшей точности измерения рекомендуется переключатель «размах» установить в положение «3рН» только на время отсчета на данном диапазоне. Во всех остальных случаях (замена буферного раствора, предварительное определение величин рН) переключатель «Размах» должен быть установлен в положение «15pH».
7. Отсчет величины рН по шкале прибора следует производить
после того, как показания примут установившееся значение, то есть
после 30-минутного прогрева прибора.
8. По окончании работы с прибором электроды должны оставаться погруженными в дистиллированную воду.
Отсчет показаний на широком диапазоне измерения (1 – 14) необходимо производить по нижней шкале показывающего прибора, оцифрованной от -1 до +14 рН при установке переключателя «размах» в положение «15рН».
Отсчет показаний на любом из узких диапазонов (-1÷2; 2÷5; 5÷8; 8÷11; 11÷14) необходимо производить по верхней шкале показывающего прибора, руководствуясь оцифровкой верхней шкалы и положением переключателя «пределы измерения». Переключатель «Размах» устанавливается в положение «3рН».
Примеры. А) Переключатель диапазонов установлен в положении «11÷14», а стрелка показывающего прибора установилась на значении 1,25. Измеряемая величина = 11 + 1,25 = 12,25 рН.
Б) Переключатель диапазонов установлен в положении «-1÷2», а стрелка показывающего прибора установилась на значении 1,25. Измеряемая величина = — I + 1,25 = 0,25 рН.
Проверка и настройка прибора по двум буферным растворам.
Проверка и настройка прибора рН-340 производится по стандартным буферным растворам. Буферные растворы приготавливаются из реактивов квалификации «для рН-метрии» из фиксаналов. Проверку показаний прибора рекомендуется производить после 30-минутного прогрева прибора. Переключатель «Размах» должен быть установлен в положение «15рН». Электроды перед погружением в буферный раствор необходимо тщательно промывать дистиллированной водой, а остатки воды с электродов удалять фильтровальной бумагой.
Электроды поместить в стандартный буферный раствор 1,68рН. Переключатель «Пределы измерения» установить в положение «-1÷2», переключатель «Размах» в положение «15рН». Указатель температурного корректора установить на отметку, соответствующую температуре буферного раствора. Переключатель «Размах» установить в положение «3рН». Потенциометром «Е» установить стрелку показывающего прибора на отметку 1,68 рН по верхней шкале.
Проверить показания прибора по раствору 9,18 рН (на диапазоне 8÷11), Ошибка не должна превышать 0,05 рН. Если ошибка измерения превышает 0,05 рН, необходимо слабить цанговый зажим потенциометра и установить его ось в такое положение, чтобы показания прибора соответствовали 9,18 рН. Проверить показания прибора по раствору 1,68 рН и в случае необходимости ручкой «Е» установить стрелку показывающего прибора на отметку 1,68 pН. Повторно проверить показания прибора по раствору 9,18 рН (на диапазоне 8÷11). Прибор готов к работе.
Использование прибора рН-340 для
производства потенциометрического титрования.
Титрование может производиться любым известным в аналитической химии методом с использованием зависимости рН и окислительно-восстановительного потенциала. Индикатором при титровании ионов какого-либо вида может служить любой другой электрод, который реагирует на изменение концентрации определяемого иона в растворе. В качестве электрода сравнения применяется хлорсеребряный электрод.
Потенциометрическое титрование для окислительно-восстановительных реакций проводится на приборе рН-340 с платиновым электродом ЭТПЛ-01М.
При титровании до известного значения окислительно-восстановительного потенциала с помощью платинового электрода переключатель «Размах» устанавливается в положение «1500мВ». Визуальный контроль величины окислительно-восстановительного, потенциала по прибору pН-340 по окончании титрования может быть осуществлен по нижней шкале показывающего прибора с точностью ± 60 мВ или по верхней шкале на соответствующем диапазоне в точностью ±5 мВ.
Использование прибора рН-340 как милливольтметра.
Ручки переключателей «Род работы» и «Размах» установить в положение соответственно «+мВ» и «15рН (1500мВ)». В приборе предусмотрена возможность измерения ЭДС различной полярности. Следует иметь в виду, что при отсчете показаний на участке шкалы от 0 до 1400 мВ знак, соответствующий положению ручки переключателя «Род работы», в момент измерения соответствует знаку потенциала измерительного электрода. Отсчет показаний производится так же, как описано выше. Показания, отсчитанные на любом диапазоне измерения, необходимо умножить на 100.
Пример. Переключатель диапазона установлен в положение «-I + 2», стрелка показывающего прибора установилась на значении 0,25. Измеряемая величина — I +0,25 = -0,75.100 = -75мВ.
Вопросы по теме: «Потенциометрия и потенциометрическое титрование».
1. В чем сущность потенциометрического метода анализа?
2. Какие методы потенциометрии известны?
3. Природа двойного электрического слоя и причина возникновения электродных потенциалов.
4. Потенциометрическое титрование. Общие принципы.
5. Потенциометрическое титрование окислительно-восстановительных систем.
6. Потенциометрическое титрование кислот и оснований.
7. Потенциометрическое титрование, основанное на образовании труднорастворимых соединений.
8. Электроды в потенциометрии. Водородный, каломельный,
хлорсеребряный, стеклянный электроды.
9. Уравнение потенциалов этих электродов. Работа электродов.
http://infourok.ru/tema-potenciometricheskiy-metod-analiza-3088213.html
http://pandia.ru/text/78/520/43722.php