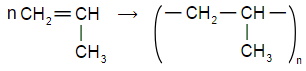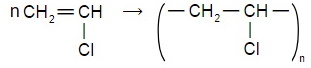В результате 3ch ch образуется напишите уравнение реакции
FOR-DLE.ru — Всё для твоего DLE 😉
Привет, я Стас ! Я занимаюсь так называемой «вёрсткой» шаблонов под DataLife Engine.
На своем сайте я выкладываю уникальные, адаптивные, и качественные шаблоны. Все шаблоны проверяются на всех самых популярных браузерх.
Раньше я занимался простой вёрсткой одностраничных, новостных и т.п. шаблонов на HTML, Bootstrap. Однажды увидев сайты на DLE решил склеить пару шаблонов и выложить их в интернет. В итоге эта парочка шаблонов набрала неплохую популярность и хорошие отзывы, и я решил создать отдельный проект.
Кроме шаблонов я так же буду выкладывать полезную информацию для DataLife Engin и «статейки» для веб мастеров. Так же данный проект будет очень полезен для новичков и для тех, кто хочет правильно содержать свой сайт на DataLife Engine. Надеюсь моя работа вам понравится и вы поддержите этот проект. Как легко и удобно следить за обновлениями на сайте?
Достаточно просто зарегистрироваться на сайте, и уведомления о каждой новой публикации будут приходить на вашу электронную почту!
Задание 1
Определите молекулярную формулу алкена, молярная масса которого в три раза больше, чем у этилена.
Дано: M(CnH2n)/M(C2H4)=3
Найти: формулу CnH2n — ?
Решение
M(CnH2n)=3•M(C2H4)=3•28 г/моль=84 г/моль
M(CnH2n)=n • Ar(C)+2n • Ar(H)=n • 12+2n • 1=14 n
Имеем уравнение: 14n=84, n=84:14=6, следовательно формула имеет вид C6H12
Ответ: C6H12
Задание 2
Назовите этиленовый углеводород по международной номенклатуре. 2-метилпропен
Задание 3
Каковы основные источники промышленного получения этиленовых углеводородов? Крекинг нефти (термический, каталитический) и пиролиз (сильное нагревание) алканов.
Задание 5
Как отличить друг от друга этан и этилен? Этилен, в отличие от этана, обесцвечивает бромную воду и раствор перманганата калия.
Напишите уравнение реакции.
CH2=CH2 + Br2 H₂O ⟶ BrCH2 — CH2Br
CH2=CH2 + [O] + H2O ⟶ CH2OH — CH2OH
Задание 6
В чём состоит основное отличие химических свойств предельных и непредельных углеводородов? Непредельные углеводороды, в отличие от предельных, способны к реакциям присоединения по кратной связи.
Задание 7
Напишите уравнения реакций пропена с водородом, бромом, хлороводородом и водой. Помните, что присоединение несимметричных реагентов происходит по правилу Марковникова.
CH3 — CH=CH2 + H2 кат. ⟶ CH3 — CH2 — CH3
CH3 — CH=CH2 + Br2 ⟶ CH3 — CHBr — CH2Br
CH3 — CH=CH2 + HCl ⟶ CH3 — CHCl — CH3
Задание 8
С каким жидким веществом при обычных условиях реагируют как алканы, так и алкены? С бромом.
Чем отличаются эти реакции? Реакция брома с алканами является реакцией замещения, а с алкенами — реакцией присоединения.
Задание 9
Объясните, почему химические свойства полиэтилена отличаются от свойств этилена. Полиэтилен, в отличие от этилена, не содержит кратных связей, поэтому для него характерны химические свойства предельных алканов.
Задание 10
Напишите уравнение реакции полимеризации:
а) пропена;
б) 1-хлорэтена.
Задание 11
Используя Интернет, подготовьте сообщение об областях применения и свойствах одного из полимеров:
1) полиэтилен,
Применение: производство плёнки, различной тары, труб, электроизоляции, термоклея, брони.
Свойства: малопрозрачное вещество, значительно легче воды (плотность примерно 0,92 г/см 3 ) , плохо проводит теплоту и электрический ток, при нагревании размягчается (80°C—120°C) , на ошупь немного жирный, напоминает парафин.
2) полипропилен,
Применение: производство мешков, тары, труб, деталей технической аппаратуры, пластиковых стаканчиков, плёнки для парников, теплиц, предметов домашнего обихода, нетканых материалов, электроизоляционного материала, в строительстве для вибро- и шумоизоляции.
Свойства: обладает большей механической прочностью (стойкий к стиранию) , более термостойкий (начинает размягчаться при 140°С, температура плавления 175°С) , почти не подвергается коррозионному растрескиванию.
3) поливинилхлорид.
Применение: производство линолеума, изоляционной ленты, непромокаемых плащей, искусственных кож, поливинилхлоридного волокна, грязезащитных ковриков, обувных пластикатов, мебельной кромки.
Свойства: отличается химической стойкостью к щелочам, минеральным маслам, многим кислотам и растворителям, в чистом виде не поддерживает горение на воздухе, обладает малой морозостойкостью (-15°C) и нагревостойкостью (66°C) .
Задание 12
При взаимодействии этилена с бромом образовалось 37,6 г дибромэтана. Какой объём этилена (н.у.) вступил в реакцию?
Дано: m(C2H4Br2)=37,6 г
Найти: V(C2H4)-?
Решение
1-й способ
Mr(C2H4Br2)=2•Ar(C)+4•Ar(H)+2•Ar(Br)= 2•12+4•1+2•80= 188, поэтому M(C2H4Br2)=1 88 г/моль
n( C2H4Br2 )=m( C2H4Br2 )/M( C2H4Br2 )=37,6 г : 188 г/моль=0,2 моль
Составляем уравнение реакции: C2H4 + Br2 ⟶ C2H4Br2
По уравнению реакции n(C2H4)/1=n(C2H4Br2)/1, поэтому
n( C2H4 )=n( C2H4Br2 )=0,2 моль
V( C2H4 )=n( C2H4 )•Vm=0,2 моль • 22,4 л/моль=4,48 л
2-й способ
1. Составим химическое уравнение:
х л 37,6 г
C2H4 + Br2 ⟶ C2H4Br2
22,4 л 188 г
Над формулами соединений C2H4 и C2H4Br2 записываем неизвестный объем этилена (х л) и приведенную в условии задачи массу дибромэтана (37,6 г), а под формулами соединений ― массу и объём соответствующего количества вещества согласно коэффициентам в химическом уравнении. При н.у. 1 моль газа при н.у. занимает объем 22,4 л.
Mr(C2H4Br2)=2•Ar(C)+4•Ar(H)+2•Ar(Br)= 2•12+4•1+2•80= 188, поэтому M(C2H4Br2)=1 88 г/моль
2. Объём этилена рассчитываем с помощью пропорции:
х л / 22,4 л = 37,6 г / 188 г, отсюда
х=V( C2H4 )=22,4 л • 37,6 г : 188 г=4,48 л
Ответ: V( C2H4 )=4,48 л
Пропанол-1: химические свойства и получение
Пропанол-1, пропиловый спирт CH3CH2CH2OH – органическое вещество, молекула которого содержит, помимо углеводородной цепи, одну группу ОН.
Общая формула предельных нециклических одноатомных спиртов: CnH2n+2O.
Строение пропанола-1
В молекулах спиртов, помимо связей С–С и С–Н, присутствуют ковалентные полярные химические связи О–Н и С–О.
| Электроотрицательность кислорода (ЭО = 3,5) больше электроотрицательности водорода (ЭО = 2,1) и углерода (ЭО = 2,4). |
Электронная плотность обеих связей смещена к более электроотрицательному атому кислорода:
| Атом кислорода в спиртах находится в состоянии sp 3 -гибридизации. |
В образовании химических связей с атомами C и H участвуют две 2sp 3 -гибридные орбитали, а еще две 2sp 3 -гибридные орбитали заняты неподеленными электронными парами атома кислорода.
Поэтому валентный угол C–О–H близок к тетраэдрическому и составляет почти 108 о .
Водородные связи и физические свойства спиртов
Спирты образуют межмолекулярные водородные связи. Водородные связи вызывают притяжение и ассоциацию молекул спиртов:
Поэтому спирты – жидкости с относительно высокой температурой кипения (температура кипения пропанола +92 о С).
Водородные связи образуются не только между молекулами спиртов, но и между молекулами спиртов и воды. Поэтому спирты очень хорошо растворимы в воде. Молекулы спиртов в воде гидратируются:
| Чем больше углеводородный радикал, тем меньше растворимость спирта в воде. Чем больше ОН-групп в спирте, тем больше растворимость в воде. |
Пропанол смешивается с водой в любых соотношениях.
Изомерия пропанола-1
Структурная изомерия
Для пропанола-1 характерна структурная изомерия – изомерия положения гидроксильной группы и межклассовая изомерия.
Структурные изомеры — это соединения с одинаковым составом, которые отличаются порядком связывания атомов в молекуле, т.е. строением молекул.
Межклассовые изомеры — это вещества разных классов с различным строением, но одинаковым составом. Спирты являются межклассовыми изомерами с простыми эфирами. Общая формула и спиртов, и простых эфиров — CnH2n+2О.
| Например. Межклассовые изомеры с общей формулой С3Н8О пропиловый спирт СН3–CH2–CH2–OH и метилэтиловый эфир CH3–O–CH2–CH3 |
| Пропиловый спирт | Метилэтиловый эфир |
| СН3–CH2–CH2–OH | CH3–O–CH2–CH3 |
Изомеры с различным положением группы ОН отличаются положением гидроксильной группы в молекуле. Такая изомерия характерна для спиртов, которые содержат три или больше атомов углерода.
| Например. Пропанол-1 и пропанол-2 |
| Пропанол-1 | Пропанол-2 |
 |  |
Химические свойства пропанола-1
Спирты – органические вещества, молекулы которых содержат, помимо углеводородной цепи, одну или несколько гидроксильных групп ОН.
Химические реакции гидроксисоединений идут с разрывом одной из связей: либо С–ОН с отщеплением группы ОН, либо связи О–Н с отщеплением водорода. Это реакции замещения, либо реакции отщепления (элиминирования).
Свойства спиртов определяются строением связей С–О–Н. Связи С–О и О–Н — ковалентные полярные. При этом на атоме водорода образуется частичный положительный заряд δ+, на атоме углерода также частичный положительный заряд δ+, а на атоме кислорода — частичный отрицательный заряд δ–.
Такие связи разрываются по ионному механизму. Разрыв связи О–Н с отрывом иона Н + соответствует кислотным свойствам гидроксисоединения. Разрыв связи С–О соответствует основным свойствам и реакциям нуклеофильного замещения.
С разрывом связи О–Н идут реакции окисления, а с разрывом связи С–О — реакции восстановления.
Таким образом, для спиртов характерны следующие свойства:
|
1. Кислотные свойства пропанола-1
| Спирты – неэлектролиты, в водном растворе не диссоциируют на ионы; кислотные свойства у них выражены слабее, чем у воды. |
1.1. Взаимодействие с раствором щелочей
При взаимодействии спиртов с растворами щелочей реакция практически не идет, т. к. образующиеся алкоголяты почти полностью гидролизуются водой.
Равновесие в этой реакции так сильно сдвинуто влево, что прямая реакция не идет. Поэтому пропанол-1 не взаимодействует с растворами щелочей.
1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
Пропанол-1 взаимодействует с активными металлами (щелочными и щелочноземельными). При этом образуются алкоголяты. При взаимодействии с металлами спирты ведут себя, как кислоты.
| Например, пропанол-1 взаимодействует с калием с образованием пропилата калия и водорода . |
Алкоголяты под действием воды полностью гидролизуются с выделением спирта и гидроксида металла.
| Например, пропилат калия разлагается водой: |
СН3–CH2–CH2–OK + H2O → СН3–CH2–CH2–OH + KOH
2. Реакции замещения группы ОН
2.1. Взаимодействие с галогеноводородами
При взаимодействии спиртов с галогеноводородами группа ОН замещается на галоген и образуется галогеналкан.
| Например, пропанол-1 реагирует с бромоводородом. |
2.2. Взаимодействие с аммиаком
Гидроксогруппу спиртов можно заместить на аминогруппу при нагревании спирта с аммиаком на катализаторе.
| Например, при взаимодействии пропанола-1 с аммиаком образуется пропиламин. |
2.3. Этерификация (образование сложных эфиров)
Cпирты вступают в реакции с карбоновыми кислотами, образуя сложные эфиры.
| Например, пропанол-1 реагирует с уксусной кислотой с образованием пропилацетата (пропилового эфира уксусной кислоты): |
2.4. Взаимодействие с кислотами-гидроксидами
Спирты взаимодействуют и с неорганическими кислотами, например, азотной или серной.
| Например, при взаимодействии пропанола-1 с азотной кислотой образуется пропилнитрат. |
3. Реакции замещения группы ОН
В присутствии концентрированной серной кислоты от спиртов отщепляется вода. Процесс дегидратации протекает по двум возможным направлениям: внутримолекулярная дегидратация и межмолекулярная дегидратация.
3.1. Внутримолекулярная дегидратация
При высокой температуре происходит внутримолекулярная дегидратация и образуется соответствующий алкен.
| Например, из пропанола-1 под действием концентрированной серной кислоты при высокой температуре образуется пропилен: |
3.2. Межмолекулярная дегидратация
При низкой температуре происходит межмолекулярная дегидратация: ОН-группа в одной молекуле спирта замещается на группу OR другой молекулы. Продуктом реакции является простой эфир.
| Например, при дегидратации пропанола-1 при низкой температуре образуется дипропиловый эфир: |
4. Окисление спиртов
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
В зависимости от интенсивности и условий окисление можно условно разделить на каталитическое, мягкое и жесткое.
| Вторичные спирты окисляются в кетоны: в торичные спирты → кетоны |
Типичные окислители — оксид меди (II), перманганат калия KMnO4, K2Cr2O7, кислород в присутствии катализатора.
4.1. Окисление оксидом меди (II)
Cпирты можно окислить оксидом меди (II) при нагревании. При этом медь восстанавливается до простого вещества. Первичные спирты окисляются до альдегидов.
| Например, пропанол-1 окисляется оксидом меди до пропионового альдегида |
4.2. Окисление кислородом в присутствии катализатора
Cпирты можно окислить кислородом в присутствии катализатора (медь, оксид хрома (III) и др.). Первичные спирты окисляются до альдегидов.
| Например, при окислении пропанола-1 образуется пропаналь |
4.3. Жесткое окисление
При жестком окислении под действием перманганатов или соединений хрома (VI) первичные спирты окисляются до карбоновых кислот.
| При нагревании первичного спирта с перманганатом или дихроматом калия в кислой среде может образоваться также альдегид, если его сразу удаляют из реакционной смеси. |
| Например, при взаимодействии пропанола-1 с перманганатом калия в серной кислоте образуется пропионовая кислота |
4.4. Горение спиртов
Образуются углекислый газ и вода и выделяется большое количество теплоты.
| Например, уравнение сгорания пропанола-1: |
5. Дегидрирование спиртов
При нагревании спиртов в присутствии медного катализатора протекает реакция дегидрирования. При дегидрировании первичных спиртов образуются альдегиды.
| Например, при дегидрировании пропанола-1 образуется пропаналь. |
Получение пропанола-1
1. Щелочной гидролиз галогеналканов
При взаимодействии галогеналканов с водным раствором щелочей образуются спирты. Атом галогена в галогеналкане замещается на гидроксогруппу.
| Например, при нагревании 1-хлорпропана с водным раствором гидроксида натрия образуется пропанол-1 |
2. Гидрирование карбонильных соединений
Присоединение водорода к альдегидам протекает при нагревании в присутствии катализатора. При гидрировании альдегидов образуются первичные спирты.
НАПИШИТЕ УРАВНЕНИЕ РЕАКЦИЙ:СН3-С тройная связь СН+Br2 избыток -amp;gt;СН3-С тройная связь
НАПИШИТЕ УРАВНЕНИЕ РЕАКЦИЙ:
СН3-С тройная связь СН+Br2 излишек -gt;
СН3-С тройная связь СН+Н2 избыток -gt;
СН3-С тройная связь СН+Н2О -HgSo4gt;
СН3-С тройная связь СН+HCl избыток -gt;
напишите уравнение реакции последующего превращения, укажите условия проведения реакции:
С2Н5OH-gt; C2H4-gt; C2H4Br2-gt; C2H2-gt;C6H6
- Костя Кавнацкий
- Химия 2019-02-16 10:43:32 5 1
Тройная связь будет =- если что
CH3-C=-CH + 2Br2 = CH3-C(Br2)-CH(Br)2
CH3-C=-CH + 2H2 = CH3-CH2-CH3
CH3-C=-CH + H2O = CH3-C(=O)-CH3 (если что HgSO4-катализатор)
CH3-C=-CH + 2HCl = CH3-CH(Cl)-CH2(Cl)
CH3-CH2OH = CH2=CH2 (над = H2SO4, tgt;140)
CH2=CH2 + Br2 = CH2(Br)-CH2(Br)
CH2(Br)-CH2(Br) + KOHспирт = 2KBr + 2H2O + C2H2
3C2H2 = C6H6 (C, t=600)
http://chemege.ru/propanol/
http://obrazovalka.com/qa/ximiya/2784105-napishite-uravnenie-reakcijsn3-s-trojnaja-svjaz-snbr2izbytok-ampgtsn3-s-trojnaja-svjaz.html