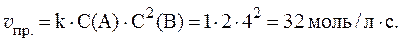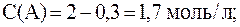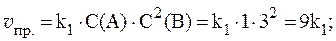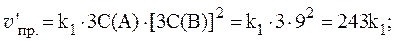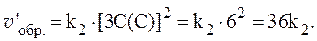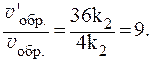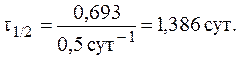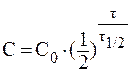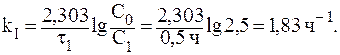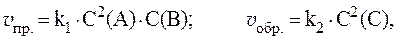В смеси газов реагирующих по уравнению
Репетитор по химии и биологии
Богунова В.Г.
100 баллов ЕГЭ по химии!
Первый МГМУ им. И.М. Сеченова
выпускница репетитора В.Богуновой
РГМУ по химии 2010
Диплом II степени
РНИМУ им. Н.И. Пирогова
выпускница репетитора В.Богуновой
Первый МГМУ им. И.М. Сеченова
выпускница репетитора В.Богуновой
МГМСУ, лечебный факультет
выпускник репетитора В.Богуновой
МГМСУ, лечебный факультет
выпускница репетитора В. Богуновой
Первый МГМУ им. И.М. Сеченова
выпускница репетитора В.Богуновой
МГМСУ им. А.И. Евдокимова
выпускница репетитора В.Богуновой
РНИМУ им. Н.И. Пирогова
выпускник репетитора В.Богуновой
Первый МГМУ им. И.М. Сеченова
выпускница репетитора В.Богуновой
МГМСУ им. А.И. Евдокимова
выпускница репетитора В. Богуновой
РНИМУ им. Н.И. Пирогова
выпускник репетитора В.Богуновой
МГМСУ им. А.И. Евдокимова
выпускник репетитора В.Богуновой
Секретная шпаргалка по химии
4.2 Состав смеси газов
Вы хотите познавать химию и профессионально, и с удовольствием? Тогда вам сюда! Автор методики системно-аналитического изучения химии Богунова В.Г. раскрывает тайны решения задач, делится секретами мастерства при подготовке к ОГЭ, ЕГЭ, ДВИ и олимпиадам
Команда «Газы!» была объявлена еще две недели назад. И что?! Легкие задачи решили и расслабились?! Или вы думаете, что задачи на газы касаются только 28-х заданий ЕГЭ?! Как бы не так! Если газов пока еще не было в 34-х заданиях, это ничего не значит! Задач на электролиз тоже не было в ЕГЭ до 2018 года. А потом как врезали, мама не горюй! Обязательно прочитайте мою статью «Тайны задач по химии? Тяжело в учении — легко в бою!» . В этой статье очень подробно рассказывается о новых фишках на электролиз. Статья вызвала шквал самых разных эмоций у преподавателей химии. До сих пор мне и пишут, и звонят, и благодарят, и бьются в конвульсиях. Просто цирк с конями, в котором я — зритель в первом ряду.
Однако, вернемся к нашим баранам, вернее, Газам. Я прошла через огонь и воду вступительных экзаменов и знаю точно — хочешь завалить абитуриента, дай ему задачу на Газы. Почитайте на досуге сборник задач И.Ю. Белавина. Я процитирую одну такую «мозгобойню», чтобы вам жизнь медом не казалась. Попробуйте решить.
И.Ю. Белавин, 2005, задача 229
Два из трех газов (сероводород, водород и кислород) смешали и получили газовую смесь, плотность которой оказалась равной плотности оставшегося газа. Полученную газовую смесь вместе с равным ей объемом третьего газа под давлением поместили в замкнутый сосуд емкостью 4 л, содержавший азот при н.у. и нагревали при 600 С до окончания химических реакций, затем постепенно охладили. Определите массы веществ, содержавшихся в сосуде после охлаждения, если плотность газовой смеси в сосуде перед нагреванием равнялась 9,25г/л. (Ответ: m(S) = 7,5 г, m(SO2) = 15 г, m(Н2О) = 9 г)
Ну как, решили? Нет?! А ваши репетиторы?! Извините, это был риторический вопрос. Кстати, мои ученики, абитуриенты 2003-2008 гг. такие задачи щелкали, как семечки, на экзаменах во 2-й медицинский (теперь РНИМУ им. Н.И. Пирогова). Надеюсь, вам понятно, что 34-м задачам ЕГЭ еще есть куда усложняться, perfectio interminatus est (нет предела совершенству), с газами нужно работать, работать и работать. Поэтому команду «Газы!» отменять рано. Итак, поехали!
Сегодня мы поговорим о газовых смесях, затронем понятие плотности газа (абсолютной и относительной), средней молярной массы, решим задачи: определение средней молярной массы и плотности газа по компонентам смеси и наоборот.
• Газовая смесь — смесь отдельных газов НЕ вступающих между собой в химические реакции. К смесям газов относятся: воздух (состоит из азота, кислорода, углекислого газа, водяного пара и др.), природный газ (смесь предельных и непредельных углеводородов, оксида углерода, водорода, сероводорода, азота, кислорода, углекислого газа и др.), дымовые газы (содержат азот, углекислый газ, пары воды, сернистый газ и др.) и др.
• Объемная доля — отношение объема данного газа к общему объему смеси, показывает, какую часть общего объема смеси занимает данный газ, измеряется в долях единицы или в процентах.
• Мольная доля — отношение количества вещества данного газа к общему количеству вещества смеси газов, измеряется в долях единицы или в процентах.
• Плотность газа (абсолютная) — определяется как отношение массы газа к его объему, единица измерения (г/л). Физический смысл абсолютной плотности газа — масса 1 л, поэтому молярный объем газа (22,4 л при н.у. t° = 0°C, P = 1 атм) имеет массу, численно равную молярной массе.
• Относительная плотность газа (плотность одного газа по другому) — это отношение молярной массы данного газа к молярной массе того газа, по которому она находится
• Средняя молярная масса газа — рассчитывается на основе молярных масс составляющих эту смесь газов и их объемных долей
Настоятельно рекомендую запомнить: средняя молярная масса воздуха Мср(в) = 29 г/моль , в заданиях ЕГЭ часто встречается.
Обязательно посетите страницу моего сайта «Изучаем Х-ОбХ-04. Закон Авогадро. Следствия из закона Авогадро. Нормальные условия. Молярный объем газа. Абсолютная и относительная плотность газа. Закон объемных отношений » и сделайте конспекты по теории. Затем возьмите бумагу и ручку и решайте задачи вместе со мной. Чует мое сердце, что ЕГЭ по химии устроит нам газовую атаку, а противогазы не выдаст!
Определить плотность по азоту газовой смеси, состоящей из 30% кислорода, 20% азота и 50% углекислого газа.
Вычислите плотность по водороду газовой смеси, содержащей 0,4 моль СО2, 0,2 моль азота и 1,4 моль кислорода.
5 л смеси азота и водорода имеют относительную плотность по водороду 12. Определить объем каждого газа в смеси.
Плотность по водороду пропан-бутановой смеси равна 23,5. Определите объемные доли пропана и бутана
Газообразный алкан объемом 8 л (н.у.) имеет массу 14,28 г. Чему равна его плотность по воздуху
Плотность паров альдегида по метану равна 2,75. Определите альдегид
Ну как? Пошло дело? Если туго, вернитесь к задачам и решайте их самостоятельно до тех пор, пока не щелкнет! А для стимуляции — десерт в виде еще одной задачи И.Ю. Белавина на газы. Наслаждайтесь ее решением самостоятельно!
И.Ю. Белавин, 2005, задача 202
Сосуд емкостью 5,6 л при н.у. заполнили метаном, затем нагрели до высокой температуры, в результате чего про-изошло частичное разложение метана. Определите массу образовавшейся сажи, если известно, что после приведения к нормальным условиям объем полученной газовой смеси оказался в 1,6 раза больше объема исходного метана, эта газовая смесь обесцвечивает бромную воду и имеет плотность по воздуху 0,2931. (Ответ: m(C) = 0,6 г)
Задачи И.Ю. Белавина — это крутой драйв! Попробуйте решить, и вы откажетесь от просмотра любых ужастиков, поскольку запасетесь адреналином надолго! Но нам нужно спуститься на землю к ЕГЭ, простому и надежному, как первый советский трактор. Кстати, у меня в коллекции припасено немало сюрпризов с газовыми фишками, собранными за все годы работы и бережно хранимыми. Думаю, пришло время сказать им: «И снова здравствуйте!», поскольку ЕГЭ с каждым годом становится «все чудесатее и чудесатее». Но это уже совсем другая история. Читайте мои статьи — и вы подстелите соломку под свою ЕГЭшную попу.
Вы готовитесь к ЕГЭ и хотите поступить в медицинский? Обязательно посетите мой сайт Репетитор по химии и биологии. Здесь вы найдете огромное количество задач, заданий и теоретического материала, познакомитесь с моими учениками, многие из которых уже давно работают врачами.
Полный каталог статей репетитора Богуновой В.Г. вы найдете на странице сайта Статьи репетитора
Подписывайтесь на видео-канал Репетитор по химии и биологии. Ежедневно появляются новые вебинары, видео-уроки, видео-консультации, видео-решения заданий ЕГЭ.
Урок химии в 11-м классе: «Решение задач с использованием газовых законов»
Разделы: Химия
РЕШЕНИЕ ЗАДАЧ С ИСПОЛЬЗОВАНИЕМ ГАЗОВЫХ ЗАКОНОВ
Урок химии в 11 классе
Цели урока: получить практические навыки применения газовых законов для решения химических задач,
установить межпредметные связи с физикой и экологией.
Тип урока: урок закрепления и обобщения изученного материала
Форма урока: практическое занятие
Основные методы: объяснительно-иллюстративный, метод проблемного изложения учебного материала, самостоятельная работа учащихся.
Средства обучения: справочный материал; тексты задач.
I. Блок мотивации и актуализации.
Постановка цели:
- Сегодня на занятии мы должны научиться решать конкурсные задачи с использованием газовых законов. Для этого придется вспомнить курс физики.
II. Блок изучения материала.
(весь изложенный ниже теоретический материал имеется у учащихся в виде карточек)
— Итак, какие газовые законы известны вам из курса физики?
(ученики называют законы, учитель записывает их на доске)
а) Закон Бойля-Мариотта
При постоянной температуре произведение давления газа на его объем есть величина постоянная, или объем газа обратно пропорционален давлению, при котором он находится.
б) Закон Гей-Люссака
При постоянном давлении изменение объема газа прямо пропорционально температуре.
в) Закон Шарля
При постоянном объеме давление прямо пропорционально температуре.
г) Объединенный газовый закон
д) Уравнение Клапейрона – Менделеева
Давайте более подробно рассмотрим уравнение Клапейрона – Менделеева и вспомним, что означают входящие в него величины
Вопрос учащимся: Что означает величина R?

Вопрос учащимся: Что означает величина 
— Это количество вещества.
Вопрос учащимся: В каких единицах измеряется количество вещества?
— Для измерения количества вещества используют особую величину “моль” . 1 моль содержит столько структурных частиц, сколько атомов углерода содержится в 12 г изотопа C12.
В 1 моль содержится примерно 
Вопрос учащимся: Как можно найти количество вещества?
— Для того, чтобы найти количество вещества, надо массу разделить на молярную массу:
Часто используют понятие молярного объема V(m), который равен объему одного моль вещества.
С использованием понятия молярного объема уравнение Клапейрона – Менделеева
может быть записано в виде:
— Теперь вспомним один из важнейших законов химии — Закон Авогадро.
е) Закон Авогадро
В равных объемах различных газов при одинаковых условиях содержится одинаковое число молекул.
Для химических расчетов применяют следствия из Закона Авогадро:
Следствие 1 Моль любого газа при нормальных условиях занимает один и тот же объем, равный приблизительно 22,4 л.
Вопрос учащимся: Какие параметры характеризуют состояние газа при нормальных условиях? ( ученики перечисляют, учитель записывает).
Нормальными условиями считаются: давление
Таким образом, в соответствии с законом Авогадро:
Вопрос учащимся: При решении задач часто приходится проводить расчеты для условий, отличающихся от нормальных. Как привести параметры газа к нормальным условиям?
Для приведения объема газа к нормальным условиям можно пользоваться объединенным газовым законом:


Масса одного и того же объема газа тем больше, чем больше масса его молекул. Если в равных объемах газов при одинаковых условиях содержится одинаковое число молекул, то очевидно, что отношение масс равных объемов газов будет равно отношению их молекулярных масс или отношению численно равных им молярных масс, то есть m1/m2 = M1/M2, где
m1 — масса объема первого газа,
m2 — масса такого же объема второго газа,
M1 — молярная масса первого газа,
M2 — молярная масса второго газа.
Отношение массы определенного объема одного газа к массе такого же объема другого газа, взятого при тех же условиях, называется относительной плотностью первого газа по второму (обозначается буквой — D).
Обычно плотность газов определяют по отношению к водороду M(H2) = 2 г/моль или к воздуху М(возд.) = 29 г/моль. В итоге получим: М = 2D (H2) и M = 29 D( возд.).
Таким образом, зная плотность газа по водороду или по воздуху, можно легко определить его молярную, а, следовательно, и относительную молекулярную массу и сформулировать II следствие из закона Авогадро.
Следствие 2 Относительная плотность газов – величина, показывающая, во сколько раз один газ тяжелее (легче) другого, т.е. равна отношению плотностей газов или молярных масс.
Молярная масса вещества (M), а значит, и относительная молекулярная масса (Mr) вещества в газообразном состоянии, численно равна удвоенной плотности паров этого вещества по водороду.
Измерения объемов газов обычно производят при условиях, отличных от нормальных.
Если мы рассматриваем смесь газов, необходимо использовать закон Дальтона
ж) Закон Дальтона (для газовой смеси)
Общее давление газовой смеси равно сумме парциальных давлений газов, входящих в эту смесь:
Пояснение. В некоторых текстах задач встречаются внесистемные единицы измерений различных величин; необходимо уметь их переводить в систему СИ.
Внесистемные единицы давления: 1 атм.=101325 Па; 1 мм рт. ст. = 133,3 Па.
Перевод температуры:
T — температура по шкале Кельвина, t 0 C — температура по шкале Цельсия.
— Итак, мы повторили основные теоретические положения и сейчас перейдем к практике и научимся решать задачи этого типа. У Вас на столах находятся тексты задач – разбираем 1-ю задачу.
I этап
(учитель сам решает с объяснением задачу у доски)
Задача 1.
Какой объем (н.у.) займут 0,4•10 -3 м 3 газа, находящегося при 50 о С и давлении 0,954•10 5 Па?
Учитель записывает на доске, ученики в тетради условие:
| Дано V = 0,4•10 -3 м 3 t = 50 o C; T=323 К P=0,954•10 5 Па V0 — ? | Решение Для приведения объема газа к н.у. используем  |
Отсюда 
(текст задачи читают сами учащиеся, записывают условие задачи в тетрадь; учитель комментирует решение, записывая его на доске)
Масса 0,327•10 -3 м 3 газа, при 13 о С и давлении 1,04•10 5 Па равна 0,828•10 -3 кг. Вычислить молярную массу газа.
(Учитель предлагает составить план решения данной задачи; опрашивает 2-3 учеников, затем решает задачу на доске с их помощью).
t = 50 o C; T=323 К
P=0,954•10 5 Па
Для решения задачи применим уравнение Клапейрона – Менделеева
Задача 3, аналогичная предыдущей; дается время (3-5 минут), чтобы все решали на местах. Для выполнения задания учитель вызывает сильного ученика, чтобы он объяснил у доски решение данной задачи.
Задача 3.
Определить молярную массу ацетона, если он в парообразном состоянии при температуре 87 о С и давлении 720 мм рт. ст. занимает объем 0,5 л навеска взятого вещества 0,93 г.
Ответ:
Решение этой задачи аналогично решению предыдущей. Особенностью является необходимость перевода давления из мм рт. ст. в Паскали.
Предлагаются тексты задач по мере их усложнения. Каждый решает индивидуально. Учитель наблюдает, как учащиеся справляются с заданиями. Первый решивший выписывает на доске свое решение и комментирует его.
225 г паров хлорбензола, находясь при температуре 25 о С в резервуаре на 10 л, создают давление в 0,51 МПа. Оцените отклонение состояния этих паров от идеального газа. Чем можно объяснить такое отклонение?
V = 10 л =10 -2 м 3 t = 25 o C; T=298 К М=142,5•10 -3 кг/моль
P=5,1•10 5 Па
По данным задачи определяем, какое могло бы быть давление идеального газа при тех же условиях, и сравниваем с давлением реального газа
Подставляем значения величин данные в условии задачи.

III. Блок подведения итогов и рефлексии
Сегодня на уроке мы вспомнили основные газовые законы, их математические выражения, единицы измерения, потренировались на конкретных примерах в решении задач на газовые законы, в основном на уравнение Клапейрона – Менделеева. На следующем занятии мы разберем задачи на смеси газов.
IV.Домашнее задание:
Повторить основные газовые законы, решить задачу однотипную с разобранной на уроке.
- Задачи для самостоятельной работы типовые и нестандартные можно найти в приложении 1. Там же представлены решения пяти различных по сложности задач
При подготовке к уроку была использована литература:
- Архангельская О.В. Использование универсальной газовой постоянной при решении
задач //Химия в школе — 1994, №2, с. 51-53.
Кузьменко Н.Е., Еремин В.В., Попков В.А. Начала химии. Современный курс для
Эталоны решения задач
1. В сосуде смешали газ А количеством вещества 4,5 моль и газ В количеством вещества 3 моль. Газы А и В реагируют в соответствии с уравнением А + В = С. Через некоторое время в системе образовался газ С количеством вещества 2 моль. Какие количества непрореагировавших газов А и В остались в системе?
Из уравнения реакции следует, что:
Dn(A) = Dn(B) = Dn(C) = 2 моль,
где Dn ‑ изменение количества вещества в ходе реакции.
Следовательно, в сосуде осталось:
2. Реакция протекает по уравнению: 2A + B ⇄ C и имеет второй порядок по веществу А и первый по веществу B. В начальный момент времени скорость реакции равна 15 моль/л×с. Рассчитать константу скорости и скорость прямой реакции в тот момент, когда прореагирует 50% вещества B, если начальные концентрации равны: С(A) = 10 моль/л; С(B) = 5 моль/л. Как изменится скорость химической реакции?
Согласно закону действующих масс:

С(B), вступившего в реакцию, равна:
С(B) = 0,5·5 = 2,5 моль/л.
Соответственно С(A), вступившего в реакцию, равна:
2 моль/л A — 1 моль/л B
С(A) и С(B) после протекания реакции:
С(A) = 10 — 5 = 5 моль/л,
С(B) = 5 — 2,5 = 2,5 моль/л.
Скорость прямой реакции будет равна:
Скорость химической реакции изменится:
т. е. уменьшится в 8 раз.
3. Реакция между веществами А и В выражается уравнением: А + 2В = С и имеет первый порядок по веществу А и второй по веществу B. Начальные концентрации веществ равны: С(А) = 2 моль/л; С(В) = 4 моль/л; константа скорости равна 1,0. Найти начальную скорость реакции и скорость по истечении некоторого времени, когда концентрация вещества А уменьшится на 0,3 моль/л.
Согласно закону действующих масс:
Если концентрация вещества А уменьшится на 0,3 моль/л, то концентрация вещества В уменьшится на 0,3×2 = 0,6 моль/л. После протекания реакции концентрации равны:
4. Скорости прямой и обратной газофазных реакций, протекающих в замкнутом сосуде, выражаются уравнениями:
Рассчитать, как изменятся скорости прямой и обратной реакций при увеличении давления в системе в 3 раза, если исходные концентрации веществ равны: С0(A) = 1 моль/л; С0(B) = 3 моль/л; С0(C) = 2 моль/л.
Согласно закону действующих масс, скорости прямой и обратной реакций при начальных условиях равны:
Увеличение давления в 3 раза для газообразных систем приводит к уменьшению объема газовой смеси в 3 раза, во столько же раз увеличатся концентрации всех трех газов, и скорости обеих реакций станут соответственно равны:
Отношения скоростей реакций составляют:
Таким образом, скорость прямой реакции увеличится в 27 раз, обратной — в 9.
5. Реакция при температуре 50 0 С протекает за 2 мин 15 с. За какое время закончится эта реакция при температуре 70 0 С, если в данном температурном интервале температурный коэффициент скорости gравен 3?
При увеличении температуры от 50 до 70 0 С скорость реакции в соответствии с правилом Вант-Гоффа возрастает:
где 
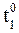


т.е. скорость реакции увеличивается в 9 раз.
В соответствии с определением, время реакции обратно пропорционально скорости протекания реакции, следовательно:
где 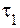

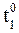

Учитывая, что 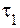

6. Во сколько раз увеличится скорость химической реакции при повышении температуры от 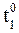

Из правила Вант-Гоффа:
Скорость реакции увеличится в 128 раз.
7. При изучении кинетики выведения лекарственного препарата из организма больного было установлено, что за 3 часа в организме пациента осталось 50% от исходного количества лекарственного средства. Определить период полувыведения и константу скорости реакции выведения препарата из организма человека, если известно, что это реакция первого порядка.
Так как за данный промежуток времени из организма было выведено 50% препарата, то t1/2 = 3 часа. Константу скорости реакции рассчитаем из уравнения:
8. При лабораторных исследованиях водных растворов лекарственного средства было установлено, что вследствие гидролиза концентрация препарата за сутки уменьшилась от 0,05 моль/л до 0,03 моль/л. Вычислить период полупревращения реакции гидролиза препарата.
Так как реакции гидролиза обычно протекают при значительном избытке воды, то ее концентрацию можно постоянной. Следовательно, в ходе реакции изменяется только концентрация препарата и реакцию гидролиза можно считать реакцией первого порядка.
Значение константы скорости реакции найдем из уравнения:
9. Период полувыведения препарата из организма больного (реакция первого порядка) равен 5 часам. Определить время, за которое из организма будет выведено 75% препарата.
При выведении из организма 75% препарата отношение С/С0 составит 0,25. В данном случае удобно воспользоваться формулой:
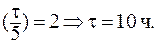
10. Константа скорости реакции гидролиза сахарозы равна 2,31×10 — 3 ч — 1 . Рассчитать:
1) период полупревращения реакции;
2) время, за которое гидролизу подвергнется 20% сахарозы;
3) какая часть глюкозы подвергнется гидролизу через 5 суток.
1. Период полупревращения равен:
2. После того, как гидролизу подвергнется 20% сахарозы, отношение С/С0 составит 0,8. Следовательно:
3. Через 5 суток (120 часов) отношение С/С0 составит:
Следовательно, гидролизу подверглось 24% глюкозы.
11. В ходе некоторой реакции первого порядка за 30 мин превращению подвергается 60% исходного количества вещества. Определить, какая часть вещества останется через 1 час.
1. Через 30 минут количество оставшегося вещества составит:
2. Найдем константу скорости реакции:
3. Количество вещества С2, оставшееся через 1 час, определим по формуле:
Таким образом, через 1 час останется 16% от исходного вещества.
Вопросы для самоконтроля
1. Что называется скоростью химической реакции?
2. Что называется истинной скоростью гомогенной реакции?
3. Какова размерность скорости гомогенной реакции?
4. Что называется скоростью гетерогенной реакции?
5. Какова размерность скорости гетерогенной реакции?
6. Перечислите факторы, влияющие на скорость реакции.
7. Сформулируйте закон действующих масс.
8. Каков физический смысл константы скорости реакции? От чего зависит и от чего не зависит константа скорости реакции?
9. Что называется порядком реакции? Приведите примеры уравнений реакций нулевого, первого, второго и третьего порядков.
10. Зависит ли размерность константы скорости реакции от порядка реакции?
11. Что называется молекулярностью реакции?
12. По какой формуле можно рассчитать период полупревращения реакции первого порядка?
13. Дайте определение простым и сложным реакциям. Приведите классификацию сложных реакций.
14. Сформулируйте правило Вант-Гоффа. Приведите математическое выражение правила Вант-Гоффа.
15. Как скорость реакции зависит от энергии активации? Напишите уравнение Аррениуса.
16. Что такое активированный комплекс? Почему протекание реакций протекает через стадии образования активированных комплексов?
17. Что называется катализатором? Гомогенный и гетерогенный катализ. Почему в присутствии катализаторов реакции протекают быстрее?
18. Что такое ферментативный катализ? Напишите уравнение Михаэлиса-Ментен.
Варианты задач для самостоятельного решения
Вариант № 1
1. Реакция между веществами А и В выражается уравнением 2А + В = С и имеет второй порядок по веществу А и первый по веществу B. Начальные концентрации веществ равны: С0(А) = 0,4 моль/л; С0(В) = 0,8 моль/л; k = 0,6. Найти начальную скорость реакции и скорость по истечении некоторого времени, когда концентрация вещества А уменьшится на 0,2 моль/л.
2. На сколько градусов необходимо повысить температуру, чтобы скорость реакции увеличилась в 64 раза? Температурный коэффициент скорости реакции gравен 2.
3. Как изменятся скорости прямой и обратной реакций, протекающих в газовой фазе и подчиняющихся уравнениям:
а) при увеличении давления в системе в 2 раза?
б) при увеличении объемов газов в 2 раза?
Вариант №2
1. Реакция протекает по уравнению: A + B = C и имеет первый порядок по веществу А и по веществу B. Концентрацию A увеличили с 2 до 8 моль/л, а концентрацию B с 3 до 9 моль/л. Во сколько раз возросла скорость прямой реакции?
2. При 150 0 С реакция заканчивается за 10 минут. Принимая температурный коэффициент gравным 2, рассчитайте, через сколько минут закончилась бы реакция при 170 0 C.
3. Скорость реакции выражается уравнением: 
Вариант №3
1. Реакция выражается уравнением: A + B = C и имеет первый порядок по веществу А и по веществу B. При начальных концентрациях С0(A) = 3 моль/л и С0(B) = 5 моль/л скорость прямой реакции равна 0,3 моль/л×с. Определить константу скорости и скорость реакции через некоторое время, когда концентрация A уменьшится на 2 моль/л.
2. Во сколько раз увеличится скорость химической реакции при повышении температуры от 10 до 70 0 С, если температурный коэффициент скорости gравен 2?
3. Скорость реакции A(тв) + 2B(газ) = C(тв) выражается уравнением: 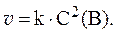
1. Реакция протекает по уравнению: 2A + B = 2C и имеет второй порядок по веществу А и первый по веществу B. Рассчитать скорость прямой реакции в тот момент, когда прореагирует 40% вещества B, если начальные концентрации равны: С0(А) = 8 моль/л; С0(B) = 4 моль/л; k = 0,4.
2. Некоторая реакция при 100 0 С заканчивается за 5 мин. За какое время она закончится при 80 0 С, если температурный коэффициент скорости g равен 3?
3. Скорость реакции 3A + B = C выражается уравнением: 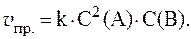
а) при увеличении концентрации вещества A в 2 раза?
б) при одновременном уменьшении концентрации исходных веществ в 2 раза?
Вариант №5
1. Скорость некоторой реакции при повышении температуры с 40 до 70 0 С увеличилась в 8 раз. Определить величину g.
2. Реакция протекает по уравнению: A + 3B = 2C и имеет первый порядок по веществу А и второй по веществу B. Начальные концентрации веществ равны: С0(A) = 2 моль/л; С0(B) = 6 моль/л; k = 1. Рассчитать начальную скорость прямой реакции и скорость в тот момент, когда концентрация вещества A уменьшилась на 1 моль/л. Как изменится скорость химической реакции?
3. Как изменятся скорости прямой и обратной реакций, протекающих в газовой фазе и подчиняющихся уравнениям:
при изотермическом увеличении давления в 2 раза?
Вариант №6
1. В закрытом сосуде находится смесь газов, состоящая из 1 моль A и 3 моль B, которая реагирует по уравнению: A + 3B = 2C. Скорость прямой реакции описывается уравнением 
2. На сколько градусов надо увеличить температуру, чтобы скорость реакции возросла в 9 раз, если температурный коэффициент скорости g равен 3?
3. Как изменится скорость прямой газофазной реакции: 2A = B, порядок которой оценивается как 0,5, при изотермическом уменьшении давления в системе в 3 раза?
Вариант №7
1. Реакция между веществами А и В протекает по уравнению: A + 2B = C и имеет первый порядок по веществу А и по веществу В. Начальные концентрации реагирующих веществ составили: С0(A) = 1,5 моль/л; С0(B) = 3 моль/л; k = 0,4. Вычислить скорость химической реакции в начальный момент времени и по истечении некоторого времени, когда прореагирует 75% А.
2. Чему равен температурный коэффициент скорости g, если при увеличении температуры на 30 0 С скорость реакции возрастает в 27 раз?
3. Как изменятся скорости прямой и обратной реакций, протекающих в газовой фазе и подчиняющихся уравнениям:
при изотермическом увеличении давления в 2 раза?
Вариант №8
1. В растворе объемом 1 л, содержащем 1 моль вещества A и 2 моль вещества B, протекает реакция: A + 3B = 2C + D. Прямая реакция имеет первый порядок по веществу А и второй по веществу B. Во сколько раз уменьшится скорость прямой реакции после того, как прореагируют 0,65 моль вещества A?
2. При повышении температуры от -5 до +5 0 С скорость бактериального гидролиза (ферментативный процесс) увеличивается в 4 раза. Найти значение температурного коэффициента скорости реакции g.
3. Во сколько раз следует увеличить концентрацию вещества A в системе 2A(газ) = B(газ) + C(тв.), чтобы скорость прямой реакции, которая является реакцией второго порядка, увеличилась в 4 раза?
Вариант №9
1. Реакция протекает по уравнению: 2A + B = 2C и имеет второй порядок по веществу А и первый по веществу B. Скорость прямой реакции равна 8 моль/л×с. Рассчитать константу скорости и скорость прямой реакции в тот момент, когда прореагирует 30% вещества B, если начальные концентрации равны: С0(A) = 2 моль/л; С0(B) = 1 моль/л. Как изменится скорость химической реакции?
2. При увеличении температуры от 10 до 50 0 С скорость реакции увеличилась в 16 раз. Определить температурный коэффициент скорости g.
3. Реакция протекает по уравнению: A + B = C + D + E и имеет первый порядок по веществу А и нулевой по веществу B. Как изменится скорость прямой реакции после разбавления реагирующей смеси в 3 раза?
Вариант №10
1. Реакция протекает по уравнению: A + 2B = AB2 и имеет первый порядок по веществу А и второй по веществу B. Константа скорости реакции равна 0,01. Рассчитать скорость реакции при начальных концентрациях: С0(A) = 0,8 моль/л; С0(B) = 0,8 моль/л и скорость реакции к моменту образования 0,2 моль/л вещества АВ2.
2. Во сколько раз увеличится скорость химической реакции при повышении температуры от 30 до 60 0 С, если температурный коэффициент скорости g равен 3?
3. Период полувыведения препарата из организма больного (реакция первого порядка) равен 6 часам. Определить, за какое время содержание препарата в организме человека уменьшится в 8 раз.
Вариант №11
1. Реакция протекает по уравнению: A + B = 2C и имеет первый порядок по веществу А и по веществу B. Начальные концентрации веществ равны: С0(A) = 0,3 моль/л; С0(B) = 0,5 моль/л; k = 0,1. Найти начальную скорость реакции и скорость реакции по истечении некоторого времени, когда концентрация А уменьшится на 0,1 моль/л.
2. При 100 0 С некоторая реакция заканчивается за 16 минут. Принимая температурный коэффициент скорости g равным 2, рассчитать, через сколько минут закончилась бы эта же реакция при 140 0 С?
3. Период полувыведения препарата из организма больного (реакция первого порядка) равен 2 часам. Определить время, за которое из организма будет выведено 99% препарата.
Вариант №12
1. Реакция протекает по уравнению: A + 2B = C и имеет первый порядок по веществу А и второй по веществу B. Начальные концентрации веществ равны: С0(A) = 0,9 моль/л; С0(B) = 1,5 моль/л; k = 0,6. Найти начальную скорость реакции и скорость по истечении некоторого времени, когда израсходуется 50% вещества A.
2. Чему равен температурный коэффициент скорости химической реакции g, если при увеличении температуры на 30 0 С скорость возрастает в 27 раз?
3. Период полупревращения некоторой реакции первого порядка равен 30 мин. Рассчитать, какая часть от исходного количества останется через 1 час.
Вариант №13
1. Реакция протекает по уравнению: 2A + B = 2C и имеет второй порядок по веществу А и первый по веществу B. Константа скорости реакции равна 5×10 — 2 . Рассчитать скорость реакции при начальных концентрациях С0(A) = 0,4 моль/л; С0(B) = 0,9 моль/л и скорость реакции к моменту образования 0,1 моль вещества С.
2. При температуре 10 0 С реакция протекает за 80 минут. При какой температуре реакция закончится за 20 минут, если температурный коэффициент скорости gравен 2?
3. В ходе лабораторных исследований было установлено, что за сутки концентрация препарата в организме больного снизилась от 0,1 моль/л до 0,02 моль/л. Вычислить период полуэлиминации препарата, считая, что данная реакция первого порядка.
Вариант №14
1. В закрытом сосуде объемом 1 л находится смесь газов, состоящая из 1 моль газа A и 3 моль газа B, которая реагирует по уравнению: A + 3B = 2C. Прямая реакция имеет первый порядок по веществу А и второй по веществу B. Как изменится скорость прямой реакции после того, как прореагирует 0,5 моль газа A?
2. При увеличении температуры системы от 10 до 50 0 С скорость химической реакции увеличилась в 16 раз. Определить температурный коэффициент скорости реакции g.
3. Во время аварии на Чернобыльской АЭС (1986 г.) произошел выброс радионуклида Cs-137, период полураспада которого составляет 30 лет. Рассчитать, какая часть попавшего в организм радионуклида осталась в настоящее время.
Вариант № 15
1. Реакция протекает по уравнению: A + B = C имеет первый порядок по веществу А и по веществу B. При начальных концентрациях веществ С0(A) = 0,6 моль/л; С0(B) = 0,8 моль/л скорость реакции равна 0,03 моль/л×с. Определить константу скорости и скорость реакции через некоторое время, когда концентрация вещества A уменьшится на 0,3 моль/л.
2. Скорость реакции при 0 0 С равна 1 моль/л×с. Вычислить скорость этой реакции при 30 0 С, если температурный коэффициент скорости реакции равен 3.
3. Константа скорости гидролиза пестицида при 25 0 С равна 0,32 с — 1 . Исходная концентрация пестицида в пробе составила 2,5 моль/л. Рассчитать, за какое время концентрация пестицида снизится до 0,01 моль/л.
Вариант №16
1. Реакция разложения протекает по уравнению: 2A = 2B + C и имеет второй порядок по веществу А. Константа скорости данной реакции при 200 0 С равна 0,05. Начальная концентрация С(A) = 2 моль/л. Определить скорость реакции при указанной температуре в начальный момент и в тот момент, когда разложится 80% вещества A.
2. Как изменится скорость прямой реакции: 2A(тв) + 3B(газ) = 2С(тв), которая имеет нулевой порядок по веществу А и третий по веществу B, если давление в системе увеличить в 3 раза?
3. В ходе некоторой реакции первого порядка за 45 мин превращению подвергается 20% исходного количества вещества. Определить, какая часть вещества останется через 1,5 часа.
Вариант №17
1. Взаимодействие газов протекает по уравнению: A + 2B = 2C и имеет первый порядок по веществу А и второй по веществу B. Начальные концентрации газов равны: С0(A) = 2 моль/л; С0(B) = 4 моль/л; k = 0,02. Вычислить скорость прямой реакции в начальный момент времени и по истечении некоторого времени, когда прореагирует 50%вещества A.
2. При 20 0 С реакция протекает за 2 мин. За какое время будет протекать эта же реакция при 0 0 С, если g = 2?
3. Муравьиная кислота разлагается на оксид углерода (IV) и водород на поверхности золота. Константа скорости этой реакции при 140 0 С равна 5,5×10 — 4 мин –1 , а при 185 0 С составляет 9,2×10 — 3 мин –1 . Определить энергию активации данной реакции.
Вариант №18
1. Реакция протекает по уравнению: 2A + B = 2C и имеет первый порядок по веществу А и по веществу B. Скорость реакции 0,5 моль/л×с. Начальные концентрации веществ равны: С(A) = 6 моль/л; С(B) = 3 моль/л. Определить константу скорости данной реакции и скорость реакции через некоторое время, когда концентрация вещества B уменьшится на 1 моль/л.
2. При 20 0 С реакция протекает за 2 мин. За сколько времени будет протекать эта же реакция при 50 0 С, если g = 2?
3. Константа скорости реакции инверсии тростникового сахара при 25 0 С равна 9,67×10 — 3 мин — 1 , а при 40 0 С составляет 73,4×10 — 3 мин –1 . Определить энергию активации данной реакции в указанном интервале температур.
http://urok.1sept.ru/articles/211588
http://mydocx.ru/12-66543.html





m.jpg)
m.jpg)
m.jpg)

m.jpg)
m.jpg)
m(2).jpg)
_m.jpg)


m.jpg)
_m.jpg)


_01.jpg)
_02.jpg)
_03.jpg)
_04.jpg)
_1.jpg)
_2.jpg)
_3.jpg)
_4.jpg)
_5.jpg)
_6.jpg)