8. В 730 г 12%-ной соляной кислоты растворили 33,6 л хлороводорода. Найдите массовую долю хлороводорода в полученном растворе. Ответ: 18,14%.

задача №8
к главе «Глава 4. Вещества и их свойства. §20. Кислоты органические и неорганические».
Выделите её мышкой и нажмите CTRL + ENTER
Большое спасибо всем, кто помогает делать сайт лучше! =)
Нажмите на значок глаза возле рекламного блока, и блоки станут менее заметны. Работает до перезагрузки страницы.
Реакция металлов с соляной кислотой: признак взаимодействия цинка, железа и меди
Известно доказанный факт, что соляная кислота взаимодействует с активными металлами. При этом часть веществ способна реагировать на такое соединение, другая часть остается нетронутой.
Неактивные металлы не могут реагировать на вещество: к ним относят золото, серебро, ртуть.
Соляная кислота представляет собой соединение хлора и водорода. Путем растворения в воде газообразного вещества под названием хлороводород получается данное соединение.
Ионы водорода при таком уравнении исполняют роль окислителя, что вызывает реакцию у активных металлов.
Какие вещества вступают в реакцию с соляной кислотой
На вступительных экзаменах по химии часто можно встретить задание на определение веществ, которые способны реагировать на соляную кислоту.
Кроме того, задание «составьте уравнение» нередко вызывает страх в глазах выпускников.
Чтобы не путаться с химическими задачами, рекомендуется подробнее изучить информацию о взаимодействии с данным соединением.
Все существующие вещества можно поделить на металлы, вытесняющие водород из соединения, не вытесняющие водород, а также активные и неактивные металлы.
В реакцию с соляной кислотой вступают такие вещества:
- Химические основания. Соляная кислота способна нейтрализовать основания. Как известно, они состоят из атома металла, на который и воздействует кислота.
К ним относят гидроксид натрия, бария, алюминия. Реакция нейтрализации дает образования соли и воды.
Металлы. Если обратиться к электрохимическому ряду, можно увидеть, что соляная кислота реагирует со всеми элементами, стоящими до водорода в этом ряду.
Сюда относят натрий, магний, алюминий, литий, барий, кальций, цинк, железо и другие элементы. При взаимодействии они образуют хлориды и выделяют газообразный водород.
Из него следует, что выделяется углекислый газ, а также образуется вода и угольная кислота.
Признак взаимодействия с цинком, железом и другими металлами
Если курс школьной химии был успешно забыт, можно вспомнить о том, какие бывают признаки взаимодействия металлов, вступающих в реакцию с соляной кислотой.
Чтобы экспериментальные опыты не вызвали несчастного случая, рекомендуется заранее открыть все окна, вооружиться защитной одеждой, чтобы кожа рук была закрыта.
Также рекомендуется использовать перчатки и повязку на лицо.
Обратите внимание! Ниже будет рассказано о том, какие признаки говорят о вступлении в реакцию элементов с соединением.
Чтобы не проводить наглядные опыты, можно воспользоваться теоретической информацией.
Рассмотрим, что происходит, если добавить немного кислоты на определенный вид металла:
| Металл | Признак взаимодействия |
| Цинк | Если опустить этот металл серебристого цвета в пробирку с указанным веществом, можно постепенно наблюдать выделение небольшого количества пузырьков и водорода. |
В результате возникает хлорид цинка ZnCl₂
Реакция происходит медленно, однако, если пробирку подогреть, то процесс пойдет быстрее
На поверхности этого металла, относящегося к щелочной группе, можно увидеть маленькие пузыри
Также выделяется газообразный водород. Такая реакция происходит при условии нагревания до 350 градусов, а в качестве катализатора выступает медь
Как составить уравнение реакции
Одно из самых распространенных заданий на экзаменах и в контрольных работах – составить уравнение на реакцию HCl, в данном случае – соляной, с другими веществами или соединениями.
Чтобы не запутаться в решении, предлагаем несколько советов и шпаргалок для легкого запоминания:
- Запомните буквенное обозначение данного вещества – соляная кислота в химии обозначается как HCl: если вещество разбавленное, это указывается в скобках рядом.
- Как уже было сказано выше, вещество способно реагировать с активными металлами, стоящими до водорода в электрохимическом ряду; кроме того, она реагирует на основания, оксиды, гидроксиды и карбонаты.
- Химические основания обозначаются как OH, оксиды – O, гидроксиды – OH2, карбонаты – CO3.
- Уравнение реакции всегда будет иметь знак +, потому как в процессе взаимодействия происходит соединение нескольких компонентов.
- HCl может идти первым или вторым слагаемым, после прибавления металла, вещества идет знак =, после этого описывается реакция, где указаны продукты распада.
- Например, при реакции кислоты серы с сульфатом магния получается такое уравнение: Mg+H2SO4 = MgSO4+H2.
- Соляная кислота и гидроксид бария дают такое уравнение: 2HCl + Ba(OH)2 = BaCl2 + 2H2O.
- При реакции соединения водорода, хлора и мела образуется хлорид кальция: СаСО3 + 2HCl = CaCl2 + СО2 + Н2О.
- Раствор карбоната натрия с кислотой выглядит так: HCl+Na2CO3=2NaCl+H2O+CO2.
Составить уравнение несложно, важно изначально правильно обозначить буквенные символы каждого элемента или вещества.
Для правильного уравновешивания формулы пользуются правилами школьного курса химии, основанными на математическом принципе расстановки коэффициентов.
Полезное видео
Готовые домашние задания, готовые задачи по химии и биологии
Характеристика сульфидов. Задачи 851 — 854
Свойства и получение сульфидов
Задача 851.
Почему сульфид цинка растворяется в соляной кислоте, а сульфид меди нет? В какой кислоте можно растворить сульфид меди?
Решение:
Взаимодействие сульфида цинка с соляной кислотой выражается уравнением:
ZnS(к) + 2HCl ↔ ZnCl2 + H2S(г)
ZnS + 2H + ↔ Zn 2+ + H2S
Присутствие в числе исходных веществ малорастворимого электролита ZnS, при образовании которого связываются ионы S 2- , обуславливает протекание реакции влево. С другой стороны, при образовании слабого электролита H2S также связываются ионы S 2- , способствующие протеканию реакции вправо. Таким образом, ионы S 2- участвуют в двух процессах, приводящих к установлению двух равновесий:
S 2- + Zn 2+ ↔ ZnS(к);
S 2- + 2Н + ↔ Н 2 S(г).
Протекание того или иного процесса зависит от того, какое из двух веществ – сероводород или сульфид цинка – в большей степени связывает ионы S 2- . Константа диссоциации H2S (K = K1 . K2 = 6 . 10 -22 ), произведение растворимости ZnS равно 1,3 . 10 -23 . Из чего вытекает, что связывание ионов S 2- в молекулы H2S происходит полнее, чем в ZnS. Поэтому рассматриваемая реакция протекает вправо – сульфид цинка растворяется в соляной кислоте. Аналогично два равновесия устанавливаются в системе CuS—HCl:
S 2- +Cu 2+ ↔ CuS(к);
S 2- + 2Н + ↔ Н2S(г).
Но произведение растворимости CuS равно 3,2 . 10 -38 , что меньше, чем 6 . 10 -22 . Поэтому связывание ионов S 2- в CuS происходит полнее, чем в молекулах H2S и, равновесие в системе:
сместится влево; сульфид меди не растворим в растворе соляной кислоты. Следовательно, сульфид меди растворится в растворе той кислоты, суммарная константа диссоциации которой будет иметь меньшее численное значение, чем ПР(CuS), например, ортокремниевая кислота H4SiO4 численное значение К = К1 . К2 . К3 . К4 = 8 . 10 -48 .
Задача 852.
Каковы продукты реакции взаимодействия хлорида железа (III): а) с сероводородом; б) с сульфидом аммония?
Решение:
а) Хлорид железа (III) и сероводород реагируют с образованием хлорида железа (II), серы и хлороводорода:
Данная реакция протекает по окислительно-восстановительному механизму, где роль окислителя играет FeCl3, а восстановителя – H2S.
б) Между хлоридом железа (III) и сульфидом аммония протекает реакция по обменному механизму с образованием сульфида железа (III) и хлорида аммония:
Задача 853.
Объяснить, почему ZnS и РbS можно получить обменной реакцией в водном растворе, а Al2S3 и Cr2S3 нельзя. Указать способ получения Al2S3 и Cr2S3.
Решение:
Малорастворимые сульфиды металлов можно осадить из растворов солей действием сероводорода или сульфида аммония:
Являясь солями слабой кислоты, растворимые сульфиды подвергаются гидролизу. Гидролиз сульфидов, содержащих элементы в высоких степенях окисления Al2S3 и Cr2S3 и др.), часто идет до конца, он необратим. Поэтому Al2S3 и Cr2S3 нельзя получить обменной реакцией в водном растворе. Обычно для их получения используют сплавление метала с серой в отсутствие кислорода и влаги:
2Al + 3S 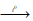
2Cr + 3S 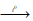
Сульфид хрома поучают:
Сплавление оксида хрома(III) с сероводородом:
2Cr2O3 + 9S 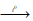
Пропускание сероводорода через нагретый оксид хрома(III):
Cr2O3 + 3H2S 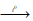
Задача 854.
Какова реакция среды в растворах: а) Na2S; 6) (NH4)2S; в) NaНS?
Решение:
а) Na2S – соль сильного основания и слабой кислоты, гидролизующаяся по аниону:
Na2S ↔ 2Na + + S 2- ;
S 2- + H2O ↔ HS — + OH — (ионно-молекулярная форма);
Na2S + H2O ↔ NaHS + NaOH (молекулярная форма).
Гидролиз преимущественно протекает по первой ступени, при этом образуется избыток ионов ОН — , которые придают раствору соли щелочную среду, рН > 7.
б) (NH4)2S – соль слабого однокислотного основания и слабой двухосновной кислоты, гидролизуется как по катиону, так и по аниону:
(NH4)2S ↔ 2NH4 + + S 2- ;
NH4 + + H2O ↔ NH4OH + H + (ионно-молекулярная форма);
S 2- + H2O ↔ HS — + NH4OH (ионно-молекулярная форма).
При гидролизе солей, образованных слабым основанием и слабой кислотой в растворе образуются в избытке как ионы Н + так и ионы ОН — , которые взаимодействуя друг с другом образуют Н2О:
Н + + ОН — ↔ Н2О
Казалось бы, реакция среды должна быть нейтральной по причине образования воды, но, на самом деле, реакция среды бывает или слабокислой, или слабощелочной, что зависит от силы кислоты и основания, образующие соль. Так, если КD основания меньше, чем KD кислоты, то гидролиз соли будет преимущественно протекать по катиону и, следовательно, в растворе будут незначительно преобладать ионы водорода Н + , что придаст раствору слабокислую среду, рН раствора будет незначительно меньше семи. Так как KD(H2S) — , что придаёт ему слабощелочную среду, рН > 7.
в) NaНS – кислая соль слабой кислоты и сильного основания, которая будет гидролизоваться по аниону:
NaHS ↔ Na + + HS — ;
HS — + H2O ↔ H2S + OH — (ионно-молекулярная форма);
NaHS + H2O ↔ H2S + NaOH (молекулярная форма).
При гидролизе гидросульфида натрия образуется избыток ионов ОН — , которые придают раствору соли щелочную среду, рН > 7.
http://ladyvapm.com/house/solyanaya-kislota-reakcii.html
http://buzani.ru/2-uncategorised/1279-kharakteristika-sulfidov-zadachi-851-854




