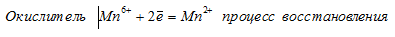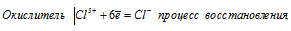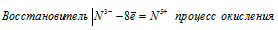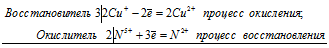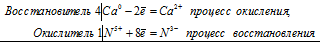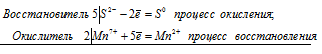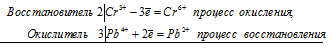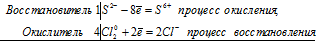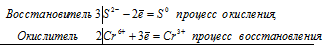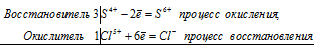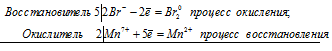Используя метод электронного баланса, составьте уравнение реакции NH3 + CuO → Cu + N2 + H2O Определите окислитель и восстановитель
Ваш ответ
решение вопроса
Похожие вопросы
- Все категории
- экономические 43,299
- гуманитарные 33,630
- юридические 17,900
- школьный раздел 607,256
- разное 16,836
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Методы составления уравнений окислительно-восстановительных реакций
Решение задач по химии на определение коэффициентов в уравнении реакции методом электронного баланса
Задание 226.
Составьте электронные уравнения и укажите, какой процесс — окисление или восстановление — происходит при следующих превращениях:
Мn 6+ ⇔ Мn 2+ ; С1 5+ ⇔ С l- ; N 3- ⇔ N 5+ . На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме:
Сu2O + HNO3 ⇔ Cu(NO3)2 + NO + H2O.
Решение:
При превращении Мn 6+ ⇔ Мn 2+ происходит процесс восстановления (присоединение электронов).
При превращении С1 5+ ⇔ С l- происходит процесс восстановления (присоединение электронов).
При превращении N 3- ⇔ N 5+ происходит процесс окисления (отдача электронов).
Если в условии задачи даны как исходные вещества, так и продукты их взаимодействия, то написание уравнения реакции сводится, как правило, к нахождению и расстановке коэффициентов. Коэффициенты определяют методом электронного баланса с помощью электронных уравнений. Вычисляем, как изменяют степень окисления восстановитель и окислитель, и отражаем это в электронных уравнениях:
6Сu + + 2N 5+ = 6Cu 2+ + 2N 2+
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов шесть. Разделив это число на 3, получаем коэффициент 2 для окислителя и продукта его восстановления, а при делении 6 на 2 получаем коэффициент 3 для восстановителя и продукта его окисления. Коэффициент перед веществами, атомы которых не меняют свою степень окисления, находят подбором. Молекулярное уравнение реакции:
Задание 227.
Реакции выражаются схемами:
HNO3 + Ca ⇔ NH4NO3 + Ca(NO3)2 + H2O;
K2S + KMnO4 +Н2SO4 ⇔ S + K2SO4 + MnSO4 + H2O
Составьте электронные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите, какое вещество является окислителем, какое — восстановителем; какое вещество окисляется, какое — восстанавливается.
Решение:
Если в условии задачи даны как исходные вещества, так и продукты их взаимодействия, то написание уравнения реакции сводится, как правило, к нахождению и расстановке коэффициентов. Коэффициенты определяют методом электронного баланса с помощью электронных уравнений. Вычисляем, как изменяют степень окисления восстановитель и окислитель, и отражаем это в электронных уравнениях. Коэффициенты для восстановителя и окислителя идентичны для продуктов окисления и восстановления. . Коэффициент перед веществами, атомы которых не меняют свою степень окисления, находят подбором.
4Са 0 + N 5+ = 4Са 2+ + N 3-
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов восемь. Разделив это число на 8, получаем коэффициент 1 для окислителя и продукта его восстановления, а при делении 8 на 2 получаем коэффициент 4 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
В данной реакции: Са – восстановитель, HNO3 – окислитель; Са окисляется до Ca(NO3)2, HNO3 – восстанавливается до NH4NO3.
5S 2- + 2Mn 7+ ⇔ 5S 0 + 2Mn 2+
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов десять. Разделив это число на 5, получаем коэффициент 2 для окислителя и продукта его восстановления, а при делении 10 на 2 получаем коэффициент 5 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
В данной реакции: К2S – восстановитель, KMnO4 – окислитель; К2S окисляется до К2SO4, KMnO4 – восстанавливается до MnSO4.
Задание 228.
Исходя из степени окисления хрома, йода и серы в соединениях К2Cr2O7, КI и Н2SO4, определите, какое из них является только окислителем, только восстановителем и какое может проявлять как окислительные, так и восстановительные свойства. Почему? На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме
NaCrO 2 + РbO 2 + NаОН ⇔ Na 2 CrO 4 + Na 2 PbO 2 + Н 2 O
Решение:
а) Степень окисления хрома, йода и серы в указанных соединениях соответственно равна +6 (высшая), -1 (низшая) и +6 (высшая). Отсюда: К2Cr2O7 только окислитель; КI — только восстановитель; Н2SO4 — только окислитель.
б) NaCrO 2 + РbO 2 + NаОН ⇔ Na 2 CrO 4 + Na 2 PbO 2 + Н 2 O
Если в условии задачи даны как исходные вещества, так и продукты их взаимодействия, то написание уравнения реакции сводится, как правило, к нахождению и расстановке коэффициентов. Коэффициенты определяют методом электронного баланса с помощью электронных уравнений. Вычисляем, как изменяют степень окисления восстановитель и окислитель, и отражаем это в электронных уравнениях. Коэффициенты для восстановителя и окислителя идентичны для продуктов окисления и восстановления. . Коэффициент перед веществами, атомы которых не меняют свою степень окисления, находят подбором.
2Сr 3+ + 3Pb 4+ ⇔ 2Сr 6+ + Pb 2+
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов шесть. Разделив это число на 2, получаем коэффициент 3 для окислителя и продукта его восстановления, а при делении 6 на 3 получаем коэффициент 2 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
Задание 229.
Реакции выражаются схемами:
H2S + Cl2 + H2O ⇔ H2SO4 + HCl
K 2Cr 2O 7 + H 2 S + Н 2 SO 4 ⇔ S + Cr 2 (SO 4 ) 3 + K 2 SO 4 + H 2 O
Составьте электронные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите, какое вещество является окислителем, какое — восстановителем; какое вещество окисляется, какое — восстанавливается.
Решение:
Если в условии задачи даны как исходные вещества, так и продукты их взаимодействия, то написание уравнения реакции сводится, как правило, к нахождению и расстановке коэффициентов. Коэффициенты определяют методом электронного баланса с помощью электронных уравнений. Вычисляем, как изменяют степень окисления восстановитель и окислитель, и отражаем это в электронных уравнениях. Коэффициенты для восстановителя и окислителя идентичны для продуктов окисления и восстановления. Коэффициент перед веществами, атомы которых не меняют свою степень окисления, находят подбором.
Уравнения электронного баланса:
S -2 + 4Cl2 0 ⇔ S +6 + 8Cl -1
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов восемь. Разделив это число на 2, получаем коэффициент 4 для окислителя и продукта его восстановления, а при делении 8 на 8 получаем коэффициент 1 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
В данной реакции: Н2S – восстановитель, Cl2 – окислитель; Н2S окисляется до Н2SO4, Cl2 – восстанавливается до HCl.
б) K 2Cr 2O 7 + H 2 S + Н 2 SO 4 ⇔ S + Cr 2 (SO 4 ) 3 + K 2 SO 4 + H 2 O
3S 2- + 2Cr 6+ ⇔3S 0 + 2Cr 3+
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов шесть. Разделив это число на 3, получаем коэффициент 2 для окислителя и продукта его восстановления, а при делении 6 на 3 получаем коэффициент 2 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
Задание 230.
Реакции выражаются схемами:
KClO3 + Na2SO3 ⇔ KCl + Na2SO4;
KMnO4 + HBr ⇔ Br2 + KBr + MnBr2 + H2O
Составьте электронные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите, какое вещество является окислителем, какое — восстановителем; какое вещество окисляется, какое — восстанавливается.
Решение:
Если в условии задачи даны как исходные вещества, так и продукты их взаимодействия, то написание уравнения реакции сводится, как правило, к нахождению и расстановке коэффициентов. Коэффициенты определяют методом электронного баланса с помощью электронных уравнений. Вычисляем, как изменяют степень окисления восстановитель и окислитель, и отражаем это в электронных уравнениях. Коэффициенты для восстановителя и окислителя идентичны для продуктов окисления и восстановления. Коэффициент перед веществами, атомы которых не меняют свою степень окисления, находят подбором.
3S 4+ + Cl 5+ = 3S 6+ + Cl —
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов шесть. Разделив это число на 6, получаем коэффициент 1 для окислителя и продукта его восстановления, а при делении 6 на 2 получаем коэффициент 3 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
В данной реакции: Na2SO3 – восстановитель, KClO3 – окислитель; Na2SO3 окисляется до Na2SO4, KClO3 – восстанавливается до KCl.
10Br — + 2Mn 7+ ⇔ 5Br2 0 + 2Mn 2+
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов десять. Разделив это число на 5, получаем коэффициент 2 для окислителя и продукта его восстановления, а при делении 10 на 2 получаем коэффициент 5 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
В данной реакции: HBr – восстановитель, KMnO4 – окислитель; HBr окисляется до Br2, KMnO4 – восстанавливается до MnBr2.
А-1. Схема строения иона углерода со степенью окисления –4
1) +14 ) ) )
2 8 4
2) +6 ) )
2 4
3) +6 ) )
2 8
4) +14 ) ) )
2 8 8
А-2. Положительную степень окисления кислород проявляет в соединении
1) N2O 2) СO 3) OF2 4) Al2O3
А-3. В ряду SiO2-P2O5-SO3 — Cl2O7 с увеличением относительной молекулярной массы оксидов
1) усиливаются основные свойства веществ
2) усиливаются кислотные свойства веществ
3) усиливаются амфотерные свойства веществ
4) свойства веществ практически не изменяются
А-4. Сера не вступает в химическую реакцию
1) с водородом 3) с металлами 2) с кислородом 4) с водой
А-5. Соединения азота с металлами называют
1) нитратами 3) нитридами
2) нитритами 4) азотистыми металлами
А-6. В результате полного сгорания метана образуются
1) углекислый газ и водород 3) углекислый газ и вода
2) углерод (сажа) и вода 4) угарный газ и вода
А-7. Сокращённому ионному уравнению
PO43- + 3Ag+ = Ag3PO4
соответствует химическая реакция
1) между фосфатом натрия и хлоридом серебра
2) между фосфатом натрия и нитратом серебра
3) между фосфатом натрия и оксидом серебра
4) между фосфатом натрия и серебром
А-8. Из приведённых уравнений химических реакций реакцией обмена является
1) (NH4)2CO3 = 2NH3 + CO2 + H2O
2) H3PO4 + 3NaOH = Na3PO4 + 3H2O
3) Cu + 4HNO3 = Cu(NO3)2 + 2NO2 + 2H2O
4) 4P + 5O2 = 2P2O5
В-1. Установите соответствие между исходными и полученными веществами в уравнениях химических реакций, ха-
рактеризующих свойства аммиака.
1) NH3 + H2O= A. N2 + H2O
2) NH3 + H2SO4= Б. NO2 + H2O
3) NH3 + O2(недостаток)= В. NH4HSO4 + H2O
4) NH3+O2(избыток) = Г. NO + H2O
Д. NH4OH
B2. Установите соответствие между ионом и способом его обнаружения в растворах.
1) I– А. при добавлении щёлочи образуется газ с характерным запахом
2) SO42- Б. при добавлении нитрата серебра образуется жёлтый творожистый осадок, не растворимый в азотной кислоте
3) NO3– В. при нагревании с медью и концентрированной
серной кислотой образуется голубой раствор и выделяется бурый газ
4) NH4+ Г. при добавлении нитрата бария выпадает мелкокристаллический осадок, нерастворимый в азотной кислоте
В-3. Установите соответствие между схемой перехода электронов в химической реакции и примером, иллюстрирующим её.
1) S0 = S-2 A. SO2 + H2S=S + H2O
2) S–2 = S+4 Б. S + O2=SO2
3) S+4 = S0 В. S + H2= H2S
4) S+4 = S+6 Г. H2S + O2=SO2 + H2O
Д. H2S + O2 = SO2 + H2O
Е. SO2 + O2 = SO3
В-4. Сероводород проявляет свойства восстановителя в химических реакциях
1) H2S + O2=S + H2O
2) H2S + NaOH=Na2S + H2O
3) H2S + SO2=S + H2O
4) H2S + Pb(NO3)2=PbS + HNO3
5) H2S + O2=SO2 + H2O
Ответ:
В-5. Напишите полные и сокращённые ионные уравнения химических реакций в тех случаях, где возможно взаимодействие между следующими парами веществ:
1) SiO2 + O2=
2) (NH4)2CO3 + HNO3=
3) SiO2 + H2O =
4) Ca(OH)2 + CO2 =
5) 5) SiO2 + HCl =
Ответ:
С-1. Какая из приведённых схем показывает, что азот может быть восстановителем? Ответ поясните соответствующими уравнениями химических реакций.
1) N+5 +e = N+4 _____________
2) N0 – 2e = N+2 _____________
С-2. В приведённой схеме напишите над стрелками формулы веществ, с помощью которых можно осуществить указанные превращения.
KMnO4=Cl2=Zn=AlI3
Рассмотрите одно из уравнений в свете представлений об окислительно-восстановительных реакциях.
http://buzani.ru/zadachi/khimiya-shimanovich/935-okislitelno-vosstanovitelnye-reaktsii-zadaniya-226-230
http://znanija.org/himiya/34392285.html