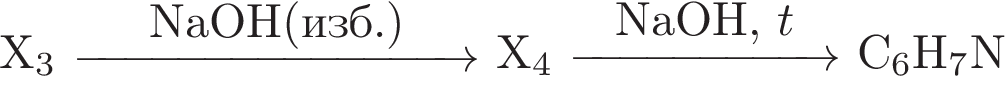Задания и решения школьного этапа олимпиады по химии для 11 класса.
Данная разработка содержит задания с решениями для школьного этапа олимпиады по химии.
Просмотр содержимого документа
«Задания и решения школьного этапа олимпиады по химии для 11 класса.»
Школьный этап олимпиады по химии 2017 -2018 учебный год.
Максимальный балл – 50
11.1 Тест (10 баллов) Вам предложены задания с выбором ответа (в каждом задании только один ответ правильный). Выберите верный ответ.
1. Какие продукты образуются при взаимодействии двух молекул хлористого этила с металлическим натрием:
1) бутан; 2) пропан и метан; 3) две молекулы этана; 4) 2-метилпропан.
2. При одинаковых условиях больше всего атомов содержится в:
1) 6 л озона; 2) 7 л водорода; 3) 15 л гелия; 4) 4 л азота.
3. Из какого галогеналкана можно получить бутен-2:
1) 2-метил-1-хлорпропан; 2) 2-хлорбутан; 3) 2-метил-2-хлорпропан; 4) 1-хлорбутан.
4. Какой из реагентов можно использовать в химической реакции алкинов, чтобы отличить
пентин-1 от пентин-2:
1) Br2; 2) НС1; 3) Na металлический; 4) уксусная кислота.
5. Какие конечные продукты образуются при специфическом окислении бутана (а) и бутена-2 (б):
1) а. муравьиная, уксусная и пропановая кислоты,
б. уксусная кислота;
2) а. масляная кислота,
б. муравьиная и пропановая кислоты;
3) а. уксусная кислота,
б. уксусная кислота;
4) а. муравьиная и уксусная кислоты,
б. масляная кислота.
6. Одновременно в растворе могут находиться ионы:
1) Сu 2+ , Na + , SO4 2– , ОН – ; 2) NH4 + , Na + , SO4 2– , CH3COO – ; 3) Fe 3+ ; Ca 2+ , OH – , F – ;
4) Ag + , Zn 2+ , S 2– , NO3 – .
7. Плотность некоторого газа при нормальных условиях составляет 1,786 г/л. Молярная масса (г/моль) этого газа равна:
1) 22; 2) 32; 3) 38; 4) 40.
8. Содержание азота максимально в:
1) аммиачной селитре;
2) в сульфате аммония;
4) в натриевой селитре.
9. Методом вытеснения воздуха и методом вытеснения воды можно собрать:
10. Определите сумму коэффициентов в уравнении окислительно-восстановительной реакции, схема которой:
1) 29; 2) 32; 3) 7; 4) 21.
11.2 Решите задачу (10 баллов).
При полном сгорании органического вещества массой 3,48 г получено 11,16 г смеси углекислого газа и воды, в которой количество углекислого газа равно количеству воды.
Относительная плотность сгоревшего вещества по водороду равна 29.
1. Определите молекулярную формулу сгоревшего вещества.
2. Постройте две структурные формулы изомерных соединений сгоревшего органического вещества и назовите их по систематической номенклатуре.
3. Составьте уравнение реакции окисления одного из изомерных веществ дихроматом калия в кислой среде, приведите схему электронного баланса, укажите окислитель и восстановитель.
11.3 Решите задачу (10 баллов)
Какова масса кристаллогидрата Na2SO4 × 10 H2O, которая останется после испарения 3 кг 10 %-ного по массе раствора сульфата натрия?
11.4 (10 баллов) Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения (в уравнениях приведите структурные формулы органических веществ):
11.5 (10 баллов) Мысленный эксперимент
Состав малахита определяется формулой Cu2(OH)2CO3.
Как можно доказать качественный состав минерала, выделив каждый из входящих в него элементов в виде простого вещества?
Как можно получить это соединение из простых веществ?
Составьте уравнения возможных реакций (считать, что экспериментальные возможности не ограничены какими-то условиями).
Примерные варианты решений и оценка задач
Школьного этапа Всероссийской олимпиады школьников по химии
2017–2018 учебный год
11.1 Распределение баллов: всего 10 баллов, за каждый верный ответ по одному баллу.
В уравнении реакции схема которой олимпиада
Используя метод электронного баланса, расставьте коэффициенты в уравнении реакции, схема которой
Определите окислитель и восстановитель.
1) Составлен электронный баланс:
5 | →
1 | →
2) Расставлены коэффициенты в уравнении реакции:
3) Реакция диспропорционирования. Указано, что бром в степени окисления 0 является окислителем и восстановителем.
Школьная олимпиада по химии
Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
Выберите документ из архива для просмотра:
Выбранный для просмотра документ Задания для школьной олимпиады.doc
Задания для 10 классов
В вашем распоряжении имеются вещества: оксид серы ( VI ), фтороводородная кислота, аргон, оксид кальция и азотная кислота. Какие из этих соединений могут реагировать между собой? Ответ подтвердите уравнениями соответствующих реакций. (4 балла)

За каждое правильное составленное уравнение – (1 балл)
Максимальное количество – (7 баллов)
14 л (н.у.) бутана окислили кислородом воздуха с получением уксусной кислоты с практическим выходом 60 %. Полученную кислоту растворили в воде с получением 90 %-ного по массе раствора. Рассчитайте массу полученного раствора. Ответ проиллюстрируйте уравнениями соответствующих реакций. (4 балла)
Составьте уравнения реакций в соответствии со схемой. Расшифруйте неизвестные вещества – приведите их структурные формулы и названия.
За каждое правильное составленное уравнение – (1 балл)
За каждую структурную формулу неизвестного вещества и название – (1 балл)
Максимальное количество – (10 баллов)
Какой объем 12 %-ного по массе раствора гидроксида калия плотностью 1,1 г/мл можно приготовить из 2 л 44 %-ного по массе раствора КОН плотностью 1,5 г/мл? (4 балла)
ИТОГО: 29 баллов
Задания для 11 классов
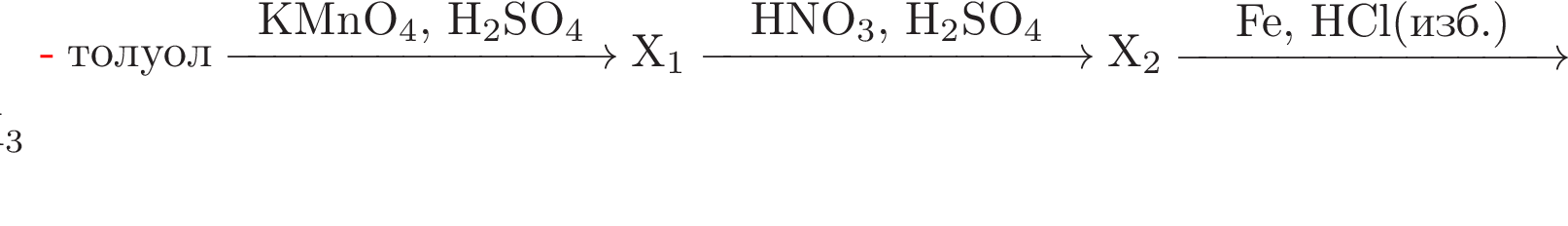
Расшифруйте вещества Х1, Х2 и Х3 в схеме превращений
Приведите уравнения соответствующих реакций.
За каждое правильное составленное уравнение – (1 балл)
Максимальное количество – (4 балла)
Обнаружьте и исправьте ошибки в приведенных ниже уравнениях:
За каждое правильное составленное уравнение – (2 балла)
Максимальное количество – (6 баллов)
При электролизе водного раствора бромида натрия на аноде выделился бром, масса которого составила 8 г. Вычислите объем газа (нормальные условия), который выделился при этом на катоде.
Максимальное количество – (7 баллов)

Приведите уравнения соответствующих реакций.
За каждое правильное составленное уравнение – (1 балл)
Максимальное количество – (4 балла)
При нитровании 73,6г ароматического углеводорода получили мононитропроизводное, которое в кислой среде взаимодействует с железом с получением (с 60 %-ным выходом) вещества, которое, в свою очередь, полностью поглощает газ, выделяющийся при действии избытка серной кислоты на 28,08 г хлорида натрия. О каком ароматическом углеводороде идет речь?
За каждое правильное составленное уравнение – (1 балл)
Максимальное количество – (8 баллов)
Определите продукты реакции окисления сульфата железа ( II ) перманганатом калия в кислой и щелочной средах:
Максимальное количество – (10 баллов)
ИТОГО: 39 баллов
Задания для 9 классов
Задание 1. В ряду активности металл1в натрий стоит левее меди. Какие процессы происходят при внесении натрия в водный раствор сульфата меди. Приведите уравнения реакций в молекулярном и ионном виде.
Задание 2. В каждом задании выберите один правильный ответ из числа предложенных:
А1 Изотопы одного и того же элемента отличаются друг от друга:
1) числом нейтронов 3) числом протонов
2) числом электронов 4) зарядом ядра
А2 Ионный характер связи выражен в соединении:
А3 В соединениях PH 3, P 2 O 5, H 3 PO 3 фосфор имеет степени окисления, соответственно равные
1) + 3; + 5; — 3 3) – 3; + 3; + 5
2) — 3; + 5; + 3 4) + 3; — 5; — 3
А4 Молекулярную кристаллическую решетку имеет
A 5 Химический элемент, формула высшего оксида которого R 2 O 7 , имеет электронную конфигурацию атома
1) 1s 2 2s 2 2p 1 3) 1s 2 2s 2 2 p 6 3s 2 3p 6 4s 1
2) 1s 2 2s 2 2 p 6 3s 2 3 p 5 4) 1s 2 2s 1
А6 Только кислотные оксиды указаны в ряду
A 7 В уравнении реакции между магнием и разбавленной серной кислотой сумма коэффициентов равна:
1) 2 2) 5 3) 7 4) 4
А
1
2
Задание 3. Какой станет концентрация раствора, если к 100г. 10 % -го раствора гидроксида калия добавить 10 г. твердого гидроксида калия?
Задание 4. При прокаливании 48,3 г. кристаллогидрата сульфата натрия образовалось 21,3 г. безводной соли. Определите состав кристаллогидрата сульфата натрия.
Задание 5. На взаимодействие 58, 8 г смеси алюминия, меди и железа израсходовали 35,88 л (н.у.) хлора. При обработке такого же количества исходной смеси металлов избытком концентрированной азотной кислоты выделилось 17,92 л (н.у.) газа бурого цвета. Определите количественный состав исходной смеси.
http://chem-oge.sdamgia.ru/problem?id=9402
http://infourok.ru/shkolnaya-olimpiada-po-himii-560146.html