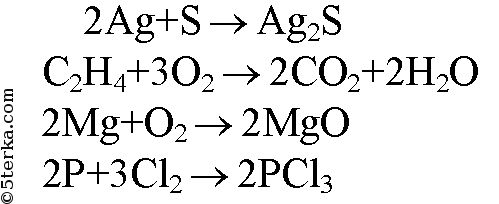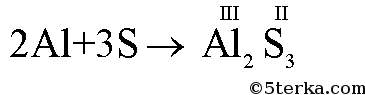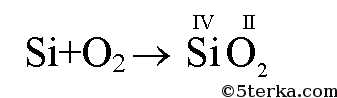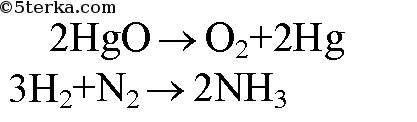Тема I. Работа 4. Химические уравнения. Вариант 3
Вопросы:
1. Расставьте коэффициенты в схемах реакций. а) Ag + S → Ag2S в) Mg + O2 → MgO б) С2H4 + O2 → СO2 + H2O г) Р + С12 → РС13
2. Составьте формулы веществ, образующихся в результате реакций, и расставьте в схемах реакций коэффициенты.
а) Al + S II → AlS б) Si + O2 → SiO
3. Перепишите приведенные схемы реакций, вместо знаков вопроса напишите формулы соответствующих веществ и расставьте коэффициенты. а) HgO → O2 + ? б) ? + N2 → NH3
Решения и ответы:

задача №3
к главе «Тема I. Первоначальные химические понятия. Работа 4. Химические уравнения».
Вариант 3 расставьте коэффициенты в уравнениях реакции
Используя метод электронного баланса, расставьте коэффициенты в уравнении реакции, схема которой:
Определите окислитель и восстановитель.
1) Составлен электронный баланс:
2) Расставлены коэффициенты в уравнении реакции:
3) Указано, что сера в степени окисления +6 является окислителем, а иод в степени окисления −1 — восстановителем.
Но кислород — тоже меняет свой заряд, можно его вместо йода выписать? Это ошибка?
Кислород остается в степени окисления -2
Почему там — 2 электрона?
потому что два йода.
Используя метод электронного баланса, составьте уравнение реакции по схеме:
Определите окислитель и восстановитель
1) Составим электронный баланс:
2) Определены коэффициенты, и составлено уравнение реакции:
3) Указаны окислитель и восстановитель:
окислитель — восстановитель —
Проверочная работа по теме «Типы химических реакций»
тренажёр по химии (8 класс)
Проверочная работа по теме «Типы химических реакций», 2 варианта из 5 заданий
Скачать:
| Вложение | Размер |
|---|---|
| Проверочная работа по теме «Типы химических реакций» | 15.17 КБ |
| Проверочная работа по теме «Типы химических реакций» 15 вариантов | 27.47 КБ |
Предварительный просмотр:
Проверочная работа по теме «Типы химических реакций»
- Кто сформулировал закон сохранения массы веществ.
- Укажите в уравнении реакции: исходные вещества, продукт реакции, коэффициент, индекс, закон сохранении массы веществ.
- Реакция, в которой из одного сложного вещества получается два или несколько простых или сложных веществ. Это реакция ……
- Напишите уравнения реакции, определите тип реакции, расставьте коэффициенты.
А) ….. + HCl= FeCl 2 + H 2
Б) SO 3 +H 2 O=H 2 SO 4
В) H 2 O = H 2 +O 2
Г) K 2 O +H 2 O=КОН
Д) AgNO 3 +….=Cu(NO 3 ) 2 +Ag
5. Сумма коэффициентов в уравнении реакции между медью и кислородом.
Проверочная работа по теме «Типы химических реакций»
1. Кто экспериментально доказал закон сохранения массы веществ.
2. Укажите в уравнении реакции: исходные вещества, продукт реакции, коэффициент, индекс, закон сохранении массы веществ.
3. Реакция между простым и сложным веществами, при котором атомы простого вещества замещают атомы одного из элементов в сложном веществе. Это реакция ……
4. Напишите уравнения реакции, определите тип реакции, расставьте коэффициенты.
А) КClO 3 = КСl +O 2
Б) CuO + …..= Cu + H 2 O
В) Cu(OH) 2 = CuO + H 2 O
Г) SO 2 +O 2 =SO 3
Д) CuCl 2 + …= FeCl 2 +Cu
Е) CaO + CO 2 =CaCO 3
5. Сумма коэффициентов в уравнении реакции между водородом и кислородом.
http://chem-oge.sdamgia.ru/test?theme=20
http://nsportal.ru/shkola/khimiya/library/2021/01/14/proverochnaya-rabota-po-teme-tipy-himicheskih-reaktsiy