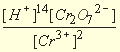Окислительно-восстановительный потенциал: расчет и измерение
Окислительно-восстановительный потенциал (ОВП) – это параметр, описывающий уровень окисления (оксидации) и восстановления вещества. Другими словами, это способность отдавать или принимать электроны в результате взаимодействия химических элементов в зависимости от природы процессов и условий протекания реакций.
Краткая характеристика
Окислительно-восстановительный потенциал – понятие в большей степени отображающее способность, чем акцию (деятельность). Энергетический потенциал – это энергия, которая скапливается и в любой момент готова к применению. В момент, когда все химические соединения, могущие подвергаться оксидации и редукции, будут использованы, система приходит в состояние равновесия. Чаще всего в таких случаях остается определенный излишек энергии, который образует редукционный или оксидационный потенциал раствора.
Образование ржавчины – типичный пример процесса оксидации/редукции. Элементы, участвующие в этом процессе, подвергаются химическим изменениям. Кислород соединяется с железом, образуя оксид железа (более известный как ржавчина): железо подвергается окислению, а кислород редуцируется. В результате окислительно-восстановительный потенциал системы «Fe/O2» становится равновесным.
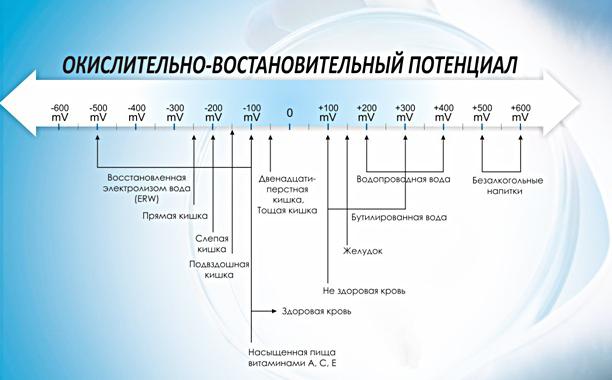
ОВП воды
Чистая питьевая вода – очень важный фактор в жизни, о котором зачастую забывают. К сожалению, абсолютно чистых питьевых источников живительной влаги, добываемых в промышленных масштабах для обеспечения населенных пунктов, очень мало. Поэтому воду, поступающую в систему водопроводов, приходится очищать и обеззараживать. Как оказалось, для этого можно использовать свойства ОВП.
Окислительно-восстановительный потенциал воды измеряется в минивольтах (mV). Данный параметр показывает активность дезинфицирующих средств, а не его концентрации, выражаемый в ppm. Химические соединения – хлор, бром, перекись водорода, надуксусная кислота или озон – являются высокоэффективными окислителями (но не всегда безопасными).
Они способны к окислению («отбору») электронов из других химических соединений, поэтому и являются отличными средствами для дезинфекции. Вызывая изменения в химическом состоянии болезнетворных микробов, вредных водорослей и в другом органическом материале, дезсредство убивает их. На практике это означает, что обеззараженная вода с соответствующим уровнем pH может не только уничтожать вредные бактерии, но самоочищаться от них.
Нормы безопасности
В 1972 году Всемирная организация здравоохранения (WHO) в Регламенте, относящемся к стандартам питьевой воды, установила, что при показателе ОВП, равном 650 mV, вода считается дезинфецированной, а инактивация вирусов наступает почти мгновенно. Исследования показали, что если окислительно-восстановительный потенциал составляет 650 mV, бактерии E. coli уничтожаются мгновенно или в течение нескольких секунд. Для уничтожения более стойких микроорганизмов, таких как листерия, сальмонелла, дрожжи и грибки, необходимо, чтобы показатель ОВП был 750 mV или выше.
Как измерять ОВП
На практике измерение окислительно-восстановительного потенциала осуществляется специальными приборами. Принцип работы устройства, регистрирующего ОВП, основан на измерении напряжения (в минивольтах, mV) в электрической цепи, образованной электродом из серебра (отрицательный полюс) и электродом из платиновой полоски (положительный полюс). Также могут применяться другие материалы, например, графит и стеклоуглерод. Электроды прибора помещаются в водный раствор, а затем снимаются показания.
Измеряется очень малое напряжение (мВ), которое создается при помещении металла в воду, содержащую окисляющие и восстанавливающие вещества. Эти значения напряжения характеризуют потенциал окислителей, содержащихся в жидкости.
Возможные ограничения
Точно измерить стандартный окислительно-восстановительный потенциал не представляется возможным, поэтому на практике значение ОВП исследуемой редокс-пары измеряют относительно любой стандартной полуреакции сравнения и электрода, созданного на ее основе (электрода сравнения). Стандартная полуреакция должна быть обратимой, а электрод сравнения должен обладать постоянным и воспроизводимым потенциалом и иметь достаточно простую конструкцию.
Окислительно-восстановительные электродные потенциалы
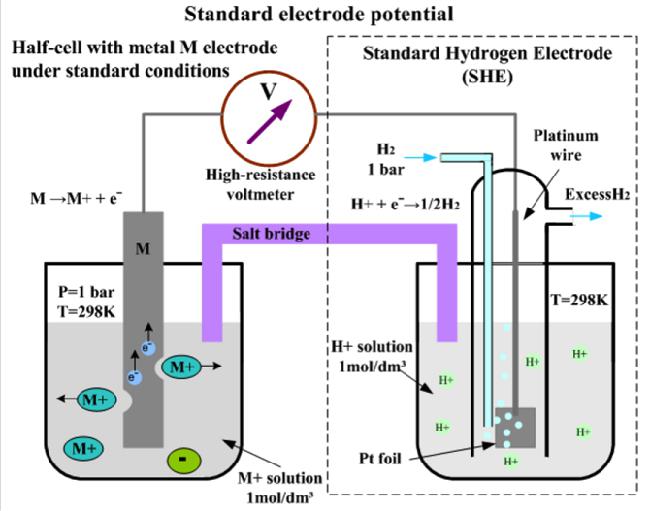
В качестве универсального электрода сравнения для измерения ОВП принят научным сообществом стандартный водородный электрод, состоящий из платиновой полоски, покрытой слоем мелкодисперсной платины (платиновой черни), и погруженной в раствор соляной (серной) кислот с активностью ионов химэлемента водорода, равной единице: аН + =1.
Платина омывается газообразным водородом под давлением 101,3 кПа (или 1 атм), который сорбируется на пористой поверхности платиновой черни. Обозначается стандартный водородный электрод: Pt(H2) (p=1атм) HCl (аН + =1).
На поверхности подобного обратимо работающего электрода протекает полуреакция: 2Н + + 2е ↔ Н2↑. Потенциал, которой условно принят нулю при любой температуре: ЕСВЭ=0. Следует отметить, что СВЭ не является окислительно-восстановительным электродом, а относится к так называемым электродам первого рода. Их потенциал зависит от активности определенных катионов – в приведенном примере от активности катионов водорода.
Окислительно-восстановительные реакции
ОВР называют реакции с изменением степеней окисления реагирующих веществ. При этом изменение степени окисления происходит с присоединением/отдачей электронов. Процессы присоединения и отдачи электронов рассматривают ученые как полуреакции восстановления и окисления соответственно:
В каждой полуреакции элемент с более высокой степенью окисления называют окисленной формой (Ок), а в более низкой степени окисления – восстановленной формой (Вос). Окисленная/восстановленная формы вещества представляют сопряженную окислительно-восстановительную пару, называемую редокс-парой. В окислительно-восстановительной паре окисленная форма (Ок) является акцептором электронов, восстановленная форма (Вос) является своеобразным донором электронов. Полуреакции восстановления/окисления неосуществимы по отдельности – если присутствует донор электронов, значит должен присутствовать и акцептор.
Стандартный ОВП
Если потенциал исследуемой окислительно-восстановительной пары измерен в стандартизированных условиях – температура 25 ᵒ С (298 K), давление 1 атм (101,3 кПа) и активности окисленной и восстановленной форм равны единице (аок = авос = 1 моль/л), то его называют «стандартный окислительно-восстановительный потенциал» и обозначают: Е 0 ок/вос.
Таблица потенциалов
Стандартные ОВП множества окислительно-восстановительных пар учеными измерены на практике. Их значения в вольтах отображает таблица окислительно-восстановительных потенциалов:
Расшифровка значений
Чем больше окислительно-восстановительный потенциал Е 0 Ок/Вос, тем окисленная форма является более сильной, соответственно, восстановленная форма обладает более слабой функцией восстановления. И наоборот, чем меньше Е 0 Ок/Вос, тем сильнее восстановленная форма.
Положительный знак потенциала указывает на самопроизвольное протекание реакции восстановления в паре со СВЭ, отрицательный – на самопроизвольное протекание реакции окисления. Потенциалы сильных окислителей будут всегда положительны, а сильных восстановителей – отрицательны.
Таблица окислительно-восстановительных потенциалов свидетельствует, что наибольшими окислительными свойствами обладает молекулярный фтор, а наибольшими восстановительными – металлический магний. При этом ионы фтора и магния практически не обладают восстановительными и окислительными свойствами соответственно.
Уравнение Нернста
Потенциал системы зависит от соотношений концентраций восстановленной и окисленной форм веществ, участвующих во взаимодействии, окружающей температуры, свойств растворителя, рН раствора и других факторов. Расчет окислительно-восстановительного потенциала, выражаемого зависимостью потенциала от состава раствора, показывает уравнение Нернста:
ЕОк/Вос = Е 0 Ок/Вос + (RT / nF) × ln (aOk / aBoc), где
- ЕОк/Вос – реальный ОВП полуреакции (редокс-пары).
- Е 0 Ок/Вос – стандартный ОВП полуреакции (редокс-пары).
- n – число электронов ОВ-реакции.
- R = 8,314 Дж/моль х K (молярная газовая постоянная).
- F = 96500 Кл/моль (число Фарадея).
- Т – абсолютная температура (в K).
Восстановление и окисление
Окислительно-восстановительные реакции определяются степенью окисления и восстановления. Окислением считаются процессы, когда атомы, молекулы или ионы отдают электроны. А восстановлением – когда атомы, молекулы или ионы приобретают электроны.
Соответственно различают вещества окислители, присоединяющие электроны (O2, галогены, HNO3, KMnO4), и восстановители, отдающие электроны другим атомам в ходе окислительно-восстановительного процесса (Н2, металлы, HI). Отдавая электроны другим, восстановители сами окисляются, а окислители, принимая электроны от других участников реакции – восстанавливаются: 2FeCl2 + Cl2 → 2FeCl3.
Степень окисления
Это заряд, которым обладал бы атом в химическом соединении, если бы электроны каждой образованной им химической связи были бы полностью смещены к более электроотрицательному атому. Например:
ОВР могут включать частичный или полный переходы электронов, степени окисления элементов при этом меняются. При этом действуют правила:
- В простом веществе степень окисления атома будет равна нулю (Cl2: 2Cl 0 ).
- Степень окисления атомов из состава молекулы также равна нулю.
- Степень окисления атомов сложного иона будет равна заряду иона.
Определение окислительно-восстановительного потенциала почв
ОВП напрямую влияет на структуру почв. Для его измерения электрод втыкают во влажную землю и на специальном приборе определяют значение в мВ (милливольтах). Одновременно в почвах проявляется много процессов и окислительно-восстановительных реакций превращений активных химических элементов: органики, марганца, железа, серы, азота.
Решающее влияние на состояние почв оказывает кислород в двух формах: растворенный во влаге земли и атмосферный. Они находятся в равновесном состоянии. Также на окислительно-восстановительные процессы влияют редуцирующие вещества микроорганизмов. Главными факторами, определяющими направленность и интенсивность ОВП являются:
- Степень увлажнения почв.
- Активность микрофлоры.
- Аэрация почв.
- Содержание органических веществ.
Высоким уровнем ОВП характеризуются автоморфные почвы:
- Сероземы – 350-450 мВ.
- Черноземы – 400-600 мВ.
- Подзолистые – 550-750 мВ.
При орошении потенциал снижается.
ОВП вина
При производстве вина важной его характеристикой является окислительно-восстановительный (редокс) потенциал. Контролируя редокс-потенциал, можно регулировать или хотя бы понимать смысл процессов, «бушующих» при созревании виноматериалов. Это процессы брожения, реакции восстановления и окисления.
При контакте с кислородом изменяются самоокисляемые системы, в результате повышается потенциал. Соответственно, чем более продолжительный этап проветривания виноматериала, тем выше его редокс-потенциал. Если доступ к воздуху прекратить, потенциал плавно уменьшается, достигая определенных значений, называемых предельным потенциалом. Как правило, аэрированные сорта вин имеют показатели 350-500 мВ, вина, созревавшие без доступа воздуха – 100-150 мВ. Чем больший срок прошел с момента розлива алкогольного напитка в бутылки, тем меньше будет его потенциал. Стоит бутылку открыть, либо взболтать, коэффициент мВ резко возрастет.
ОВП в космическом масштабе
Нормальный окислительно-восстановительный потенциал исторически явился определяющим фактором геологической эволюции Земли и других космических тел. Основным окислителем в геологических системах является кислород. Летучесть кислорода (fO2) – мера окисленности природных систем, независимо от присутствия или отсутствия в них газовой фазы, содержащей свободный кислород. Летучесть кислорода контролирует поведение многих элементов в процессах конденсации протопланетного облака, в ходе аккреции планет и формирования их металлических ядер. Эти знания помогают прогнозировать наличие полезных ископаемых.
Применение ОВП на практике
Измерение ОВП позволяет определить эффективность дезинфекции воды, независимо от вида применяемого оксиданта или смеси дезинфицирующих соединений и других факторов. Результат измерения информирует о том, действительно ли эффективен процесс дезинфекции. Измерение ОВП воды можно проводить в любой точке системы, определяя таким образом чистоту источника воды, труб, а также водопроводной инсталляции.
Показатели окислительно-восстановительного потенциала на каждом конце системы должны быть выше, чем 650 мВ. Если ОВП, измеряемое в конце системы, меньше, чем в ее начале, это говорит о том, что система водоснабжения не была хорошо очищена.
Применение ОВП позволяет найти оптимальное равновесие между pH и содержанием несвязанного хлора. Точность измерительных приборов позволяет снизить уровень хлора до такого, в котором нет риска появления коррозии. К примеру, если ОВП составляет 850 мВ, следует понизить уровень хлора, а в случае, когда значение составляет 600 мВ, уровень pH и несвязанного хлора следует проверить и, соответственно, отрегулировать путем уменьшения pH либо повышения наличия хлора.
Технология ОВП применяется в таких областях, как водоподготовка (до и после употребления), металлообработка, обеззараживание свежих овощей и фруктов, озонирование воды (коммерческие аквариумы, дезинфекция воды), производство вина, производство отбеливателей, убойные цеха на птицеводческих фермах, бумажная промышленность (отбеливание целлюлозной массы), бассейны, СПА. Температура воды не влияет на значение ОВП.
Величина окислительно восстановительного потенциала уравнение
Глава 4. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ
4.1 Теоретическая часть
Окислительно-восстановительные реакции (ОВР) – это реакции, при протекании которых происходит изменение степени окисления химических элементов, входящих в состав реагентов.
Степень окисления – условный (формальный) заряд атома в химическом соединении, который находят, считая химические связи в соединении чисто ионными.
Окисление
потеря электронов, т.е. повышение степени окисления.
Окислитель
присоединяет электроны, сам восстанавливается, понижает свою степень окисления
Восстановление
приобретение электронов, т.е. понижение степени окисления.
Восстановитель
отдает электроны, сам окисляется, повышает свою степень окисления
Окислителями являются вещества, содержащие элемент, который может приобретать более низкую степень окисления, чем в данном веществе. Например, Fe +3 является окислителем в составе FeCl3, так как существует Fe +2 в составе FeCl2.
Восстановителями являются вещества, содержащие элемент, который может проявлять более высокую степень окисления. Например, Fe +2 в составе FeCl2 является восстановителем, так как существует Fe +3 в составе FeCl3.
В промежуточной степени окисления элемент может выступать как в роли окислителя, так и восстановителя. Например, сера (IV) в составе SO2 – окислитель, так как существует сера S (0) в простом веществе, и, в других обстоятельствах – окислитель, так как существует S (VI) в составе SO3.
Для составления уравнений окислительно-восстановительных реакций используют два метода подбора коэффициентов: электронного баланса и электронно-ионного баланса.
Для реакций, протекающих в водном растворе, предпочтителен метод электронно-ионного баланса. Этим методом составляются уравнения реакций окисления и восстановления реально существующих в растворе ионов (например, MnO4 2– , SO4 2– , Cr2O7 2– ) и молекул (например, H2S, SO2, H2O2).
Молекулы растворителя (вода) или ионы среды (H + , OH – ) также могут участвовать в процессе окисления-восстановления.
Среда должна учитываться при составлении уравнений ОВР в соответствии со следующими правилами:
- В кислой среде при составлении уравнений полуреакций можно использовать ионы H + и молекулы H2O
- В щелочной — молекулы H2O и ион OH –
- В нейтральной среде в левой части уравнения полуреакции пишут только молекулы воды, а в правой как ионы H + , так и OH – .
Окислительную способность веществ характеризует окислительно-восстановительный потенциал E. В справочниках приведены стандартные окислительно-восстановительные потенциалы E o , измеренные относительно обратимого водородного электрода.
В любой окислительно-восстановительной реакции как в исходных веществах, так и в продуктах реакции, имеются сопряженные пары окислитель-восстановитель. Направление окислительно-восстановительной реакции обусловливает тот окислитель, у которого значение электродного потенциала больше.
Например, в смеси веществ: K2Cr2O7, HCl, CrCl3, Cl2 (4.1) окислителями являются K2Cr2O7 и Cl2. Их стандартные окислительно-восстановительные потенциалы соответственно равны:.
У хлора стандартный электродный потенциал выше, следовательно в стандартных условиях он является более сильным окислителем, чем дихромат калия. Соответственно в смеси веществ (4.1) при стандартных условиях должна идти реакция:
Уравнения (4.2) и (4.3) называют уравнениями полуреакций.
Если разность стандартных восстановительных потенциалов невелика ( не более 0.3В), направление окислительно-восстановительной реакции можно изменить, изменяя концентрации веществ и температуру.
При изменении концентрации и температуры величина окислительно-восстановительного потенциала определяется уравнением Нернста
E=E o + 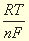
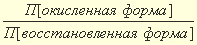
где R – газовая постоянная, 8,314 Дж/моль.К, Т – температура, К, n– число электронов, принимающих участие в полуреакции
Например, для полуреакции (4.2) для стандартной температуры 298К и с переходом от натурального логарифма к десятичному уравнение Нернста будет иметь вид
E=1,33 + (0,059/6) lg
Окислительно-восстановительные реакции протекают самопроизвольно, если разность стандартных электродных потенциалов окислителя и восстановителя, или э.д.с. окислительно-восстановительной реакции 
По известному значению 
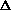
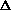
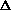
где m – наименьшее общее кратное числа отданных и принятых в реакции электронов.
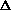
На окислительную способность реагентов влияет pН среды.
Особенно наглядно это видно на примере окислительных свойств перманганат-иона.
| MnO4 – + 8H + +5e | Mn 2+ +4H2O | (бесцветный или слабо розовый) |
| E o = + 1,51 В | ||
| MnO4 – + 4H + +3e | MnO2 + 2H2O | (бурый раствор или осадок) |
| E o = + 1,69 В |
| MnO4 – + 2H2O + 3e | MnO2 + 4OH – | ( бурый раствор или осадок) |
| E o = + 0,60 В |
| MnO4 – + е | MnO4 2– | (зеленый раствор) |
| E o = + 0,56В |
Манганат ион MnO4 2– неустойчив и легко диспропорционирует
3MnO4 2– +2H2O + 2e 2MnO4 – + MnO2 + 4OH –
Для соединений хрома (VI) среда мало влияет на степень окисления продуктов, но вследствие амфотерности гидроксида хрома (III) оказывает влияние на их состав
Кислотная среда Cr2O7 2– + 6e + 14H + 2Cr 3+ + 7H2O
Щелочная среда CrO4 2– + 3e +4H2O – Cr(OH)4 – + 4OH –
Окислительные свойства галогенов ослабевают в ряду F2> Cl2> Br2> I2
| F2 + 2e = 2F – | E o = + 2,87В |
| Cl2 + 2e=2Cl – | E o = +1,36В |
| Br2+ 2e= 2Br – | E o = + 1,06В |
| I2 +2e = 2I – | E o = + 0,54В |
Наглядно это проявляется в реакции кристаллических солей галогенидов с концентрированной серной кислотой.
В случае бромида идут обе реакции.
Убедиться в образовании галогенов можно по окраске бензольного слоя.
Пероксид водорода H2O2 проявляет как окислительные, так и восстановительные свойства. В зависимости от среды ОВР с его участием можно представить в виде следующих полуреакций
| Окислитель: | H2O2 +2H + +2e = 2H2O | Е o =+1,77 |
| H2O2 +2e = 2OH – | E o = 0,94 | |
| Восстановитель | H2O2 –2e = O2 + 2H + | E o =–0,68 |
| H2O2 + 2OH – –2e = O2 + 2H2O | E o = +0,15 |
Например, пероксид водорода в щелочной среде окисляет Cr(III) до Cr(VI)
2[Cr(OH)4] – +3H2O2 +2OH – = 2CrO4 2– +8H2O и образуется желтый раствор хромата.
В сильно кислой среде под действием дихромата идет окисление пероксида водорода.
В некоторых случаях, действие пероксида водорода на дихромат приводит к образованию различных пероксокомплексов, устойчивых только в органической фазе.
Например, в кислой среде образуются голубого цвета соединения состава
Образующееся перекисное соединение экстрагируется в органический слой, окрашивая его в синий цвет. Эту реакцию используют в аналитической химии для обнаружения хрома (VI)
4.1.1.Вопросы по теме
4.2.1. Цель работы
Исследование окислительных свойств соединений в высших, низших и промежуточных степенях окисления.
4.2.2. Реактивы
0,1 М KMnO4, 0,5 M K2Cr2O7, 1 M Na2SO3, 1 M NaOH, 1 M H2SO4, H2SO4 (d=1,83), бензол, свежеприготовленные растворы хлорной, бромной, иодной воды и 0,3 M Na2S, кристаллические KCl, KBr, KI.
4.2.3. Оборудование
Пробирки, штативы, шпатели
4.2.4. Порядок выполнения работы
Опыт 1. Окислительные свойства MnO4 – в различных средах
Налейте в три пробирки по 2 капли 0,1 М раствора KMnO4 и по 1 мл дистиллированной воды, затем добавьте в первую пробирку 2 капли 1 М H2SO4, в третью 2 капли 1 M NaOH, потом добавьте во все пробирки по несколько кристаллов KI и по 1 мл бензола. Тщательно встряхните пробирки и дайте им постоять 2–3 минуты.
Внимание: После опыта растворы слейте в емкость «для слива».
Вопросы и задания
- Опишите наблюдаемые явления.
- Напишите уравнения химических реакций и расставьте коэффициенты методом электронно-ионного баланса.
- Как влияет среда раствора на состав продуктов реакции?
- Рассчитайте стандартные э.д.с.,
G, и К реакций
Опыт 2. Окислительные свойства Cr2O7 2– в различных средах
Налейте в две пробирки по 1 капле 0,5 М раствора дихромата калия и по 1 мл дистиллированной воды, затем добавьте в первую пробирку 2 капли концентрированной серной кислоты, а во вторую 2 капли 1 М NaOH. В каждую пробирку внесите на кончике шпателя несколько кристаллов KI или KBr, KCl ( по выбору преподавателя) и по 1 мл бензола. Тщательно встряхните обе пробирки и дайте им постоять 2–3 минуты.
Внимание: После опыта растворы слейте в емкость «для слива».
Вопросы и задания
- Опишите наблюдаемые явления.
- Напишите уравнения химических реакций и расставьте коэффициенты методом электронно-ионного баланса.
- Как влияет среда раствора на состав продуктов реакции?
- На основании значений электродных потенциалов сделайте вывод о возможности протекания реакции дихромата калия в стандартных условиях в кислой и щелочной среде с хлоридом калия
- Рассчитайте стандартные э.д.с.,
G, и К реакций
Опыт 3. Окислительные свойства галогенов
В три пробирки налейте по 2–3 капли свежеприготовленного раствора 0,3 М Na2S, затем добавьте в каждую пробирку по 2 капли 1 M H2SO4 . В первую пробирку прилейте 3 капли хлорной воды, во вторую прилейте 3 капли бромной воды, в третью – 3 капли иодной воды и тщательно перемешайте.
Внимание: После опыта растворы слейте в емкость «для слива».
Вопросы и задания
- Опишите наблюдаемые явления.
- Напишите уравнения химических реакций и расставьте коэффициенты методом электронно-ионного баланса.
- Каковы возможные продукты окисления сульфид-иона?
- Рассчитайте стандартные э.д.с.,
G, и К реакций
Опыт 4. Восстановительные свойства галогенид-ионов
(Опыт выполняется в вытяжном шкафу!)
В три пробирки осторожно налейте по 1 мл концентрированной серной кислоты. Затем в первую пробирку добавьте несколько кристаллов KCl, во вторую пробирку KBr, в третью KI. В каждую пробирку добавьте по 1мл бензола. Тщательно встряхните и дайте постоять 2–3 минуты.
Вопросы и задания
- Опишите наблюдаемые явления.
- Напишите уравнения химических реакций и расставьте коэффициенты методом электронно-ионного баланса.
- Объясните усиление восстановительных свойств галогенид-ионов в ряду Cl – Br – I – .
- Рассчитайте стандартные э.д.с.,
G о , и К реакций
Опыт 5. Окислительно-восстановительные свойства сульфит-иона
Налейте в две пробирки по 2–3 капли 1 М раствора сульфита натрия. В первую пробирку добавьте 2 капли 1 M H2SO4 и 2 капли 0,5 M K2Cr2O7, во вторую пробирку 2 капли дистиллированной воды и 5 капель свежеприготовленного раствора Na2S . Тщательно перемешайте.
Вопросы и задания
- Опишите наблюдаемые явления.
- Напишите уравнения химических реакций и расставьте коэффициенты методом электронно-ионного баланса.
- Используя значения стандартных электродных потенциалов, объясните, в каких случаях сульфит-ион ведет себя как окислитель, а в каких как восстановитель
- Рассчитайте стандартные э.д.с.,
G, и К реакций
4.2.5. Что должен студент представить преподавателю
 G о , и К реакций
G о , и К реакций4.3.1. Цель работы
Выявить влияние величины рН на состав продуктов окислительно-восстановительной реакции
4.3.2.Реактивы
4.3.3.Оборудование:
Пробирки, штативы, рН–метры, 8 мерных стаканов на 100 мл, пипетки, капельные, шпатели, горелка, пипетка на 1 мл, лучинка.
4.3.4 Порядок выполнения работы.
Опыт 6. Взаимодействие KMnO4 c Na2SO3 при различных рН
а) (Коллективный опыт) Приготовьте растворы перманганата калия с различными рН. Для этого возьмите 8 мерных стаканов, в каждый пипеткой внесите по 1 мл 0,1 М раствора перманганата калия.
Не забудьте смыть остатки раствора перманганата в пипетке в мерный стакан!
В первый добавьте 30–40 мл воды, внесите 3–4 капли концентрированной серной кислоты и добавьте воды до метки 50 мл. Измерьте рН с помощью рН–метра. (рН должен быть в интервале 1–2)
Во второй стакан добавьте 30–40 мл воды, внесите пипеткой 6–8 капель 0,1 М серной кислоты и добавьте воды до метки 50 мл. Измерьте рН ( рН должен быть в интервале 2–3)
В третий добавьте воды до метки 50 мл. Измерьте рН ( рН от 5 –8)
В четвертый стакан добавьте немного воды, внесите 2–4 капли 0,1 М КОН и добавьте воды до метки 50 мл. Измерьте рН( рН 9–10)
В пятый стакан внесите 7–10 капель 0,1 М КОН и добавьте воды до метки 50 мл. Измерьте рН ( рН 10–11)
В шестой стакан добавьте немного воды, 5–6 капель 6 М КОН и доведите водой до метки 50 мл. Измерьте рН. ( рН 13)
В седьмой стакан добавьте 10 мл 6 М КОН и добавьте воды до 50 мл. Измерьте рН. (рН 13,5)
В восьмой стакан добавьте 6 М KOH до 50 мл. Измерьте рН. Этот раствор необходимо готовить непосредственно перед проведением эксперимента
В случае, если измеренное значение рН оказывается больше рекомендуемого интервала( для кислой среды) или меньше (для щелочной) проведите коррекцию, добавив по 1–2 капли соответствующей кислоты или щелочи.
б) (Индивидуальный опыт) Отлейте полученные растворы в пробирки, предварительно пронумеровав их. Поместите пробирки в штатив. В каждую (кроме восьмой) внесите на шпателе несколько кристалликов сульфита натрия. Результаты наблюдений внесите в таблицу 4.2.
N стакана
Наблюдения
В графе «наблюдения» опишите прозрачность, цвет раствора, наличие осадка и его цвет.
В графе «наблюдения через 10–15 мин» опишите произошедшие изменения: изменение или усиление цвета, изменение прозрачности, появление или исчезновение осадка и его цвет и т.д.
Вопросы и задания
- Исходя из наблюдений, напишите уравнения реакций, протекающих в каждой пробирке.
- Почему с течением времени могут меняться цвет и прозрачность раствора. Ответ обоснуйте уравнениями реакций.
- Как влияет рН на состав продуктов реакции перманганата с сульфитом?.
- Выразите уравнением в общем виде из уравнения Нернста (4.5) зависимость электродного потенциала перманганат-иона от рН для кислой, нейтральной и щелочной среды.
- По уравнению Нернста (4.5) рассчитайте значение окислительно-восстановительного потенциала перманганата при рН каждого опыта для равных активностей (концентраций) окисленной и восстановленной формы
- На основании проведенных исследований и уравнений постройте на миллиметровой бумаге график зависимости потенциала перманганат-иона от рН во всем исследованном интервале рН
- По таблице электродных потенциалов найдите вещества, которые будут взаимодействовать с перманганатом в кислой среде и не будут в щелочной.
Опыт 7. Влияние концентрации и среды на реакцию пероксида водорода с соединениями хрома (III) и (VI)
7а) Взаимодействие хрома (III) с перокcидом водорода в щелочной среде
К 2–3 каплям раствора, содержащего соль хрома (III), добавьте по каплям 2 М NaOH до образования осадка Cr(OH)3 и далее до растворения последнего с образованием гидроксокомплексов. Затем добавьте 1–2 капли 10% Н2О2 ( или 6–8 капель 3% Н2О2) и нагрейте.
Вопросы и задания
- Опишите наблюдения. Отметьте цвет растворов.
- Напишите уравнения всех реакций
- Какой ион обусловливает наблюдаемую в конце опыта окраску?
- Рассчитайте э.д.с. и
G о окислительно-восстановительной реакции.
7б) Реакция дихромата калия с пероксидом водорода в кислой среде
К 2–3 каплям раствора дихромата калия добавьте несколько капель 2 М серной кислоты. Затем добавьте или 6–8 капель 3% Н2О2.
Вопросы и задания
- Опишите наблюдения. Отметьте цвет раствора в начале и конце опыта.
- Какой ион обусловливает наблюдаемую в конце опыта окраску?
- Рассчитайте э.д.с.,
G о и К реакции
- В каком из проделанных опытов пероксид водорода проявляет свойства окислителя, а в каком восстановителя? Почему?
- Обоснуйте с помощью величин э.д.с., почему возможна как прямая, так и обратная реакция? (Опыты 7а и 7б)
7в) Качественная реакция на хром (VI)
К 2–3 каплям раствора дихромата калия добавьте 1 каплю 3% Н2О2, 3–4 капли эфира или изоамилового спирта и по каплям при встряхивании 4–5 М серную кислоту.
Вопросы и задания
- Опишите наблюдения.
- Какое вещество обусловливает окраску эфирной фазы? Где по вашему мнению (снизу, сверху) находится эфирная фаза?
- Какое свойства пероксида водорода иллюстрирует этот опыт?
7г) Каталитическое разложение пероксида водорода в присутствии дихромата калия
Приготовьте 0,02 М раствор дихромата калия из имеющегося в наличии раствора разбавлением. В пробирку налейте 2 мл пероксида водорода и добавьте 0,5 мл приготовленного раствора дихромата калия. Через 1–2 минуты внесите в пробирку тлеющую лучинку.
Оставьте раствор на 10–15 минут.
Качественно отметьте скорость выделения газа в начале и конце опыта.
Вопросы и задания
- Отметьте изменение окраски раствора после окончания выделения газа.
- Как изменилась окраска раствора дихромата после приливания к нему пероксида водорода?
- Что наблюдается при внесении лучинки? Почему? Напишите уравнение реакции.
- Какой вывод о роли дихромата калия в этом опыте можно сделать?
4.3.5. Что студент должен представить преподавателю
 G о и К реакций.
G о и К реакций.4.4.1.Цель работы
4.4.2.Реактивы
0,1 М K2Cr2O7, 0,01 М KMnO4, раствор дифениламина в серной кислоте, 5% KI, раствор крахмала, H2SO4 (1:4), хлороформ или бензол. Растворы солей (0,1 M) по выбору преподавателя: Cr2(SO4)3 (или другая соль хрома (III)), 0,1 М MnSO4, 1 М FeCl3 (или 1 М Fe2(SO4)3), 1 М FeCl2 (или 1 М FeSO4 или соль Мора), NaNO2 (или KNO2), NaNO3 (или KNO3), KNO3, SnCl2, Na2SO4 (или K2SO4), Na2SO3 (или K2SO3).
4.4.3. Оборудование
Пробирки, (4–5) предметных стекол, стеклянная палочка (на каждого студента) капельные пипетки.
4.4.4. Порядок выполнения работы
Опыт 1. Проба на окислитель
| Проба на окислитель I: | На предметное стекло поместите отдельно 1–2 капли исследуемых растворов (KMnO4, FeCl3, NaNO3, K2SO4). Рядом наносят 1–2 капли раствора KI и 1–2 капли крахмала. Соедините капли исследуемого раствора, KI и крахмала стеклянной палочкой. Если раствор содержит окислители, наблюдают появление синей окраски. |
| Проба на окислитель II: «дифениламинная» | Дифениламин реагирует с окислителями с образованием дифенилбензидина, а затем синего хиноидного соединения: |
| Выполнение: 1 каплю исследуемого раствора (KMnO4, FeCl3, NaNO3, K2SO4) наносят на предметное стекло. Рядом наносят каплю раствора дифениламина. Осторожно! Реактив растворен в концентрированной серной кислоте! Соединяют капли стеклянной палочкой. Если исследуемый раствор содержит окислители, появляется синее окрашивание. Опыт 2. Проба на восстановитель | |
| Проба на восстановитель I: | Выполнение: На предметное стекло наносят отдельно по 2–3 капли исследуемого раствора (KNO2, FeCl2, K2SO3, SnCl2 или других по выбору преподавателя) рядом добавляют 1 каплю H2SO4 (1:4) и 1–2 капли раствора KMnO4. Соединяют растворы палочкой. Если раствор содержит восстановители, прибавляемый перманганат обесцвечивается. |
| Проба на восстановитель II: | Выполнение: 1–2 капли исследуемого раствора (KNO2, FeCl2, K2SO3, SnCl2 или других по выбору преподавателя) наносят на предметное стекло и к ним добавляют 1 каплю H2SO4 (1:4). Рядом наносят 1–2 капли раствора K2Cr2O7.Соединяют стеклянной палочкой. Если раствор содержит восстановители, желто-оранжевая окраска бихромата переходит в зеленую окраску соли хрома (III) Каким должен быть потенциал восстановителя для обнаружения этой реакцией? Какой окислитель, бихромат или перманганат, позволяет обнаруживать более слабые восстановители? Результаты проб |
| вещество |
Вопросы и задания
- На основании результатов проб сделайте вывод об окислительно-восстановительной способности исследуемых веществ.
- силу окислителя (восстановителя)? Какие данные нужны для количественной оценки?
- Используя таблицу потенциалов (справочник) подберите вещество, которое будет давать только Как качественно по результатам проб можно оценить одну пробу на окислитель. Какую именно пробу будет давать это вещество, а какую — нет? Это вещество сильный окислитель или слабый?
- Используя таблицу потенциалов (справочник) подберите вещество, которое будет давать только одну пробу на восстановитель. Какую именно пробу будет давать это вещество, а какую — нет? Это вещество сильный восстановитель или слабый?
- Предложите эксперимент, который позволяет проверить, является ли сульфат (нитрат) ион окислителем, или окислителем является только серная (азотная) кислота.
4.4.5.Что студент должен представить преподавателю
4.5. Задачи
- Уравняйте методом электронно-ионного баланса реакции
- P + HNO3 + H2O H3PO4 + NO2
- Al + KOH + H2O K[Al(OH)4] +H2
- H2S + H2SO3 S + H2O
Пользуясь табличными данными рассчитайте для стандартных условий Е о , rG о и константы равновесия К этих реакций .
.Рассчитайте величину окислительно-восстановительного потенциала
Cr2O7 2– + 14H+ +6e = 2Cr 3+ + 7H2O
- при концентрациях [Cr2O7 2– ] =[Cr 3+ ] = 0,1M и рН =1
- при стандартных концентрациях и t=30 o C
Окислительно — восстановительный потенциал
Электродные потенциалы. ЭДС реакции
Окислительно — восстановительный потенциал является частным, узким случаем понятия электродного потенциала. Рассмотрим подробнее эти понятия.
В ОВР передача электронов восстановителями окислителям происходит при непосредственном контакте частиц, и энергия химической реакции переходит в теплоту.
Энергия любой ОВР, протекающей в растворе электролита, может быть превращена в электрическую энергию, если, например, окислительно-восстановительные процессы разделить пространственно, т.е. передача электронов восстановителем будет происходить через проводник электричества.
Это реализовано в гальванических элементах, где электрическая энергия получается из химической энергии окислительно-восстановительной реакции.
Элемент Даниэля-Якоби
Рассмотрим гальванический элемент Даниэля-Якоби, в котором левый сосуд наполнен раствором сульфата цинка ZnSO4, с опущенной в него цинковой пластинкой, а правый сосуд – раствором сульфата меди CuSO4, с опущенным в него медной пластинкой.
Взаимодействие между раствором и пластиной, которая выступает в качестве электрода, способствует тому, чтобы электрод приобрел электрический заряд.
Возникающая на границе металл-раствор электролита разность потенциалов, называется электродным потенциалом. Значение и знак (+ или -) электродного потенциала определяются природой раствора и находящегося в нем металла.
При погружении металлов в растворы их солей более активные из них (Zn, Fe и др.) заряжаются отрицательно, а менее активные (Cu, Ag, Au и др.) положительно.
Результатом соединения цинковой и медной пластинки проводником электричества, является возникновение в цепи электрического тока за счет перетекания электронов с цинковой к медной пластинке по проводнику.
При этом происходит уменьшение количества электронов в цинке, что компенсируется переходом Zn 2+ в раствор т.е. происходит растворение цинкового электрода — анода (процесс окисления).
Zn — 2e — = Zn 2+
В свою очередь, рост количества электронов в меди компенсируется разряжением ионов меди, содержащихся в растворе, что приводит к накоплению меди на медном электроде – катоде (процесс восстановления):
Cu 2+ + 2e — = Cu
Таким образом, в элементе Даниэля-Якоби происходит такая реакция:
Zn + Cu 2+ = Zn 2+ + Cu
Zn + CuSO4 = ZnSO4 + Cu
Количественно охарактеризовать окислительно-восстановительные процессы позволяют электродные потенциалы, измеренные относительно нормального водородного электрода (его потенциал принят равным нулю).
Чтобы определить стандартные электродные потенциалы используют элемент, одним из электродов которого является испытуемый металл (или неметалл), а другим является водородный электрод. По найденной разности потенциалов на полюсах элемента определяют нормальный потенциал исследуемого металла.
Окислительно-восстановительный потенциал
Значениями окислительно-восстановительного потенциала пользуются в случае необходимости определения направления протекания реакции в водных или других растворах.
2Fe 3+ + 2I — = 2Fe 2+ + I2
таким образом, чтобы йодид-ионы и ионы железа обменивались своими электронами через проводник.
В сосуды, содержащие растворы Fe 3+ и I — , поместим инертные (платиновые или угольные) электроды и замкнем внутреннюю и внешнюю цепь. В цепи возникает электрический ток.
Йодид-ионы отдают свои электроны, которые будут перетекать по проводнику к инертному электроду, погруженному в раствор соли Fe 3+ :
2I — — 2e — = I2
2Fe 3+ + 2e — = 2Fe 2+
Процессы окисления-восстановления происходят у поверхности инертных электродов. Потенциал, который возникает на границе инертный электрод – раствор и содержит как окисленную, так восстановленную форму вещества, называется равновесным окислительно-восстановительным потенциалом.
Факторы, влияющие на значение окислительно-восстановительного потенциала
Значение окислительно-восстановительного потенциала зависит от многих факторов, в том числе и таких как:
1) Природа вещества (окислителя и восстановителя)
2) Концентрация окисленной и восстановленной форм.
При температуре 25°С и давлении 1 атм. величину окислительно-восстановительного потенциала рассчитывают с помощью уравнения Нернста:
E – окислительно-восстановительный потенциал данной пары;
E°- стандартный потенциал (измеренный при Cок = Cвос);
R – газовая постоянная (R = 8,314 Дж);
T – абсолютная температура, К
n – количество отдаваемых или получаемых электронов в окислительно-восстановительном процессе;
F – постоянная Фарадея (F = 96484,56 Кл/моль);
Cок – концентрация (активность) окисленной формы;
Cвос– концентрация (активность) восстановленной формы.
Подставляя в уравнение известные данные и перейдя к десятичному логарифму, получим следующий вид уравнения:
При Cок > Cвос, E > E° и наоборот, если Cок 2- , CrO4 2- , MnO4 — ) при уменьшении pH раствора окислительно-восстановительный потенциал возрастает, т.е. потенциал растет с ростом H + . И наоборот, окислительно-восстановительный потенциал падает с уменьшением H + .
4) Температура
При увеличении температуры окислительно-восстановительный потенциал данной пары также растет.
Стандартные окислительно-восстановительные потенциалы представлены в таблицах специальных справочников. Следует иметь ввиду, что рассматриваются только реакции в водных растворах при температуре ≈ 25°С.
Такие таблицы дают возможность сделать некоторые выводы:
Что можно определить по значению окислительно-восстановительного потенциала
- Величина и знак стандартных окислительно-восстановительных потенциалов, позволяют предсказать какие свойства (окислительные или восстановительные) будут проявлять атомы, ионы или молекулы в химических реакциях, например
E°(F2/2F — ) = +2,87 В – сильнейший окислитель
E°(K + /K) = — 2,924 В – сильнейший восстановитель
Окислительно-восстановительная пара будет обладать тем большей восстановительной способностью, чем больше числовое значение ее отрицательного потенциала, а окислительная способность тем выше, чем больше положительный потенциал.
- Возможно определить какое из соединений одного элемента будет обладать наиболее сильным окислительными или восстановительными свойствами.
- Возможно предсказать направление ОВР. Известно, что работа гальванического элемента имеет место при условии, что разность потенциалов имеет положительное значение. Протекание ОВР в выбранном направлении также возможно, если разность потенциалов имеет положительное значение. ОВР протекает в сторону более слабых окислителей и восстановителей из более сильных, например, реакция
Sn 2+ + 2Fe 3+ = Sn 4+ + 2Fe 2+
практически протекает в прямом направлении, т.к.
E° (Sn 4+ /Sn 2+ ) = +0,15 В,
E° (Fe 3+ /Fe 2+ ) = +0,77 В,
т.е. E° (Sn 4+ /Sn 2+ ) 3+ /Fe 2+ ).
Cu + Fe 2+ = Cu 2+ + Fe
невозможна в прямом направлении и протекает только справа налево, т.к.
В процессе ОВР количество начальных веществ уменьшается, вследствие чего Е окислителя падает, а E восстановителя возрастает. При окончании реакции, т.е. при наступлении химического равновесия потенциалы обоих процессов выравниваются.
- Если при данных условиях возможно протекание нескольких ОВР, то в первую очередь будет протекать та реакция, у которой разность окислительно-восстановительных потенциалов наибольшая.
- Пользуясь справочными данными, можно определить ЭДС реакции.
Как определить электродвижущую силу (ЭДС) реакции?
Рассмотрим несколько примеров реакций и определим их ЭДС:
- Mg + Fe 2+ = Mg 2+ + Fe
- Mg + 2H + = Mg 2+ + H2
- Mg + Cu 2+ = Mg 2+ + Cu
E° (Mg 2+ /Mg) = — 2,36 В
E° (Fe 2+ /Fe) = — 0,44 В
Чтобы определить ЭДС реакции, нужно найти разность потенциала окислителя и потенциала восстановителя
ЭДС = Е 0 ок — Е 0 восст
- ЭДС = — 0,44 — (- 2,36) = 1,92 В
- ЭДС = 0,00 — (- 2,36) = 2,36 В
- ЭДС = + 0,34 — (- 2,36) = 2,70 В
Все вышеуказанные реакции могут протекать в прямом направлении, т.к. их ЭДС > 0.
Связь константы равновесия и окислительно — восстановительного потенциала
Если возникает необходимость определения степени протекания реакции, то можно воспользоваться константой равновесия.
Например, для реакции
Zn + Cu 2+ = Zn 2+ + Cu
Применяя закон действующих масс, можно записать
Здесь константа равновесия К показывает равновесное соотношение концентраций ионов цинка и меди.
Значение константы равновесия можно вычислить, применив уравнение Нернста
Подставим в уравнение значения стандартных потенциалов пар Zn/Zn 2+ и Cu/Cu 2+ , находим
В состоянии равновесия E 0 Zn/Zn2+ = E 0 Cu/Cu2+, т.е.
-0,76 + (0,59/2)lgCZn2+ = +0,34 + (0,59/2)lgCCu2+, откуда получаем
Значение константы равновесия показывает, что реакция идет практически до конца, т.е. до того момента, пока концентрация ионов меди не станет в 10 37,7 раз меньше, чем концентрация ионов цинка.
Константа равновесия и окислительно-восстановительный потенциал связаны общей формулой:
lgK = (E1 0 -E2 0 )n/0,059, где
K — константа равновесия
E1 0 и E2 0 – стандартные потенциалы окислителя и восстановителя соответственно
n – число электронов, отдаваемых восстановителем или принимаемых окислителем.
Если E1 0 > E2 0 , то lgK > 0 и K > 1.
Следовательно, реакция протекает в прямом направлении (слева направо) и если разность (E1 0 — E2 0 ) достаточно велика, то она идет практически до конца.
Напротив, если E1 0 0 , то K будет очень мала.
Реакция протекает в обратном направлении, т.к. равновесие сильно смещено влево. Если разность (E1 0 — E2 0 ) незначительна, то и K ≈ 1 и данная реакция не идет до конца, если не создать необходимых для этого условий.
Зная значение константы равновесия, не прибегая к опытным данным, можно судить о глубине протекания химической реакции. Следует иметь ввиду, что данные значений стандартных потенциалов не позволяют определить скорость установления равновесия реакции.
По данным таблиц окислительно-восстановительных потенциалов возможно найти значения констант равновесия примерно для 85000 реакций.
Как составить схему гальванического элемента?
Приведем рекомендации ИЮПАК, которыми следует руководствоваться, чтобы правильно записать схемы гальванических элементов и протекающие в них реакции:
- ЭДС элемента — величина положительная, т.к. в гальваническом элементе работа производится.
- Значение ЭДС гальванической цепи – это сумма скачков потенциалов на границах раздела всех фаз, но, учитывая, что на аноде происходит окисление, то из значения потенциала катода вычитают значение потенциала анода.
Таким образом, при составлении схемы гальванического элемента слева записывают электрод, на котором происходит процесс окисления (анод), а справа – электрод, на котором происходит процесс восстановления (катод).
- Граница раздела фаз обозначается одной чертой — |
- Электролитный мостик на границе двух проводников обозначается двумя чертами — ||
- Растворы, в которые погружен электролитный мостик записываются слева и справа от него (если необходимо, здесь же указывается концентрация растворов). Компоненты одной фазы, при этом записываются через запятую.
Например, составим схему гальванического элемента, в котором осуществляется следующая реакция:
Fe 0 + Cd 2+ = Fe 2+ + Cd 0
В гальваническом элементе анодом является железный электрод, а катодом – кадмиевый.
Анод Fe 0 |Fe 2+ || Cd 2+ |Cd 0 Катод
Типичные задачи на составление схем гальванического элемента и вычисление ЭДС реакции с решениями вы найдете здесь.
http://www.chem.msu.su/rus/teaching/general/praktika/part4.html
http://zadachi-po-khimii.ru/obshaya-himiya/okislitelno-vosstanovitelnyj-potencial.html