Вириальные коэффициенты в уравнении ван дер ваальса
Поведение реального газа можно описать с высокой точностью с помощью вириального уравнения (или уравнения с вириальными коэффициентами). Идея состоит в отказе от минимального числа параметров и использовании бесконечных рядов — разложений по степеням 1/V:
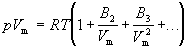
Коэффициенты B2, B3, . (которые зависят от температуры и природы рассматриваемого газа, но не зависят от плотности и давления) называются соответственно вторым, третьим, . вириальными коэффициентами. Первый вириальный коэффициент равен 1. Второй вириальный коэффициент обычно более важен, чем последующие, поскольку для большинства случаев B2 /Vm >> B3 /V 2 m >> . .
Уравнение состояния в виде бесконечного ряда (1.15) было предложено Тиссеном в 1885 г. Однако основное развитие вириальное уравнение получило в 1901 г. в работе Камерлинг-Оннеса, который рассмотрел несколько вариантов этого уравнения и предложил называть его коэффициенты вириальными.
Если подходить в вириальному уравнению только как к эмпирическому уравнению состояния, то оно имеет ряд недостатков. Например, как показывают экспериментальные данные, сходимость ряда не очень хорошая, особенно в области высокой плотности. Кроме того, при высоких плотностях для удовлетворительного описания экспериментальных данных необходимо использовать большое число членов ряда, а для этого нужно экспериментально определять большое число вириальных коэффициентов. Более того, часто тот же набор экспериментальных данных можно более точно описать с помощью других эмпирических уравнений с меньшим числом параметров. Однако исключительная важность вириального уравнения состояния заключается в том, что это единственное из известных уравнений состояния, имеющее строгую теоретическую основу. Как будет показано в главе 2, каждый вириальный коэффициент можно выразить через силы межмолекулярного взаимодействия. Так, второй вириальный коэффициент отражает парные взаимодействия, третий – тройные и т.д. Таким образом, вириальное уравнение состояния позволяет объяснить свойства газа с позиции межмолекулярных взаимодействий.
Для некоторых целей вириальное уравнение удобнее записать в виде разложения по степеням p:
Таким образом, вириальное уравнение является примером того, когда простое выражение (в данном случае pVm = RT) представляет собой только первый член ряда разложения по степеням переменной (в данном случае p или Vm).
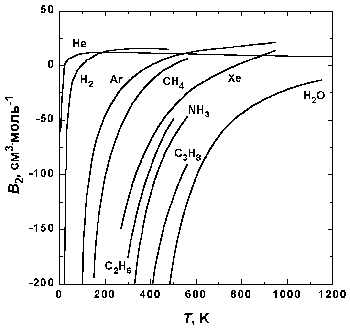
Рис.1.5. Зависимость второго вириального коэффициента некоторых газов от температуры.
На рис. 1.5 представлена зависимость второго вириального коэффициента от температуры для некоторых газов. При низких температурах B2 n-1 . Таким образом, уравнение Ван-дер-Ваальса качественно правильно передает температурную зависимость второго вириального коэффициента при низких температурах (при низких температурах B2
| [предыдущий раздел] | [содержание] | [следующий раздел] |


Сервер создается при поддержке Российского фонда фундаментальных исследований
Не разрешается копирование материалов и размещение на других Web-сайтах
Вебдизайн: Copyright (C) И. Миняйлова и В. Миняйлов
Copyright (C) Химический факультет МГУ
Написать письмо редактору
Вириальные коэффициенты в уравнении ван дер ваальса
В работах по химической термодинамике для формального описания зависимости химического потенциала реального газа от давления пользуются методом Льюиса (1901), согласно которому вводится новая функция f, которая называется фугитивностью или летучестью и имеет размерность давления:
(p, T) = (T) + RT ln f(p, T). (1.45)
Выражение (1.45) аналогично зависимости химического потенциала идеального газа от давления. Однако аналогия эта чисто формальна, поскольку фугитивность является функцией давления и температуры, причем характер зависимости f(p, T) индивидуален и зависит от природы газа. Коэффициентом фугитивности называется безразмерная величина


Из уравнений (1.43) и (1.45) вытекает:


Используя определение фактора сжимаемости Z = pV/RT, уравнение (1.47) можно записать в виде:

Используя уравнения (1.46) – (1.48), можно рассчитать фугитивность реальных газов графическими или аналитическими методами.
1.7.1. Графические методы
Графические методы используют для определения фугитивности чистого газа по экспериментальным данным об его объеме V при различных давлениях p и T = const.
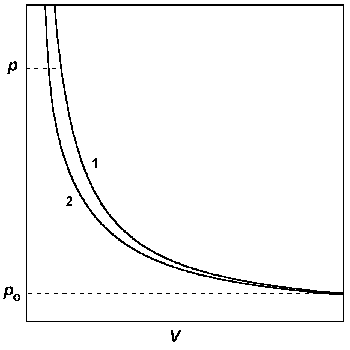
А) В координатах p – V строят изотермы идеального и реального газов от достаточно низкого давления, при котором эти изотермы практически сливаются, до давления, при котором требуется определить фугитивность. Интеграл в правой части уравнения (1.46) определяют графически (рис. 1.7).
Рис.1.7. Графический метод определения фугитивности: построение р — V изотерм для идеального (1) и реального (2) газов.
Б) Вычисляют объемную поправку реального газа , равную подынтегральному выражению в уравнениях (1.46) и (1.47):

Затем строят зависимость от p при заданной температуре и интеграл в правой части уравнения (1.47) определяют графически(рис. 1.8).
Рис.1.8. Графический метод определения фугитивности: построение зависимости от р
Преимущества метода Б) по сравнению с методом А) заключаются в следующем. Во-первых, интервал изменения значительно меньше, чем V, особенно при высоких температурах. Во-вторых, при p 
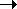


При низких p экспоненту можно разложить в ряд, ограничившись двумя членами:

где pид – давление, которое имел бы идеальный газ, если бы он занимал тот же объем, что и реальный. С помощью уравнения (1.52) можно приближенно вычислять фугитивность при низких давлениях.
Смысл поправки при p 0 наглядно проявляется при использовании вириального уравнения состояния. При низких давлениях в уравнении (1.16) можно ограничиться членом со вторым вириальным коэффициентом, т.е.

Таким образом, при p 0 поправка равна второму вириальному коэффициенту со знаком «минус». [Отметим, что при любых конечных значениях в пределе p 0 получается уравнение состояния идеального газа, поскольку RT – pV = p, и, следовательно, 
1.7.2. Аналитические методы
А). Аналитические методы основаны на подстановке в соотношение (1.47) уравнения состояния реального газа и аналитическом вычислении интеграла в правой части. Например, для газа Ван-дер-Ваальса после интегрирования получаем

Точность расчета фугитивности будет определяться точностью используемого уравнения состояния в исследуемом интервале p и T.
Б). Фугитивность газа можно приближенно определить на основе закона соответственных состояний (метод Ньютона). Согласно закону соответственных состояний, коэффициент фугитивности является универсальной функцией приведенных давления pr и температуры Tr. Зависимость ( pr, Tr) представляют в виде обобщенных диаграмм или уравнений, из которых легко определить коэффициент фугитивности (и фугитивность f = p), зная критические параметры газа.
Задачи и упражнения к главе 1
* Задачи, помеченные звездочкой, рекомендуется решать с помощью компьютера, оснащенного программой графической обработки экспериментальных данных, например, Excel, Origin или SigmaPlot.
1.1. Выразите уравнение состояния Ван-дер-Ваальса в виде вириального разложения по степеням 1/Vm и получите выражения для вириальных коэффициентов B2 и B3 через параметры a и b. Воспользуйтесь разложением: 1/(1–x) = 1 + x + x 2 + .
1.2. Уравнения (1.15) и (1.16) являются разложениями по степеням 1/Vm и p, соответственно. Найдите соотношение между B2, B3 и B2‘, B3‘.
1.3. Предложено следующее уравнение состояния:

Покажите, что это уравнение приводит к критическому поведению. Выразите критические константы газа через параметры B и C и получите выражение для фактора сжимаемости в критической точке.
1.4. Покажите, что для газа с жесткими молекулами сферической формы при учете только парных взаимодействий константа b в уравнении Ван-дер-Ваальса равна учетверенному собственному мольному объему молекул. Оцените значение b для Ne, если его молекулярный диаметр равен 0.258 нм.
1.5.* Покажите, что второй вириальный коэффициент и молярную массу газа можно получить, строя график p/ от p, где p – давление газа, – его плотность. Рассчитайте B2 для диметилового эфира, пользуясь следующими данными:
| р,Торр | 91,74 | 188,98 | 277,3 | 452,8 | 639,3 | 760,0 |
| ,г/л | 0,232 | 0,489 | 0,733 | 1,25 | 1,87 | 2,30 |
1.6.* Рассчитайте второй вириальный коэффициент для водорода при 0° C, пользуясь следующими данными:
| р, бар | 50,7 | 101,3 | 202,6 | 303,9 |
| V,л/моль | 0,4634 | 0,2386 | 0,1271 | 0,090 |
1.7.* Пользуясь правилом прямолинейного диаметра [уравнение (1.2)], определите критический мольный объем CCl4, используя следующие данные:
| t, o C | 100 | 150 | 200 | 250 | 270 | 280 |
| ж,г/см 3 | 1,4343 | 1,321 | 1,1888 | 0,9980 | 0,8666 | 0,7634 |
| п, г/см 3 | 0,0103 | 0,0304 | 0,0742 | 0,1754 | 0,2710 | 0,3597 |
Критическая температура CCl4 равна 283,1 o C.
1.8. Найдите 


1.9. Выведите выражение для работы изотермического обратимого расширения газа, подчиняющегося уравнению состояния Ван-дер-Ваальса.
1.10. Выведите выражение для работы изотермического обратимого расширения газа, подчиняющегося вириальному уравнению состояния (1.15).
1.11. Второй и третий вириальные коэффициенты в уравнении (1.15) для аргона при 273 К равны соответственно В2 = – 21,7 см 3 /моль и В3 = 1200 см 6 /моль 2 . Рассчитайте: а) работу обратимого изотермического расширения при этой температуре, б) работу расширения против постоянного давления 1 атм и в) работу расширения в предположении, что аргон ведет себя идеально. Примите, что Vm,1 = 500 см 3 и Vm,2 = 1000 см 3 .
1.12. Покажите, что работа изотермического обратимого расширения газа Ван-дер-Ваальса может быть выражена в виде приведенных переменных и что, определив приведенную работу как Ar = A3b/a, можно получить выражение, не зависящее от природы газа.
Литература к главе 1
1.М.П. Вукалович, И.И. Новиков
Уравнение состояния реальных газов
М.-Л., Госэнергоиздат, 1948.
2.В.И. Горшков, И.А. Кузнецов
Основы физической химии
М.: Изд-во Моск. ун-та, 1993.
3.Физическая химия / под ред. Б.П. Никольского
Л.: Химия, 1987.
4.Курс физической химии / под ред. Я.И. Герасимова. Т. 1
М.: Госхимиздат, 1963.
5.Е.Н. Еремин.
Основы химической термодинамики
М.: Высшая школа, 1978.
6.Е.М. Кузнецова, Е.П. Агеев
Термодинамика в вопросах и ответах
М.: Химический факультет МГУ, 1997.
7.Э. Мейсон, Е. Сперлинг
Вириальное уравнение состояния
М.: Мир, 1972
8.О.М. Полторак
Термодинамика в физической химии
М.: Высшая школа, 1991.
9.R.A. Alberty, R.J. Silbey
Physical Chemistry
Wiley, New York, 1997.
10.P.W. Atkins
Physical Chemistry
Oxford University Press, 1994.


Сервер создается при поддержке Российского фонда фундаментальных исследований
Не разрешается копирование материалов и размещение на других Web-сайтах
Вебдизайн: Copyright (C) И. Миняйлова и В. Миняйлов
Copyright (C) Химический факультет МГУ
Написать письмо редактору
Вириальные коэффициенты.







Вириальные коэффициенты.
- Вириальные коэффициенты. Сначала мы ограничиваемся изучением чистых газов, а затем переходим к смешанным газам. Высокоточное давление газа можно представить в виде ряда порядка 1 / v (а молярный объем равен V / p: Где B, C-только функция температуры. Количество терминов, необходимых для описания точек экспериментальных данных в пределах точности измерений, варьируется от 2 до 4 в зависимости от рассматриваемого интервала температур и давлений. Коэффициент/?, Таких как C, 2й, 3й и т. д., называется коэффициентом вириала.
nWrf ВР \ Во-вторых, коэффициент virpal имеет размерность объема на 1 моль. А в качестве единицы измерения объема часто выбирается единица мага а. Это, по определению, равно молярному объему газа при 0°С и 1 атм. Точное значение этой единицы зависит от природы рассматриваемого газа, но составляет приблизительно 22,4×10 см * / моль. И недавно, Б часто представлены непосредственно в СМ ^ / моль.
Для газа, который немного отличается от идеального, достаточно ограничить его первыми 2 участками разложения. Людмила Фирмаль
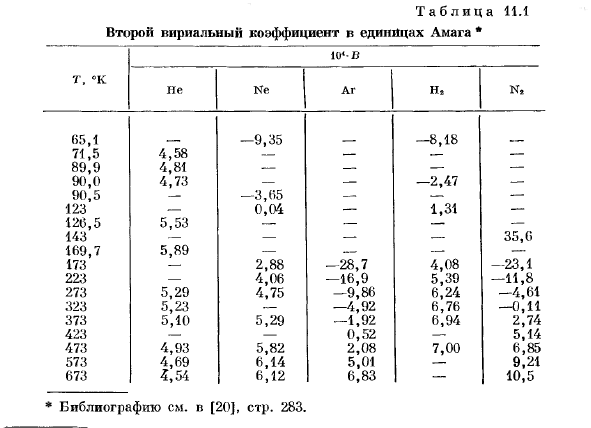
Внутри таблицы. 11.1 показано значение 2-го вириального коэффициента для некоторых нормальных газов в зависимости от температуры. 2-й вириальный коэффициент при низких температурах отрицательный, он увеличивается с температурой и становится положительным при высоких температурах. Температура при B = 0 называется температурой кипения. В статистической механике вириальный коэффициент может быть выражен в интегралах, которые определяются законом взаимодействия молекул газа 1.На рис. 11.1 схематично показана зависимость потенциальной энергии взаимодействия E (g)между 2 молекулами от расстояния r между центрами их притяжения. — При приближении молекулы сначала уменьшается потенциальная энергия. Это соответствует их притяжению и проходит минимальное значение при r = r * l, а затем быстро возрастает.
Аналитическое выражение потенциальной энергии кривой можно приближенно представить в виде суммы привлекательный потенциал, который изменяется пропорционально R-6 и отталкивающий потенциал, который изменяется пропорционально р〜р или Е〜кг. Очень быстро Рисунок 11.1. схематическое представление потенциальной энергии межмолекулярного взаимодействия как функции расстояния между молекулами g. Для приближенных расчетов можно использовать потенциал до бесконечности в растении r ® .
Из показаний B (T) при различных температурах находим e ® , особенно r *и минимальную глубину e. дело в том, что B (T) отрицательно при низких температурах и положительно при высоких температурах заключается в том, что интегральное значение уравнения низкой температуры (11.15) в значительной степени определяется значением R, где e ® отрицательно, а при высоких температурах e ® положительно, область r играет важную роль. Формула для 3-го вириального коэффициента была получена de Boerom2 и Montroll. М и 3 основная свободная энергия ослабляет нсидеалпого газа, что выражается во втором вириальном коэффициенте. Применяя (7.11) и (11.14), получаем Гонка 11.2.
Принципиальная схема потенциальной энергии межмолекулярного взаимодействия (приближение твердой сферы). (11.16) (11.17) Химический потенциал идеального газа определяется по формуле (10.11 Где p16-давление, создаваемое идеальным газом n моль объема T7, so= hRT / ’ V. By подставляя эти выражения для (11.17)、 Широта / ЗРТ * 2 РТРС с = ХТ(г)+ RTln-+. (11.18) Молярная энтропия газа определяется по формуле S 1 (dF\, a lH / m dB \ Где s и d-энтропия тех же T и V, Если газ ведет себя как идеальный газ. Это значение может быть вычислено по формуле (11.19), если известно уравнение состояния и$измеряется калорически (см. Главу 9). таким образом, было найдено исправление, которое использовалось в численных расчетах Sec. JX.
Вместо разложения ряда давлений газа по степеням 1 / y объем газа можно представить в виде ряда стенок. В = ^(1 + б ’п + с’ Р2 + …(11.20).) Где, B’, C1… — функция температуры. Для неидеальных газов вы можете игнорировать все термины, начиная с p2, и вычислить свободную энергию Гиббса. ДФР = шь’/’ / / >、* В-В [Д = firmb \ И согласно (11.8)、 С. С. Г (т, п, н)= КЦ ^(л \ р, п)+ \ \ м ж «нртб» ’ДП = Г(Т, Пина)+пПТВ’р. ^ п *(11.21) Для однокомпонентных систем Г = п \ я,(11.22) И затем… li (T, p)= p * BT, p)+ R TV’R. используйте (11.23) (10.11), чтобы получить p = ^ t(71) 4-R7-In p + bBTp. (11.24) Коэффициент (11.20)/?’, С ’ г…
- Может быть выражен вириальным коэффициентом формулы (-11.13).Это можно легко проверить на примере 2-го дополнительного коэффициента. Из уравнения (d ’ 1.13)、 R T v С другой стороны, (11.20) ПВ = 1 + и P +. (л, б \ Р Т Если вы игнорируете членов высшего порядка、 Б = р б ’ Ри. Итак, используя правильное приближение, вы можете написать: C = попадание. В этом приближении вместо (11.20)、 R5T /. 。 П. С. Или В = ВЛД + Б Таким образом, 2-й вириальный коэффициент приблизительно равен разнице между молярным объемом фактического газа и идеального газа при одинаковой температуре и давлении. Наконец, рассмотрим смесь 2 слабых и неидеальных газов, которые не взаимодействуют химически. Формулу (11.14) следует записать в более общем виде, так как необходимо учитывать взаимодействие между идентичными и разными молекулами. ю | л р. г р = ±(Vishch + 2Vapm + Вла).
Фактор B \ \ относится к взаимодействию между молекулами типа 1, # 12-к взаимодействию между неравными молекулами 1 и 2, а Vuj-к взаимодействию между молекулами типа 2.При переходе к мольной концентрации 、 Р = + 2JW * + м ^). (11.27) к V ^ Если мы сравним полученную формулу с (11.14), то увидим, что 2-й коэффициент вири-ал смеси можно определить как функцию 2-го порядка от молярной доли. Б = Бин \ + 2Bi2xtx2 + BiXxi(11.28) Следует подчеркнуть, что для определения 2-го вириального коэффициента смеси недостаточно знать вириальный коэффициент каждого чистого газа, а также необходимо знать дополнительно.
В этом случае коэффициенты в \ ч, статистической механики вытекает уравнения, например, (11.15) N 0 КТГ(Т)= — $(1-е-MrVkT)^(11.29) И Где eig ® — энергия взаимодействия между молекулами 1 и 2.So по крайней мере, как правило, исследование вириального коэффициента двойной газовой смеси позволяет определить не только энергию взаимодействия En и 822 между молекулами одного типа, но и энергию 6i2.Однако в этом направлении проделано мало работ2.
Как и раньше, вы можете найти свободную энергию смеси. Людмила Фирмаль
/ «=я- + кг * »» ’(11.30) И химический потенциал обоих ингредиентов: 1 * 1 = я я = | * я + 2Р » — й —- V dhz) Tf v>Пж ^ V Из \и _ _ _ Впщ + V9Up2 !12. Ф-О Г \ ИД Л — М-4- = () = М2 + 2R71″ DN2 по)Т, Т (11.31) Используя последнее уравнение (10.34) t, можно также придать следующий вид: Я… = г(т)+ Р71 в + 2RT (11.32)) В. 1 Фаулер и Гуггенхайм [20), стр. 2. М. См. Newitt. Конструкция установки высокого давления (Оксфорд.1940); И. А. Beafr-галстук, У. Stokmayer. Ж. Chcm. Физика., 10, 473(1942); K. J. Lumbeck, A. J. II. Boerboom Physica, 17, 7G(1951).




















































Образовательный сайт для студентов и школьников
Копирование материалов сайта возможно только с указанием активной ссылки «www.lfirmal.com» в качестве источника.
© Фирмаль Людмила Анатольевна — официальный сайт преподавателя математического факультета Дальневосточного государственного физико-технического института
http://www.chem.msu.ru/rus/teaching/realgases/chap1(7).html
http://lfirmal.com/virialnye-koehfficienty/