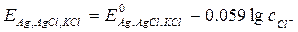Влияние различных факторов на потенциал уравнение нернста
4.2. ОСНОВНЫЕ ФАКТОРЫ, ВЛИЯЮЩИЕ НА ПОТЕНЦИАЛ
Рассчитанный по уравнению Нернста равновесный потенциал зависит прежде всего от соотношения концентраций окисленной и восстановленной форм рассматриваемой полуреакции: увеличение концентрации окисленной формы, также как уменьшение концентрации восстановленной формы, приводит к возрастанию потенциала. Однако эти изменения потенциала сравнительно невелики. Например для n =1 увеличение концентрации окисленной формы в 1000 раз приводит к изменению потенциала на (0,059/ n ) lg 1000 ≈ 0,188В.
Во многих окислительно-восстановительных реакциях участвуют ионы водорода (гидроксония)
Cr 2 O 7 2- +14 H + + 6 e — = 2 Cr 3+ + 7 H 2 O .
Для полуреакции в общем виде имеем:
В соответствии с уравнением Нернста потенциал выражается следующим образом:
Отсюда видно, что изменение концентрации ионов водорода в процессе химического взаимодействия вносит существенный вклад в изменение потенциала окислительно-восстановительной системы.
В тех случаях, когда в окислительной или восстановительной полуреакции ионы водорода не принимают непосредственного участия, они могут влиять на состояние ионов окисленной и восстановленной форм в растворе, тем самым изменяя потенциал.
Значение рН среды иногда определяет возможность осуществления окислительно-восстановительной реакции и использование ее в аналитической химии. Например, в зависимости от кислотности раствора реальный потенциал восстановления перманганата принимает следующие значения: рН =0, Е=1,51 В; рН=3, Е=1,23 В; рН=6, Е=0,93 В. Учитывая это, можно использовать перманганат калия для дифференцированного окисления следующих окислительно-восстановительных систем: Е ° С l 2/2 Cl — = 1,36 В; Е ° Br 2/2 Br — = 1,09 В ; Е ° I 2/2 I — =0,54 В. При рН =6 окисляется только I — , при рН=3 – I — и Br — , тогда как при рН=0 окислить можно все три иона.
На значение потенциала существенное влияние оказывают любые побочные химические процессы, в которых участвуют окисленная и восстановленная формы. Часто такими процессами являются реакции комплексообразования, при которых возможно существование в растворе ряда комплексных соединений. Обычно наиболее склонна к реакциям комплексообразования окисленная форма, в результате чего потенциал системы и окислительные свойства уменьшаются. Эту зависимость потенциала от концентрации комплесообразующего реагента широко используют в аналитической практике для регулирования окислительно-восстановительных свойств различных систем. Например, при титровании раствора, содержащего ионы Fe 2+ , раствором бихромата калия в присутствии дифениламина комплексообразование используется для снижения индикаторной ошибки.
Изменение стандартного (реального) потенциала вследствие реакции комплексообразования используют для стабилизации в растворе ионов металлов. Например, некоторые неорганические лиганды стабилизируют ионы Fe 3+ , а органические лиганды – ионы Fe 2+ .
Как следует из уравнения Нернста, потенциал системы зависит от температуры (предлогарифмический множитель). Наиболее существенно влияние температуры на потенциал окислительно-восстановительных систем, включающих гетерогенную фазу. Кроме того, значительное влияние температура оказывает на скорость окислительно-восстановительных реакций.
Факторы, влияющие на величину электродного потенциала
Электродный равновесный потенциал зависит от следующих основных факторов.
От природы металла. Чем большей химической активностью обладает данный металл, тем в большей степени равновесие (4.1) смещено вправо, тем отрицательнее потенциал.
От концентрации ионов металла в растворе.Переход ионов металла в раствор происходит тем интенсивнее, чем меньше концентрация катионов в растворе. Наоборот, с увеличением концентрации раствора равновесие (4.1) смещается влево и потенциал становится более положительным.
От температуры. С повышением температуры потенциал становится более положительным, т.е. равновесие (4.1) смещается влево.
Зависимость величины потенциала от указанных факторов выражается уравнением Нернста:
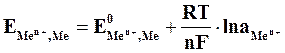
где 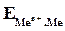
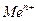
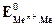
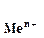
Если в уравнение (4.2) подставить значения постоянных R, F, принять температуру для стандартных условий (Т 0 = 298К) и перейти от натуральных к десятичным логарифмам, получим:
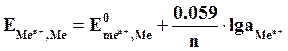
Из уравнения (4.3) следует, что стандартный электродный потенциал (E 0 ) – это потенциал электрода при стандартных условиях: 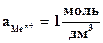
Величина (Е 0 ) характеризует химическую активность металла.
4.4. Типы электродов
В зависимости от свойств веществ, участвующих в электродных процессах, все электроды можно разделить на несколько типов.
Электроды первого рода. К этому типу относятся все металлические электроды в водородный электрод. Условное обозначение таких электродов: Ме|Ме n + , например Cu|Cu 2+ , водородный: (Pt)H2|H + . Вертикальная черта символизирует поверхность раздела фаз. Общим для этих электродов является то, что в равновесии на электроде участвуют нейтральные атомы (или молекулы) и один вид катионов. Такие электроды являются обратимыми относительно катионов.
Электроды второго рода.Такие электроды состоят из трех фаз: металл покрыт слоем труднорастворимой соли этого металла, а в растворе, куда он опущен, находятся те же анионы, которые входят в состав труднорастворимой соли.
Например, хлорсеребряный электрод: Ag, AgCl|KCl; каломельный электрод: Hg, Hg2Cl2|KCl.
Между твердой фазой и раствором на этих электродах возникают следующие равновесия:
Ag + Cl − − ē D AgCl
В отличие от электродов первого рода здесь в равновесии участвуют анионы, т.е. электроды второго рода обратимы относительно анионов. Величина потенциала этих электродов зависит от концентрации анионов:
Эти электроды в лабораторной практике обычно используют в качестве электродов сравнения.
Окислительно-восстановительные электроды. Эти электроды представляют собой пластинку из благородного металла (чаще всего платины), погруженную в раствор, содержащий ионы одного элемента в разной степени окисления. Например, Pt|Fe 3+ , Fe 2+ ; Pt|Sn 4+ , Sn 2+ .
На поверхности платины происходит обмен электронами между ионами и устанавливаются равновесия:
Sn 2+ − 2ē D Sn 4+
Платина в этих равновесиях не участвует и играет роль переносчика электронов. Величина потенциала может быть рассчитана по уравнению Нернста:
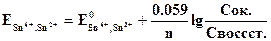
где 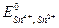
Величина стандартного окислительно-восстановительного потенциала характеризует свойства окислителей и восстановителей, а именно:
чем выше Е 0 , тем более сильным окислителем являются ионы в высшей степени окисления;
Дата добавления: 2015-09-28 ; просмотров: 12326 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Окислительно — восстановительный потенциал
Электродные потенциалы. ЭДС реакции
Окислительно — восстановительный потенциал является частным, узким случаем понятия электродного потенциала. Рассмотрим подробнее эти понятия.
В ОВР передача электронов восстановителями окислителям происходит при непосредственном контакте частиц, и энергия химической реакции переходит в теплоту.
Энергия любой ОВР, протекающей в растворе электролита, может быть превращена в электрическую энергию, если, например, окислительно-восстановительные процессы разделить пространственно, т.е. передача электронов восстановителем будет происходить через проводник электричества.
Это реализовано в гальванических элементах, где электрическая энергия получается из химической энергии окислительно-восстановительной реакции.
Элемент Даниэля-Якоби
Рассмотрим гальванический элемент Даниэля-Якоби, в котором левый сосуд наполнен раствором сульфата цинка ZnSO4, с опущенной в него цинковой пластинкой, а правый сосуд – раствором сульфата меди CuSO4, с опущенным в него медной пластинкой.
Взаимодействие между раствором и пластиной, которая выступает в качестве электрода, способствует тому, чтобы электрод приобрел электрический заряд.
Возникающая на границе металл-раствор электролита разность потенциалов, называется электродным потенциалом. Значение и знак (+ или -) электродного потенциала определяются природой раствора и находящегося в нем металла.
При погружении металлов в растворы их солей более активные из них (Zn, Fe и др.) заряжаются отрицательно, а менее активные (Cu, Ag, Au и др.) положительно.
Результатом соединения цинковой и медной пластинки проводником электричества, является возникновение в цепи электрического тока за счет перетекания электронов с цинковой к медной пластинке по проводнику.
При этом происходит уменьшение количества электронов в цинке, что компенсируется переходом Zn 2+ в раствор т.е. происходит растворение цинкового электрода — анода (процесс окисления).
Zn — 2e — = Zn 2+
В свою очередь, рост количества электронов в меди компенсируется разряжением ионов меди, содержащихся в растворе, что приводит к накоплению меди на медном электроде – катоде (процесс восстановления):
Cu 2+ + 2e — = Cu
Таким образом, в элементе Даниэля-Якоби происходит такая реакция:
Zn + Cu 2+ = Zn 2+ + Cu
Zn + CuSO4 = ZnSO4 + Cu
Количественно охарактеризовать окислительно-восстановительные процессы позволяют электродные потенциалы, измеренные относительно нормального водородного электрода (его потенциал принят равным нулю).
Чтобы определить стандартные электродные потенциалы используют элемент, одним из электродов которого является испытуемый металл (или неметалл), а другим является водородный электрод. По найденной разности потенциалов на полюсах элемента определяют нормальный потенциал исследуемого металла.
Окислительно-восстановительный потенциал
Значениями окислительно-восстановительного потенциала пользуются в случае необходимости определения направления протекания реакции в водных или других растворах.
2Fe 3+ + 2I — = 2Fe 2+ + I2
таким образом, чтобы йодид-ионы и ионы железа обменивались своими электронами через проводник.
В сосуды, содержащие растворы Fe 3+ и I — , поместим инертные (платиновые или угольные) электроды и замкнем внутреннюю и внешнюю цепь. В цепи возникает электрический ток.
Йодид-ионы отдают свои электроны, которые будут перетекать по проводнику к инертному электроду, погруженному в раствор соли Fe 3+ :
2I — — 2e — = I2
2Fe 3+ + 2e — = 2Fe 2+
Процессы окисления-восстановления происходят у поверхности инертных электродов. Потенциал, который возникает на границе инертный электрод – раствор и содержит как окисленную, так восстановленную форму вещества, называется равновесным окислительно-восстановительным потенциалом.
Факторы, влияющие на значение окислительно-восстановительного потенциала
Значение окислительно-восстановительного потенциала зависит от многих факторов, в том числе и таких как:
1) Природа вещества (окислителя и восстановителя)
2) Концентрация окисленной и восстановленной форм.
При температуре 25°С и давлении 1 атм. величину окислительно-восстановительного потенциала рассчитывают с помощью уравнения Нернста:
E – окислительно-восстановительный потенциал данной пары;
E°- стандартный потенциал (измеренный при Cок = Cвос);
R – газовая постоянная (R = 8,314 Дж);
T – абсолютная температура, К
n – количество отдаваемых или получаемых электронов в окислительно-восстановительном процессе;
F – постоянная Фарадея (F = 96484,56 Кл/моль);
Cок – концентрация (активность) окисленной формы;
Cвос– концентрация (активность) восстановленной формы.
Подставляя в уравнение известные данные и перейдя к десятичному логарифму, получим следующий вид уравнения:
При Cок > Cвос, E > E° и наоборот, если Cок 2- , CrO4 2- , MnO4 — ) при уменьшении pH раствора окислительно-восстановительный потенциал возрастает, т.е. потенциал растет с ростом H + . И наоборот, окислительно-восстановительный потенциал падает с уменьшением H + .
4) Температура
При увеличении температуры окислительно-восстановительный потенциал данной пары также растет.
Стандартные окислительно-восстановительные потенциалы представлены в таблицах специальных справочников. Следует иметь ввиду, что рассматриваются только реакции в водных растворах при температуре ≈ 25°С.
Такие таблицы дают возможность сделать некоторые выводы:
Что можно определить по значению окислительно-восстановительного потенциала
- Величина и знак стандартных окислительно-восстановительных потенциалов, позволяют предсказать какие свойства (окислительные или восстановительные) будут проявлять атомы, ионы или молекулы в химических реакциях, например
E°(F2/2F — ) = +2,87 В – сильнейший окислитель
E°(K + /K) = — 2,924 В – сильнейший восстановитель
Окислительно-восстановительная пара будет обладать тем большей восстановительной способностью, чем больше числовое значение ее отрицательного потенциала, а окислительная способность тем выше, чем больше положительный потенциал.
- Возможно определить какое из соединений одного элемента будет обладать наиболее сильным окислительными или восстановительными свойствами.
- Возможно предсказать направление ОВР. Известно, что работа гальванического элемента имеет место при условии, что разность потенциалов имеет положительное значение. Протекание ОВР в выбранном направлении также возможно, если разность потенциалов имеет положительное значение. ОВР протекает в сторону более слабых окислителей и восстановителей из более сильных, например, реакция
Sn 2+ + 2Fe 3+ = Sn 4+ + 2Fe 2+
практически протекает в прямом направлении, т.к.
E° (Sn 4+ /Sn 2+ ) = +0,15 В,
E° (Fe 3+ /Fe 2+ ) = +0,77 В,
т.е. E° (Sn 4+ /Sn 2+ ) 3+ /Fe 2+ ).
Cu + Fe 2+ = Cu 2+ + Fe
невозможна в прямом направлении и протекает только справа налево, т.к.
В процессе ОВР количество начальных веществ уменьшается, вследствие чего Е окислителя падает, а E восстановителя возрастает. При окончании реакции, т.е. при наступлении химического равновесия потенциалы обоих процессов выравниваются.
- Если при данных условиях возможно протекание нескольких ОВР, то в первую очередь будет протекать та реакция, у которой разность окислительно-восстановительных потенциалов наибольшая.
- Пользуясь справочными данными, можно определить ЭДС реакции.
Как определить электродвижущую силу (ЭДС) реакции?
Рассмотрим несколько примеров реакций и определим их ЭДС:
- Mg + Fe 2+ = Mg 2+ + Fe
- Mg + 2H + = Mg 2+ + H2
- Mg + Cu 2+ = Mg 2+ + Cu
E° (Mg 2+ /Mg) = — 2,36 В
E° (Fe 2+ /Fe) = — 0,44 В
Чтобы определить ЭДС реакции, нужно найти разность потенциала окислителя и потенциала восстановителя
ЭДС = Е 0 ок — Е 0 восст
- ЭДС = — 0,44 — (- 2,36) = 1,92 В
- ЭДС = 0,00 — (- 2,36) = 2,36 В
- ЭДС = + 0,34 — (- 2,36) = 2,70 В
Все вышеуказанные реакции могут протекать в прямом направлении, т.к. их ЭДС > 0.
Связь константы равновесия и окислительно — восстановительного потенциала
Если возникает необходимость определения степени протекания реакции, то можно воспользоваться константой равновесия.
Например, для реакции
Zn + Cu 2+ = Zn 2+ + Cu
Применяя закон действующих масс, можно записать
Здесь константа равновесия К показывает равновесное соотношение концентраций ионов цинка и меди.
Значение константы равновесия можно вычислить, применив уравнение Нернста
Подставим в уравнение значения стандартных потенциалов пар Zn/Zn 2+ и Cu/Cu 2+ , находим
В состоянии равновесия E 0 Zn/Zn2+ = E 0 Cu/Cu2+, т.е.
-0,76 + (0,59/2)lgCZn2+ = +0,34 + (0,59/2)lgCCu2+, откуда получаем
Значение константы равновесия показывает, что реакция идет практически до конца, т.е. до того момента, пока концентрация ионов меди не станет в 10 37,7 раз меньше, чем концентрация ионов цинка.
Константа равновесия и окислительно-восстановительный потенциал связаны общей формулой:
lgK = (E1 0 -E2 0 )n/0,059, где
K — константа равновесия
E1 0 и E2 0 – стандартные потенциалы окислителя и восстановителя соответственно
n – число электронов, отдаваемых восстановителем или принимаемых окислителем.
Если E1 0 > E2 0 , то lgK > 0 и K > 1.
Следовательно, реакция протекает в прямом направлении (слева направо) и если разность (E1 0 — E2 0 ) достаточно велика, то она идет практически до конца.
Напротив, если E1 0 0 , то K будет очень мала.
Реакция протекает в обратном направлении, т.к. равновесие сильно смещено влево. Если разность (E1 0 — E2 0 ) незначительна, то и K ≈ 1 и данная реакция не идет до конца, если не создать необходимых для этого условий.
Зная значение константы равновесия, не прибегая к опытным данным, можно судить о глубине протекания химической реакции. Следует иметь ввиду, что данные значений стандартных потенциалов не позволяют определить скорость установления равновесия реакции.
По данным таблиц окислительно-восстановительных потенциалов возможно найти значения констант равновесия примерно для 85000 реакций.
Как составить схему гальванического элемента?
Приведем рекомендации ИЮПАК, которыми следует руководствоваться, чтобы правильно записать схемы гальванических элементов и протекающие в них реакции:
- ЭДС элемента — величина положительная, т.к. в гальваническом элементе работа производится.
- Значение ЭДС гальванической цепи – это сумма скачков потенциалов на границах раздела всех фаз, но, учитывая, что на аноде происходит окисление, то из значения потенциала катода вычитают значение потенциала анода.
Таким образом, при составлении схемы гальванического элемента слева записывают электрод, на котором происходит процесс окисления (анод), а справа – электрод, на котором происходит процесс восстановления (катод).
- Граница раздела фаз обозначается одной чертой — |
- Электролитный мостик на границе двух проводников обозначается двумя чертами — ||
- Растворы, в которые погружен электролитный мостик записываются слева и справа от него (если необходимо, здесь же указывается концентрация растворов). Компоненты одной фазы, при этом записываются через запятую.
Например, составим схему гальванического элемента, в котором осуществляется следующая реакция:
Fe 0 + Cd 2+ = Fe 2+ + Cd 0
В гальваническом элементе анодом является железный электрод, а катодом – кадмиевый.
Анод Fe 0 |Fe 2+ || Cd 2+ |Cd 0 Катод
Типичные задачи на составление схем гальванического элемента и вычисление ЭДС реакции с решениями вы найдете здесь.
http://helpiks.org/5-38376.html
http://zadachi-po-khimii.ru/obshaya-himiya/okislitelno-vosstanovitelnyj-potencial.html