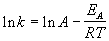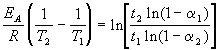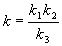Влияние температуры на скорость реакции уравнение аррениуса
Из качественных соображений понятно, что скорость реакций должна увеличиваться с ростом температуры, т.к. при этом возрастает энергия сталкивающихся частиц и повышается вероятность того, что при столкновении произойдет химическое превращение. Для количественного описания температурных эффектов в химической кинетике используют два основных соотношения — правило Вант-Гоффа и уравнение Аррениуса.
Правило Вант-Гоффа заключается в том, что при нагревании на 10 о С скорость большинства химических реакций увеличивается в 2 
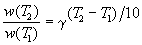
где 


Гораздо более точным является уравнение Аррениуса, описывающее температурную зависимость константы скорости:
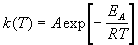
где R — универсальная газовая постоянная; A — предэкспоненциальный множитель, который не зависит от температуры, а определяется только видом реакции; EA — энергия активации, которую можно охарактеризовать как некоторую пороговую энергию: грубо говоря, если энергия сталкивающихся частиц меньше EA, то при столкновении реакция не произойдет, если энергия превышает EA, реакция произойдет. Энергия активации не зависит от температуры.
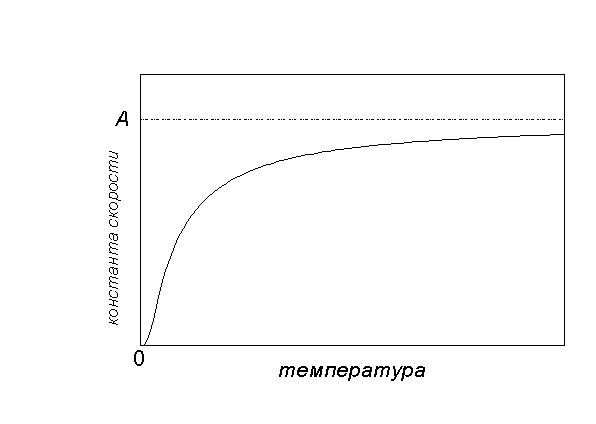
Графически зависимость k(T) выглядит следующим образом:
При низких температурах химические реакции почти не протекают: k(T) 

Энергию активации можно определить, измерив константу скорости при двух температурах. Из уравнения (4.2) следует:
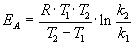
Более точно энергию активации определяют по значениям константы скорости при нескольких температурах. Для этого уравнение Аррениуса (4.2) записывают в логарифмической форме
и записывают экспериментальные данные в координатах ln k — 1/T. Тангенс угла наклона полученной прямой равен —EA / R.
Для некоторых реакций предэкспоненциальный множитель слабо зависит от температуры. В этом случае определяют так называемую опытную энергию активации:
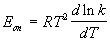
Если предэкспоненциальный множитель — постоянный, то опытная энергия активации равна аррениусовской энергии активации: Eоп = EA.
Пример 4-1. Пользуясь уравнением Аррениуса, оцените, при каких температурах и энергиях активации справедливо правило Вант-Гоффа.
Решение. Представим правило Вант-Гоффа (4.1) как степенную зависимость константы скорости:
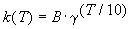
где B — постоянная величина. Сравним это выражение с уравнением Аррениуса (4.2), приняв для температурного коэффициента скорости значение
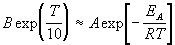
Возьмем натуральный логарифм обеих частей этого приближенного равенства:
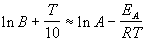
Продифференцировав полученное соотношение по температуре, найдем искомую связь связь между энергией активации и температурой:
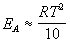
Если энергия активации и температура примерно удовлетворяют этому соотношению, то правилом Вант-Гоффа для оценки влияния температуры на скорость реакции пользоваться можно.
Пример 4-2. Реакция первого порядка при температуре 70 о С завершается на 40% за 60 мин. При какой температуре реакция завершится на 80% за 120 мин, если энергия активации равна 60 кДж/моль?
Решение. Для реакции первого порядка константа скорости выражается через степень превращения следующим образом:
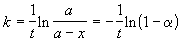
где a = x/a — степень превращения. Запишем это уравнение при двух температурах с учетом уравнения Аррениуса:
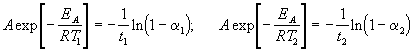
где EA = 60 кДж/моль, T1 = 343 K, t1 = 60 мин, a 1 = 0.4, t2 = 120 мин, a 2 = 0.8. Поделим одно уравнение на другое и прологарифмируем:
Подставляя в это выражение приведенные выше величины, находим T2 = 333 К = 60 о С.
Пример 4-3. Скорость бактериального гидролиза мышц рыб удваивается при переходе от температуры -1.1 о С к температуре +2.2 о С. Оцените энергию активации этой реакции.
Решение. Увеличение скорости гидролиза в 2 раза обусловлено увеличением константы скорости: k2 = 2k1. Энергию активации по отношению констант скорости при двух температурах можно определить из уравнения (4.3) с T1 = t1 + 273.15 = 272.05 K, T2 = t2 + 273.15 = 275.35 K:
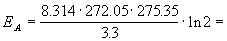
4-1. При помощи правила Вант-Гоффа вычислите, при какой температуре реакция закончится через 15 мин, если при 20 о С на это требуется 2 ч. Температурный коэффициент скорости равен 3.(ответ)
4-2. Время полураспада вещества при 323 К равно 100 мин, а при 353 К — 15 мин. Определите температурный коэффициент скорости.(ответ)
4-3. Какой должна быть энергия активации, чтобы скорость реакции увеличивалась в 3 раза при возрастании температуры на 10 0 С а) при 300 К; б) при 1000 К?(ответ)
4-4. Реакция первого порядка имеет энергию активации 25 ккал/моль и предэкспоненциальный множитель 5 . 10 13 сек -1 . При какой температуре время полураспада для данной реакции составит: а) 1 мин; б) 30 дней?(ответ)
4-5. В каком из двух случаев константа скорости реакции увеличивается в большее число раз: при нагревании от 0 о С до 10 о С или при нагревании от 10 о С до 20 о С? Ответ обоснуйте с помощью уравнения Аррениуса.(ответ)
4-6. Энергия активации некоторой реакции в 1.5 раза больше, чем энергия активации другой реакции. При нагревании от T1 до T2 константа скорости второй реакции увеличилась в a раз. Во сколько раз увеличилась константа скорости первой реакции при нагревании от T1 до T2?(ответ)
4-7. Константа скорости сложной реакции выражается через константы скорости элементарных стадий следующим образом:
Выразите энергию активации и предэкспоненциальный множитель сложной реакции через соответствующие величины, относящиеся к элементарным стадиям.(ответ)
4-8. В необратимой реакции 1-го порядка за 20 мин при 125 о С степень превращения исходного вещества составила 60%, а при 145 o C такая же степень превращения была достигнута за 5.5 мин. Найдите константы скорости и энергию активации данной реакции .(ответ)
4-9. Реакция 1-го порядка при температуре 25 о С завершается на 30% за 30 мин. При какой температуре реакция завершится на 60% за 40 мин, если энергия активации равна 30 кДж/моль?(ответ)
4-10. Реакция 1-го порядка при температуре 25 о С завершается на 70% за 15 мин. При какой температуре реакция завершится на 50% за 15 мин, если энергия активации равна 50 кДж/моль?(ответ)
4-11. Константа скорости реакции первого порядка равна 4.02 . 10 -4 с -1 при 393 К и 1.98 . 10 -3 с -1 при 413 К. Рассчитайте предэкспоненциальный множитель для этой реакции.(ответ)
4-12. Для реакции H2 + I2 
4-13. Для реакции 2N2O 
4-14. Трихлорацетат-ион в ионизирующих растворителях, содержащих H + , разлагается по уравнению
H + + CCl3COO — 
Стадией, определяющей скорость реакции, является мономолекулярный разрыв связи C- C в трихлорацетат-ионе. Реакция протекает по первому порядку, и константы скорости имеют следующие значения: k = 3.11 . 10 -4 с -1 при 90 о С, k = 7.62 . 10 -5 с -1 при 80 о С. Рассчитайте а) энергию активации, б) константу скорости при 60 о С.(ответ)
4-15. Для реакции CH3COOC2H5 + NaOH ѕ 
4-16. Для реакции C12H22O11 + H2O 
4-17. Вещество разлагается двумя параллельными путями с константами скорости k1 и k2. Какова разность энергий активации этих двух реакций, если при 10 o C k1/k2 = 10, а при 40 o C k1/k2 = 0.1?(ответ)
4-18. В двух реакциях одинакового порядка разница энергий активации составляет E2 — E1 = 40 кДж/моль. При температуре 293 К отношение констант скорости равно k1/k2 = 2. При какой температуре константы скорости сравняются?(ответ)
4-19. Разложение ацетондикарбоновой кислоты в водном растворе — реакция первого порядка. Измерены константы скорости этой реакции при разных температурах:
T, о С
k. 10 5 , с -1
Рассчитайте энергию активации и предэкспоненциальный множитель. Чему равен период полураспада при 25 о С? (ответ)


Сервер создается при поддержке Российского фонда фундаментальных исследований
Не разрешается копирование материалов и размещение на других Web-сайтах
Вебдизайн: Copyright (C) И. Миняйлова и В. Миняйлов
Copyright (C) Химический факультет МГУ
Написать письмо редактору
Лекция 8 Влияние температуры на скорость химических реакций. Теория активных столкновений. Основные понятия теории активированного комплекса
Лекция 8 Влияние температуры на скорость химических реакций. Теория активных столкновений. Основные понятия теории активированного комплекса.
Температура сильно влияет на скорость химической реакции. Наблюдается несколько типов зависимости скорости реакции от температуры:
а – нормальный характер зависимости, когда с увеличением температуры происходит быстрое возрастание скорости;
б – гетерогенные реакции в диффузионной области;
в – зависимость характерная для взрывчатых процессов (скачек скорости реакции при достижении температуры воспламенения);
г – каталитическая реакция, скорость которой определяется скоростью адсорбции (количество адсорбированного вещества уменьшается с возрастанием температуры);
д – характерная кривая для реакций, осложненных побочными процессами, скорость которых становиться значительной при высоких температурах;
е – скорость реакции уменьшается с повышением температуры, например для O2 + NO, при которой более полному равновесному превращению способствуют более низкие температуры.
Следует сказать, что зависимость типа а – характерна для простых реакций, другие же типы температурной зависимости – для сложных реакций или реакций, на протекание которых влияет скорость физических процессов.
ЭНЕРГИЯ АКТИВАЦИИ
В 1884г. Вант-Гофф установил из равенства 


Если принять, что 


Если константа I= 0, то после интегрирования получим уравнение:



где 
В 1889г. Аррениус определил, что почти для всех реакций графики зависимости lnk от 1/T представляют собой прямые линии (см. Рис. 2). Впоследствии было выведено уравнение:


При сравнении уравнений (35) и (36) очевидно, что E/RT=2,303a. Аррениус считал, чтоЕ представляет собой разность энергий исходных реагентов и реагентов в активированном виде. Он предполагал также, что I=0, так как это соответствовало результатам его обработки для большинства известных тогда реакций. В 1909г. Величина Е была названа Траутцемэнергией активации. Она является характеристикой реакции и определяет влияние температуры на скорость реакции. Из уравнения (35) видно, что константами характеризующими реакцию, являются предэкспонициальный множительА и энергия активации Е. Когда реакцию проводят при двух различных температурах Т1и Т2 , то уравнение (35) можно записать в следующем виде: 
Рис.2. График (зависимость) Аррениуса.
Параметр Е в случае простых реакций, протекающих в одну стадию показывает какой минимальной энергией, в расчете на 1 моль, должны обладать реагирующие молекулы, чтобы они могли вступить в реакцию.
В случае сложных реакций или реакций протекающих в несколько стадий Е не имеет строгого физического смысла и является некоторой функцией энергии активации отдельных стадий, обычно называемой эмпирической (кажущейся) энергией активации.
Никакой особой формы энергии, отвечающей энергии активации в молекулах нет. Энергия активации это то избыточное количество энергии (по сравнению со средней величиной), которой должна обладать молекула в момент столкновения, чтобы быть способной к химическому взаимодействию.
Избыточная энергия может быть:
Повышенная кинетическая энергия вращательного или поступательного движения. Повышенная энергия взаимного колебания атомов или атомных групп в молекулах. Повышенная энергия движения электронов.
Так, например, повышенная энергия движения электронов может достигаться при поглощении света (или от воздействия электромагнитных полей). Энергия электронов в атомах может повышаться при разрыве валентной связи (диссоциации, образование свободных радикалов или других атомов с ненасыщенной валентностью, при ударе молекул о стеку сосуда, электроразряд, ультразвук, излучения и т. д.). Обычно при рассмотрении вопросов химической кинетики приходиться иметь дело с системами, в которых доля активных молекул N*/N = 10-10 – 10-20. Если меньше – скорость реакции чрезвычайно мала, если больше – реакция протекает со взрывом.
ТЕОРИЯ СОУДАРЕНИЙ
В 1918г. Льюис предположил, что для протекания реакции А + В = АВ должны столкнуться две молекулы А и В. Поэтому, зная число столкновений, можно, казалось бы, рассчитать скорость химической реакции. Однако если сравнить расчетное число соударяющихся молекул с числом реагирующих молекул, которое определяется экспериментально, то обнаруживаются два противоречия. Во-первых, число соударений примерно в 1017 раз больше числа реагирующих молекул, т. е. из каждых 1017 соударений только одно соударение является эффективным в осуществлении реакции. Во-вторых, в то время как при повышении температуры на 100С число бинарных столкновений увеличивается примерно на 2%, скорость химической реакции возрастает на 200-300%.
Эти противоречия были разрешены при допущении, что реакция происходила только в том случае, если соударяющиеся молекулы обладали некоторой избыточной энергией; все остальные соударения неэффективны и не приводят к химической реакции, т. е. скорость реакции равна общему числу соударений, умноженному на долю эффективных соударений. Это допущение опиралось на изучение: 1) распределения скоростей реагирующих молекул и 2) влияния температуры.
Закон распределения скоростей. Все молекулы газа движутся с различными скоростями из-за частых соударений. Между молекулами постепенно происходит взаимообмен количеством движения и, следовательно, их скорости изменяются: одни молекулы увеличивают свою скорость, другие – уменьшают. Математический закон, которому подчиняется распределение скоростей и энергий, был найден Максвеллом и Больцманом в 1860г. Согласно этому закону, доля ΔN/N молекул, обладающих большими скоростями, чем средняя скорость и, или кинетической энергией, превышающей величину Ѕ mи2, составляет:

где k’ – константа Больцмана;u — средняя квадратичная скорость, см/с.
В дифференциальной форме это уравнение имеет вид:

где R — универсальная газовая постоянная, эрг; Т — температура газа, К.
На рисунке 3 представлен график, построенный по уравнению (45). Доля молекул, энергия которых лежит в пределах определенного интервала, изображается площадью столбика, ограниченного кривой и соответствующими ординатами.
Рисунок 3. Распределение энергии по Максвеллу-Больцману.
В результате соударений всегда имеется несколько молекул с энергиями, намного превосходящими среднее значение. Таким образом, возможны столкновения между молекулами, имеющими высокую энергию активации, необходимую для реакции, но число таких соударений будет составлять очень небольшую долю от общего числа столкновений, происходящих в газе. Это объясняет тот факт, что лишь небольшая часть соударений приводит к реакции.
Влияние температуры на распределение скорости (см. Рис. 5.). С ростом температуры наблюдается смещение максимума в сторону более высокой скорости; происходит резкое увеличение числа молекул, имеющих скорости намного выше средней [при скорости имеется число (доля) молекул n1, при температуре Т1, которое увеличивается до n2 при температуре Т2, T2 >T1]. Общее число молекул, имеющих скорости, равные или большие определенного значения определяются площадью под кривой. Но именно небольшая доля молекул n1иn2 при температурах Т1 и Т2в конце кривых распределения, обладающих максимальными энергиями и скоростями в сечениях и будет определять эффективную долю столкновений, приводящих к их взаимодействию.
Экспоненциальный фактор в уравнении Максвелла учитывает изменение формы кривой при повышении температуры. Если 

ТЕОРИЯ АКТИВИРОВАННОГО КОМПЛЕКСА.
Теория столкновений непригодна для сложных молекул потому, что она предполагает существование молекул в виде идеальных упругих сферических частиц. Однако для сложных молекул, помимо поступательной энергии, должны быть учтены другие виды молекулярной энергии, например, вращательная и колебательная. По теории столкновений невозможно существование реакций, в которых должны столкнуться три и более молекулы. Кроме того, реакции разложения типа АВ = А + В трудно объяснить этой теорией.
Для преодоления указанных затруднений Х. Эйринг в 1935г. предложил теорию активированного комплекса. Всякая химическая реакция или любой другой молекулярный процесс, протекающий во времени(диффузия, вязкое течение и т. д.), состоит в непрерывном изменении расстояний между ядрами атомов. При этом конфигурация ядер, отвечающая начальному состоянию, через некоторую промежуточную конфигурацию – активированный комплекс или переходное состояние – превращается в конечную конфигурацию. Предполагается, что активированный комплекс образуется как промежуточное состояние во всех химических реакциях. Он рассматривается, как молекула, которая существует лишь временно и разрушается при определенной скорости. Этот комплекс образуется из таких взаимодействующих молекул, энергия которых достаточна для того, чтобы они смогли близко подойти друг к другу по схеме: реагенты

Энергия активации реакции есть дополнительная энергия, которую должны приобрести реагирующие молекулы, чтобы образовать активированный комплекс, необходимый для протекания реакции.
Энергия активации всегда представляет поглощенную энергию, независимо от того, является ли общее изменение ее для реакции положительным (эндотермическая реакция) или отрицательным (экзотермическая реакция). Это схематично показано на рис. 6.
Рисунок 6. Энергетическая схема образования активированного комплекса.
Активация – сообщение молекулам такого количества энергии, что при их эффективном превращении происходит образование веществ в активированном состоянии.
Превращение – образование из веществ, находящихся в активированном состоянии, продуктов реакции.
Если система не может перейти через этот энергетический барьер в ней не могут произойти химические превращения. Значит, эта система химически неактивна и нуждается в некоторой дополнительной энергии для активации. Количество этой дополнительной энергии зависит от того, какой энергией уже обладает система.
Энергия исходной системы не может быть меньше ее нулевой энергии (т. е. при 00К). Для активации любой системы достаточно сообщить ей дополнительную энергию. Эта энергия называется истинной энергией активации.
Истинной энергией активации элементарного химического акта называется минимальная энергия, которой должна обладать исходная система сверх совей нулевой энергии (т. е. при 00 К), чтобы в ней могли произойти химические превращения. Разность истинной энергии активации обратной и прямой реакций равна тепловому эффекту реакции при абсолютном нуле.
Влияние температуры на скорость реакции
Скорость химических реакций сильно зависит от температуры.
При повышении температуры увеличивается скорость движения молекул, возрастает число столкновений между ними и, соответственно этому доля активных молекул. Все это, естественно, обусловливает увеличение скорости химических реакций с повышением температуры.
Так, если осуществить синтез воды
при t = 20оС, ее практически осуществить невозможно, чтобы она прошла на 15% потребуется 54 миллиарда лет.
При t = 500оС — необходимо всего 50 минут.
При t = 700оС — реакция происходит мгновенно.
Количественно зависимость скорости гомогенных реакций от температуры может быть выражена установленным опытным путем в приближенной форме правилом Вант — Гоффа: при повышении температуры на каждые 10оС скорость гомогенной химической реакции увеличивается в 2-4 раза.
Математически правило Ван-Гоффа, может быть выражено следующим образом:
Vt2 =Vt1 ·г( t2-t1 ) / 10
если температура повышается от t1 до t2, то скорость реакции при температуре t2 (Vt2) выразится через скорость при температуре t1 (Vt1), де г – температурный коэффициент скорости реакции ( изменяется обычно от 2 до 4 ) – это число, показывающее во сколько именно раз увеличивается скорость химической реакции при повышении температуры на 100С ( это отношение константы скорости при температуре t + 10 к константе при температуре t).
Для большинства биохимических реакций температурный коэффициент Вант-Гоффа варьирует от 1,5 ÷ 3,0. Поэтому, если в результате какого-либо заболевания температура человеческого тела поднялась, например, с 36,50 до 39,50С, это значит увеличение скорости происходящих биохимических процессов в 1,13 – 1,39 раз, т. е. на 13-39%.
Увеличение скорости реакции с повышением температуры можно было бы объяснить учащением столкновений молекул вследствие увеличения скорости их движения с повышением температуры. Однако увеличение скорости реакции с повышением температуры значительно больше, чем увеличение скорости движения молекул. Очевидно, наряду с этим, есть и другая причина значительного увеличения скорости реакции с повышением температуры. Разъясняет действие этой другой причины теория активации, согласно которой во взаимодействие вступают только активные молекулы, энергия которых превышает среднюю энергию молекул данного вещества. Для активации остальных молекул им необходимо придать дополнительную энергию, что и может быть достигнуто повышением температуры.
Энергия, которую надо придать молекулам реагирующих веществ, для того, чтобы сделать их активными, называется энергией активации. Она зависит от природы реагирующих веществ и является характеристикой любой реакции и обычно выражается в кДж/моль.
Чем больше энергия активации, тем меньше активных молекул при данной температуре и тем медленнее идет реакция.
Поясним на примере реакции в общем виде:
По оси ординат откладываем потенциальную энергию системы, а по оси абсцисс – ход реакции:
исходное состояние —- переходное состояние – конечное состояние.
Чтобы войти в химический контакт друг с другом, реагирующие вещества А2 и В2 должны преодолеть энергетический барьер С. На это затрачивается энергия активации Еа.
Энергия активации – это своеобразный энергетический барьер, который отделяет исходные вещества от продуктов реакции.
При этом в ходе реакции из частиц реагирующих веществ образуется промежуточная неустойчивая группировка, называемая переходным состоянием или активированным комплексом (в точке С), последующий распад которого приводит к образованию конечного продукта АВ.
Активированный переходный комплекс представляет собой соединение, в котором ослаблены и удлинены связи, разрываемые в ходе данной реакции.
Механизм реакции можно изобразить схемой
исходные реагенты активированный продукты реакции
начальное состояние комплекс конечное состояние
Энергетические барьеры ограничивают протекание реакций. Благодаря этому многие, в принципе, возможные реакции (при ΔG О — эндотермический процесс, т. е. 

для протекания эндотермических реакций требуется подвод энергии извне.
Скорость реакции непосредственно зависит от значения энергии активации, если она мала, то за определенное время протекания реакции энергетический барьер преодолеет большое число частиц и скорость будет высокой, но если энергия активации велика, то реакция идет медленно.
Шведский ученый Аррениус предложил уравнение, выражающее более точно зависимость скорости реакции от температуры:

где К – константа скорости реакции ;
А – предэкспоненциальный множитель, зависящий от числа столкновений молекул за единицу времени;
е — основание натуральных логарифмов (е = 2,72 );
Еа – энергия активации;
R — универсальная газовая постоянная;
Т — абсолютная температура.
Из уравнения видно, что чем больше энергия активации, тем меньше константа скорости реакции, т. е. тем меньше скорость реакции.
В логарифмической форме
ln k = ln A – Eа/RT
Если известны константы скорости kT1 и kT2 при двух температурах Т1 и Т2 можно найти значение Еа из уравнения Аррениуса в логарифмической форме:
ln kT1 = lnA – Eа/RT1 (1)
ln kT2 = lnA — Eа/RT2 (2)
Из уравнения 2 вычитаем уравнение 1:
lnkT2 – lnkT1 = — Eа/RT2 + Eа/RT1
ln kT2/kT1 = Eа/R(1/T1 — 1/T2)
Из уравнения Аррениуса видно, что поскольку Т входит в показатель степени, скорость химической реакции очень чувствительна к изменению температуры. Например, при повышении температуры на 100оС скорость реакции
возрастает примерно в 1000 раз.
Т, К 556 575 629 666 700 781 K 4,45 ⋅10-5 1,37⋅ 10-4 2,52 ⋅10-3 1,41⋅ 10-2 6,43 ⋅ 10-2 1,34
Влияние катализатора на скорость реакции
Одним из наиболее распространенных в химической практике методов ускорения химических реакций является катализ.
Катализатор – это вещество, изменяющее скорость химической реакции, но само в реакции не расходуется и в конечные продукты не входит.
При этом изменение скорости реакции происходит за счет изменения энергии активации, причем катализатор с реагентами образует активированный комплекс.
Катализатор после разрушения активированного комплекса не входит в состав продуктов реакции, поэтому общее уравнение процесса остается прежним. К
Если гомогенная реакция В + А → АВ протекает с малой скоростью, то можно подобрать вещество К, которое с одним из реагентов образует активированный комплекс, взаимодействующий в свою очередь с другим реагентом:
1/2О2 + NO = NO2 NO2 + SO2 = SO3 + NO
А + К → [ А….К ] [ А….К ] + В → АВ + К
Если энергия активации этих стадий ниже энергии активации процесса в отсутствии катализатора, то общая скорость процесса значительно возрастает и такой катализ называется положительным, в противном случае скорость процесса уменьшится и катализ будет отрицательным, иначе называемый ингибированием. Отрицательные катализаторы – ингибиторы, которые отличаются от катализаторов тем, что входят в состав продуктов реакции.
Энергетическая диаграмма хода реакции в отсутствии катализатора (кривая 1) и в присутствии катализатора (кривая 2). Очевидно, в присутствии катализатора энергия активации реакции снижается на величину ДЕK..
Влияние катализатора на снижение энергии активации процесса Еа можно показать на следующих данных для реакции
без катализатора 168
катализатор Au 105
катализатор Pt 59
Так как в выражении для константы скорости реакции энергия активации входит в отрицательный показатель степени, то даже небольшое изменение энергии активации вызывает очень большое увеличение скорости реакции. Так, для данной реакции уменьшение Еа на 40 кДж соответствует повышению скорости реакции при 500К в 30 000 раз.
Катализаторы обладают избирательностью (селективностью) :
Аl2O3 t= 350-3600С
С2Н5ОН →C2H4 + H2O дегидратация этанола
С2Н5ОН →CH3COH + H2 дегидрирование
Подбирая катализатор получают необходимый продукт.
Различают два вида катализа – гомогенный (однородный) и гетерогенный (неоднородный). При гомогенном катализе реагенты и катализатор образуют однородную систему – газовую или жидкую и между реагентами и катализатором отсутствует поверхность раздела.
Примерами гомогенного катализа могут служить реакции между газами в присутствии газообразных катализаторов (NO2, H2O и др.) и между растворенными веществами в присутствии растворенного катализатора или растворителя.
Если катализатор и реагенты находятся в разных фазах и процесс протекает на поверхности их раздела, то это гетерогенный катализ. Распространенными кристаллическими катализаторами являются металлы и их оксиды.
CH2 =CH2(г) + Н2(г) → C2H6
Как в гомогенном, так и в гетерогенном катализе действие положительных катализаторов сводится к уменьшению энергии активации реакции, к снижению высоты энергетического барьера. В присутствии катализатора образуется активированный комплекс с более низким уровнем энергии, чем без катализатора, и поэтому скорость реакции очень возрастает. Реакции с участием катализатора протекают при более низкой температуре, чем без него.
Механизм гетерогенного катализа более сложен.
В этом случае существенную роль играет поглощение поверхностью катализатора реагирующих частиц. При гетерогенном катализе исключительно большое значение имеет поверхность соприкосновения реакционной смеси с катализатором (площадь контакта). Так платина, взятая в виде пластинки, повышает скорость реакции в сотни раз меньше, чем тоже весовое количество металла в виде порошка.
Начальными стадиями являются диффузия частиц исходных реагентов к катализатору и поглощение частиц его поверхностью (активированная адсорбция). Это вызывает сближение молекул и повышение их химической активности, при этом понижается активационный барьер. В результате на катализаторе происходит реакция. Затем продукты взаимодействия покидают катализатор и в результате диффузии переходят в объем. Таким образом, в гетерогенном катализе образуются промежуточные поверхностные соединения, которые формируются на активных участках (активные центры) катализатора. Активные центры составляют небольшую долю всей поверхности катализатора. Для увеличения поверхности катализатора и, тем самым, числа активных центров его нужно тонко измельчить.
Некоторые вещества снижают активность или полностью дезактивируют твердый катализатор. Такие вещества называются каталитическими ядами. Вещества, которые усиливают действие катализаторов данной реакции, хотя сами катализаторами не являются, называются промоторами. Биологические катализаторы называются ферментами (энзимами). Они участвуют в химических процессах в растительных, животных организмах.
Ферменты – это особый класс белков, присутствие которых в небольших количествах жизненно необходимо для всех биологических организмов. Лучшие неорганические катализаторы по своей активности уступают ферментам в десятки тысяч раз и более.
Шпаргалки к экзаменам и зачётам
студентам и школьникам
Шпаргалки по электрохимии — Влияние температуры на скорость химической реакции
Cмотрите так же.
- Влияние температуры на скорость химической реакции. Уравнение Аррениуса, его термодинамический вывод. Энергия активации, ее опытное определение.
Влияние температуры на скорость реакции
Скорость большинства реакций увеличивается с ростом температуры, так как при этом возрастает энергия сталкивающихся частиц и повышается вероятность того, что при столкновении произойдет химическое превращение. Для количественного описания температурных эффектов в химической кинетике используют два основных соотношения – правило Вант-Гоффа и уравнение Аррениуса.
Правило Вант-Гоффа : при повышении температуры на 10 о С скорость реакции возрастает в 2–4 раза. Для характеристики зависимости скорости химической реакции от Т был введен температурный коэффициент скорости реакции
где k T +10 и k T – константы скорости химической реакции при температуре Т+10 и Т. В среднем этот коэффициент равен 3. Следовательно, при изменении Т на 100 о С скорость реакции изменяется в 3 10 или 59049 раз. Пользуясь температурным коэффициентом скорости реакции, можно рассчитывать константы скоростей при различных Т. Для этого прологарифмируем вышеприведенное выражение


Если считать, что в пределах 10 о температурный коэффициент остается постоянным, можно записать


После интегрирования 

где 
Такая оценка зависимости скорости реакции от температуры носит весьма приближенный характер, применима только в очень ограниченном интервале температур и потому имеет малую практическую ценность. Более обоснованную зависимость константы скорости реакции от Т можно получить с помощью уравнения изохоры или изобары химической реакции . Без индексов, характеризующих условия протекания процесса, уравнения изохоры и изобары запишутся одинаково:
где К = k 1 / k 2 – константа химического равновесия; k 1 и k 2 – константы скоростей прямой и обратной реакций; D Н – теплота химической реакции.
Запишем тепловой эффект как разность двух величин
С точностью до постоянной величины В можно считать, что слагаемые правой и левой части попарно равны друг другу:




Опыт показал, что В = 0. Поэтому в общем виде можно записать
Это уравнение называется уравнением Аррениуса и характеризует зависимость константы скорости химической реакции от температуры. Величина Е имеет размерность энергии и носит название энергии активации. Энергию активации можно определить как тот избыток энергии по сравнению со средней энергией молекул при данной температуре, которой должны обладать молекулы, чтобы они могли вступить в химическую реакцию. Для большинства реакций между валентнонасыщенными молекулами энергия активации составляет 50-100 кДж/моль.
Проинтегрируем уравнение Аррениуса, считая, что Е – величина постоянная:
ln k = – 
( ln C – константа интегрирования). Величину Е можно определить из графика (см. рис. 7).
Потенцируя вышеприведенное выражение, получим
Из этого уравнения видно, что константами, характеризующими реакцию, являются предэкспоненциальный множитель С и энергия активации Е. Чем больше Е, тем меньше скорость химической реакции. Экспоненциальный множитель e – E / RT можно интерпретировать как долю молекул, энергия которых превышает Е при температуре Т.
Рис. 7. Графическое нахождение энергии активации химической реакции
Если уравнение Аррениуса проинтегрировать в пределах от Т1 до Т2, то получим
( k 2 – константа скорости химической реакции при Т2 , k 1 – то же при Т1). Таким образом, зная величину константы скорости реакции при одной Т, можно вычислить ее величину при другой Т.
Энергию активации можно определить и не зная констант скоростей. Отношение скоростей реакции при двух температурах можно в общем виде записать следующим образом:
Если реакцию проводят так, что концентрации участников при двух температурах одинаковы, то
Экспериментально определяя скорости реакции v 1 и v 2 для двух температур Т1 и Т2 при условии, что концентрации реагирующих веществ при этих двух температурах одинаковы, по формуле (2) можно определить энергию активации. Такой расчет представляет большой интерес, так как может явиться одним из методов проверки справедливости предлагаемого кинетического уравнения. Если значение Е, найденное из зависимости ln k от 1/Т, совпадает со значением энергии активации, найденной по уравнению (2), это свидетельствует о справедливости предлагаемого кинетического уравнения.
Рис. 8. Изменение энтальпии в ходе химической реакции и его связь с энергией активации
Связь энергии активации с тепловым эффектом реакции можно проиллюстрировать с помощью представления об энергетическом барьере. Химическую реакцию можно представить как переход системы из энергетического состояния I в энергетическое состояние II , сопровождающийся теплотой D Н. Из рис. 8 видно, что переход из состояния I в состояние II возможен при затрате энергии Е1; обратный переход возможен при затрате энергии Е2.
При осуществлении реакции в прямом направлении выделяется количество энергии
Величина 
отсчитываемых от некоторого исходного значения, принятого за нулевое (Н = 0).
Аномальную зависимость константы скорости от температуры проявляют некоторые реакции 3-го порядка, а также цепные, фотохимические и ферментативные реакции. В реакциях 3-го порядка константа скорости убывает с ростом температуры (рис. 9, а). Течение ферментативных реакций может осложняться денатурацией фермента, поэтому эффективная константа скорости при нагревании сначала возрастает, а затем убывает (рис. 9, б). В цепных экзотермических реакциях возможно явление «теплового взрыва», при котором константа скорости резко возрастает при температуре выше некоторого предела (рис. 9, в).
Рис 9. Аномальная зависимость скорости реакции от температуры: а – реакции 3-го порядка, б – ферментативные реакции, в – цепные экзотермические реакции
http://pandia.ru/text/80/608/13259.php
http://spargalki.ru/himia/102-electrohimiya.html?start=7