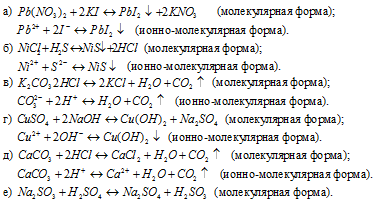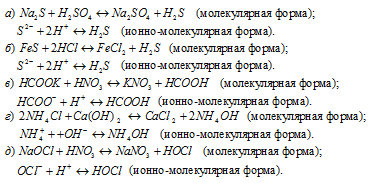Аммиачная вода: получение, формула, применение
Бесцветный газ с резким запахом аммиак NH3 не только хорошо растворяется в воде с выделением тепла. Вещество активно взаимодействует с молекулами H2O с образованием слабой щелочи. Раствор получил несколько названий, одно из них — аммиачная вода. Соединение обладает удивительными свойствами, которые заключаются в способе образования, составе и химических реакциях.
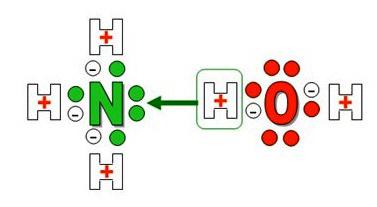
Образование иона аммония
Образуется ион аммония с одним положительным зарядом и особым типом слабой ковалентной связи – донорно-акцепторной. По своим размерам, заряду и некоторым другим особенностям он напоминает катион калия и ведет себя подобно щелочным металлам. Необычное в химическом плане соединение реагирует с кислотами, образует соли, имеющие важное практическое значение. Названия, в которых отражены особенности получения и свойства вещества:
- аммиачная вода;
- гидроксид аммония;
- гидрат аммиака;
- едкий аммоний.
Меры предосторожности
Необходимо соблюдать осторожность при работах с аммиаком и его производными. Важно помнить:
- Аммиачная вода имеет неприятный запах. Выделяющийся газ раздражает слизистую поверхность носовой полости, глаз, вызывает кашель.
- При хранении нашатырного спирта в неплотно закрытых флаконах, ампулах выделяется аммиак.
- Можно обнаружить без приборов, только по запаху даже небольшое количество газа в растворе и воздухе.
- Соотношение между молекулами и катионами в растворе изменяется при разных рН.
- При значении около 7 снижается концентрация токсичного газа NH3, увеличивается количество менее вредных для живых организмов катионов NH4 +
Получение гидроксида аммония. Физические свойства
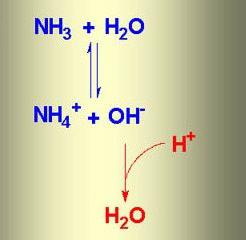
При растворении аммиака в воде образуется аммиачная вода. Формула этого вещества – NH4OH, но на самом деле одновременно присутствуют ионы
NH4 + , OH – , молекулы NH3 и H2O. В химической реакции ионного обмена между аммиаком и водой устанавливается равновесное состояние. Процесс можно отразить с помощью схемы, на которой противоположно направленные стрелочки указывают на обратимость явлений.
В лаборатории получение аммиачной воды проводят в опытах с азотосодержащими веществами. При смешивании аммиака с водой получается прозрачная бесцветная жидкость. При высоких давлениях растворимость газа увеличивается. Вода больше отдает растворенный в ней аммиак при повышении температуры. Для производственных нужд и сельского хозяйства в промышленных масштабах получают 25-процентное вещество при растворении аммиака. Второй способ предусматривает использование реакции коксового газа с водой.
Химические свойства гидроксида аммония
При соприкосновении две жидкости — аммиачная вода и соляная кислота — покрываются клубами белого дыма. Он состоит из частиц продукта реакции – хлорида аммония. С таким летучим веществом, как соляная кислота, реакция происходит прямо в воздухе.
Слабо-щелочные химические свойства гидрата аммиака:
- Вещество обратимо диссоциирует в воде с образованием катиона аммония и гидроксид-иона.
- В присутствии иона NH4 + бесцветный раствор фенолфталеина окрашивается в малиновый цвет, как в щелочах.
- Химическая реакция нейтрализации с кислотами приводит к образованию солей аммония и воды: NH4OH + HCl = NH4Cl + H2O.
- Аммиачная вода вступает в реакции ионного обмена с солями металлов, которым соответствуют слабые основания, при этом образуется нерастворимый в воде гидроксид: 2NH4OH + CuCl2 = 2NH4Cl + Cu(OH)2 (синий осадок).
Аммиачная вода: применение в разных отраслях хозяйства
Необычное вещество широко используется в быту, сельском хозяйстве, медицине, промышленности. Технический гидрат аммиака применяется в сельском хозяйстве, производстве кальцинированной соды, красителей и других видов продукции. В жидком удобрении азот содержится в легкоусвояемой растениями форме. Вещество считается наиболее дешевым и эффективным для внесения в предпосевной период под все сельскохозяйственные культуры.
На производство аммиачной воды затрачивается в три раза меньше средств, чем на выпуск твердых гранулированных азотных удобрений. Для хранения и транспортировки жидкости применяются герметически закрытые цистерны из стали. Некоторые виды красок и средств для обесцвечивания волос производятся с использованием едкого аммония. В каждом медицинском учреждении есть препараты с нашатырным спиртом — 10-процентным раствором аммиака.
Соли аммония: свойства и практическое значение
Вещества, которые получают при взаимодействии гидроксида аммония с кислотами, используются в хозяйственной деятельности. Соли разлагаются при нагревании, растворяются в воде, подвергаются гидролизу. Они вступают в химические реакции со щелочами и другими веществами. Наиболее важное практическое значение приобрели хлориды, нитраты, сульфаты, фосфаты и карбонаты аммония.
Очень важно соблюдать правила и меры безопасности, проводя работы с веществами, в составе которых есть ион аммония. При хранении на складах промышленных и сельскохозяйственных предприятий, в подсобных хозяйствах не должно быть соприкосновения таких соединений с известью и щелочами. Если нарушится герметичность упаковок, то начнется химическая реакция с выделением ядовитого газа. Каждый, кому приходится работать с аммиачной водой и ее солями, обязан знать основы химии. При соблюдении требований техники безопасности используемые вещества не принесут вреда людям и окружающей среде.
Cоставление ионно-молекулярных форм уравнений реакций
Задача 580.
Написать в ионно-молекулярной форме уравнения реакций, приводящих к образованию малорастворимых осадков или газов: 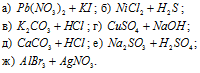
Решение:
Так как реакция протекает с образованием сернистой кислоты – слабого электролита и при этом не выпадает осадок и не выделяется газ, то, по условию задачи, ионно-молекулярное уравнение не пишем.
Задача 581.
Написать в ионно-молекулярной форме уравнения реакций, приводящих к образованию малодиссoциированных соединений: 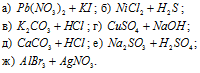
Решение:
Задача 582.
Написать в ионно-молекулярной форме уравнения реакций нейтрализации: 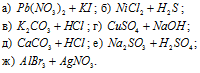
Указать, какие из этих реакций протекают обратимо, а какие необратимо.
Решение:
а) 2HCl + Ba(OH)2 ⇔ BaCl2 + 2H2O (молекулярная форма);
2H + + 2OH — ⇔ 2H 2 O (ионно-молекулярная форма).
Реакция протекает до конца, так как в реакцию вступают сильные электролиты соляная кислота и гидроксид бария образуется слабый электролит вода.
б) HF + KOH ⇔ KF + H2O (молекулярная форма);
H + + OH — ⇔ H2O (ионно-молекулярная форма).
В реакции участвуют два слабых электролита фтороводород и вода, согласно принципу Ле Шателье, равновесие реакции будет смещено в сторону более слабого электролита, т.е. вправо в сторону образования воды. Реакция обратима.
в) Fe(OH)3 + 3HNO3 ⇔ Fe(NO3)3 + 3H2O (молекулярная форма);
3H + + 3OH — ⇔ 3H2O (ионно-молекулярная форма).
В реакции участвуют слабое малорастворимое основание и сильная кислота, равновесие будет смещено в сторону образования более слабого электролита воды. Реакция будет протекать до конца.
г) CH3COOH + NH4OH ⇔ CH3COONH4 + H2O (молекулярная форма);
H + + OH — ⇔ H2O (ионно-молекулярная форма).
Реакция обратима, так как в реакции участвуют три слабых электролита уксусная кислота, гидроксид аммония и вода. Согласно принципу Ле Шателье равновесие системы будет смещено в сторону образования самого слабого электролита, вправо, в сторону образования воды.
д) HNO2 + NH4OH ⇔ NH4NO2 + H2O (молекулярная форма);
H + + OH — ⇔ H2O (ионно-молекулярная форма).
Реакция обратима, так как в реакции участвуют три слабых электролита уксусная кислота, гидроксид аммония и вода. Согласно принципу Ле Шателье равновесие системы будет смещено в сторону образования самого слабого электролита, вправо, в сторону образования воды.
е) H2S + 2NH4OH ⇔ (NH4)2S + 2H2O (молекулярная форма);
2H + + 2OH — ⇔ 2H2O (ионно-молекулярная форма).
Реакция обратима, так как в реакции участвуют три слабых электролита сероводородная кислота, гидроксид аммония и вода. Согласно принципу Ле Шателье равновесие системы будет смещено в сторону образования самого слабого электролита, вправо, в сторону образования воды.
Таким образом, реакции нейтрализации, в которых участвуют слабые кислоты или основания, — обратимы, т.е. могут протекать как в прямом так и в обратном направлении.
Вода гидроксид аммония ионное уравнение


Аммиак (в европейских языках его название звучит как «аммониак») своим названием обязан оазису Аммона в Северной Африке, расположенному на перекрестке караванных путей. В жарком климате мочевина (NH2)2CO, содержащаяся в продуктах жизнедеятельности животных, разлагается особенно быстро. Одним из продуктов разложения и является аммиак. По другим сведениям, аммиак получил своё название от древнеегипетского слова амониан. Так называли людей, поклоняющихся богу Амону. Они во время своих ритуальных обрядов нюхали нашатырь NH4Cl, который при нагревании испаряет аммиак.
I. Строение молекулы аммиака
Молекула аммиака имеет форму тригональной пирамиды с атомом азота в вершине. Три неспаренных p-электрона атома азота участвуют в образовании полярных ковалентных связей с 1s-электронами трёх атомов водорода (связи N−H), четвёртая пара внешних электронов является неподелённой, она может образовать донорно-акцепторную связь с ионом водорода, образуя ион аммония NH4 + .
Вид химической связи: ковалентная полярная, три одинарные σ — сигма связи N-H.
II. Физические свойства аммиака
При нормальных условиях — бесцветный газ с резким характерным запахом (запах нашатырного спирта), почти вдвое легче воздуха, ядовит. По физиологическому действию на организм относится к группе веществ удушающего и нейротропного действия, способных при ингаляционном поражении вызвать токсический отёк лёгких и тяжёлое поражение нервной системы. Пары аммиака сильно раздражают слизистые оболочки глаз и органов дыхания, а также кожные покровы. Это мы и воспринимаем как резкий запах. Пары аммиака вызывают обильное слезотечение, боль в глазах, химический ожог конъюктивы и роговицы, потерю зрения, приступы кашля, покраснение и зуд кожи. Растворимость NH3 в воде чрезвычайно велика — около 1200 объёмов (при 0 °C) или 700 объёмов (при 20 °C) в объёме воды.
III. Получение аммиака
В лаборатории
В промышленности
Для получения аммиака в лаборатории используют действие сильных щелочей на соли аммония:
Внимание! Гидроксид аммония неустойчивое основание, разлагается: NH4OH ↔ NH3↑ + H2O
При получении аммиака держите пробирку — приёмник дном кверху, так как аммиак легче воздуха:
Промышленный способ получения аммиака основан на прямом взаимодействии водорода и азота:
- катализатор – пористое железо
- температура – 450 – 500 ˚С
- давление – 25 – 30 МПа
Это так называемый процесс Габера (немецкий физик, разработал физико-химические основы метода)
IV. Химические свойства аммиака
Для аммиака характерны реакции:
- C изменением степени окисления атома азота (реакции окисления)
- Без изменения степени окисления атома азота (присоединение)
1. Реакции с изменением степени окисления атома азота (реакции окисления)
NH3 – сильный восстановитель
- Взаимодействие с кислородом
2. Каталитическое окисление амииака (катализатор Pt – Rh, температура)
- Взаимодействие с оксидами металлов
- Взаимодействие с сильными окислителями
- Аммиак – непрочное соединение, при нагревании разлагается
2. Реакции без изменения степени окисления атома азота (присоединение —Образование иона аммония NH4 + по донорно-акцепторному механизму)

Видео — эксперимент: «Фонтан»
Видео — эксперимент: «Растворение аммиака в воде»
V. Применение аммиака
По объемам производства аммиак занимает одно из первых мест; ежегодно во всем мире получают около 100 миллионов тонн этого соединения. Аммиак выпускается в жидком виде или в виде водного раствора – аммиачной воды, которая обычно содержит 25% NH3. Огромные количества аммиака далее используются для получения азотной кислоты, которая идет на производство удобрений и множества других продуктов. Аммиачную воду применяют также непосредственно в виде удобрения, а иногда поля поливают из цистерн непосредственно жидким аммиаком. Из аммиака получают различные соли аммония, мочевину, уротропин. Его применяют также в качестве дешевого хладагента в промышленных холодильных установках.
Аммиак используется также для получения синтетических волокон, например, найлона и капрона. В легкой промышленности он используется при очистке и крашении хлопка, шерсти и шелка. В нефтехимической промышленности аммиак используют для нейтрализации кислотных отходов, а в производстве природного каучука аммиак помогает сохранить латекс в процессе его перевозки от плантации до завода. Аммиак используется также при производстве соды по методу Сольве. В сталелитейной промышленности аммиак используют для азотирования – насыщения поверхностных слоев стали азотом, что значительно увеличивает ее твердость.
Медики используют водные растворы аммиака (нашатырный спирт) в повседневной практике: ватка, смоченная в нашатырном спирте, выводит человека из обморочного состояния. Для человека аммиак в такой дозе не опасен.
VI. Соли аммония
1. Составление формул солей аммония
Соли аммония — это сложные вещества, в состав которых входят ионы аммония NH4+, соединённые с кислотными остатками.
2. Физические свойства
Кристаллические вещества, хорошо растворимые в воде.
3. Получение
1 способ: Аммиак + кислота: NH3 + HNO3 → NH4NO3
2 способ: Аммиачная вода + кислота: 2NH4OH + H2SO4 → (NH4)2SO4+ 2Н2O
4. Химические свойства

1. Сильные электролиты (диссоциируют в водных растворах полностью)
NH4Cl → NH4 + + Cl —
2. Взаимодействие с кислотами (реакция обмена)
(NH4)2CO3 + 2НCl → 2NH4Cl + Н2O + CO2
2NH4 + + CO3 2- + 2H + + 2Cl — → 2NH4 + + 2Cl — + Н2O + CO2
CO3 2- + 2H + → Н2O + CO2
Взаимодействие с солями (реакция обмена)
(NH4)2SO4 + Ba(NO3)2 → BaSO4↓ + 2NH4NO3
2NH4 + + SO4 2- + Ba 2+ + 2NO3 — → BaSO4↓ + 2NH4 + + 2NO3 —
Ba 2+ + SO4 2- → BaSO4↓
Спецефические свойства
1. Разложение при нагревании
a) если кислота летучая: NH4Cl → NH3 + HCl (при нагревании)
NH4HCO3 → NH3 + Н2O + CO2
б) если анион проявляет окислительные свойства: NH4NO3 → N2O + 2Н2O (при нагревании)
(NH4)2Cr2O7 → N2 + Cr2O3 + 4Н2O (при нагревании)
2. Качественная реакция на NH4 + — ион аммония
При нагревании со щелочами выделяется газ аммиак
NH4Cl + NaOH → NaCl + NH3 + Н2O (при нагревании)
3. Соли аммония подвергаются гидролизу (как соль слабого основания и сильной кислоты) – среда кислая:
NH4Cl + Н2O → NH4OH + HCl
NH4 + + Н2O → NH4OH + H +
5. Применение
- Нитрат аммония (аммиачная селитра) NH4NO3 применяют как азотное удобрение и для изготовления взрывчатых веществ — аммонитов;
- Сульфат аммония (NH4)2SO4 — как дешёвое азотное удобрение;
- Гидрокарбонат аммония NH4HCO3 и карбонат аммония (NH4)2CO3 — в пищевой промышленности при производстве мучных кондитерских изделий в качестве химического разрыхлителя, при крашении тканей, в производстве витаминов, в медицине;
- Хлорид аммония NH4Cl — в гальванических элементах (сухих батареях), при пайке и лужении, в текстильной промышленности, как удобрение, в ветеринарии.
VII. Закрепление
Задание №1. Заполните таблицу – запишите молекулярные, полные и краткие ионные уравнения для следующих солей аммония:
Химические свойства, общие с другими солями
http://buzani.ru/zadachi/khimiya-glinka/1194-ionno-molekulyarnaya-forma-uravneniya-zadachi-580-582
http://kardaeva.ru/89-dlya-uchenika/9-klass/207-ammiak-fizicheskie-i-khimicheskie-svojstva-ammiaka-poluchenie-primenenie-soli-ammoniya