Этанол: химические свойства и получение
Этанол C2H5OH или CH3CH2OH, этиловый спирт – это органическое вещество, предельный одноатомный спирт .
Общая формула предельных нециклических одноатомных спиртов: CnH2n+2O.
Строение этанола
В молекулах спиртов, помимо связей С–С и С–Н, присутствуют ковалентные полярные химические связи О–Н и С–О.
| Электроотрицательность кислорода (ЭО = 3,5) больше электроотрицательности водорода (ЭО = 2,1) и углерода (ЭО = 2,4). |
Электронная плотность обеих связей смещена к более электроотрицательному атому кислорода:
| Атом кислорода в спиртах находится в состоянии sp 3 -гибридизации. |
В образовании химических связей с атомами C и H участвуют две 2sp 3 -гибридные орбитали, а еще две 2sp 3 -гибридные орбитали заняты неподеленными электронными парами атома кислорода.
Поэтому валентный угол C–О–H близок к тетраэдрическому и составляет почти 108 о .
Водородные связи и физические свойства спиртов
Спирты образуют межмолекулярные водородные связи. Водородные связи вызывают притяжение и ассоциацию молекул спиртов:
Поэтому этанол – жидкость с относительно высокой температурой кипения (температура кипения этанола +78 о С).
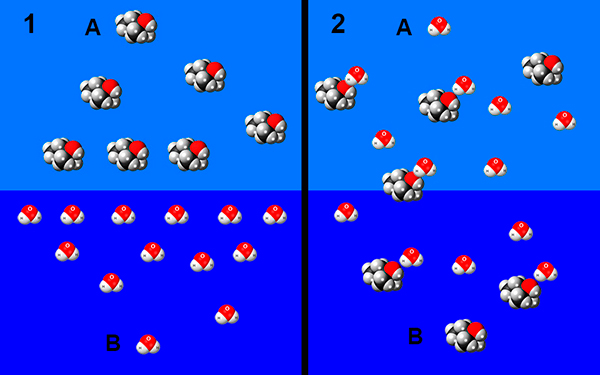
Водородные связи образуются не только между молекулами спиртов, но и между молекулами спиртов и воды. Поэтому спирты очень хорошо растворимы в воде. Молекулы спиртов в воде гидратируются:
| Чем больше углеводородный радикал, тем меньше растворимость спирта в воде. Чем больше ОН-групп в спирте, тем больше растворимость в воде. |
Этанол смешивается с водой в любых соотношениях.
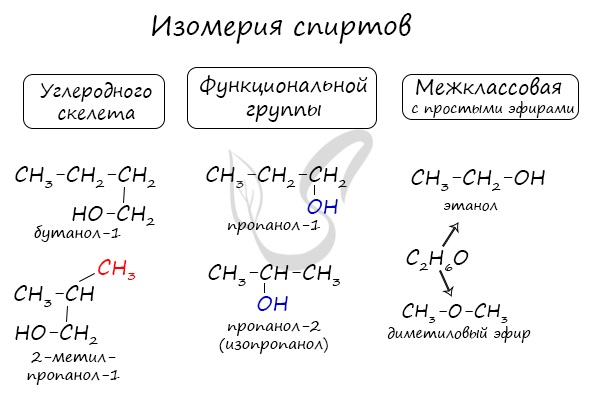
Изомерия спиртов
Структурная изомерия
Для этанола характерна структурная изомерия – межклассовая изомерия.
Межклассовые изомеры — это вещества разных классов с различным строением, но одинаковым составом. Спирты являются межклассовыми изомерами с простыми эфирами. Общая формула и спиртов, и простых эфиров — CnH2n+2О.
| Например. Межклассовые изомеры с общей формулой С2Н6О этиловый спирт СН3–CH2–OH и диметиловый эфир CH3–O–CH3 |
| Этиловый спирт | Диметиловый эфир |
| СН3–CH2–OH | CH3–O–CH3 |
Химические свойства этанола
Спирты – органические вещества, молекулы которых содержат, помимо углеводородной цепи, одну или несколько гидроксильных групп ОН.
1. Кислотные свойства
| Спирты – неэлектролиты, в водном растворе не диссоциируют на ионы; кислотные свойства у них выражены слабее, чем у воды. |
1.1. Взаимодействие с раствором щелочей
При взаимодействии этанола с растворами щелочей реакция практически не идет, т. к. образующийся алкоголят почти полностью гидролизуется водой.
Равновесие в этой реакции так сильно сдвинуто влево, что прямая реакция не идет. Поэтому этанол не взаимодействуют с растворами щелочей.
1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
Этанол взаимодействует с активными металлами (щелочными и щелочноземельными).
| Например, этанол взаимодействует с калием с образованием этилата калия и водорода . |
Алкоголяты под действием воды полностью гидролизуются с выделением спирта и гидроксида металла.
| Например, этилат калия разлагается водой: |
2. Реакции замещения группы ОН
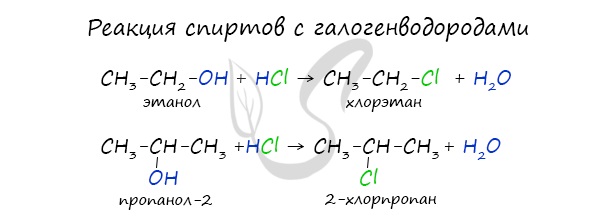
2.1. Взаимодействие с галогеноводородами
При взаимодействии спиртов с галогеноводородами группа ОН замещается на галоген и образуется галогеналкан.
| Например, этанол реагирует с бромоводородом. |
2.2. Взаимодействие с аммиаком
Гидроксогруппу спиртов можно заместить на аминогруппу при нагревании спирта с аммиаком на катализаторе.
| Например, при взаимодействии этанола с аммиаком образуется этиламин. |
2.3. Этерификация (образование сложных эфиров)
Одноатомные и многоатомные спирты вступают в реакции с карбоновыми кислотами, образуя сложные эфиры.
| Например, этанол реагирует с уксусной кислотой с образованием этилацетата (этилового эфира уксусной кислоты): |
2.4. Взаимодействие с кислотами-гидроксидами
Спирты взаимодействуют и с неорганическими кислотами, например, азотной или серной.
| Например, при взаимодействии этанола с азотной кислотой образуется сложный эфир этилнитрат : |
3. Реакции замещения группы ОН
В присутствии концентрированной серной кислоты от спиртов отщепляется вода. Процесс дегидратации протекает по двум возможным направлениям: внутримолекулярная дегидратация и межмолекулярная дегидратация.
3.1. Внутримолекулярная дегидратация
При высокой температуре (больше 140 о С) происходит внутримолекулярная дегидратация и образуется соответствующий алкен.
| Например, из этанола под действием концентрированной серной кислоты при температуре выше 140 градусов образуется этилен: |
В качестве катализатора этой реакции также используют оксид алюминия.
3.2. Межмолекулярная дегидратация
При низкой температуре (меньше 140 о С) происходит межмолекулярная дегидратация по механизму нуклеофильного замещения: ОН-группа в одной молекуле спирта замещается на группу OR другой молекулы. Продуктом реакции является простой эфир.
| Например, при дегидратации этанола при температуре до 140 о С образуется диэтиловый эфир: |
4. Окисление этанола
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
В зависимости от интенсивности и условий окисление можно условно разделить на каталитическое, мягкое и жесткое.
| При окислении первичных спиртов они последовательно превращаются сначала в альдегиды, а потом в карбоновые кислоты. Глубина окисления зависит от окислителя. Первичный спирт → альдегид → карбоновая кислота |
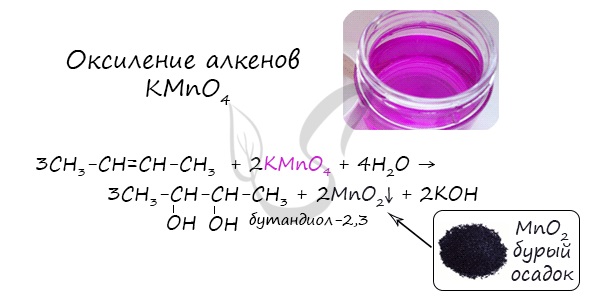
Типичные окислители — оксид меди (II), перманганат калия KMnO4, K2Cr2O7, кислород в присутствии катализатора.
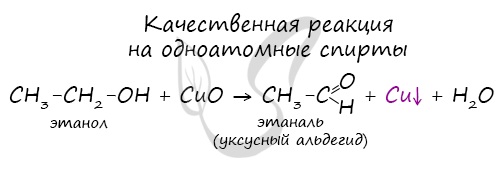
4.1. Окисление оксидом меди (II)
Cпирты можно окислить оксидом меди (II) при нагревании. При этом медь восстанавливается до простого вещества.
| Например, этанол окисляется оксидом меди до уксусного альдегида |
4.2. Окисление кислородом в присутствии катализатора
Cпирты можно окислить кислородом в присутствии катализатора (медь, оксид хрома (III) и др.).
4.3. Жесткое окисление
При жестком окислении под действием перманганатов или соединений хрома (VI) первичные спирты окисляются до карбоновых кислот.
| Например, при взаимодействии этанола с перманганатом калия в серной кислоте образуется уксусная кислота |
4.4. Горение спиртов
Образуются углекислый газ и вода и выделяется большое количество теплоты.
| Например, уравнение сгорания этанола: |
5. Дегидрирование этанола
При нагревании спиртов в присутствии медного катализатора протекает реакция дегидрирования.
| Например, при дегидрировании этанола образуется этаналь |
Получение этанола
1. Щелочной гидролиз галогеналканов
При взаимодействии галогеналканов с водным раствором щелочей образуются спирты. Атом галогена в галогеналкане замещается на гидроксогруппу.
| Например, при нагревании хлорэтана с водным раствором гидроксида натрия образуется этанол |
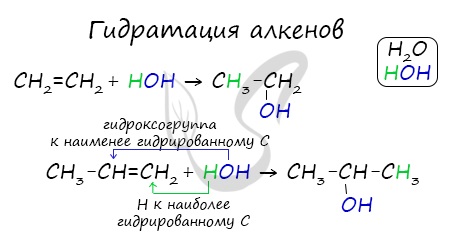
2. Гидратация алкенов
Гидратация (присоединение воды) алкенов протекает в присутствии минеральных кислот. При присоединении воды к алкенам образуются спирты.
| Например, при взаимодействии этилена с водой образуется этиловый спирт. |
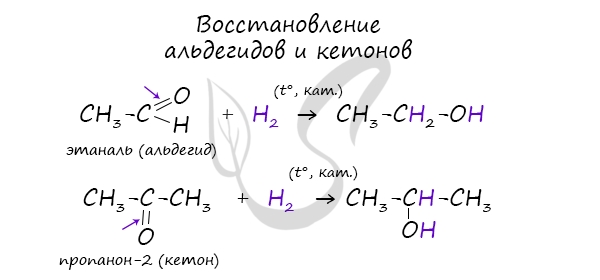
3. Гидрирование карбонильных соединений
Присоединение водорода к альдегидам и кетонам протекает при нагревании в присутствии катализатора. При гидрировании альдегидов образуются первичные спирты, при гидрировании кетонов — вторичные спирты, а из формальдегида образуется метанол.
| Например, при гидрировании этаналя образуется этанол |
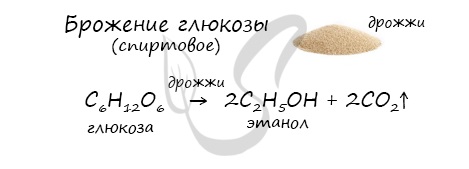
4. Получение этанола спиртовым брожением глюкозы
Для глюкозы характерно ферментативное брожение, то есть распад молекул на части под действием ферментов. Один из вариантов — спиртовое брожение.
Как правильно разбавить спирт или самогон водой.
Какой водой лучше разбавлять спирт для водки.
Чтобы водка или самогон был вкусный, то спирт нужно разбавлять мягкой водой.
Мягкая вода имеет жесткость до 2 мг-экв/л.
Таблица. Жесткость воды, принятая в России.
| Жесткость воды | Значение,1 мг-экв/л |
|---|---|
| Мягкая вода | менее 2 |
| Средняя жесткость | 2-10 |
| Жесткая вода | более 10 |
Таблица. Жесткость воды, принятая в США.
| Жесткость воды | Значение,1 мг-экв/л |
|---|---|
| Мягкая вода | менее 1.2 |
| Средняя жесткость | 1.2-2.4 |
| Жесткая вода | 2.4-3.6 |
| Очень жесткая | более 3.6 |
Жесткость бутилированной воды указывается на этикетке.
Например, на этикетке воды Шишкин лес указана жесткость 1 мг-экв/л, вода мягкая.
На этикетке воды Красная цена, от магазина Пятерочка, указана жесткость до 7 мг-экв/л. Это разброс значения от мягкой до почти жесткой воды, какая попадется.
Мягкую воду можно набрать на роднике, она протекая через слои песка и очищается от примесей.
У родниковой воды может быть недостаток, в ней могут находиться бактерии.
Спиртом мы убиваем бактерии, чем больше крепость самогона тем сильнее удар по ним.
Как узнать мягкая у вас вода или нет.
Мягкая вода не оставляет налета и осадка в чайнике после кипячения. Нет налета, значит вода мягкая.
Что наливают сначала, спирт в воду или наоборот, воду в спирт.
При разбавлении спирта водой, не имеет значения, что наливать спирт в воду или наоборот, воду в спирт. Как вам удобно так и разбавляйте спирт водой.
Никакой химической реакции при разбавлении спирта водой не происходит.
Вопрос. А почему тогда мы кислоту наливаем в воду, а не наоборот?
Можно и воду наливать и в кислоту, только встает вопрос о вашей безопасности.
Кислота имеет плотность большую чем вода, и если мы будем наливать воду в кислоту, то капли воды с кислотой будут отскакивать от поверхности и обожгут нас.
Налейте воду на пол и увидите как она брызгается, потому что пол плотнее воды.
Если мы будем наливать кислоту в воду, то она войдет в нее, как нож в масло, сильных брызг не будет.
При разбавлении спирта водой, появление брызг, я думаю нас сильно тревожить не будет, и поэтому нет разницы, что наливать первым воду или спирт.
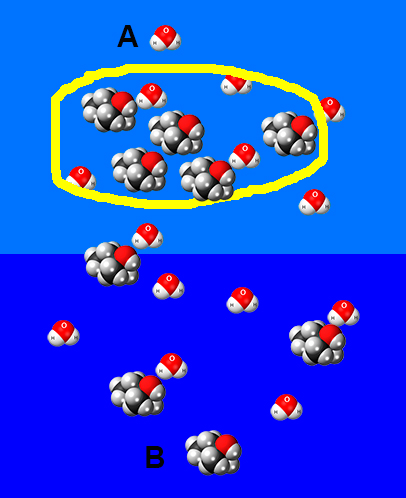
Предположим мы аккуратно налили спирт в воду, и у нас образовалось два слоя, снизу вода, а сверху спирт.
Через какое-то время за счет теплового движения, диффузии, верхняя молекула спирта из точки А окажется внизу, в точке В, а нижняя молекула воды из точки В окажется вверху, в точке А.
Молекулы спирта и воды за счет тепловой энергии будут стремиться туда где их меньше.
Молекулы спирта будут расталкивать молекулы воды и пробираться ко дну, а молекулы воды будут просачиваться к поверхности.
Через какое-то время раствор спирта и воды станет однородным, везде будет одно и тоже количество молекул воды и спирта.
Это вопрос времени и температуры. Чем выше температура жидкости, тем быстрее все перемешается.
Отсюда видно, нет никакой разницы что наливать первым воду или спирт, все равно все перемешается.
Чтобы самогон или водка были мягкими, необходимо распределить молекулы спирта и воды равномерно между собой, не должно быть сгустков спирта.
Например, если у нас в стакане с водкой будут островки спирта, то при выпивании они попадут на вкусовые рецепторы, которые дадут сигнал мозгу, что в стакане концентрат спирта, водка будет резкой на вкус.
Чтобы после разбавления спирта, самогон или водка были однородными, нужно время и температура. В холодном помещении самогон должен дольше стоять.
Метод ускорения равномерного смешивания воды и спирта.
Наливаем разбавленный самогон в емкость или бочку, до верха, чтобы там не было кислорода.
Кислород будет окислять спирт, до альдегида, а это ядовитые головы.
Убираем емкость с самогоном в багажник машины и ездим на ней по делам.
Через определенное время езды самогон равномерно перемешается и будет мягким на вкус.
Почему при разбавлении спирта водой, выделяется тепло, может там какая нибудь химическая реакция.
При разбавлении спирта водой, молекулы воды и спирта образуют между собой временные водородные связи, при этом они отдают энергию и поэтому выделяется тепло.
Если надо разорвать эту связь, то нужно дать им уже эту тепловую энергию назад, нужно нагреть самогон.
При нагревании самогона, а точнее спирт сырца, молекула спирта отрывается от молекулы воды, но потом прилипает к другой молекуле, опять отрывается, пока не долетит до поверхности и не испарится.
Чем меньше крепость спирт сырца, тем дольше нужно его греть, до начала испарения спирта.
Почему самогон мутнеет после разбавления его водой.
Самогон мутнеет после разбавления его водой, потому что в нем есть примеси.
Спирт это растворитель, когда его было много, то он растворял примесь полностью, после того как мы разбавили самогон, спирта стало мало и его не хватает на всю примесь, самогон становиться мутным.
Если мы например, добавим в самогон кусочек сахара, то вначале его видно, потом молекулы воды и спирта прилипают к молекулам сахарозы и растаскивают их в разные стороны, куска сахара не видно.
Так и с примесями, их спирт растаскивает в разные стороны, а когда мы разбавляем самогон, то молекул спирта становиться меньше и примеси группируются, самогон мутнеет.
Основная причина почему мутнеет самогон при разбавлении его водой, в нем есть хвосты, косяки перегонки вылезли наружу.
Если вы хотите скрыть косяки в самогоне, то делайте его крепче.
Если вы хотите узнать качество своего самогона, то разбавляйте его побольше водой и нюхайте, пробуйте.
Взяли 50 грамм самогона, разбавили его водой посильнее и пробуем.
Другая причина помутнения самогона, это наличие примесей от продукта, на котором вы настаивали самогон.
Мы настаивали крепкий самогон на ягодах, спирт прилип к молекулам ягод и утащил их в самогон, после того как самогон разбавили молекулы от ягод стали свободными, они объединились с другими своими молекулами, и их стало видно.
Молекула спирта постоянно не держит молекулу примеси, примесь отрывается, но ее подбирает другая молекула спирта.
От воды самогон вряд-ли помутнеет, надо чтобы в воде было много примесей, например она из реки.
Как правильно настаивать самогон на ягодах и фруктах.
Если вы делаете настойку, то выдерживать ее в настаиваемом продукте надо при повышенной крепости, а употреблять при пониженной.
Так как самогон на котором мы настаиваем, например ягоды у нас крепкий, то молекул спирта много в нем. Они вытащат из ягод много ароматных примесей. Потом мы крепкую настойку разбавим мягкой водой, ароматные вещества высвободяться в нее.
Настойку делаем на крепком самогоне, градусов 50-60, спирт вытянет все ароматные и вкусовые вещества, а когда будем делать напиток для питья, то разбавляем его до маленькой крепости, градусов 20-30.
Настойку разбавляем согласно калькулятору самогонщика. Спиртометр и рефрактометр точную крепость не покажет, ведь там будут примеси, а значит они будут врать в большую сторону.
Разбавлять можно и без таблицы. Например мне нужна крепость напитка 25 градусов, то настойку я делаю на самогоне 55 градусов, 5 градусов я даю на потери. На выходе у меня настойка получается крепостью 50 градусов. Я ее разбавляю 1:1 и добавляю сахар для вкуса, получаю настойку крепостью 25 градусов.
Настойке надо дать время постоять, чтобы она получилась однородной, мягкой.
Как правильно разбавить спирт или самогон водой.
Спирты
Спирты — кислородсодержащие органические соединения, функциональной группой которых является гидроксогруппа (OH) у насыщенного атома углерода.
Спирты также называют алкоголи. Первый член гомологического ряда — метанол — CH3OH. Общая формула их гомологического ряда — CnH2n+1OH.
Классификация спиртов
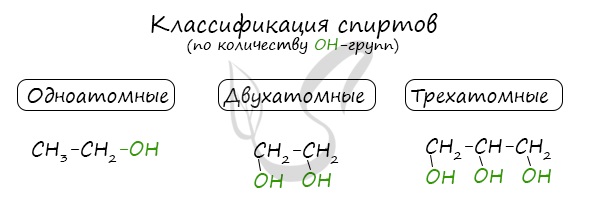
По числу OH групп спирты бывают одноатомными (1 группа OH), двухатомными (2 группы OH — гликоли), трехатомными (3 группы OH — глицерины) и т.д.
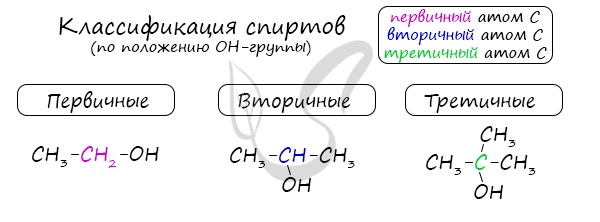
Одноатомные спирты также подразделяются в зависимости от положения OH-группы: первичные (OH-группа у первичного атома углерода), вторичные (OH-группа у вторичного атома углерода) и третичные (OH-группа у третичного атома углерода).
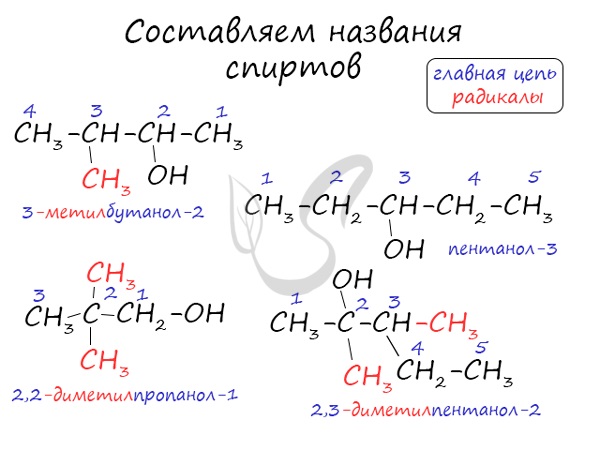
Номенклатура и изомерия спиртов
Названия спиртов формируются путем добавления суффикса «ол» к названию алкана с соответствующим числом атомов углерода: метанол, этанол, пропанол, бутанол, пентанол и т.д.
Для спиртов характерна изомерия углеродного скелета (начиная с бутанола), положения функциональной группы и межклассовая изомерия с простыми эфирами, которых мы также коснемся в данной статье.
Получение спиртов
- Гидролиз галогеналканов водным раствором щелочи
Помните, что в реакциях галогеналканов со сПИртовым раствором щелочи получаются Пи-связи (π-связи) — алкены, а в реакциях с водным раствором щелочи образуются спирты.
Присоединения молекулы воды (HOH) протекает по правилу Марковникова. Атом водорода направляется к наиболее гидрированному атому углерода, а гидроксогруппа идет к соседнему, наименее гидрированному, атому углерода.
В результате восстановления альдегидов и кетонов получаются соответственно первичные и вторичные спирты.
Синтез газом в промышленности называют смесь угарного газа и водорода, которая используется для синтеза различных химических соединений, в том числе и метанола.
Получение этанола брожением глюкозы
В ходе брожения глюкозы выделяется углекислый газ и образуется этанол.
В результате такой реакции у атомов углерода, прилежащих к двойной связи, формируются гидроксогруппы — образуется двухатомный спирт (гликоль).
Химические свойства спиртов
Предельные спирты (не содержащие двойных и тройных связей) не вступают в реакции присоединения, это насыщенные кислородсодержащие соединения. У спиртов проявляются новые свойства, которых мы раньше не касались в органической химии — кислотные.
Щелочные металлы (Li, Na, K) способны вытеснять водород из спиртов с образованием солей: метилатов, этилатов, пропилатов и т.д.
Необходимо особо заметить, что реакция с щелочами (NaOH, KOH, LiOH) для предельных одноатомных спиртов невозможна, так как образующиеся алкоголяты (соли спиртов) сразу же подвергаются гидролизу.
Реакция с галогеноводородами
Реакция с галогеноводородами протекают как реакции обмена: атом галогена замещает гидроксогруппу, образуется молекула воды.
В результате реакций спиртов с кислотами образуются различные эфиры.
Дегидратация спиртов (отщепление воды) идет при повышенной температуре в присутствии серной кислоты (водоотнимающего) компонента.
Возможен межмолекулярный механизм дегидратации (при t 140°С) механизм дегидратации становится внутримолекулярный — образуются алкены.
Названия простых эфиров формируются проще простого — по названию радикалов, входящих в состав эфира. Например:
- Диметиловый эфир — CH3-O-CH3
- Метилэтиловый эфир — CH3-O-C2H5
- Диэтиловый эфир — C2H5-O-C2H5
Качественной реакцией на спирты является взаимодействие с оксидом меди II. В ходе такой реакции раствор приобретает характерное фиолетовое окрашивание.
Замечу, что в обычных условиях третичные спирты окислению не подвергаются. Для них необходимы очень жесткие условия, при которых углеродный скелет подвергается деструкции.
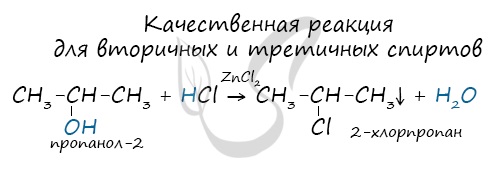
Вторичные и третичные спирты определяются другой качественной реакцией с хлоридом цинка II и соляной кислотой. В результате такой реакции выпадает маслянистый осадок.
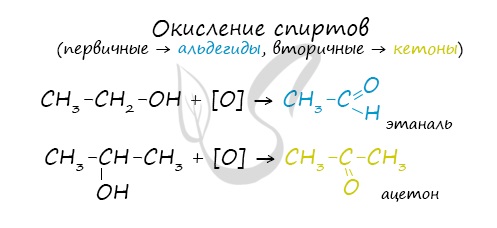
Первичные спирты окисляются до альдегидов, а вторичные — до кетонов. Альдегиды могут быть окислены далее — до карбоновых кислот, в отличие от кетонов, которые являются «тупиковой ветвью развития» и могут только снова стать вторичными спиртами.
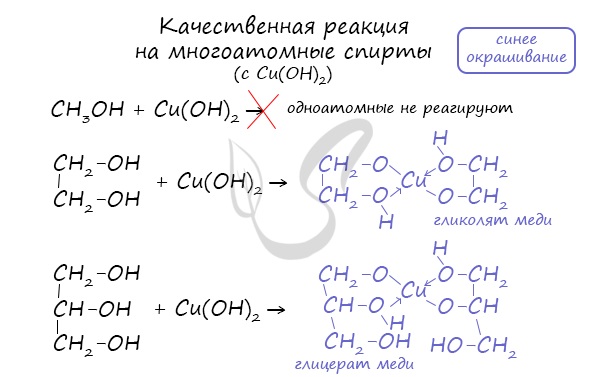
Такой реакцией является взаимодействие многоатомного спирта со свежеприготовленным гидроксидом меди II. В результате реакции раствор окрашивается в характерный синий цвет.
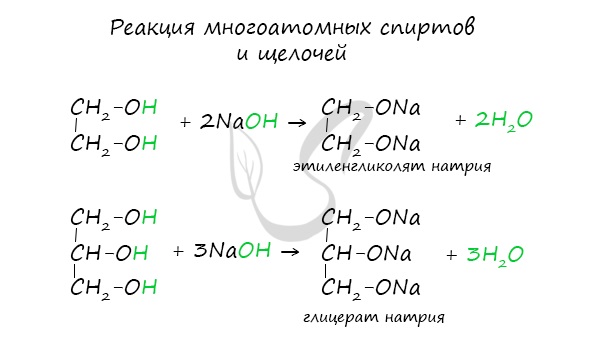
Важным отличием многоатомных спиртов от одноатомных является их способность реагировать со щелочами (что невозможно для одноатомных спиртов). Это говорит об их более выраженных кислотных свойствах.
© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
http://spirtyaga.ru/CONTENT/NAPITKI/razbavlenie.html
http://studarium.ru/article/187