Урок №48. Химические свойства кислот
Химические свойства кислот
Универсальная индикаторная бумага
» jsaction=»rcuQ6b:WYd;»>
2.Реагируют с металлами в ряду активности до H 2 (искл. HNO 3 –азотная кислота)
Ме + КИСЛОТА =СОЛЬ + H 2 ↑ (р. замещения)
Zn + 2 HCl = ZnCl 2 + H 2
3. С основными (амфотерными) оксидами – оксидами металлов
Ме х О у + КИСЛОТА= СОЛЬ + Н 2 О (р. обмена)
КИСЛОТА + ОСНОВАНИЕ= СОЛЬ+ H 2 O ( р. обмена)
H 3 PO 4 + 3NaOH = Na 3 PO 4 + 3H 2 O
5. Реагируют с солями слабых, летучих кислот — если образуется кислота, выпадающая в осадок или выделяется газ:
2 NaCl (тв.) + H 2 SO 4 (конц.) = Na 2 SO 4 + 2HCl↑ ( р. обмена)
Сила кислот убывает в ряду:
HI > HClO 4 > HBr > HCl > H 2 SO 4 > HNO 3 > HMnO 4 > H 2 SO 3 > H 3 PO 4 > HF > HNO 2 >H 2 CO 3 > H 2 S > H 2 SiO 3 .
Каждая предыдущая кислота может вытеснить из соли последующую
6. Разложение кислородсодержащих кислот при нагревании ( искл. H 2 SO 4 ; H 3 PO 4 )
КИСЛОТА = КИСЛОТНЫЙ ОКСИД + ВОДА (р. разложения )
Запомните! Неустойчивые кислоты (угольная и сернистая) – разлагаются на газ и воду :
Сероводородная кислота в продуктах выделяется в виде газа:
ЗАДАНИЯ ДЛЯ ЗАКРЕПЛЕНИЯ
№1. Составьте уравнения реакций:
Назовите продукты реакции.
№2. Составьте уравнения реакций, назовите продукты:
№3. Составьте уравнения реакций взаимодействия кислот с основаниями и солями:
Химия, Биология, подготовка к ГИА и ЕГЭ
Серная кислота химические свойства
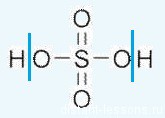
Формула серной кислоты — H2SO4
Тяжелая, маслянистая жидкость.
Чтобы лучше понять строение и свойства кислоты, почитайте про серу — именно из-за ее способности распаривать электроны и переносить их на d-подуровень степень окисления +6 стала возможной. Это максимальная степень окисления (максимальная с.о. соответствует номеру группы), поэтому для серной кислоты характерны окислительные свойства.
Давайте разберем все по подробнее…
Свойства кислоты
Почему серная кислота считается сильной? Потому что в растворе она практически полностью диссоциирует на ионы: H2SO4 = 2H(+) + SO4(2-)
Разбавленная серная кислота реагирует именно как кислота — с отщеплением водорода:
Качественная реакция на сульфат-ион:
Ba(2+) + SO4(-2) = BaSO4↓ (осадок белого цвета)
Окислительные свойства серной кислоты
Концентрированная серная кислота — довольно сильный окислитель:
Серная кислота и вода
C серной кислотой надо ОЧЕНЬ АККУРАТНО обращаться: при ее разбавлении надо приливать именно кислоту к воде.
Дело в том, что растворение кислоты сопровождается выделением большого количества тепла (стакан, пробирка или колба могут нагреться до 90 градусов!) , вода сильно нагревается и может произойти выброс ее из посуды (пробирка «плюнет» кислотой). Ожог от кислоты (тем более горячей) — очень страшный. Рубцы от ожога кислотой убрать нельзя никаким хирургическим путем.
Соли серной кислоты
- Средние: все атомы водорода замещены на металл: Na2SO4
- Кислые: от кислоты остался один водород: NaHSO4 — гидросульфат натрия.
Переход средняя соль —-> кислая соль:
Переход кислая соль —->средняя соль:
Как видите, серная кислота не обладает большим разнообразием продуктов реакции, но по химическим свойствам — очень активна и как кислота, и как кислота-окислитель.
Химические свойства кислот
О чем эта статья:
8 класс, 9 класс, ЕГЭ/ОГЭ
Кислоты — это сложные химические вещества, состоящие из одного или нескольких атомов водорода, способных замещаться атомами металла, и кислотных остатков.
Рассмотрим подробнее общие свойства кислот.
Диссоциация
Кислоты — это электролиты, которые при диссоциации образуют катионы водорода и анионы кислотного остатка. Диссоциация кислот происходит ступенчато. По способности к диссоциации кислоты разделяют на две группы:
Хорошо диссоциирующие (сильные): H2SO4, HCl, HBr, HNO3, HClO4, HI.
Разложение
В результате реакций разложения кислородсодержащих кислот образуются кислотный оксид и вода. Бескислородные кислоты образуют простые вещества. Для разложения некоторых кислот необходимо нагревание или излучение (HCl, HNO3, H3PO4) другие же разлагаются самопроизвольно в момент образования (H2CO3, H2SO3, HNO2).
Взаимодействие кислот с металлами
Металл может вытеснять водород из кислоты только в том случае, если металл стоит левее водорода в ряду активности металлов. Продукты реакции — соль и водород.
При взаимодействии с кислотами-окислителями, например, азотной, образуется продукт восстановления кислоты, хотя протекание реакции также неоднозначно.
Высокая окислительная способность серной и азотной кислот позволяет им вступать в реакции с металлами. Продукты реакции будут зависеть от активности металла и от концентрации кислот.
Таблица: химические свойства кислот-окислителей
На холоду — пассивация
На холоду — пассивация
Реакция не проходит
На холоду — пассивация
На холоду — пассивация
Взаимодействие кислот с основаниями
Кислоты реагируют с основаниями и амфотерными гидроксидами, в результате образуются соль и вода. Взаимодействие кислот с основаниями называют реакцией нейтрализации.
NaOH + HCl = NaCl + H2O
Взаимодействие кислот с солями
Сильные кислоты вытесняют слабые из растворов их солей, при этом образуются новая соль и новая кислота. Условие протекания реакции кислот с солями — одним из продуктов реакции должны быть нерастворимая соль или слабая кислота, вода, газ.
Взаимодействие кислот с основными и амфотерными оксидами
Кислоты вступают в реакцию с основными и амфотерными оксидами (последние ведут себя как основные оксиды). В результате реакции образуется соль и вода.
Восстановительные свойства бескислородных кислот
Бескислородные кислоты (кроме HF) проявляют восстановительные свойства за счет химического элемента, который входит в состав аниона, при действии на них различных окислителей.
Например, в качестве окислителей для всех галогеноводородных кислот выступают диоксид марганца MnO2, перманганат калия KMnO4, дихромат калия K2Cr2O7.
Результат этих реакций — образование свободных галогенов.
Из галогеноводородных кислот наибольшая восстановительная активность — у йодоводородной. Ее могут окислять оксид железа (III) и соль трехвалентного железа.
Высокая восстановительная активность характерна для сероводородной кислоты, она может быть окислена диоксидом серы.
Способность окрашивать индикаторы
Индикаторы кислот — это специальные вещества, при помощи которых определяют наличие кислот в растворе.
Вопросы для самоконтроля
С чем реагируют кислоты?
При каких условиях кислоты взаимодействуют с солями? Приведите пример.
Составьте уравнения реакций и назовите продукты реакций:
Разбавленный раствор серной кислоты реагирует с: медью, хлоридом меди, сульфатом меди, цинком?
Соляная кислота вступает в реакцию с каждым из двух веществ:
http://distant-lessons.ru/sernaya-kislota-ximicheskie-svojstva.html
http://skysmart.ru/articles/chemistry/himicheskie-svojstva-kislot