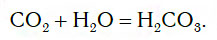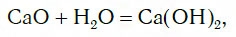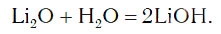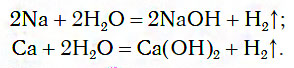ГДЗ (ответы) Химия 7 класс Григорович А.В. §24 Взаимодействие воды с оксидами
Контрольные вопросы
Вопрос 1 Какие оксиды называют кислотными, а какие — оснóвными?
Оксиды, гидраты которых являются кислотами, называют кислотными оксидами.
Оксиды, гидраты которых являются основаниями, называют оснóвнимы оксидами.
Вопрос 2 Какие вещества называют гидратами? Вещества, образующиеся путем соединения воды с другими веществами, называют гидратами.
Вопрос 3 Какие оксиды (кислотные и оснóвные) в обычных условиях взаимодействуют с водой, а какие — нет? Все кислотные оксиды, за исключением силиций (IV) оксида, и осн ó вные оксиды, гидраты которых растворяются в воде — щёлочи.
Задания для усвоения материала
Упражнение 1 Приведите уравнения реакций кислотных и оснóвных оксидов с водой.
Реакции кислотных оксидов с водой:
Реакций оснóвных оксидов с водой:
K 2 O + H 2 O = 2KOH (калий гидроксид)
Li2O + H2O = 2LiOH (литий гидроксид)
BaO + H2O = Ba(OH)2 (барий гидроксид)
CaO + H2O = Ca(OH)2 (кальций гидроксид)
Упражнение 2 Из приведенного перечня Na2O, P2O5, CO2, SO3, CrО, Cu2O, SiО2, Mn2O7 выпишите отдельно формулы оксидов:
Упражнение 3 Какие из приведенных оксидов Na2O, CO2, SO3,CrО, SiО2 взаимодействуют с водой? Na2 O, CO2 , SO3
Составьте соответствующие уравнения реакций.
Na2O + H2O = 2NaOH (натрий гидроксид)
Упражнение 4 Раствор, который образовался при растворении газообразного оксида в воде, окрашивает лакмус в красный цвет. К акой это газ мог бы быть? Лакмус в красный цвет окрашивает раствор кислоты, а кислота образуется вследствие взаимодействия с водой кислотного оксида, например, сульфур (IV) оксида SO2
Составьте уравнения реакций.
Упражнение 5 Гашение извести — это взаимодействие негашеной извести (кальций оксида) с водой. Составьте уравнение этой реакции.
CaO + H 2 O = Ca(OH) 2
Упражнение 6 Как вы считаете, существуют ли в природных условиях фосфор (V) оксид, сульфур (VI) оксиды, натрий оксид? Ответ обоснуйте. Нет, потому что эти оксиды являются химически активными и в обычных условиях реагируют с водой, образуя кислоты (H3PO4, H2SO3) или щелочь (NaOH), которые реагируют с образованием соответствующих солей.
Упражнение 7 Дополните схемы реакций и назовите продукты реакции:
а) Li2 O + H2 O = 2LiOH — литий гидроксид
в) BaO + H2 O = Ba(OH)2 — барий гидроксид
Упражнение 8* Некоторые оксиды используют как осушители для обезвоживания газов. На каком принципе основано действие оксидовкак осушителей? На способности некоторых оксидов взаимодействовать с водой, но не взаимодействовать с газом, содержащего воду как примесь.
Какие оксиды можно для этого использовать и почему? Фосфор (V) оксид P2O5 можно использовать для обезвоживания сероводорода (H2S), сероуглерода (CS2), метана (CH4), а кальций оксид СаО — благородных газов.
Вода с основными и кислотными оксидами уравнение
Перечислите химические свойства воды, иллюстрируя их уравнениями соответствующих реакций. Какую роль играют эти свойства в природе?
Химические свойства воды
Реакция фотосинтеза:
6CO2 + 6H2O hv,хлорофилл ⟶ C6H12O6 + 6O2
Фотосинтез основной поставщик кислорода в атмосферу, а из глюкозы в ходе дальнейших превращений возникает поразительное многообразие органических соединений.
Вода взаимодействует с щелочными и щёлочноземельными металлами:
2Na + 2H2O ⟶ 2NaOH + H2↑
Ca + 2H2O ⟶ Ca(OH)2 + H2↑
Вода соединяется с основными и кислотными оксидами, если образуется растворимый гидроксид – щёлочь или кислородсодержащая кислота:
H2O + Na2O ⟶ 2NaOH
H2O + SO3 ⟶ H2SO4
Вода разлагается под действием света, электрического тока или высоких температур (свыше 1500°C):
2H2O t ⟶ 2H2 + O2
Вода разлагает некоторые неорганические и многие органические вещества. Необратимому гидролизу подвергаются некоторые бинарные соединения, например соли летучих бескислородных кислот и нерастворимых оснований:
Al2S3 + 6H2O ⟶ 2Al(OH)3 + 3H2S↑.
Урок 28. Химические свойства воды
В уроке 28 «Химические свойства воды» из курса «Химия для чайников» узнаем о взаимодействии воды с различными веществами.
При обычных условиях вода является достаточно активным веществом по отношению к другим веществам. Это означает, что со многими из них она вступает в химические реакции.
Взаимодействие с оксидами неметаллов
Если струю газообразного оксида углерода(IV) CO2 (углекислого газа) направить в воду, то часть его растворится в ней (рис. 109).
При этом в растворе протекает химическая реакция соединения, в результате которой образуется новое вещество — угольная кислота H2CO3:
На заметку: Собирая углекислый газ над водой, Дж. Пристли обнаружил, что часть газа растворяется в воде и придает ей приятный терпкий вкус. По сути дела, Пристли впервые получил напиток типа газированной, или содовой, воды.
Реакция соединения происходит также, если к воде прибавить твердый оксид фосфора(V) P2O5. При этом протекает химическая реакция с образованием фосфорной кислоты H3PO4 (рис. 110):
Испытаем растворы, полученные при взаимодействии CO2 и P2O5 с водой, индикатором метиловым оранжевым. Для этого прибавим по 1—2 капли раствора индикатора к полученным растворам. Цвет индикатора изменится с оранжевого на красный, что говорит о присутствии кислот в растворах. Значит, при взаимодействии CO2 и P2O5 с водой действительно образовались кислоты H2CO3 и H3PO4.
Оксиды, подобные CO2 и P2O5, которые при взаимодействии с водой образуют кислоты, относят к кислотным оксидам.
Кислотные оксиды — это оксиды, которым соответствуют кислоты.
Некоторые из кислотных оксидов и соответствующих им кислот приведены в таблице 11. Обратите внимание, что это оксиды элементов неметаллов. Как правило, оксиды неметаллов являются кислотными оксидами.
Взаимодействие с оксидами металлов
С оксидами металлов вода реагирует иначе, чем с оксидами неметаллов.
Исследуем взаимодействие оксида кальция CaO с водой. Для этого поместим в стакан с водой небольшое количество CaO и тщательно перемешаем. При этом протекает химическая реакция:
в результате которой образуется новое вещество Ca(OH)2, относящееся к классу оснований. Таким же образом реагируют с водой оксиды лития, натрия. При этом также образуются основания, например:
Подробнее с основаниями вы познакомитесь в следующем уроке. Оксиды металлов, которым соответствуют основания, называют основными оксидами.
Основные оксиды — это оксиды, которым соответствуют основания.
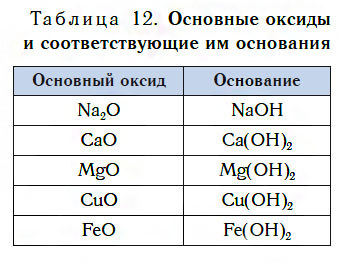
В таблице 12 приведены формулы некоторых основных оксидов и соответствующих им оснований. Заметьте, что, в отличие от кислотных оксидов, в состав основных оксидов входят атомы металлов. Большинство оксидов металлов — это основные оксиды.
Несмотря на то что каждому основному оксиду соответствует основание, не все основные оксиды взаимодействуют с водой, подобно CaO, образуя основания.
Взаимодействие с металлами
При обычных условиях активные металлы (K, Na, Ca, Ba и др.) бурно реагируют с водой:
В этих реакциях выделяется водород и образуются растворимые в воде основания.
Как химически активное вещество вода вступает в реакции со многими другими веществами, но об этом вы узнаете при дальнейшем изучении химии.
Краткие выводы урока:
- Вода — химически активное вещество. Она вступает в реакции с кислотными и основными оксидами, активными металлами.
- При взаимодействии воды с большинством кислотных оксидов образуются соответствующие кислоты.
- Некоторые основные оксиды при реакции с водой образуют растворимые основания.
- При обычных условиях вода реагирует с наиболее активными металлами. При этом образуются растворимые основания и водород.
Надеюсь урок 28 «Химические свойства воды» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
http://gomolog.ru/reshebniki/9-klass/gabrielyan-2014/20/6.html
http://himi4ka.ru/arhiv-urokov/urok-28-himicheskie-svojstva-vody.html