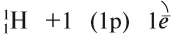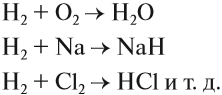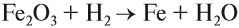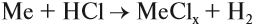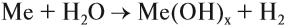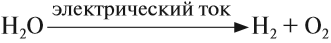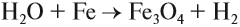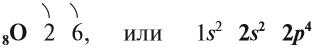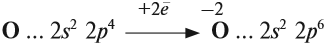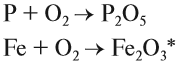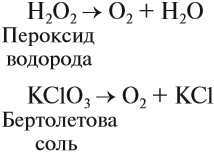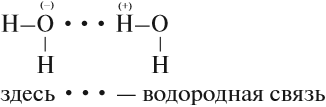Урок 12. Водород и кислород
Водород
Водород — самый распространённый химический элемент во Вселенной. Именно он составляет основу горючего вещества Звёзд.
Водород — первый химический элемент Периодической системы Менделеева. Его атом имеет простейшее строение: вокруг элементарной частицы «протон» (ядро атома) вращается один-единственный электрон:
Природный водород состоит из трех изотопов: протий 1 Н, дейтерий 2 Н и тритий 3 Н.
Задание 12.1. Укажите строение ядер атомов этих изотопов.
Имея на внешнем уровне один электрон, атом водорода может проявлять единственно возможную для него валентность I:
Вопрос. Образуется ли завершённый внешний уровень при приёме атомом водорода электронов?
Таким образом, атом водорода может и принимать, и отдавать один электрон, т. е. является типичным неметаллом. В любых соединениях атом водорода одновалентен.
Простое вещество «водород» Н2 — газ без цвета и запаха, очень лёгкий. Он плохо растворим в воде, но хорошо растворим во многих металлах. Так, один объём палладия Рd поглощает до 900 объёмов водорода.
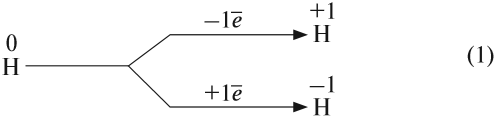
Схема (1) показывает, что водород может быть и окислителем, и восстановителем, реагируя с активными металлами и многими неметаллами:
Задание 12.2. Определите, в каких реакциях водород является окислителем, а в каких — восстановителем. Обратите внимание, что молекула водорода состоит из двух атомов.
Смесь водорода и кислорода является «гремучим газом», поскольку при поджигании её происходит сильнейший взрыв, который унёс многие жизни. Поэтому опыты, в которых выделяется водород, нужно выполнять подальше от огня.
Чаще всего водород проявляет восстановительные свойства, что используется при получении чистых металлов из их оксидов*:
* Аналогичные свойства проявляет алюминий (см. урок 10 — алюминотермия).
Разнообразные реакции происходят между водородом и органическими соединениями. Так, за счёт присоединения водорода (гидрирование) жидкие жиры превращаются в твёрдые (подробнее урок 25).
Водород можно получить разными способами:
- Взаимодействием металлов с кислотами:
Задание 12.3. Составьте уравнения таких реакций для алюминия, меди и цинка с соляной кислотой. В каких случаях реакция не идет? Почему? В случае затруднения см. уроки 2.2 и 8.3;
- Взаимодействие активных металлов с водой:
Задание 12.4. Составьте уравнения таких реакций для натрия, бария, алюминия, железа, свинца. В каких случаях реакция не идёт? Почему? В случае затруднений см. урок 8.3.
В промышленных масштабах водород получают электролизом воды:
а также при пропускании паров воды через раскалённые железные опилки:
Водород — самый распространённый элемент Вселенной. Он составляет бОльшую часть массы звёзд и участвует в термоядерном синтезе — источнике энергии, которую эти звёзды излучают.
Кислород
Кислород — самый распространённый химический элемент нашей планеты: более половины атомов Земной коры приходится на кислород. Вещество кислород О2 составляет около 1/5 нашей атмосферы, а химический элемент кислород — 8/9 гидросферы (Мирового океана).
В Периодической системе Менделеева кислород имеет порядковый номер 8 и находится в VI группе второго периода. Поэтому строение атома кислорода следующее:
Имея на внешнем уровне 6 электронов, кислород является типичным неметаллом, т. е. присоединяет два электрона до завершения внешнего уровня:
Поэтому кислород в своих соединениях проявляет валентность II и степень окисления –2 (за исключением пероксидов).
Принимая электроны, атом кислорода проявляет свойства окислителя. Это свойство кислорода исключительно важно: процессы окисления происходят при дыхании, обмене веществ; процессы окисления происходят при горении простых и сложных веществ.
Горение — окисление простых и сложных веществ, которое сопровождается выделением света и теплоты. В атмосфере кислорода горят или окисляются почти все металлы и неметаллы. При этом образуются оксиды:
При горении в кислороде сложных веществ образуются оксиды химических элементов, входящих в состав исходного вещества. Только азот и галогены выделяются в виде простых веществ:
Вторая из этих реакций используется как источник тепла и энергии в быту и промышленности, так как метан CH4 входит в состав природного газа.
Кислород позволяет интенсифицировать многие промышленные и биологические процессы. В больших количествах кислород получают из воздуха, а также электролизом воды (как и водород). В небольших количествах его можно получить разложением сложных веществ:
Задание 12.5. Расставьте коэффициенты в приведенных здесь уравнениях реакций.
Воду нельзя ничем заменить — этим она отличается практически от всех других веществ, которые встречаются на нашей планете. Воду может заменить только сама вода. Без воды нет жизни: ведь жизнь на Земле возникла тогда, когда на ней появилась вода. Жизнь зародилась в воде, поскольку она является естественным универсальным растворителем. Она растворяет, а значит, измельчает все необходимые питательные вещества и обеспечивает ими клетки живых организмов. А в результате измельчения резко возрастает скорость химических и биохимических реакций. Более того, без предварительного растворения невозможно протекание 99,5 % (199 из каждых 200) реакций! (См. также урок 5.1.)
Известно, что взрослый человек в сутки должен получать 2,5–3 л воды, столько же выводится из организма: т. е. в организме человека существует водный баланс. Если он нарушается, человек может просто погибнуть. Например, потеря человеком всего 1–2 % воды вызывает жажду, а 5 % — повышает температуру тела вследствие нарушения терморегуляции: возникает сердцебиение, возникают галлюцинации. При потере 10 % и более воды в организме возникают такие изменения, которые уже могут быть необратимы. Человек погибнет от обезвоживания.
Вода — уникальное вещество. Её температура кипения должна составлять –80 °C (!), однако равна +100 °C. Почему? Потому что между полярными молекулами воды образуются водородные связи:
Поэтому и лёд, и снег — рыхлые, занимают больший объём, чем жидкая вода. В результате лёд поднимается на поверхность воды и предохраняет обитателей водоёмов от вымерзания. Свежевыпавший снег содержит много воздуха и является прекрасным теплоизолятором. Если снег покрыл землю толстым слоем, то и животные и растения спасены от самых суровых морозов.
Кроме того, вода имеет высокую теплоёмкость и является своеобразным аккумулятором тепла. Поэтому на побережьях морей и океанов климат мягкий, а хорошо политые растения меньше страдают от заморозков, чем сухие.
Без воды в принципе невозможен гидролиз, химическая реакция, которая обязательно сопровождает усвоение белков, жиров и углеводов, которые являются обязательными компонентами нашей пищи. В результате гидролиза эти сложные органические вещества распадаются до низкомолекулярных веществ, которые, собственно, и усваиваются живым организмом (подробнее см. уроки 25–27). Процессы гидролиза были нами рассмотрены в уроке 6. Вода реагирует со многими металлами и неметаллами, оксидами, солями.
Задание 12.6. Составьте уравнения реакций:
- натрий + вода →
- хлор + вода →
- оксид кальция + вода →
- оксид серы (IV) + вода →
- хлорид цинка + вода →
- силикат натрия + вода →
Изменяется ли при этом реакция среды (рН)?
Вода является продуктом многих реакций. Например, в реакции нейтрализации и во многих ОВР обязательно образуется вода.
Задание 12.7. Составьте уравнения таких реакций.
Выводы
Водород — самый распространённый химический элемент во Вселенной, а кислород — самый распространённый химический элемент на Земле. Эти вещества проявляют противоположные свойства: водород — восстановитель, а кислород — окислитель. Поэтому они легко реагируют друг с другом, образуя самое удивительное и самое распространённое на Земле вещество — воду.
Контрольная работа по теме «КИСЛОРОД. ВОДОРОД. ВОДА. РАСТВОРЫ»
Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
КОНТРОЛЬНАЯ РАБОТА №2 «КИСЛОРОД, ВОДОРОД, ВОДА»
Задание 1. Запишите уравнение реакции, укажите тип реакции, расставьте коэффициенты:
1) горение железа;
2) взаимодействия воды с натрием;
3) горения водорода;
Задание 2. Составьте уравнение реакции горения сложного вещества – пропана ( C 3 H 8 ). Расставьте коэффициенты.
Задание 3. Рассчитайте количество сахара и воды, необходимых для приготовления 300 г раствора с массовой долей сахара в нем 45%.
Задание 4. Укажите один верный ответ:
1) Относительная молекулярная масса воды равна:
А) 16 Б) 14 В) 10 Г) 18
2) Аллотропным видоизменением кислорода является:
А) вода Б) озон В) азот Г) водород
3) К инертным (благородным) газам НЕ относится:
А) водород Б) аргон В) гелий Г) неон
4) При тушении пожара НЕ используют:
А) речной песок Б) бензин В) воду Г) углекислый газ
5) Какой из газов является самым легким из перечисленных:
А) водород Б) азот В) кислород Г) пары воды
КОНТРОЛЬНАЯ РАБОТА №2
Задание 1. Запишите уравнение реакции, укажите тип реакции, расставьте коэффициенты:
1) горения алюминия;
2) взаимодействия воды с цинком при нагревании;
3) взаимодействия водорода и серы (валентность серы в сероводороде равна II ).
Задание 2. Составьте уравнение реакции горения сложного вещества – пропена ( C 3 H 6 ). Расставьте коэффициенты.
Задание 3. Рассчитайте количество поваренной соли и воды, необходимых для приготовления 500 г раствора с массовой долей сахара в нем 32%.
Задание 4. Укажите один верный ответ:
1) Относительная атомная масса элемента кислород равна:
А) 8 Б) 16 В) 32 Г) 15
2) Раствор, в котором данное вещество при данной температуре больше не растворяется, называют:
А) Разбавленным Б) Насыщенным В) Концентрированным Г) Перенасыщенным
3) Содержание какого газа по объему в атмосферном воздухе наибольшее?
А) Водород Б) Кислород В) Углекислый газ Г) Азот
4) Водород как простое вещество в лаборатории можно получить:
А) при горении угля Б) при разложении оксида ртути
В) взаимодействии цинка и соляной кислоты Г) горении бензола ( C 6 H 6 )
5) Получение сложного вещества из более простых называется:
А) Синтез Б) Анализ В) Горение Г) Аллотропия
КОНТРОЛЬНАЯ РАБОТА №2
Задание 1. Запишите уравнение реакции, укажите тип реакции, расставьте коэффициенты: 1) горения магния;
2) взаимодействия водорода с оксидом меди ( II ) ;
3) взаимодействия воды с калием.
Задание 2. Составьте уравнение реакции горения сложного вещества – ацетилена ( C 2 H 2 ). Расставьте коэффициенты.
Задание 3. Рассчитайте количество соли и воды, необходимых для приготовления 250 г раствора с массовой долей соли в нем 30%.
Задание 4. Укажите один верный ответ:
1) Формула простого вещества кислород:
2) Сложные вещества, которые состоят из двух элементов, одним из которых является кислород:
А) гидриды Б) гидроксиды В) смеси Г) оксиды
3) Аллотропными модификациями являются:
А) кислород и водород Б) кислород и озон В) натрий и калий Г) озон и азот
4) К благородным газам НЕ относится:
А) кислород Б) неон В) гелий Г) аргон
5) Укажите, какая из реакций НЕ может быль способом получения кислорода:
А) 2 HgO = t 2 Hg + O 2 Б) 2 KMnO 4 = t K 2 MnO 4 + O 2 + MnO 2
КОНТРОЛЬНАЯ РАБОТА №2
Задание 1. Запишите уравнение реакции, укажите тип реакции, расставьте коэффициенты:
1) горения железа;
2) горение серы (образуется оксид серы ( IV ));
3) взаимодействия воды с кальцием.
Задание 2. Составьте уравнение реакции горения сложного вещества – бензола ( C 6 H 6 ). Расставьте коэффициенты.
Задание 3. Рассчитайте количество соли и воды, необходимых для приготовления 90 г раствора с массовой долей соли в нем 20%.
Задание 4. Укажите один верный ответ:
1) Качественная реакция на простое вещество кислород:
А) помутнение известковой воды Б) образование осадка
В) горение тлеющей лучинки В) появление специфического запаха
2) Газ с характерным запахом свежести, голубого цвета, в 1,5 раза тяжелее кислорода:
А) азот Б) водород В) гелий Г) озон
3) Составной частью воздуха НЕ является:
А) водород Б) кислород В) азот Г) углекислый газ
4) Метод определения состава веществ путем его разложения на более простые называется: А) синтез Б) анализ В) модификация Г) замещение
5) Раствор называется насыщенным, если:
А) в нем растворенного вещества больше, чем воды
Б) в нем на 100 г воды растворено 100 г вещества
В) в нем при данной температуре больше нельзя растворить вещества
Г) в нем при данной температуре можно растворить еще вещества
КОНТРОЛЬНАЯ РАБОТА №2
Задание 1. Запишите уравнение реакции, укажите тип реакции, расставьте коэффициенты:
1) горения кальция;
2) взаимодействия водорода с хлором (валентность хлора в хлороводороде равна I );
3) взаимодействия воды с натрием.
Задание 2. Составьте уравнение реакции горения сложного вещества – этана ( C 2 H 6 ). Расставьте коэффициенты.
Задание 3. Рассчитайте массовую долю поваренной соли в растворе, состоящем из 30 г хлорида натрия и 70 г воды.
Задание 4. Укажите один верный ответ:
1) Если первоначальный раствор имеет массовую долю соли 30%, то для приготовления из него нового раствора той же соли с массовой доле 10% нужно:
А) добавить соли Б) долить воды В) выпарить воду
Г) нельзя приготовить из одного раствора другой
2) Относительная атомная масса элемента кислород равна:
А) 8 Б) 16 В) 32 Г) 15
3) К благородным газам относится:
А) кислород Б) неон В) азот Г) озон
4) Водород как простое вещество в лаборатории можно получить:
А) при горении серы Б) при разложении оксида ртути
В) взаимодействии цинка и серной кислоты Г) горении этана ( C 2 H 6 )
5) Две молекулы простого вещества водород обозначаются:
КОНТРОЛЬНАЯ РАБОТА №2
Задание 1. Запишите уравнение реакции, укажите тип реакции, расставьте коэффициенты:
1) горения бария;
2) взаимодействия водорода с оксидом меди ( II );
3) взаимодействия воды с цинком при нагревании.
Задание 2. Составьте уравнение реакции горения сложного вещества – бензола ( C 6 H 6 ). Расставьте коэффициенты.
Задание 3. Рассчитайте массовую долю поваренной соли в растворе, состоящем из 60 г хлорида натрия и 120 г воды.
Задание 4. Укажите один верный ответ:
1) Относительная молекулярная масса вещества кислород равна:
А) 8 Б) 16 В) 32 Г) 15
2) Раствор, в котором данное вещество при данной температуре больше не растворяется, называют:
А) Разбавленным Б) Насыщенным В) Концентрированным Г) Перенасыщенным
3) Содержание какого газа по объему в атмосферном воздухе наибольшее?
А) Водород Б) Кислород В) Углекислый газ Г) Азот
4) Водород как простое вещество в лаборатории можно получить:
А) при горении угля Б) при разложении оксида ртути
В) взаимодействии цинка и соляной кислоты Г) горении бензола ( C 6 H 6 )
5) Получение сложного вещества из более простых называется:
А) Синтез Б) Анализ В) Горение Г) Аллотропия
КОНТРОЛЬНАЯ РАБОТА №2
Задание 1. Запишите уравнение реакции, укажите тип реакции, расставьте коэффициенты:
1) горения алюминия;
2) взаимодействия водорода и серы (валентность серы в сероводороде равна II );
3) взаимодействия воды и литием.
Задание 2. Составьте уравнение реакции горения сложного вещества – пропана ( C 3 H 8 ). Расставьте коэффициенты.
Задание 3. Рассчитайте количество сахара и воды, необходимых для приготовления 200 г раствора с массовой долей сахара в нем 35%.
Задание 4. Укажите один верный ответ:
1) Относительная молекулярная масса воды равна:
А) 16 Б) 14 В) 10 Г) 18
2) Аллотропным видоизменением кислорода является:
А) вода Б) озон В) азот Г) водород
3) К инертным (благородным) газам НЕ относится:
А) водород Б) аргон В) гелий Г) неон
4) При тушении пожара НЕ используют:
А) речной песок Б) бензин В) воду Г) углекислый газ
5) Какой из газов является самым легким из перечисленных:
А) водород Б) азот В) кислород Г) пары воды
КОНТРОЛЬНАЯ РАБОТА №2
Задание 1. Запишите уравнение реакции, укажите тип реакции, расставьте коэффициенты:
1) горения фосфора (образуется оксид фосфора ( V ));
2) взаимодействия водорода с хлором (валентность хлора в хлороводороде равна I );
3) взаимодействия воды с магнием при нагревании.
Задание 2. Составьте уравнение реакции горения сложного вещества – этана ( C 2 H 6 ). Расставьте коэффициенты.
Задание 3. Рассчитайте массовую долю поваренной соли в растворе, состоящем из 40 г хлорида натрия и 360 г воды.
Задание 4. Укажите один верный ответ:
1) Если первоначальный раствор имеет массовую долю соли 20%, то для приготовления из него нового раствора той же соли с массовой доле 5% нужно:
А) добавить соли Б) долить воды В) выпарить воду
Г) нельзя приготовить из одного раствора другой
2) Относительная атомная масса элемента кислород равна:
А) 8 Б) 16 В) 32 Г) 15
3) К благородным газам относится:
А) кислород Б) неон В) азот Г) озон
4) Водород как простое вещество в лаборатории можно получить:
А) при горении серы Б) при разложении оксида ртути
В) взаимодействии цинка и серной кислоты Г) горении этана ( C 2 H 6 )
5) Две молекулы простого вещества водород обозначаются:
Курс повышения квалификации
Дистанционное обучение как современный формат преподавания
- Сейчас обучается 925 человек из 80 регионов
Курс повышения квалификации
Инструменты онлайн-обучения на примере программ Zoom, Skype, Microsoft Teams, Bandicam
- Курс добавлен 31.01.2022
- Сейчас обучается 24 человека из 14 регионов
Курс повышения квалификации
Педагогическая деятельность в контексте профессионального стандарта педагога и ФГОС
- Курс добавлен 23.11.2021
- Сейчас обучается 35 человек из 23 регионов
Ищем педагогов в команду «Инфоурок»
Дистанционные курсы для педагогов
«Взбодрись! Нейрогимнастика для успешной учёбы и комфортной жизни»
Свидетельство и скидка на обучение каждому участнику
Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
5 578 831 материал в базе
Материал подходит для УМК
«Химия», Рудзитис Г.Е., Фельдман Ф.Г.
§ 27. Воздух и его состав
Самые массовые международные дистанционные
Школьные Инфоконкурсы 2022
33 конкурса для учеников 1–11 классов и дошкольников от проекта «Инфоурок»
Другие материалы
- 23.01.2022
- 140
- 2
- 22.01.2022
- 61
- 2
- 22.01.2022
- 67
- 0
- 22.01.2022
- 52
- 0
- 22.01.2022
- 80
- 0
- 22.01.2022
- 55
- 1
- 22.01.2022
- 148
- 3
- 22.01.2022
- 39
- 1
Вам будут интересны эти курсы:
Оставьте свой комментарий
Авторизуйтесь, чтобы задавать вопросы.
Добавить в избранное
- 23.01.2022 4691
- DOCX 22.4 кбайт
- 101 скачивание
- Оцените материал:
Настоящий материал опубликован пользователем Козел Наталья Олеговна. Инфоурок является информационным посредником и предоставляет пользователям возможность размещать на сайте методические материалы. Всю ответственность за опубликованные материалы, содержащиеся в них сведения, а также за соблюдение авторских прав несут пользователи, загрузившие материал на сайт
Если Вы считаете, что материал нарушает авторские права либо по каким-то другим причинам должен быть удален с сайта, Вы можете оставить жалобу на материал.
Автор материала
- На сайте: 4 месяца
- Подписчики: 0
- Всего просмотров: 21816
- Всего материалов: 25
Московский институт профессиональной
переподготовки и повышения
квалификации педагогов
Дистанционные курсы
для педагогов
663 курса от 690 рублей
Выбрать курс со скидкой
Выдаём документы
установленного образца!
Учителя о ЕГЭ: секреты успешной подготовки
Время чтения: 11 минут
В Ленобласти школьники 5-11-х классов вернутся к очному обучению с 21 февраля
Время чтения: 1 минута
Профессия педагога на третьем месте по популярности среди абитуриентов
Время чтения: 1 минута
Приемная кампания в вузах начнется 20 июня
Время чтения: 1 минута
Тринадцатилетняя школьница из Индии разработала приложение против буллинга
Время чтения: 1 минута
Онлайн-конференция о создании школьных служб примирения
Время чтения: 3 минуты
Полный перевод школ на дистанционное обучение не планируется
Время чтения: 1 минута
Подарочные сертификаты
Ответственность за разрешение любых спорных моментов, касающихся самих материалов и их содержания, берут на себя пользователи, разместившие материал на сайте. Однако администрация сайта готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием сайта. Если Вы заметили, что на данном сайте незаконно используются материалы, сообщите об этом администрации сайта через форму обратной связи.
Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления. Авторские права на материалы принадлежат их законным авторам. Частичное или полное копирование материалов сайта без письменного разрешения администрации сайта запрещено! Мнение администрации может не совпадать с точкой зрения авторов.
Водород кислород уравнение реакции расставьте коэффициенты


Что получается из водорода и кислорода, мы уже знаем:
Теперь учтем, что атомы химических элементов в химических реакциях не исчезают и не появляются из ничего, не превращаются друг в друга, а соединяются в новых комбинациях, образуя новые молекулы. Значит, в уравнении химической реакции атомов каждого сорта должно быть одинаковое количество до реакции (слева от знака равенства) и после окончания реакции (справа от знака равенства), вот так:
Это и есть уравнение реакции — условная запись протекающей химической реакции с помощью формул веществ и коэффициентов.
Это значит, что в приведенной реакции два моля водорода должны прореагировать с одним молем кислорода, и в результате получится два моля воды.
Взаимодействие водорода с кислородом — совсем не простой процесс. Он приводит к изменению степеней окисления этих элементов. Чтобы подбирать коэффициенты в таких уравнениях, обычно пользуются методом «электронного баланса«.
Когда из водорода и кислорода образуется вода, то это значит, что водород поменял свою степень окисления от 0 до +I, а кислород — от 0 до −II. При этом от атомов водорода к атомам кислорода перешло несколько (n) электронов:

Водород, отдающий электроны, служит здесь восстановителем, а кислород, принимающий электроны — окислителем.

Посмотрим теперь, как выглядят процессы отдачи и приема электронов по отдельности. Водород, встретившись с «грабителем»-кислородом, теряет все свое достояние — два электрона, и его степень окисления становится равной +I:
Получилось уравнение полуреакции окисления водорода.
А бандит-кислород О2, отняв последние электроны у несчастного водорода, очень доволен своей новой степенью окисления -II:
Это уравнение полуреакции восстановления кислорода.
Остается добавить, что и «бандит», и его «жертва» потеряли свою химическую индивидуальность и из простых веществ — газов с двухатомными молекулами Н2 и О2 превратились в составные части нового химического вещества — воды Н2О.
Дальше будем рассуждать следующим образом: сколько электронов отдал восстановитель бандиту-окислителю, столько тот и получил. Число электронов, отданных восстановителем, должно быть равно числу электронов, принятых окислителем.
Значит, надо уравнять число электронов в первой и второй полуреакциях. В химии принята такая условная форма записи уравнений полуреакций:
 |
 |
 |
При этом получается фтороводород HF или аммиак NH3.
В обоих соединениях степень окисления водорода становится равной +I, потому что партнеры по молекуле ему достаются «жадные» до чужого электронного добра, с высокой электроотрицательностью — фтор F и азот N. У азота значение электроотрицательности считают равным трем условным единицам, а у фтора вообще самая высокая электроотрицательность среди всех химических элементов — четыре единицы. Так что немудрено им оставить бедняжку-атом водорода без всякого электронного окружения.
Но водород может и восстанавливаться — принимать электроны. Это происходит, если в реакции с ним будут участвовать щелочные металлы или кальций, у которых электроотрицательность меньше, чем у водорода.
При встрече молекул водорода с такими металлами он сам становится «бандитом» и «охотником за электронами» и отнимает у металлов их электронное «достояние»:

 |
В обоих случаях получаются гидриды металлов — гидрид натрия NaH и гидрид кальция СаН2, в которых водород имеет степень окисления −I. Таким образом, мы выяснили, что водород в окислительно-восстановительных реакциях может быть и охотником за электронами, и жертвой.

http://infourok.ru/kontrolnaya-rabota-po-teme-kislorod-vodorod-voda-rastvory-5696951.html
http://www.alhimik.ru/teleclass/glava4/gl-4-3.shtml