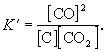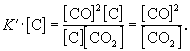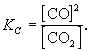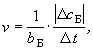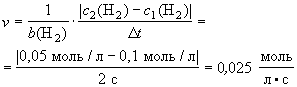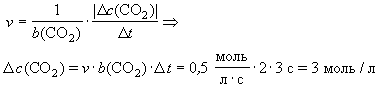Реакция взаимодействия водорода и йода
Реакция взаимодействия водорода и йода
Уравнение реакции взаимодействия водорода и йода:
Реакция взаимодействия водорода и йода.
В результате реакции образуется йодоводород.
В ходе реакции используется катализатор: платина.
Реакция протекает при условии: при температуре 350-500°C.
Формула для поиска по сайту: H2 + I2 → 2HI
Реакция взаимодействия карбоната скандия и серной кислоты
Реакция взаимодействия цинка, гидроксида лития и воды
Реакция взаимодействия хлорида олова (IV) и серной кислоты
Рубрики
ТОП 5 записей
Выбрать язык
Популярные записи
Предупреждение.
Все химические реакции и вся информация на сайте предназначены для использования исключительно в учебных целях — только для решения письменных, учебных задач. Мы не несем ответственность за проведение вами химических реакций.
Химические реакции и информация на сайте
не предназначены для проведения химических и лабораторных опытов и работ.
Водород плюс йод кинетическое уравнение
9.5. Обратимость химических реакций. Химическое равновесие
Рассмотрим эндотермическую реакцию
Смешаем в реакторе (в данном случае, в каком-либо закрытом сосуде) нагретые, например, до 450 ° С водород и пары йода. Для простоты расчетов допустим, что концентрации исходных веществ были одинаковыми и равными одному молю на литр, то есть с(Н2) = 1 моль/л и с(I2) = 1 моль/л.
Несмотря на отрицательный тепловой эффект водород и йод начнут реагировать друг с другом, образуя йодоводород. Следовательно, в данной реакции «перетягивает» энтропийный фактор. Действительно, в смеси трех газов (Н2, I2 и HI) порядка меньше, чем в смеси двух газов (Н2 и I2). Экспериментально протекание этой реакции можно обнаружить, измеряя концентрации участвующих в ней веществ. Сразу после смешивания концентрации йода и водорода начнут уменьшаться, в реакторе появится йодоводород, концентрация которого будет постепенно увеличиваться.
Может ли эта реакция пройти до конца? То есть могут ли все молекулы йода и водорода прореагировать друг с другом с образованием молекул йодоводорода?
Наверное, нет. Ведь по мере протекания реакции в реакторе будут накапливаться молекулы йодоводорода и исчезать молекулы йода и водорода. В конце реакции газ должен был бы представлять собой чистый йодоводород. Но в системе, состоящей только из молекул одного газа, порядка много больше (а энтропия меньше), чем в смеси газов. Энтропийный фактор » потянет» в обратную сторону. И энергетический фактор здесь не поможет — тепловой эффект исходной реакции отрицательный.
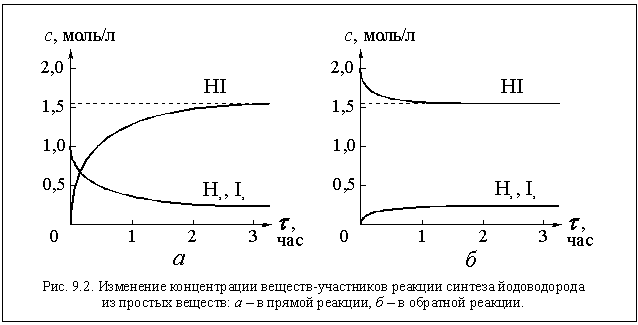
Действительно, примерно через 1,5 часа мы обнаружим, что концентрации всех трех газов в реакторе перестали изменяться и приняли следующие значения: с(Н2) = 0,22 моль/л; с(I2) = 0,22 моль/л и с(HI) = 1,56 моль/л (см. рис. 9.2 а).
Если теперь мы поместим в тот же реактор при той же температуре столько чистого йодоводорода, чтобы его концентрация была равной 2 моль/л, начавшаяся реакция
также не дойдет до конца (почему?). Дождавшись прекращения изменения концентраций, мы увидим, что концентрации газов в реакторе оказались такими же, как и в предыдущем случае (см. рис. 9.2 б).
Две рассмотренные нами реакции (1 и 2) можно представить как один процесс, в котором реакции протекают в разных направлениях. Условно одно из них называют прямым направлением (слева направо по уравнению реакции), а другое — обратным направлением (справа налево по уравнению реакции). Соответствующие реакции называются прямой и обратной реакциями, а весь процесс обратимым процессом или обратимой реакцией.
| Обратимая реакция — реакция, которая в данных условиях может протекать как в прямом, так и в обратном направлениях. |
Таким образом реакция водорода с йодом обратима.
В уравнениях обратимых реакций вместо знака равенства ставится знак обратимости — » Б » , например:
H2 + I2 
Состояние, в котором в обратимой реакции концентрации участвующих в этой реакции веществ остаются постоянными, называется состоянием химического равновесия.
В состоянии равновесия молекулы не перестают испытывать соударения, и между ними не прекращается взаимодействие, но концентрации веществ остаются постоянными. Эти концентрации называются равновесными.
| Равновесная концентрация — концентрация вещества, участвующего в обратимой химической реакции, достигшей состояния равновесия. |
Равновесная концентрация обозначается формулой вещества, взятой в квадратные скобки, например:
Как и любая другая концентрация, равновесная концентрация измеряется в молях на литр.
Если бы в рассмотренных нами примерах мы взяли другие концентрации исходных веществ, то после достижения равновесия получили бы другие значения равновесных концентраций. Эти новые значения (обозначим их звездочками) будут связаны со старыми следующим образом:
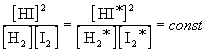
В общем случае для обратимой реакции
aA + bB 
в состоянии равновесия при постоянной температуре соблюдается соотношение
Это соотношение носит название закон действующих масс, который формулируется следующим образом:
при постоянной температуре отношение произведения равновесных концентраций продуктов реакции, взятых в степенях, равных их коэффициентам, к произведению равновесных концентраций исходных веществ, взятых в степенях, равных их коэффициентам, есть величина постоянная.
Постоянная величина (КС) называется константой равновесия данной реакции. Индекс » с» в обозначении этой величины показывает, что для расчета константы использовались концентрации.
Если константа равновесия велика, то равновесие сдвинуто в сторону продуктов прямой реакции, если мала, то — в сторону исходных веществ. Если константа равновесия очень велика, то говорят, что реакция » практически необратима» , если константа равновесия очень мала, то реакция » практически не идет» .
Константа равновесия — для каждой обратимой реакции величина постоянная только при постоянной температуре. Для одной и той же реакции при разных температурах константа равновесия принимает разные значения.
Приведенное выражение для закона действующих масс справедливо только для реакций, все участники которых представляют собой либо газы, либо растворенные вещества. В других случаях уравнение для константы равновесия несколько меняется.
Например, в протекающей при высокой температуре обратимой реакции
С(гр) + СО2 
участвует твердый графит С(гр). Формально, пользуясь законом действующих масс, запишем выражение для константы равновесия этой реакции, обозначив ее К’:
Твердый графит, лежащий на дне реактора, реагирует только с поверхности, и его » концентрация» не зависит от массы графита и постоянна при любом соотношении веществ в газовой смеси.
Умножим правую и левую части уравнения на эту постоянную величину:
Получившаяся величина и есть константа равновесия этой реакции:
Аналогичным образом, для равновесия другой обратимой реакции, протекающей также при высокой температуре,
CaCO3(кр) 
получим константу равновесия
В этом случае она просто равна равновесной концентрации углекислого газа.
С метрологической точки зрения константа равновесия не является одной физической величиной. Это группа величин с различными единицами измерений, зависящими от конкретного выражения константы через равновесные концентрации. Например, для обратимой реакции графита с углекислым газом [Kc] = 1 моль/л, такая же единица измерений и у константы равновесия реакции термического разложения карбоната кальция, а константа равновесия реакции синтеза йодоводорода — величина безразмерная. В общем случае [Kc] = 1 (моль/л) n .

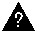
2.Составьте уравнения реакций синтеза воды и аммиака из простых веществ. Запишите выражения для констант равновесия этих реакций.
3.Составьте выражения для констант равновесия следующих обратимых химических реакций:
а) 2NO(г) + O2(г) 

в) PCl3(г) + Cl2(г) 

д) CH4(г) + I2(г) 
4.При определенных условиях равновесие в системе установилось при концентрации водорода, йода и йодоводорода 0,25 моль/л; 0,05 моль/л и 0,90 моль/л, соответственно. Рассчитайте константу равновесия этой реакции и определите исходные концентрации водорода и йода.
5.Константа равновесия обратимой реакции
H2(г) + Cl2(г) 
при комнатной температуре равна примерно 1015. Что, основываясь на этом, можно сказать об этой реакции?
Так как почти все реакции в той или иной степени обратимы, в промышленности и лабораторной практике возникают две проблемы: как получить продукт » полезной» реакции с максимальным выходом и как уменьшить выход продуктов » вредной» реакции. И в том, и в другом случае возникает необходимость сместить равновесие либо в сторону продуктов реакции, либо в сторону исходных веществ. Чтобы научиться это делать, надо знать, от чего зависит положение равновесия любой обратимой реакции.
Положение равновесия зависит:
1) от значения константы равновесия (то есть от природы реагирующих веществ и температуры),
2) от концентрации веществ, участвующих в реакции и
3) от давления (для газовых систем оно пропорционально концентрациям веществ).
Для качественной оценки влияния на химическое равновесие всех этих очень разных факторов используют универсальный по своей сути принцип Ле Шателье (французский физикохимик и металловед Анри Луи Ле Шателье сформулировал его в 1884 году), который применим к любым равновесным системам, не только химическим.
Если на систему, находящуюся в равновесии, воздействовать извне, то равновесие в системе сместится в направлении, в котором происходит частичная компенсация этого воздействия.
В качестве примера влияния на положение равновесия концентраций веществ-участников реакции рассмотрим уже известную вам обратимую реакцию получения йодоводорода
H2(г) + I2(г) 
По закону действующих масс в состоянии равновесия
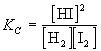
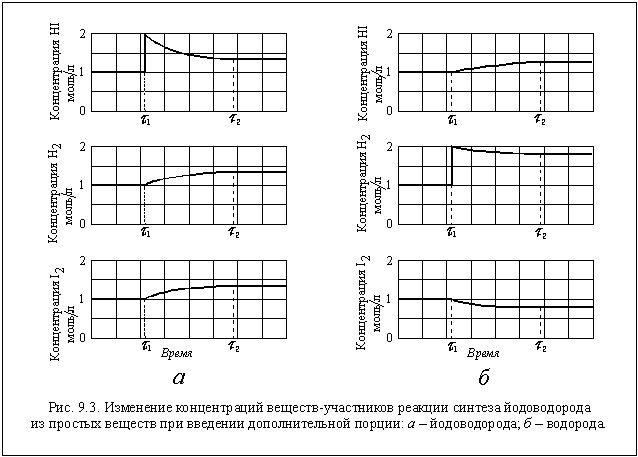
Пусть в реакторе объемом 1 литр при некоторой постоянной температуре установилось равновесие, при котором концентрации всех участников реакции одинаковы и равны 1 моль/л ([H2] = 1 моль/л; [I2] = 1 моль/л; [HI] = 1 моль/л). Следовательно, при этой температуре КС = 1. Так как объем реактора 1 литр, n(H2) = 1 моль, n(I2) = 1 моль и n(HI) = 1 моль. В момент времени t 1 введем в реактор еще 1 моль HI, его концентрация станет равной 2 моль/л. Но, чтобы КС оставалась постоянной, должны увеличиться концентрации водорода и йода, а это возможно только за счет разложения части йодоводорода по уравнению
Пусть к моменту достижения нового состояния равновесия t 2 разложилось x моль HI и, следовательно, образовалось дополнительно по 0,5x моль H2 и I2. Новые равновесные концентрации участников реакции: [H2] = (1 + 0,5x) моль/л; [I2] = (1 + 0,5x) моль/л; [HI] = (2 — x) моль/л. Подставив числовые значения величин в выражение закона действующих масс, получим уравнение
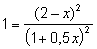
Откуда x = 0,667. Следовательно, [H2] = 1,333 моль/л; [I2] = 1,333 моль/л; [HI] = 1,333 моль/л.
Все эти изменения концентраций наглядно показаны на рисунке 9.3 а.
В результате введения в реактор дополнительной порции HI равновесие в системе нарушилось и сместилось в сторону образования исходных веществ (H2 и I2). В данном случае — это обратная реакция. Следовательно, равновесие сместилось в сторону обратной реакции (» влево» ).
Если в тот же реактор при тех же условиях ввести 1 моль водорода, то равновесие сместится в направлении, в котором водород вступит в реакцию, и его концентрация за счет этого понизится, а концентрация HI повысится. Это происходит в прямой реакции, и , следовательно, теперь равновесие смещается в сторону прямой реакции (» вправо» ). Легко посчитать новые равновесные концентрации в этом случае: [H2] = 1,865 моль/л; [I2] = 0,865 моль/л; [HI] = 1,270 моль/л (см. рис. 9.3 б).
Таким образом, введение в систему одного из веществ-участников реакции приводит к смещению равновесия в направлении, в котором это вещество расходуется.
В качестве примера влияния на положение равновесия температуры рассмотрим обратимую реакцию синтеза аммиака N2(г) + 3H2(г) 
Прямая реакция здесь экзотермическая: N2(г) + 3H2(г) = 2NH3(г) + Q,
и, следовательно, обратная реакция — эндотермическая: 2NH3(г) = N2(г) + 3H2(г) — Q.
В прямой реакции выделяется теплота. Если нам нужно сместить равновесие вправо, то есть в сторону прямой реакции, то выделение теплоты должно стать » ответом» системы на внешнее воздействие, а именно — на отвод теплоты. А отводя теплоту, мы понижаем температуру в реакторе.
Наоборот, если мы нагреем реакционную смесь, то есть подведем теплоту, » ответом» системы будет поглощение теплоты, которое может произойти только при смещении равновесия » влево» .
Таким образом, при нагревании равновесие смещается в сторону эндотермической реакции, а при охлаждении — наоборот.
Конечно, и в этой системе равновесие можно сместить, меняя концентрации веществ-участников реакции. Но посмотрим, как сместится равновесие в этой системе, если увеличить давление. По принципу Ле Шателье равновесие должно сместиться в сторону, компенсирующую внешнее воздействие, то есть в направлении той реакции, в которой при постоянном объеме общее давление уменьшается. Это возможно только при уменьшении общего числа молекул в системе. Общее число молекул уменьшается в ходе прямой реакции, следовательно, равновесие сместится в сторону образования аммиака. И наоборот, при понижении давления равновесие сместится в сторону образования азота и водорода.

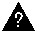
2СО(г) + О2(г) 
3.Для каждой из следующих обратимых реакций запишите выражение константы равновесия и перечислите все способы смещения равновесия вправо:
а) N2O4(г) 

в) COCl2(г) 

д) SO2(г) + O2(г) 

ж) C(т)+ H2O(г) 

к) FeO(т) + CO(г) 
Возможность протекания реакции определяется энергетическим и энтропийным факторами. Если реакция возможна, она может протекать быстро (иногда даже слишком быстро — со взрывом) или медленно (иногда даже так медленно, что мы ее не замечаем). Но в любом случае мы можем говорить о скорости химической реакции. Как скорость тела характеризует быстроту перемещения этого тела, так и скорость реакции характеризует интенсивность реакции, показывая, сколько частиц прореагировало в единицу времени в единице объема реактора. Для удобства вместо числа частиц берут количество вещества, а отношение количества вещества к объему системы — это концентрация данного вещества.
| Скорость химической реакции — физическая величина, характеризующая интенсивность протекания реакции и равная отношению изменения концентрации вещества, участвующего в реакции, к промежутку времени, за который это изменение произошло. |
Скорость химической реакции рассчитывается с учетом коэффициента перед формулой данного вещества в уравнении реакции (bБ).
Данное определение применимо только для реакций, протекающих в жидкой или газовой фазе.
где v — скорость химической реакции,
сБ = с2(Б) — с1(Б) — изменение концентрации вещества Б (c1 — начальное значение, c2 — конечное значение концентрации),
t = t2 — t1 — промежуток времени(t1 — начальное значение, t2 — конечное значение времени).
Задача
В реакции Н2 + I2 = 2HI концентрация водорода изменилась с 0,1 моль/л до 0,05 моль/л за 2 секунды. Определите скорость реакции.
Решение
Н2 + I2 = 2HI
c1(H2) = 0,1 моль/л
c2(H2) = O,05 моль/л
D t = 2 c
b(H2) = 1
Ответ: v = 0,025 моль/(л . с).
Задача
В реакции 2СО + О2 = 2СО2 при определенных условиях скорость равна 0,5 моль/(лЧ с). В некоторый момент времени с1(СО2) = 2 моль/л. Какова будет концентрация диоксида углерода через три секунды?
Решение
с2(СО2) = ?
2СО + О2 = 2СО2
с1(СО2) = 2 моль/л
D t = 2 с
v = 0,5 моль/(лЧ с)
b(СО2) = 2
c2(CO2) > c1(CO2) c2(CO2) = (2 + 3) моль/л = 5 моль/л
Если реагирующие вещества газообразны, то продукты реакции могут получиться только при столкновении молекул исходных веществ. Чем больше таких соударений, тем быстрее идет реакция. Число столкновений пропорционально концентрациям исходных веществ. Следовательно, скорость реакции А + Б = Д (все вещества газообразны) будет выражаться уравнением (закон действующих масс для скорости реакции):
где k — константа скорости реакции, а сА и сБ — концентрации веществ А и Б.
Увеличение давления в реакторе приводит к пропорциональному возрастанию всех концентраций, поэтому при увеличении давления скорость реакции возрастает.
Далеко не каждое столкновение молекул приводит к их взаимодействию. Эффективны лишь достаточно сильные соударения. Сила соударений пропорциональна кинетической энергии молекул, которая возрастает с повышением температуры. Следовательно, и скорость реакции с увеличением температуры тоже возрастает.
Для многих реакций можно оценить изменение скорости в зависимости от температуры, используя приближенное уравнение, предложенное голландским химиком Якобом Вант-Гоффом (1852 — 1911):
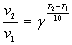
где v1 — скорость реакции при температуре T1, v2 — скорость реакции при температуре T2, а g — так называемый температурный коэффициент реакции, который для разных реакций разный, но обычно принимает значения от 2 до 4.
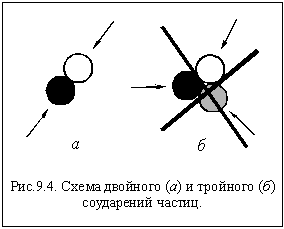
И в газах, и в жидкостях одновременно могут сталкиваться только две частицы (рис. 9.4 а). Тройное соударение крайне маловероятно (рис 9.4 б).
Поэтому большинство реакций, выражающихся иногда очень сложными уравнениями, протекает в несколько стадий, для осуществления каждой из которых необходимы только двойные соударения. Если экспериментально удается выяснить, из каких стадий складывается та или иная реакция, то говорят, что для этой реакции известен ее механизм.
| Механизм реакции — совокупность всех стадий данной реакции. |
Например, механизм реакции 4HBr + O2 = 2H2O + 2Br2, протекающей в газовой фазе при температуре около 500 ° С, включает три стадии:
HBr + O2 = HOOBr;
HOOBr + HBr = 2HOBr;
HOBr + HBr = H2O + Br2.
Скорость этих реакций различна, а общая скорость суммарной реакции определяется скоростью самой медленной из этих стадий (в данном случае первой).
Практически важно то, что по суммарному уравнению реакции невозможно определить механизм этой реакции. Например, реакция H2(г) + I2(г) = 2HI(г) простая, то есть проходит в одну стадию, а, казалось бы, совершенно аналогичная реакция
сложная, протекающая в несколько стадий по цепному механизму:
Cl2 = Cl· + · Cl (при нагревании или освещении)
Cl· + H2 = HCl + H·
H· + Cl2 = HCl + Cl·
и так далее.
Существуют и другие механизмы реакций, с некоторыми из них вы познакомитесь позже.
Скорости реакций и их механизмы изучает раздел физической химии, который называется » химическая кинетика» .
Итак, скорость химической реакции, в которой участвуют только газообразные вещества (то есть » газовый раствор» ), зависит
1) от температуры,
2) от концентрации веществ, участвующих в реакции, и, как следствие этого,
3) от давления.
Скорости реакций, протекающих в жидких растворах, от давления практически не зависят.
Если реагирующие вещества не образуют между собой раствора (жидкого или газового), то реакция протекает только на поверхности соприкосновения этих веществ. Скорость такой реакции зависит от площади этой поверхности. Действительно, щепки горят быстрее полена, а древесная пыль в смеси с воздухом иногда даже взрывается. Таким образом, скорость этих реакций зависит
1) от температуры;
2) от концентрации реагентов в том, или ином растворе;
3) от давления (если в реакции участвуют газы) и
4) от площади поверхности соприкосновения реагентов.

2.В реакции А + Б = 2В + Г, протекающей в газовой фазе, за 5 секунд концентрация вещества В увеличилась с 10 до 15 моль/л. Определите среднюю скорость этой реакции за данный промежуток времени. Почему в условии задачи речь идет о средней скорости, а не просто о скорости реакции?
3.При синтезе аммиака из азота и водорода в определенных условиях скорость реакции оказалась равной 15 моль/(л . с). За сколько секунд концентрация водорода в реакторе уменьшится вдвое при начальной его концентрации, равной 10 моль/л?
4.Если в воду бросить кусочек натрия, то реакция будет протекать очень быстро. Предложите способы а) ускорить эту реакцию, б) замедлить ее.
Многие, даже очень быстрые реакции, при простом соприкосновении реагентов не идут. Например, смесь водорода с кислородом может очень долго находиться при комнатной температуре, не изменяясь. Но стоит только поднести к ней горящую спичку, как реакция начинает протекать очень быстро, часто со взрывом (поэтому смесь водорода с кислородом в объемном отношении 2:1 даже называют » гремучим газом» ). В чем же причина?
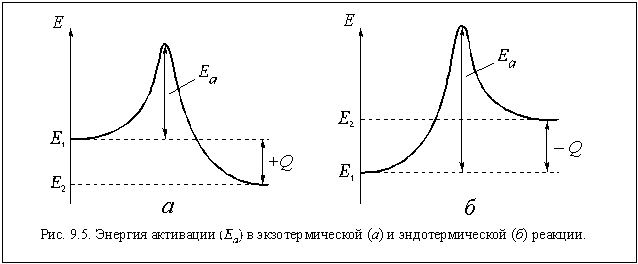
Мы уже говорили, что не любые соударения молекул или других химических частиц приводят к их взаимодействию, а только эффективные, то есть те соударения частиц, суммарная энергия которых больше какого-то определенного значения. Эта » пороговая» энергия называется энергией активации данной реакции.
Физический смысл энергии активации становится понятным, если рассмотреть графики изменения энергии частиц в ходе реакции, показанные на рис. 9.5.
Левый график соответствует экзотермической реакции, а правый — эндотермической. На этих графиках Е1 — средняя энергия молекул исходных веществ, Е2 — средняя энергия молекул продуктов реакции, Еа — энергия активации, а ± Q — тепловой эффект реакции.
Если энергия активации невелика, то в исходных веществах всегда найдутся молекулы, которые смогут преодолеть » энергетический барьер» и превратиться в молекулы продуктов реакции. Если же энергия активации велика, то таких молекул в реакторе может и не оказаться. Таким образом, скорость реакции при прочих равных условиях тем больше, чем меньше ее энергия активации.
На практике часто встречаются случаи, когда необходимо осуществить реакцию, энергия активации которой очень велика. Скорость такой реакции, естественно, очень мала или практически равна нулю. Если при этом сильно нагреть реакционную смесь нельзя (например, исходное вещество при таком нагревании разлагается, или равновесие смещается в сторону исходного вещества), то для получения нужного вещества приходится идти » обходным путем» .
Пусть нам необходимо получить вещество АБ по обратимой реакции
А +Б 
энергия активации которой очень велика. Можно, конечно, очень сильно повысить температуру, но тогда равновесие сдвинется влево, и выход продукта АБ будет небольшим. В подобных случаях дополнительно подбирают другое вещество (обозначим его К), такое, чтобы протекали реакции А + К 

| Катализатор — вещество, ускоряющее протекание химического процесса за счет взаимодействия с реагентами сложной реакции и выделяющееся на последней стадии в химически неизменном виде. |
Катализаторы используются не только для ускорения химических процессов. Если между реагентами возможно несколько реакций, то, используя катализатор, можно провести практически только ту, которая требуется.
Снижая энергию активации, катализатор ускоряет как прямую, так и обратную реакцию, и поэтому он не может быть использован для смещения равновесия.

2.Изменится ль скорость реакции йода с водородом, если в реакционную смесь ввести аргон? Ответ поясните.
3.Как изменится скорость реакции А + В = С, протекающей в газовой фазе в одну стадию, если а) концентрацию вещества А увеличить в 2 раза; б) концентрацию вещества В уменьшить в 2 раза; в) концентрации каждого из этих веществ увеличить в 2 раза; г) концентрацию вещества А уменьшить в 2 раза, а концентрацию вещества В увеличить в 2 раза; д) увеличить в 2 раза давление в реакторе?
4.В смеси водорода с кислородом при комнатной температуре объемные доли газов не меняются неопределенно долго. Можно ли считать, что в этой смеси установилось химическое равновесие?
5.В интервале температур от 30 до 80 °С скорость некоторой реакции увеличивалась в 2 раза при нагревании на каждые 10 °С. Определите, во сколько раз увеличится скорость этой реакции при увеличении температуры от 35 до 55 °С.
6.Как вы думаете, почему скоропортящиеся продукты хранят в холодильнике?
Изучая предыдущие параграфы этой главы, вы познакомились с закономерностями протекания тех реакций, которые протекают самопроизвольно («сами по себе» , без постоянного дополнительного воздействия извне). Все эти реакции стремятся к состоянию равновесия, определяемому сочетанием энергетического и энтропийного факторов. Однако в некоторых случаях можно провести реакции, самопроизвольное протекание которых невозможно. Примером таких реакций являются реакции электролиза.
Если к противоположным граням кристалла хлорида натрия приложить металлические пластины, подключить их через амперметр к источнику электрического напряжения и замкнуть цепь, то электрического тока в цепи не будет — кристаллический хлорид натрия диэлектрик, то есть вещество, которое электрический ток не проводит. Катионы и анионы в ионном кристалле прочно связаны между собой ионной связью (электростатическими силами) и не могут свободно перемещаться.
Если те же пластины погрузить в расплав хлорида натрия (tпл 800°) и включить источник электрического напряжения, то амперметр покажет, что в цепи протекает электрический ток. Что же происходит?
В расплаве соли ионы Na и Cl
, оставаясь связанными ионной связью, хаотически движутся. Одна из погруженных в раствор пластин заряжена отрицательно (в данном случае она называется катодом), а другая — положительно (в данном случае она называется анодом). В соответствии с основным свойством заряженных частиц катионы Na
начинают притягиваться к отрицательно заряженному катоду, а анионы Cl
— к положительно заряженному аноду. Возникает направленное движение заряженных частиц — электрический ток. Если к расплаву приложено достаточное напряжение, то электроны с катода переходят к притянувшимся ионам Na
(» разряжаются» ), при этом образуются атомы натрия:
K: Na + e — = Na.
Притянувшиеся к аноду ионы Cl, отдают свои » избыточные» электроны аноду (тоже » разряжаются» ), а образующиеся атомы хлора соединяются в молекулы:
A: 2Cl — 2e — = Cl2.
В результате на катоде образуется натрий, а на аноде выделяется газообразный хлор.
Несмотря на то, что процессы образования продуктов реакции разделены в пространстве, можно записать уравнение этой реакции (так, как мы это делали для обычных ОВР):
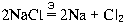
Буква » Э» над знаком равенства означает, что реакция протекает при электролизе.
| Электролитическая реакция (электролиз) — окислительно-восстановительная реакция, протекающая под действием электрического напряжения. |
Само слово » электролиз» может быть переведено как » разложение электричеством» .
Электролизу могут быть подвергнуты все ионные соединения (оксиды, гидроксиды, соли), если они плавятся без разложения.
Ионные соединения, содержащие сложные ионы, также подвергаются электролизу, но при этом протекают значительно более сложные процессы.
Подвижные ионы присутствуют не только в расплавах ионных соединений, но и в их растворах (см. главу XI), и даже в некоторых твердых веществах. В этих химических системах тоже возможны электролитические реакции.

Укажите причины, по которым остальные вещества ему не подвергаются.
2.Составьте электронные уравнения полуреакций и химические уравнения электролиза выбранных вами веществ. 
2. Окислительно-восстановительные реакции.


Сервер создается при поддержке Российского фонда фундаментальных исследований
Не разрешается копирование материалов и размещение на других Web-сайтах
Вебдизайн: Copyright (C) И. Миняйлова и В. Миняйлов
Copyright (C) Химический факультет МГУ
Написать письмо редактору
Химические свойства йода
Нитрат йода (III) разлагается уже при температуре ниже 0 °C.
Известны несколько более стойких аналогичных соединений йода I2(SO4)3, I(CH3COO)3, I(ClO4)3, IPO4, которые можно считать солями I +3 . При электролизе растворов солей этого катиона в неводных средах йод выделяется на катоде. Получен также ряд солей иодила, содержащих ионы (IO)n n+ .
Химическая активность йода – наименьшая в ряду галогенов. Со многими элементами йод непосредственно не взаимодействует, а с некоторыми реагирует только при повышенных температурах (водород, кремний, многие металлы).
Эта реакция обратима, т.к. образование йодоводорода происходит при такой температуре, что значительная его часть термически разлагается.
Цинк, железо и алюминий в смеси с порошком йода горят при добавлении катализатора (капля воды).
Благодаря низкой плотности перекрывания электронных облаков галоген-элемент в связи с увеличением размеров атомов галогенов при движении вниз по группе галогенов наблюдается и снижение прочности химической связи. По этой причине для ряда элементов (например, железо, фосфор, сурьма) в высших степенях окисления соединения с йодом неустойчивы. Более того, в водных растворах иодиды уже показывают свойства восстановителей, хотя и не очень сильных. Выделение йода из растворов иодидов, легко обнаруживаемое по изменению окраски крахмала (он становится синим), является удобным тестом на присутствие окислителей, например, хлора, озона, перекиси водорода и др. Для этого обычно используется т.н. “йодокрахмальная бумажка” – полоска фильтровальной бумаги, пропитанная смесью растворов иодида калия и крахмала. Предвнешние 4d-электроны атома йода не относятся к кайносимметричным и не удивительно, что соединения йода со степенью окисления +7 стабильны и давно известны. Соединения йода, в которых он находится в положительных степенях окисления, – оксиды, оксокислоты и их соли, пожалуй, столь же характерны для него, как и иодиды. Поэтому йод способен окисляться достаточно сильными окислителями, например:
Йод также как и бром, непосредственно не взаимодействует с кислородом, т.к. образует неустойчивые оксиды.
В водном растворе йод также как хлор и бром диспропорционирует:
Для получения IO4 – нужны чрезвычайно сильные окислители.
Скорость диспропорционирования IO – велика при любой температуре, поэтому соли этого иона не удается получить ни в растворе, ни в кристаллическом состоянии (хотя Я. А. Угай указывает на существование солей этого аниона, которые довольно устойчивы в отсутствие влаги).
NaOH + I2 ↔ NaI + NaIO + H2O, Kp = 30
2Na2S2O3 + I2 = 2NaI + Na2S4O6 – эту реакцию используют в аналитической химии для количественного определения йода (иодометрия).
Химические свойства астата
Если какое-то количество атомов астата добавить к йоду, то в дальнейших химических реакциях астат будет сопровождать йод. Это подобие свойств используется в медицине. Астат является очень удобным α-излучателем для радиотерапии раковых опухолей. Химики синтезировали препараты йода, избирательно концентрирующиеся в различных органах, а поскольку астат сопровождает йод, то это его свойство позволяет вместе с препаратами йода вводить радиоактивный астат.
http://www.chem.msu.su/rus/school/zhukov1/09a.html
http://himgdz.ru/galogeni/himicheskie-svojstva-ioda/