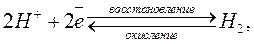Назначение и устройство водородного электрода
Стандартный водородный электрод – это элемент сравнения, применяющийся для определения потенциалов в гальванических элементах и при различных электрохимических реакциях.
Так как измерить потенциал отдельного электрода невозможно, используется сравнительный элемент, в частности в составе электролитических ячеек.
Стандартный водородный электрод: что это?
Электроды сравнения – электрохимические системы, использующиеся для измерения электродных потенциалов.
Любой электрод, находящийся в состоянии термодинамического равновесия, способный обеспечить постоянство во времени и воспроизводимость всех характеристик, может служить элементом сравнения.

Наиболее распространенными являются водородный, каломельный, галогеносеребряный и оксидно-ртутный вариант устройства.
Стандартный элемент сравнения представляет собой проволоку или пластинку, выполненную из металла, который хорошо адсорбирует гидроген.
Обычно используются такие металлы, как платина или палладий, на которые электролитическим методом нанесена платина в тонкодисперсном состоянии. Это увеличивает активную площадь поверхности для взаимодействия с гидрогеном.
Пластина погружается в водный раствор, насыщенный ионами гидрогена. Через раствор, под атмосферным давлением, пропускается химически чистый водород.
В результате поверхность платиновой пластины гидрогенизируется и на границе поверхности платиновой пластины с раствором устанавливается равновесие между переходом гидрогена из молекулярного состояния в атомарное и наоборот.
Как он работает?
Принцип работы устройства основан на растворимости металлов в электролите. Даже при погружении металла в воду он начинает подвергаться действию ее молекул.
С поверхности пластины начинают отрываться ионы, и они попадают в слой воды, контактирующий с металлом. В результате нейтральный атом превращается в ион.
Это приводит к высвобождению отрицательно заряженных частиц – электронов. Между положительными атомами и электронами появляется потенциал. Его действие обуславливает концентрацию ионов у поверхности металла, образуя адсорбционный слой.
Такая структура носит название – двойной электрический слой.

В электрохимии потенциалы металлов измеряются в вольтах, по отношению к некоторому стандартному элементу. Согласно международной договоренности, в качестве такого элемента принято считать стандартный ВЭ.
При давлении газообразного водорода на границе с раствором в 1 атмосферу, концентрации положительных ионов водорода 1 моль/л и температуре 298 К, потенциал принимается равным 0 и его называют нормальным водородным электродом.
В настоящее время не существует методики, позволяющей независимо определить потенциал отдельно взятого электрода. Для этих целей применяется данное устройство.
В частности, собирается гальваническая цепь, состоящая из измеряемого и ВЭ. Так как потенциал второго принят за 0, то относительный потенциал второго будет равен электродвижущей силе гальванического элемента.
При работе данного устройства важно использовать гидроген, хорошо очищенный от примесей серы и мышьяка. Также нежелательной примесью является кислород, который может реагировать с гидрогеном на поверхности платиновой пластины с образованием воды, что приведет к нестабильной работе.
Схема стандартного водородного электрода
Данное устройство используют для измерения потенциалов электрохимических реакций.

Схема водородного электрода представляет собой:
- пластину, изготовленную из палладия или платины;
- подвод газообразного водорода;
- водный раствор, как правило, соляной или серной кислоты с концентрацией водорода 1 моль/л;
- водяной затвор;
- электролитический мост для соединения со второй половиной гальванической цепи.
Устройство элемента сравнения очень простое. Кроме того, его можно применять в широком интервале температур и давлений, а также в не водных и частично водных растворах.
Эксплуатация устройства сопряжена с определенными трудностями, например, с необходимостью постоянной подачи химически чистого водорода. Несмотря на это, стандартные элементы сравнения широко использовались в работах многих известных ученых.
Так, С.П.Л. Серенсен, с использованием данного устройства, разработал современную теорию pH-метрии, а Макклендон впервые использовал электрод сравнения для внутрижелудочной pH-метрии.
Стандартный сравнительный элемент широко используется для определения потенциалов электродов. Для этого собирается гальванический элемент, состоящий из измеряемого и стандартного водородного электрода.
Также его применяют для определения растворимости, pH-метрии, скорости протекания электрохимических реакций и для измерения концентрации ионов водорода. Простота схемы ВЭ делает его наиболее удобным для использования.
Водородный электрод электрохимическая схема уравнение электродной полуреакции
7 ОСНОВЫ ЭЛЕКТРОХИМИИ
7.1 ГАЛЬВАНИЧЕСКИЕ ЭЛЕМЕНТЫ. НАПРАВЛЕНИЕ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ РЕАКЦИЙ
Сущность этой реакции вытеснения сводится к восстановлению одним металлом иона второго. Например, в ряду металлов Zn , Fe , Cu , Ag каждый предыдущий вытесняет последующий из его солей, тогда как обратное вытеснение не наблюдается.
Процесс взаимодействия цинка с ионом меди по приведенной выше схеме можно разбить на две полуреакции :
Очевидно, что если бы удалось осуществить передачу электронов не непосредственно, а через металлический проводник, то по нему потек бы от цинка к меди поток электронов, т.е. электрический ток. На рисунке 6.1 показана схема гальванического элемента, т.е. установки, делающей возможной такую передачу электронов по проводу. В гальваническом элементе происходит непосредственное преобразование энергии химической реакции в электрическую энергию.
Рисунок 6.1 – Конструкция медно-цинкового гальванического элемента (элемент Даниэля-Якоби)
Сосуд А и соединяющая оба сосуда трубка В заполнены раствором ZnSO4, сосуд Б – раствором CuSO4. В первый из них опущена цинковая пластинка, во второй – медная. Если соединить обе пластинки проводом, то по нему в указанном стрелкой направлении начнут перемещаться электроны (потечет электрический ток). Трубка В обеспечивает замкнутость цепи, по ней перемещаются ионы SO4 2– . Электрод, на котором происходит процесс восстановления (на рисунке 6.1 – медный) называется катодом, а электрод, на котором осуществляется окисление (в рассмотренном примере – цинковый) – анодом В электротехнике принята противоположная система обозначений электродов: катодом называют отрицательный полюс источника тока, т.е. электрод, передающий электроны во внешнюю цепь (в данном случае цинковый). В учебном пособии электроды названы так, как это принято в электрохимии. .
В данном случае электродные процессы являются гетерогенными, т.к. окисленная и восстановленная формы находятся в разных фазах *. В более общем виде гетерогенный электродный процесс можно записать в виде:
Me (ВФ, тв . фаза) – ne – 
На границе раздела фаз возникает двойной электрический слой, состоящий из катионов Me n + (в растворе) и электронов (в металле), что приводит к появлению потенциала E( Me n + / Me ). Его абсолютная величина определению не поддается, однако легко измеряется разность потенциалов катода и анода, которая называется электродвижущей силой (ЭДС) гальванического элемента Δ E = E к – Eа . Если в таких устройствах условно считать потенциал какого-то электрода равным нулю, то измерением ЭДС можно получить относительные значения других электродных потенциалов, что важно для сравнительной количественной характеристики электродов.
Условно за нуль принят потенциал стандартного водородного электрода, который состоит из платиновой пластинки, покрытой платиновой чернью и частично погруженной в раствор кислоты с активной концентрацией ионов водорода, равной 1 моль/л. Электрод омывается газообразным водородом под давлением 1,013 · 10 5 Па (1 атмосфера), что приводит к образованию системы:
2 H + + 2e
Для измерения электродных потенциалов металлов, например меди, составляют гальванический элемент, в котором вторым электродом служит стандартный водородный электрод. В основе работы составленного гальванического элемента лежит реакция
Cu 2+ + H2 → 2H + + Cu
На схеме гальванического элемента границы раздела фаз показывают одной вертикальной чертой, а электроды отделяют друг от друга двумя вертикальными чертами. Анод на схеме указывают слева, а катод – справа:
А (–) Pt (H2) | 2H + | | Cu 2+ | Cu (+) К
Катодом в этом случае является медный электрод. ЭДС гальванического элемента, измеренная при концентрации (активности) ионов меди 1 моль/л, равна 0,34 В и может быть выражена как Δ E = E(Cu 2+ / Cu )– E(2H + /H2). Так как E(2H + /H2) принят за нуль, то E(Cu 2+ / Cu )= Δ E =0,34 В при стандартных условиях. Если медь заменить цинком, то катодом будет водородный электрод. Тогда E(Zn 2+ / Zn )= – Δ E = –0,76В.
Электродные потенциалы металлов, измеренные по отношению к водородному электроду при стандартных условиях, т.е. активной концентрации ионов металла в растворе, равной 1 моль/л, и температуре 25 ° С (298 К), называют стандартными и обозначают Е ° . Так, Е ° (Cu 2+ / Cu )=0,34В, Е ° (Zn 2+ / Zn )= –0,76В. Ряд металлов, расположенных в порядке возрастания их стандартных электродных потенциалов, называется рядом напряжений. В основных чертах он имеет следующий вид:
K, Ca , Na , Mg , Al , Zn , Fe , Ni , Sn , Pb , H, Cu , Hg , Ag , Pt , Au
Ниже приведены основные следствия из ряда напряжений:
а) Каждый металл вытесняет из солей все другие, расположенные в ряду напряжений правее него.
б) Все металлы, расположенные левее водорода, вытесняют его из кислот, расположенные правее – не вытесняют.
в) Чем дальше друг от друга стоят два металла, тем большую ЭДС имеет построенный из них гальванический элемент.
Величина электродного потенциала зависит от концентрации В данном случае имеется в виду молярная концентрация (моль/л). ионов металла в растворе его соли [ Me n + ], их заряда ( n ) и температуры ( Т), что выражается уравнением Нернста:

здесь F – число Фарадея ( F=96485 
При Т=298 К можно применять упрощенную форму уравнения Нернста:
Величина ЭДС и изменение энергии Гиббса * для химического процесса, лежащего в основе работы гальванического элемента, связаны соотношением Δ G = – nF Δ E , где n – количество электронов, передаваемых от восстановителя к окислителю. Необходимо иметь в виду, что реакцию необязательно проводить в гальваническом элементе. Она может быть проведена, например, в пробирке. Единственным отличием будет то, что полуреакции окисления и восстановления не разделены по электродам, а происходят в одной области пространства. Следовательно, Δ G может вычисляться точно так же, т.е. через ЭДС гипотетического гальванического элемента, найденную из электродных потенциалов полуреакций. В качестве примера рассмотрим реакцию:
2 Fe 2+ + Cl2 → 2 Fe 3+ + 2 Cl –
Здесь n=2, т.к. молекула хлора принимает два электрона (по одному от каждого иона Fe 2+ ). Соотношение Δ G = – nF Δ E находит применение для определения Δ G окислительно-восстановительных реакций * в растворах по измеренной величине ЭДС гальванических элементов, в которых они могут протекать, а также для выяснения возможности работы гальванического элемента на той или иной химической реакции, если для нее изменение энергии Гиббса Δ G известно.
Вопрос29. Водородный электрод. Устройство и электродные процессы. Стандартный водородный электрод. Зависимость величины потенциала водородного электрода от рН среды
Измеряют относительную величину электродного потенциала, сравнивая его с потенциалом электрода, выбранного в качестве эталона.
В качестве такого электрода, называемого электродом сравнения, часто используют стандартный водородный электрод.
Водородный электрод состоит из платиновой пластинки, покрытой платиновой чернью (электролитически осажденной платиной), которая абсорбирует продуваемый через электрод газообразный водород. Пластина погружена в раствор кислоты.
На электроде устанавливается равновесие:
Водородный электрод, находящийся при стандартных условиях ([Н + ] = 1 моль/л, Р 0 = 101,3 кПа), называют стандартным водородным электродом, а потенциал такого электрода условно принят за ноль при любой температуре. Условная запись водородного электрода:
рН влияет на величину равновесного потенциала.
Это означает, что при изменении рН на единицу потенциал водородного электрода уменьшается на 59 мВ.
Чем кислее раствор, тем большую величину имеет потенциал водородного электрода.
Вопрос30. Гальванические элементы. Как можно практически определить электродный потенциал металла? От каких факторов зависит величина электродных потенциалов? Уравнение Нернста. Уравнение Нернста для металлических электродов при стандартных условиях.
Устройства, в которых энергия химической окислительно-восстановительной реакции превращается в электрическую энергию, называются источниками электрической энергии, или гальваническими элементами. Всякий гальван. элемент сост. из двух электродов – металлов, погруженных в растворы электролитов; последние сообщаются друг с другом – обычно через пористую перегородку. Переход Ме из кристалла в раствор электролита в виде гидратированных ионов с оставлением эквивалентного количества е в кристалле, называется анодным процессом — процесс окисления. Обратным анодному является катодный процесс – объединение каких-либо частиц среды с электронами металла, с восстановлением частиц на поверхности металла. Электродвижущая сила Е(э.д.с.)-максимальное напряжение гальванического элемента, отвечающего обратимому протеканию происходящей в нем реакции. В результате изучения потенциалов различных электродных процессов установлено, что их величины зависят от следующих факторов: 1) от природы веществ –участников электродного процесса. 2) от соотношения м/у концентрациями этих веществ 3) от температуры системы. Эта зависимость выражается уравнением Нернста (В. Нернст, 1889г.): E=E 0 +RT*ln(aокисл формы/aвосстан формы)/n*F, где E 0 – стандартный электродный потенциал, n – число е, принимающих участие в о.-в. реакциях , F – число фарадея (96500), а – активность (эффективная или условная концентрация, в соответствии с которой ион действует при хим активности) а=f*C(Для разбавленных растворов a=C, f->1).Формула Нернста для Ме электрода при T=298K: EМе=E0+0.059*lnaМе+n/n
Вопрос31. Типы гальванических элементов. Химические, концентрационные и термогальванические элементы. Э.Д.С. гальванических элементов. Приведите примеры. Укажите процессы, протекающие на электродах, и рассчитайте ЭДС какого-либо химического гальванического элемента.
Устройства, в которых энергия химической окислительно-восстановительной реакции превращается в электрическую энергию, называются источниками электрической энергии, или гальваническими элементами. Всякий гальван. элемент сост. из двух электродов – металлов, погруженных в растворы электролитов; последние сообщаются друг с другом – обычно через пористую перегородку. Переход Ме из кристалла в раствор электролита в виде гидратированных ионов с оставлением эквивалентного количества е в кристалле, называется анодным процессом — процесс окисления. Обратным анодному является катодный процесс – объединение каких-либо частиц среды с электронами металла, с восстановлением частиц на поверхности металла. Типы гальванических элементов: Химические – состоят из разных электродов, концентрационные – составлены из одинаковых электродов с разными концентр электролитов, термогальванические – одинаковые электроды, но при разных температурах. Медноцинковый элемент –Zn\ZnSO4\\CuSO4\Cu. ЭДС – Eк – Eа=1,1В. Процессы на аноде – окисление (Zn 0 – 2е = Zn +2 ), на катоде – восстановление (Cu +2 + 2е = Сu 0 ).
http://www.chem-astu.ru/chair/study/genchem/r7_1.htm
http://lektsii.org/7-61047.html