Эффект Хараша: реакции, идущие против правила Марковникова
Возьмем самый простой несимметричный и ненасыщенный углеводород и самый простой симметричный и ненасыщенный. Ими окажутся соответственно пропен и бутен-2. Это алкены, и они любят вступать в реакции присоединения. Пусть, например, это будет присоединение бромоводорода. В случае с бутеном-2 возможен только один продукт — 2-бромбутан, к какому из атомов углерода бром ни присоединился бы — они все равноценны. А в случае с пропеном возможно два варианта: 1-бромпропан и 2-бромпропан. Однако экспериментально было доказано, что в продуктах реакции гидрогалогенирования 2-бромпропан заметно преобладает. То же самое верно для реакции гидратации: пропанол-2 будет основным продуктом.
Чтобы объяснить эту закономерность, Марковников сформулировал правило, которое и называется его именем.
Правило Марковникова
Распространяется на несимметричные алкены и алкины. При присоединении воды или галогеноводородов к таким молекулам их водород отправляется к наиболее гидрогенизированному атому углерода в двойной связи (то есть к такому, который содержит больше всего атомов углерода при себе). Это работает на последнем примере с пропеном: центральный атом углерода имеет при себе лишь один водород, а тот, что с краю, — целых два, поэтому бромоводород водородом цепляется за крайний атом углерода, а бромом — за центральный, и получается 2-бромпропан.
Конечно, правило соткано не из воздуха, и ему имеется нормальное объяснение. Однако для этого придется подробнее изучить механизм реакции.
Механизм реакции присоединения
Реакция проходит в несколько стадий. Начинается с того, что органическую молекулу атакует катион водорода (протон, в общем); атакует он один из атомов углерода при двойной связи, потому что электронная плотность там повышена. Положительно заряженный протон всегда ищет области с повышенной электронной плотностью, поэтому его (и другие частицы, ведущие себя так же) называют электрофилом, а механизм реакции, соответственно, — электрофильным присоединением.
Протон атакует молекулу, проникает в нее, и образуется положительно заряженный карбониевый ион. И тут как раз таки находится объяснение правилу Марковникова: карбкатион образуется самый устойчивый из всех возможных, а вторичный катион устойчивее первичного, третичный устойчивее вторичного и так далее (есть еще много способов стабилизировать карбкатион). А потом все легко — отрицательно заряженный галоген, или OH-группа присоединяются к положительному заряду, и образуется конечный продукт.
Если сначала вдруг образовался какой-то неудобный карбкатион, он может перегруппироваться так, чтобы было удобно и устойчиво (с этим связан такой интересный эффект, что иногда в ходе таких реакций присоединяемый галоген или гидроксильная группа оказываются вообще у другого атома углерода, не имевшего отношения к двойной связи, просто потому что положительный заряд в карбкатионе сместился в наиболее устойчивое положение).
Что может повлиять на правило?
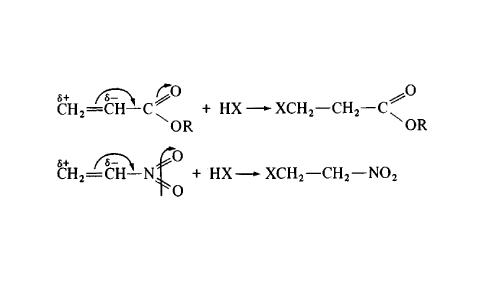
Поскольку оно основано на распределении электронной плотности в карбкатионе, влиять могут разного рода заместители, находящиеся в органической молекуле. Например, карбоксильная группа: в ней есть кислород, зацепившийся с углеродом через двойную связь, и он оттягивает электронную плотность из двойной связи на себя. Поэтому в акриловой кислоте устойчивый карбкатион — на конце цепочки (подальше от карбоксильной группы), то есть такой, что в нормальных условиях был бы менее выгоден. Это один из примеров, когда реакция идет против правила Марковникова, однако общий механизм электрофильного присоединения сохраняется.
Перекисный эффект Хараша
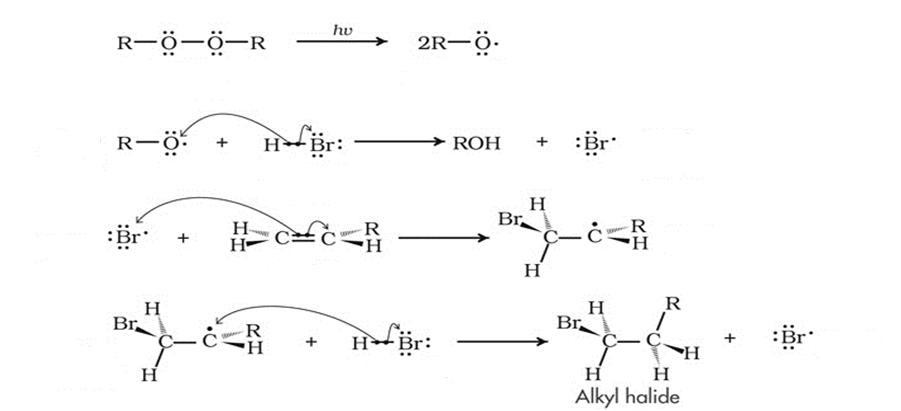
В 1933 году Моррис Хараш проводил ту же реакцию гидробромирования несимметричных алкенов, однако в присутствии перекиси. И опять продукты реакции противоречили правилу Марковникова! Эффект Хараша, как его потом назвали, заключался в том, что в присутствии перекиси меняется весь механизм реакции. Теперь он не ионный, как раньше, а радикальный. Это обусловлено тем, что перекись сама сначала разваливается на радикалы, которые дают начало цепной реакции. Потом образуется радикал брома, потом — органической молекулы с бромом. Но радикал, как и карбкатион, более устойчивый — вторичный, поэтому сам бром оказывается на конце цепи.
Вот примерное описание эффекта Хараша в химических реакциях.
Избирательность
Стоит упомянуть, что данный эффект работает только при присоединении бромоводорода. С хлороводородом и йодоводородом ничего подобного не наблюдается. Для каждого из этих соединений на то свои причины.
В хлороводороде связь между водородом и хлором достаточно сильна. И если в радикальных реакциях, инициируемых температурой и светом, энергии достаточно, чтобы ее порвать, радикалы, образующиеся при распаде перекиси, на это практически неспособны, и реакция с хлороводородом по перекисному эффекту идет очень медленно.
В йодоводороде связь рвется гораздо легче. Однако сам радикал йода оказывается с крайне низкой реакционной способностью, и эффект Хараша опять совсем почти не работает.
Вопреки правилу марковникова протекает реакция уравнение которой
Например, в реакции 3,3,3-трихлорпропена При нумерации углеродной цепи в непредельных галогеноуглеводородах предпочтение отдаётся кратной связи. Сl 3 CCH=CH 2 с HХ водород присоединяется к менее гидрогенизированному атому углерода, а Х – к более гидрогенизированному. Это обусловлено тем, что группа СCl 3 проявляет отрицательный индуктивный эффект и π-электронная плотность связи С=С смещена к менее гидрогенизированному атому углерода.
Кроме того, если реакция присоединения идет не по электрофильному, а по радикальному механизму, то правило Марковникова также не соблюдается. Так, реакция HBr с пропиленом в присутствии пероксидов (H 2 O 2 или R 2 O 2 ), образующих свободно-радикальные частицы (НО• или RО•), происходит по радикальному механизму и идет против правила Марковникова.
Механизмы реакций в органической химии
Ионный (правило В.В. Марковникова) и радикальный механизмы реакций в органической химии.
Механизмы разрыва химических связей в органических реакциях
| Гомолитический разрыв связи – это такой разрыв химической связи, когда каждый атом получает при разрыве связи по одному электрону из общей электронной пары. |
Образующиеся при этом частицы — это свободные радикалы.
| Свободные радикалы – это частицы, каждая из которых содержит один неспаренный электрон. A:B → A∙ + ∙B Гомолитический разрыв связи характерен для слабо полярных или неполярных связей. Условия протекания радикальных реакций:
Например , взаимодействие метана с хлором протекает по цепному радикальному механизму. То есть реакция протекает как цепь последовательных превращений с участием свободных радикалов. Свободные радикалы R∙ – это атомы или группы связанных между собой атомов, которые содержат один или несколько неспаренных электронов. Свободные радикалы – очень активные частицы, которые стремятся образовать связь с каким-либо другим атомом. Этапы радикально-цепного процесса: Стадия 1. Инициирование цепи. Под действием кванта света или при нагревании молекула галогена распадается на радикалы: Cl:Cl → Cl⋅ + ⋅Cl Стадия 2. Развитие цепи. Радикалы взаимодействуют с молекулами с образованием новых молекул и радикалов. Радикал галогена взаимодействует с молекулой алкана и отрывает от него водород. При этом образуется промежуточная частица – алкильный радикал, который в свою очередь взаимодействует с молекулой хлора: CH4 + ⋅Cl → CH3⋅ + HCl Стадия 3. Обрыв цепи. При протекании цепного процесса рано или поздно радикалы сталкиваются с радикалами. При этом образуются молекулы, т.е. радикальный процесс обрывается. Могут столкнуться разные радикалы, в том числе два метильных радикала:
При гетеролитическом разрыве связи образуются ионы – положительно заряженный катион и отрицательно заряженный анион. A:B → A: – + B +
Гетеролитический (ионный) механизм характерен для полярных и легко поляризуемых связей. Условия протекания ионных реакций:
Присоединение галогеноводородов (гидрогалогенирование). Например, этилен взаимодействует с бромоводородом: Реакция протекают по механизму электрофильного присоединения в несколько стадий. I стадия. Электрофилом является протон Н + в составе бромоводорода. Катион водорода присоединяется к атому углерода при двойной связи и образуется карбокатион . На втором атоме углерода, который потерял электроны π-связи, образуется положительный заряд: II стадия. Карбокатион взаимодействует с анионом Br – : При присоединении галогеноводородов и других полярных молекул к симметричным алкенам образуется одно вещество. Например , при присоединении бромоводорода к этилену образуется только бромэтан. При присоединении полярных молекул к несимметричным алкенам образуется смесь изомеров. При этом выполняется правило Марковникова.
Например , при взаимодействии хлороводорода HCl с пропиленом атом водорода присоединяется преимущественно к атому углерода группы СН2=, поэтому преимущественно образуется 2-хлорпропан. При этом 1-хлорпропан образуется в незначительном количестве: В некоторых случаях присоединение к двойным связям происходит против правила Марковникова. Исключения из правила Марковникова: 1) Если в молекуле присутствует заместитель, который оттягивает на себя электронную плотность двойной связи. Например , при взаимодействии 3-хлорпропена с хлороводородом HCl преимущественно образуется 1,3-дихлорпропан. Атом хлора смещает к себе электронную плотность, поэтому π-электронная плотность двойной связи смещена к менее гидрогенизированному атому углерода: 2) Если в реакционной системе присутствуют свободные радикалы или источники свободных радикалов, то реакция присоединения полярных молекул вида НХ к двойной связи протекает по радикальному механизму против правила Марковникова. Например , при присоединении бромоводорода к пропилену в присутствии пероксидов (H2O2 или R2O2) преимущественно образуется 1-бромпропан: источники: http://orgchem.ru/chem2/u4413_2.htm http://chemege.ru/mexanizm-org-ximiya/ |