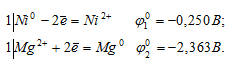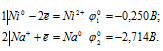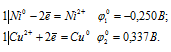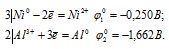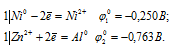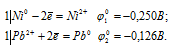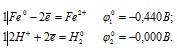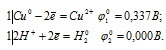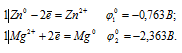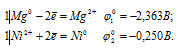Вычислите значение э.д.с. гальванического элемента: (-) Mg / MgSO4 // CuSO4 / Cu (+) Напишите процессы на аноде
Ваш ответ
решение вопроса
Похожие вопросы
- Все категории
- экономические 43,292
- гуманитарные 33,622
- юридические 17,900
- школьный раздел 607,160
- разное 16,830
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Please wait.
We are checking your browser. gomolog.ru
Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6de5bd18fabf7a49 • Your IP : 85.95.188.35 • Performance & security by Cloudflare
Восстановите пропуски в уравнениях реакций cuso4 mgso4
Задача 678.
Никелевые пластинки опущены в водные растворы перечисленных ниже солей. С какими солями никель будет реагировать: а) MgSO4; б) NaCl; в) CuSO4; г) AlCl3; д) ZnCl2; е) Pb(NO3)2?
Решение:
а) MgSO4 + Ni →
Запишем стандартные электродные потенциалы электрохимических систем участвующих в реакции:
Поскольку 

б) NaCl + Ni →
Запишем стандартные электродные потенциалы электрохимических систем участвующих в реакции:
Поскольку 

в) CuSO4 + Ni → NiSO4 +Cu
Запишем стандартные электродные потенциалы электрохимических систем участвующих в реакции:
Поскольку 
г) AlCl3 + Ni →
Запишем стандартные электродные потенциалы электрохимических систем участвующих в реакции:
Поскольку 
д) ZnCl2 + Ni →
Запишем стандартные электродные потенциалы электрохимических систем участвующих в реакции:
Поскольку 

Запишем стандартные электродные потенциалы электрохимических систем участвующих в реакции:
Поскольку 
Ответ: в); е).
Задача 679.
Между какими из перечисленных ниже взятых попарно (металл + водный раствор электролита) будет протекать реакция замещения: а) Ее + НСI; б) Ag + Cu(NO3)2; в) Cu + НСI; г) Zn + MgSO4; д) Мg + NiCl2?
Решение:
а) Ее + НСI → FeCl2 +H2
Запишем стандартные электродные потенциалы электрохимических систем участвующих в реакции:
Поскольку 
Запишем стандартные электродные потенциалы электрохимических систем участвующих в реакции:
Поскольку 

в) Cu + НСI →
Запишем стандартные электродные потенциалы электрохимических систем участвующих в реакции:
Поскольку 

г) Zn + MgSO4 →
Запишем стандартные электродные потенциалы электрохимических систем участвующих в реакции:
Поскольку 

д) Мg + NiCl2 → MgCl2 + Ni
Запишем стандартные электродные потенциалы электрохимических систем участвующих в реакции:
Поскольку 
http://gomolog.ru/reshebniki/8-klass/zadachnik-kuznecova-2020/2-11.html
http://buzani.ru/zadachi/khimiya-glinka/1233-reaktsii-metallov-s-solyami-drugikh-mettallov-zadachi-678-679