Расчет термодинамических величин (энтальпии, энтропии, энергии Гиббса) реакций восстановления оксидов железа
Реакция восстановления железа оксида железа (3) водородом
Задача 14.
Вычислите ∆Hº, ∆Sº и ∆Gтº реакции, протекающей по уравнению:
Fe2O3(к) + 3Н2(г) = 2Fe(к) + 3Н2О (г)
Возможна ли реакция восстановления Fe2O3(к) водородом при 500 и 1000 К?
Решение:
1. Расчет энтальпии реакции
В химической реакции, протекающей по уравнению:
Тепловой эффект реакции (∆Нх.р.), исходя из следствия закона Гесса, равен сумме теплот образования ∆Нобр. продуктов реакции за вычетом суммы теплот образования исходных веществ с учетом коэффициентов перед формулами этих веществ в уравнении реакции.
— теплоты образования простых веществ условно приняты равными нулю;
— теплота образования Н2О (г) равна -241.83 кДж;
— теплота образования Fe2O3(к) равна -822.10 кДж .
Исходя из указанных данных получим:
∆Нх.р.= 3(-241.83) – (-822.10) = -725.49 – (-822.10) = 96.61 кДж.
Ответ: ∆Нх.р.= 96.61 кДж
2. Расчет энтропии реакции
Изменение энтропии продуктов химической реакции, протекающей по уравнению:
Рассчитывается по формуле:
∆S°Fe(к) = 27,2 Дж/(моль . К);
∆S°Н2О (г)) = 188,72 Дж/(моль . К)
∆S° Fe2O3(к) = 89,96 Дж/(моль . К)
∆S° O/H2(г) = 130,59 Дж/(моль . К)
С учетом этих данных рассчитаем изменение энтропии реакции, получим:
∆S°х.р.= 2(27,2) + 3(188,72) – (89,96) + 3(130,59) = 620,56 — 481,73 = 138.83 Дж/(моль . К).
Ответ: ∆S°х.р.= 138.83 Дж/(моль . К)
3. Расчет термического потенциала или энергии Гиббса
Мерой химического сродства (∆G°) является убыль энергии Гиббса (изменение изобарно- термического потенциала или энергии Гиббса).
Убыль энергии Гиббса ∆G°х.р. в химической реакции:
вычисляем по формуле:
∆G°х.р. = ∆Н° — Т . ∆S°
∆G°х.р. = 96,61 – (298 . 0.,3883 = 96,61- 41.37 = +55.24 кДж.
Ответ: ∆G°х.р. = +55.24 кДж
Т.к. ∆G°х.р. > 0, то реакция при стандартных условиях невозможна; при этих условиях пойдет обратная реакция — окисление железа (коррозия).
4. Определение температуры начала реакции восстановления Fe2O3 CO
∆Н = Т . ∆S, отсюда Т = ∆Н/∆S = 96,61/0,13883 = 695.9 К.
5. Расчитаем энергию Гиббса данной реакции при 500 К.
∆G 0 500 = 96,61-(500 . 0,13883) = +27,19 кДж.
Таким образом, ∆G при температуре 500 К составляет +27.19 кДж, т.е. ∆G > 0 и это означает, что реакция при 500 К. невозможна 1 .
6. Расчитаем энергию Гиббса данной реакции при 1000 К
При температуре 1000 К находим ∆G 0 1000 аналогично:
∆G 0 1000 = 96,61 – (1000 . 0,13883 = 96,61 — 138,83 = -42,22 кДж. ∆G 0 1000 = -42,22 кДж.
Реакция восстановления оксида железа (2) оксидом углерода (2)
Задача 15.
Подсчитайте значения ∆ Н, ∆ ?S, ∆ G рекции: FeO + CO = Fe + CO2, определите, при каких условиях она возможна?
Решение:
∆Н°(FeO) = -264,8 кДж/моль;
∆Н°(CO) = -110,5 кДж/моль;
∆Н°(CO2) = -393,5 кДж/моль;
∆S°(Fe) = 27,15 Дж/(моль К);
∆S°(FeO) = 60,8 Дж/(моль К);
∆S°(CO) = 197,5 Дж/(моль К);
∆S°(CO2) = 213,7 Дж/(моль К);
∆G°(FeO) = -244,3 кДж/моль;
∆G°(CO) = -137,1 кДж/моль;
∆G°(CO2) = -394,4 кДж/моль.
1. Рассчитаем ∆ Н ° реакции, получим:
Расссчитывается по формуле:
∆Н°х.р. = ∆Н°(СO2) — [∆Н°(FeO) + ∆Н°(CeO)] = -393,5 — [(-264,8) + (-110,5)] = -393,5 — (-375,3) = -18,2 кДж/моль.
2. Рассчитать ∆S° реакции,получим:
Расссчитывается по формуле:
∆S°х.р. = [∆S°(CO2) + ∆S°(Fe)] — [∆S°(FeO) + ∆S°(CO)] = (213,7 + 27,15) — (60,8 + 197,5) = -17,45 Дж/(моль К).
Отрицательное значение изменения энтропии (убывание энтропии) свидетельствует об увеличении упорядоченности данной системы и, действительно, хотя в реакции объем газов не изменяется, но Fe значительно более устойчив чем FeO.
3. Рассчитаем G° реакции, получим:
Расссчитывается по формуле:
∆Gх.р.= ∑ ∆G обр.прод. — ∑ ∆G обр.исх.
Расчеты показали, что ∆G°х.р.
1 Примечание:
Поскольку изначальная температура, при которой начинается реакция по уравнению:
Fe2O3(к) + 3Н2(г) = 2Fe(к) + 3Н2О (г), из вышеприведенных расчетов равна 695.9 К, то путем сравнения температур можно сразу определить, что при температуре 500 К реакция не пойдет, а при температуре выше 695.9, т.е. при 1000 К пойдет с получением продуктов согласно уравнению.
Пример 4. Реакция восстановления Fe2O3 водородом протекает по уравнению:
Реакция восстановления Fe2O3 водородом протекает по уравнению:
Возможна ли эта реакция при стандартных условиях, если изменение энтропии S = 0,1387 кДж / (моль· К)? При какой температуре начнется восстановление Fe2O3?
Решение. Вычисляем G o реакции:
G = H – T S = 96,61 – 298 · 0,1387 = + 55,28 кДж.
Так как G > 0, то реакция при стандартных условиях невозможна; наоборот, при этих условиях идет обратная реакция окисления железа (коррозия). Найдем температуру, при которой G = 0:
H = T S; T = 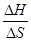
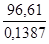
Следовательно, при температуре 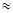
Пример.5. Вычислите H o , S o , и G o Т реакции протекающей по уравнению
Возможна ли реация восстановления Fe2O3(кр.) углеродом при температурах 500 и 1000 К?
Решение. H o х.р. и S o х.р находим из соотношений (1) и (2) так же, как в примере 3:
H o х.р. = [3(-110,52) + 2·0]-[-822,10 + 3·0] = -331,56 + 822,10 = +490,54
S o х.р = (2· 27,2 + 3·197,91) – (89,96 + 3· 5,69) = 541,1 Дж/К.
Энергию Гиббса при соответствующих температурах находим из соотношения
G o Т = =H o – T S o :
G o 500 = 490,54 — 500· 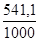
G o 1000 = 490,54 — 1000· 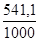
Так как G o 500 > 0, а G o 1000
Реакция восстановления Fe2O3 водородом протекает по уравнению: Fe2O3(к) + 3Н2(г) = 2Fe(к) + 3Н2О(г); Н = +96,61 кДж. Возможна ли эта реакция при стандартных условиях, если изменение энтропии S = 0






Чтобы получить решение , напишите мне в WhatsApp , оплатите, и я Вам вышлю файлы.
Кстати, если эта работа не по вашей теме или не по вашим данным , не расстраивайтесь, напишите мне в WhatsApp и закажите у меня новую работу , я смогу выполнить её в срок 1-3 дня!
Описание и исходные данные задания, 50% решения + фотография:
Реакция восстановления Fe2O3 водородом протекает по уравнению:
Fe2O3(к) + 3Н2(г) = 2Fe(к) + 3Н2О(г); D Н = +96,61 кДж.
Возможна ли эта реакция при стандартных условиях, если изменение энтропии D S = 0,1387 кДж/(моль × К)? При какой температуре начнется восстановление Fe2O3? Ответ: 696,5 К.
Решение:
Направление протекания реакции определяется значением изменения энергии Гиббса. Рассчитаем ее по формуле:
| Изучите химию на странице ➔ решение заданий и задач по химии. |
| Похожие готовые решения: |
- Определить стандартную энтальпию сгорания метана, если стандартные энтальпии образования CH4(г.), CO2(г.) и H2O(ж.) равны соответственно –74,8; –393,5 и –285,8 кДж/моль. Ответ: – 890,3 кДж/моль
- В каком направлении сместится равновесие в реакциях при повышении температуры, понижении давления и увеличении концентрации водорода? а) CO(г) + H2O(г) ↔ CO2(г) + H2(г), H 0 = 41,84 кДж; N2(г)
- Определите тип гибридизации орбиталей центрального атома в частице Н3О+ . Назовите и изобразите геометрическую форму этой частицы.
- Определите тип гибридизации и геометрическую форму комплексного иона [CuCl4]2-
Присылайте задания в любое время дня и ночи в ➔
Официальный сайт Брильёновой Натальи Валерьевны преподавателя кафедры информатики и электроники Екатеринбургского государственного института.
Все авторские права на размещённые материалы сохранены за правообладателями этих материалов. Любое коммерческое и/или иное использование кроме предварительного ознакомления материалов сайта natalibrilenova.ru запрещено. Публикация и распространение размещённых материалов не преследует за собой коммерческой и/или любой другой выгоды.
Сайт предназначен для облегчения образовательного путешествия студентам очникам и заочникам по вопросам обучения . Наталья Брильёнова не предлагает и не оказывает товары и услуги.
http://mydocx.ru/4-3176.html
http://natalibrilenova.ru/reaktsiya-vosstanovleniya-fe2o3-vodorodom-protekaet-po-uravneniyu-fe2o3k—3n2g—2fek—3n2og-n—9661-kdzh-vozmozhna-li-eta-reaktsiya-pri-standartnyih-usloviyah-esli-izmenenie-entropii-s—0/


