Уравнение Шредингера
Вы будете перенаправлены на Автор24
Предпосылки вывода уравнения Шредингера
Основная идея волновой механики заключается в том, что для таких малых тел, как электрон, нельзя с определенностью сказать, где оно находится в данное время и куда направляется. Можно установить только относительную вероятность его нахождения в том или ином месте и наличие определенного количества движения в определенный момент времени.
В соответствии с волновой механикой какая-либо система – атом, молекула, электрон и т.д. – описывается функцией состояния или волновой функцией, обозначаемой $\psi$ («пси»), которая является функцией координат всех частиц, образующих эту систему. Следовательно, величина $\psi$ зависит только от положения всех частиц в пространстве.
В 1924 г. де Бройль предположил, что точно также, как свет, который, как обычно считают, имеет волновую природу, на самом деле при определенных обстоятельствах ведет себя, как будто он состоит из частиц – квантов, — так и очень малые частицы, такие, как электроны, также могут обладать волновыми свойствами. Де Бройль предположил, что с пучком электронов следует связывать длину волны, определяемую уравнением
где $\hbar$ – постоянная Планка ($6,626\cdot 1034 Дж\cdot с$ или $6,626\cdot 10-27 эрг\cdot с$), а $p$ – количество движения (импульс) электрона в пучке, т.е. его масса, умноженная на его скорость.
Физическое подтверждение волновой природы электрона было продемонстрировано в 1927 – 1928 гг. Дейвиссоном, Джермером и Томсоном, которые показали, что пучок электронов может испытывать дифракцию на подходящей решетке (атомы в кристалле золота), аналогичную дифракции пучка света.
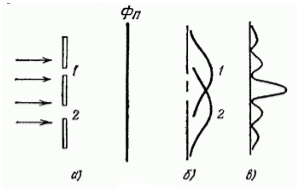
Рисунок 1. Дифракция пучка электронов
На преграду с двумя узкими щелями направлен параллельный пучок моноэнергетических (т.е. обладающих одинаковой кинетической энергией) электронов (рис. 1. а). За преградой находится фотопластина $Фn$. При закрытии щели номер $2$ и экспонировании в течение времени $t$ почернение на проявленной фотопластине будет характеризоваться кривой $1$ (рис. 1. б). При закрытии щели номер $1$, соответственно, почернение на фотопластине будет соответствовать кривой $2$. Однако в случае, когда открыты обе щели картина почернения фотопластины (рис. 1. в) отнюдь не эквивалентна наложению двух первых картин. Зато она аналогична картине, получающейся при интерференции двух когерентных световых волн.
Готовые работы на аналогичную тему
Тот факт, что системы малых частиц проявляют, по крайней мере, при определенных условиях, волновые свойства, предполагает возможность описания таких систем уравнениями, подобными те, которые описывают другие виды волнового движения, например, волны, которые распространяются вдоль колеблющейся струны, или волновое движение, приписываемое электромагнитному излучению. Действительно, можно начать с волнового уравнения, соответствующего электромагнитным волнам, и путем определенных замен, превратить его в уравнение, соответствующее нашему случаю. Хотя эти замены диктуются физическими причинами, они в основном произвольны и могут быть приняты только потому, что приводят к уравнению, которое, как показывает опыт, позволяет получить правильное решение физических задач. Поэтому следует принять волновое уравнение как постулат, так как у химиков основной интерес вызывает применение волнового уравнения к атомным и молекулярным системам, а не физические и математические соображения, которыми руководствовался Шредингер, впервые его предложивший в 1925 г.
Общий вид уравнения Шредингера
Рисунок 2. Эрвин Шрёдингер (1887 — 1961)
Волновое уравнение, применяемое для расчета стационарных состояний системы, можно записать в символическом виде:
где $H$ представляет собой определенный способ выражения общей энергии системы, а $E$ – числовое значение этой энергии. Для всех систем, которые обычно интересуют химиков, общая энергия представляет собой сумму кинетической энергии $Т$ и потенциальной энергии $V$:
Это соотношение было широко использовано физиком-теоретиком Гамильтоном, поэтому $H$ часто называют функцией Гамильтона, а $\mathcal H$ гамильтонианом системы.
Уравнение Шредингера на примере атома водорода
Рассмотрим модель атома водорода, предложенную Бором. Для простоты предположим, что тяжелое ядро закреплено (оно почти, но не совершенно неподвижно, когда электрон движется вокруг него). Тогда полная кинетическая энергия $Т$ системы представляет собой просто кинетическую энергию электрона
где $m$ – масса электрона и $\nu$ – его скорость. Потенциальная энергия системы есть просто энергия, возникающая вследствие электростатического взаимодействия (гравитационные силы приблизительно в $10^<18>$ раз меньше), и ее можно выразить как
где $e$ — заряд электрона, $r$ — радиус орбиты, знак минус появляется вследствие того, что заряд одной из частиц положителен $(+)$, а другой отрицателен $(-)$. Поэтому для атома водорода функция Гамильтона в классической (т.е. доквантовомеханической) физике равна:
Если использовать понятие количества движения электрона $p=m\nu$, данное уравнение запишется в следующем виде:
Теперь для перехода от классического описания этой или какой-либо другой системы к описанию при помощи волновой механики, необходимо взять функцию Гамильтона (уравнение 6) и произвести в ней определенные замены: в функции Гамильтона количество движения следует заменить выражением
Таким образом, гамильтониан для атома водорода в его квантовомеханической форме $<\mathcal H>$ следует записать в виде
Если теперь это выражение гамильтониана подставить в общее волновое уравнение (уравнение 1), то получим:
Это и есть волновое уравнение для атома водорода. Из уравнения 9 следует, что нужно вторые производные функции $\psi $ сложить и умножить на $-<<\hbar >^2>/<8<\pi >^2m>$, затем к этому добавить $\left(-
Решение уравнения Шредингера для многоэлектронных атомов
Автор работы: Пользователь скрыл имя, 13 Октября 2013 в 00:54, реферат
Краткое описание
Уравнение Шрёдингера для атомов, содержащих более одного электрона, не может быть решено в аналитическом виде. В связи с этим рассматривают приближённые методы, наиболее существенным, из которых является метод самосогласованного поля. Идея метода заключается в том, что каждый электрон в атоме рассматривается как движущийся в самосогласованном поле, создаваемом ядром вместе со всеми остальными электронами.
Содержание
Введение…………………………………………………………………………….3
Многоэлектронные атомы…………………………………………………………4
Методы решения уравнения Шредингера для многоэлектронных атомов
1.1 . Метод самосогласованного поля Хартри…………………………………. 5
1.2. Принцип Паули и определители Слейтора. Метод Хартри – Фока………7
Вывод………………………………………………………………………………10
Литература………………………………………………………………………. 11
Прикрепленные файлы: 1 файл
сдать2.doc
ГОСУДАРСТВЕННОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ
ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ
«ВОРОНЕЖСКИЙ ГОСУДАРСТВЕННЫЙ ПЕДАГОГИЧЕСКИЙ УНИВЕРСИТЕТ»
РЕШЕНИЕ УРАВНЕНИЯ ШРЕДЕНГЕРА ДЛЯ МНОГОЭЛЕКТРОННЫХ АТОМОВ
Выполнила студентка 4 курса 2 группы естественно-географического
факультета отделения «Химия-биология»
Проверила доцент кафедры химии
Методы решения уравнения Шредингера для многоэлектронных атомов
1.2. Принцип Паули и определители Слейтора. Метод Хартри – Фока………7
Введение.
Уравнение Шрёдингера для атомов, содержащих более одного электрона, не может быть решено в аналитическом виде. В связи с этим рассматривают приближённые методы, наиболее существенным, из которых является метод самосогласованного поля. Идея метода заключается в том, что каждый электрон в атоме рассматривается как движущийся в самосогласованном поле, создаваемом ядром вместе со всеми остальными электронами. Вместе с тем этот метод может применяться не только в атомной физике, но и просто для систем взаимодействующих частиц.
Построение самосогласованного поля может осуществляться либо методом последовательных приближений (изначально предложенным Хартри) или прямым вариационным методом.
Существенно, что вычисления методом самосогласованного поля весьма громоздки, особенно для сложных атомов. Для них применяется другой метод — метод Томаса — Ферми.
Обобщение метода Хартри — Фока, в котором учитываются волновые функции пар частиц, является метод Хартри — Фока — Боголюбова.
В атоме водорода электрон находится в силовом поле, которое создается только ядром. В многоэлектронных атомах на каждый электрон действует не только ядро, но и все остальные электроны. При этом электронные облака отдельных электронов как бы сливаются в одно общее многоэлектронное облако. Точное решение уравнения Шредингера для таких сложных систем связано с большими затруднениями и, как правило, недостижимо. Поэтому состояние электронов в сложных атомах и в молекулах определяют путем приближенного решения уравнения Шредингера.
Общим для всех приближенных методов решения этого уравнения является так называемое одноэлектронное приближение, т. е. предположение, что волновая функция многоэлектронной системы может быть представлена в виде суммы волновых функций отдельных электронов. Тогда уравнение Шредингера может решаться отдельно для каждого находящегося в атоме электрона, состояние которого, как и в атоме водорода, будет определяться значениями квантовых чисел n, l, m и s. Однако и при этом упрощении решение уравнения Шредингера для многоэлектронных атомов и молекул представляет весьма сложную задачу и требует большого объема трудоемких вычислений. В последние годы подобные вычисления выполняются, как правило, с помощью быстродействующих электронных вычислительных машин, что позволило произвести необходимые расчеты для атомов всех элементов и для многих молекул.
Исследование спектров многоэлектронных атомов показало, что здесь энергетическое состояние электронов зависит не только от главного квантового числа n, но и от орбитального квантового числа l. Это связано с тем, что электрон в атоме не только притягивается ядром, но и испытывает отталкивание со стороны электронов, расположенных между данным электроном и ядром. Внутренние электронные слои как бы образуют своеобразный экран, ослабляющий притяжение электрона к ядру, или, как принято говорить, экранируют внешний электрон от ядерного заряда. При этом для электронов, различающихся значением орбитального квантового числа l, экранирование оказывается неодинаковым.
В многоэлектронных атомах энергия электрона зависит не только от главного, но и от орбитального квантового числа. Главное квантовое число определяет здесь лишь некоторую энергетическую зону, в пределах которой точное значение энергии электрона определяется величиной l. В результате возрастание энергии по энергетическим подуровням происходит примерно в следующем порядке:
ls 2 \rij в уравнении , зависящей от координат двух электронов, выражающим, описывающим межэлектронного взаимодействия как функцию координат каждого отдельного электрона: Vэф.
Чтобы определить особые функции ѱi и особые значения оператора гамильтона надо знать потенциал Vэф.( ѱi), который зависит от искомых функций. Эта трудность устраняется в методе последовательных приближений. В качестве начальных волновых функций берут какие-либо пробные функции, например, функции водородоподобного атома.
Затем решают уравнение Шредингера и находят функции первого приближения усредненного потенциала. Обычно новые величины энергий межэлектронного взаимодействия сильно отличается от первоначальных, что связано с неточностью исходных функций. Поэтому находят функции следующего приближения и т.д.
Критерием получения достаточно хороших ѱi является совпадение с заданной точностью величин Vэф., рассчитанных для ѱ n и ѱ (n+1) т.е. потенциалы Vэф. должны быть согласованными с функциями ѱi . Это требование и определяет название метода самосогласованного поля.
http://www.referat911.ru/Himiya/reshenie-uravneniya-shredingera-dlya-mnogojelektronnyh/187177-2310669-place1.html