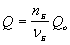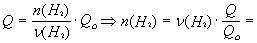1. Реакции соединения
Теория:
- Если поместить немного красного фосфора в ложечку для сжигания веществ и поджечь его, то фосфор загорится ярким пламенем. При этом из фосфора и кислорода воздуха образуется белый дым, состоящий из маленьких частичек оксида фосфора(\(V\)):
- Внесём ложечку с горящим фосфором в колбу, чтобы заполнить её густым дымом из оксида фосфора(\(V\)), затем достанем ложечку из колбы, прильём в колбу воду, закроем горлышко колбы пробкой и взболтаем содержимое.
- В первом случае из двух простых веществ образовалось одно сложное , состоящее из двух элементов.
- Во втором случае прореагировали сложные вещества и образовалось новое сложное вещество , в состав которого входят атомы трёх элементов.
при производстве азотной кислоты из оксида азота(\(II\)) получают оксид азота(\(IV\)):
Все уравнения химических реакций соединения
9.1. Какие бывают химические реакции
Вспомним, что химическими реакциями мы называем любые химические явления природы. При химической реакции происходит разрыв одних и образование других химических связей. В результате реакции из одних химических веществ получаются другие вещества (см. гл. 1).
Выполняя домашнее задание к § 2.5, вы познакомились с традиционным выделением из всего множества химических превращений реакций четырех основных типов, тогда же вы предложили и их названия: реакции соединения, разложения, замещения и обмена.
| Реакции соединения – химические реакции, в которых из двух или нескольких менее сложных по элементному составу веществ получается более сложное вещество. |
Примеры реакций соединения:
| Реакции разложения – химические реакции, в которых из одного сложного по элементному составу вещества получаются два или несколько менее сложных веществ. |
Примеры реакций разложения:
2Ag2O 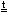
CaCO3 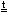
(NH4)2Cr2O7 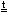
| Реакции замещения – химические реакции, в которых атомы или группы атомов одного из исходных веществ замещают атомы или группы атомов в другом исходном веществе. |
Примеры реакций замещения:
CuSO4 + Fe = FeSO4 + Cu ; (7)
2NaI + Cl2 = 2NaCl + I2; (8)
CaCO3 + SiO2 = CaSiO3 + CO 2 . (9)
| Реакции обмена – химические реакции, в которых исходные вещества как бы обмениваются своими составными частями. |
Примеры реакций обмена:
Ba(OH)2 + H2SO4 = BaSO4 + 2H2O; (10)
HCl + KNO2 = KCl + HNO2; (11)
AgNO3 + NaCl = AgCl + NaNO3. (12)
Традиционная классификация химических реакций не охватывает все их разнообразие – кроме реакций четырех основных типов существует еще и множество более сложных реакций.
Выделение двух других типов химических реакций основано на участии в них двух важнейших нехимических частиц: электрона и протона.
При протекании некоторых реакций происходит полная или частичная передача электронов от одних атомов к другим. При этом степени окисления атомов элементов, входящих в состав исходных веществ, изменяются; из приведенных примеров это реакции 1, 4, 6, 7 и 8. Эти реакции называются окислительно-восстановительными.
| Окислительно-восстановительные реакции (ОВР) – химические реакции, в которых происходит изменение степеней окисления атомов, входящих в состав реагирующих веществ. |
В другой группе реакций от одной реагирующей частицы к другой переходит ион водорода (Н + ), то есть протон. Такие реакции называют кислотно-основными реакциями или реакциями с передачей протона.
| Кислотно-основные реакции (КОР) – химические реакции, сопровождающиеся передачей протона. |
Среди приведенных примеров такими реакциями являются реакции 3, 10 и 11. По аналогии с этими реакциями окислительно-восстановительные реакции иногда называют реакциями с передачей электрона. С ОВР вы познакомитесь в § 2, а с КОР – в следующих главах.


а) HgO Hg + O2
(t); б) Li2O + SO2
Li2SO3; в) Cu(OH)2
CuO + H2O
(t);
г) Al + I2 AlI3; д) CuCl2 + Fe
FeCl2 + Cu
; е) Mg + H3PO4
Мg3(PO4)2 + H2
;
ж) Al + O2 Al2O3 (t); и) KClO3 + P P2O5 + KCl (t); к) CuSO4 + Al
Al2(SO4)3 + Cu
;
л) Fe + Cl2 FeCl3 (t); м) NH3 + O2
N2 + H2O (t); н) H2SO4 + CuO
CuSO4 + H2O.
Укажите традиционный тип реакции. Отметьте окислительно-восстановительные и кислотно-основные реакции. В окислительно-восстановительных реакциях укажите, атомы каких элементов меняют свои степени окисления.
Рассмотрим окислительно-восстановительную реакцию, протекающую в доменных печах при промышленном получении железа (точнее, чугуна) из железной руды:
Определим степени окисления атомов, входящих в состав как исходных веществ, так и продуктов реакции
+III –II
+II –II
+IV –II
3CO
Как видите, степень окисления атомов углерода в результате реакции увеличилась, степень окисления атомов железа уменьшилась, а степень окисления атомов кислорода осталась неизменной. Следовательно, атомы углерода в этой реакции подверглись окислению, то есть потеряли электроны (окислились), а атомы железа – восстановлению, то есть присоединили электроны (восстановились) (см. § 7.16). Для характеристики ОВР используют понятия окислитель и восстановитель.
| Атомы-окислители – атомы, принимающие электроны в ходе данной ОВР. |
| Атомы-восстановители – атомы, отдающие электроны в ходе данной ОВР. |
Таким образом, в нашей реакции атомами-окислителями являются атомы железа, а атомами-восстановителями – атомы углерода.
| Вещество-окислитель – исходное вещество данной ОВР, содержащее атомы-окислители |
| Вещество-восстановитель – исходное вещество данной ОВР, содержащее атомы-восстановители. |
В нашей реакции веществом-окислителем является оксид железа(III), а веществом-восстановителем – оксид углерода(II).
В тех случаях, когда атомы-окислители и атомы-восстановители входят в состав одного и того же вещества (пример: реакция 6 из предыдущего параграфа), понятия » вещество-окислитель» и » вещество-восстановитель» не используются.
Таким образом, типичными окислителями являются вещества, в состав которых входят атомы, склонные присоединять электроны (полностью или частично), понижая свою степень окисления. Из простых веществ это прежде всего галогены и кислород, в меньшей степени сера и азот. Из сложных веществ – вещества, в состав которых входят атомы в высших степенях окисления, не склонные в этих степенях окисления образовывать простые ионы: HNO3 (N +V ), KMnO4 (Mn +VII ), CrO3 (Cr +VI ), KClO3 (Cl +V ), KClO4 (Cl +VII ) и др.
Типичными восстановителями являются вещества, в состав которых входят атомы, склонные полностью или частично отдавать электроны, повышая свою степень окисления. Из простых веществ это водород, щелочные и щелочноземельные металлы, а также алюминий. Из сложных веществ – H2S и сульфиды (S –II ), SO2 и сульфиты (S +IV ), йодиды (I –I ), CO (C +II ), NH3 (N –III ) и др.
В общем случае почти все сложные и многие простые вещества могут проявлять как окислительные, так и восстановительные свойства. Например:
SO2 + Cl2 = S + Cl2O2 (SO2 – сильный восстановитель);
SO2 + C = S + CO2 (t) (SO2 – слабый окислитель);
C + O2 = CO2(t) (C – восстановитель);
C + 2Ca = Ca2C (t) (С – окислитель).
Вернемся к реакции, разобранной нами в начале этого параграфа.
+III -II
+II -II
+IV -II
3CO
Обратите внимание, что в результате реакции атомы-окислители (Fe +III ) превратились в атомы-восстановители (Fe 0 ), а атомы-восстановители (C +II ) превратились в атомы-окислители (C +IV ). Но CO2 в любых условиях очень слабый окислитель, а железо, хоть и является восстановителем, но в данных условиях значительно более слабым, чем CO. Поэтому продукты реакции не реагируют друг с другом, и обратная реакция не протекает. Приведенный пример является иллюстрацией общего принципа, определяющего направление протекания ОВР:
Окислительно-восстановительные реакции протекают в направлении образования более слабого окислителя и более слабого восстановителя.
Окислительно-восстановительные свойства веществ можно сравнивать только в одинаковых условиях. В некоторых случаях это сравнение может быть проведено количественно.
Выполняя домашнее задание к первому параграфу этой главы, вы убедились, что подобрать коэффициенты в некоторых уравнениях реакций (особенно ОВР) довольно сложно. Для упрощения этой задачи в случае окислительно-восстановительных реакций используют следующие два метода:
а) метод электронного баланса и
б) метод электронно-ионного баланса.
Метод электронного баланса вы изучите сейчас, а метод электронно-ионного баланса обычно изучается в высших учебных заведениях.
Оба эти метода основаны на том, что электроны в химических реакциях никуда не исчезают и ниоткуда не появляются, то есть число принятых атомами электронов равно числу электронов, отданных другими атомами.
Число отданных и принятых электронов в методе электронного баланса определяется по изменению степени окисления атомов. При использовании этого метода необходимо знать состав как исходных веществ, так и продуктов реакции.
Рассмотрим применение метода электронного баланса на примерах.
Пример 1. Составим уравнение реакции железа с хлором. Известно, что продуктом такой реакции является хлорид железа(III). Запишем схему реакции:
Fe + Cl2 FeCl3.
Определим степени окисления атомов всех элементов, входящих в состав веществ, участвующих в реакции:
+III –I
FeCl3.
Атомы железа отдают электроны, а молекулы хлора их принимают. Выразим эти процессы электронными уравнениями:
Fe – 3e – = Fe +III ,
Cl2 + 2e – = 2Cl –I .
Чтобы число отданных электронов было равно числу принятых, надо первое электронное уравнение умножить на два, а второе – на три:
2
3
Cl2 + 2e – = 2Cl –I
3Cl2 + 6e – = 6Cl –I .
Введя коэффициенты 2 и 3 в схему реакции, получаем уравнение реакции:
2Fe + 3Cl2 = 2FeCl3.
Пример 2. Составим уравнение реакции горения белого фосфора в избытке хлора. Известно, что в этих условиях образуется хлорид фосфора(V):
0
Молекулы белого фосфора отдают электроны (окисляются), а молекулы хлора их принимают (восстанавливаются):
| P4 – 20e – = 4P +V Cl2 + 2e – = 2Cl –I | 1 10 | 2 20 | P4 – 20e – = 4P +V Cl2 + 2e – = 2Cl –I | P4 – 20e – = 4P +V 10Cl2 + 20e – = 20Cl –I |
Полученные первоначально множители (2 и 20) имели общий делитель, на который (как будущие коэффициенты в уравнении реакции) и были разделены. Уравнение реакции:
Пример 3. Составим уравнение реакции, протекающей при обжиге сульфида железа(II) в кислороде.
+II –II
0
FeS
Fe2O3
В этом случае окисляются и атомы железа(II), и атомы серы(– II). В состав сульфида железа(II) атомы этих элементов входят в отношении 1:1 (см. индексы в простейшей формуле).
Электронный баланс:
| 4 | Fe +II – e – = Fe +III S –II – 6e – = S +IV | Всего отдают 7е – |
| 7 | O2 + 4e – = 2O –II |
Пример 4. Составим уравнение реакции, протекающей при обжиге дисульфида железа(II) (пирита) в кислороде.
0
FeS2
Fe2O3
Как и в предыдущем примере, здесь тоже окисляются и атомы железа(II), и атомы серы, но со степенью окисления – I. В состав пирита атомы этих элементов входят в отношении 1:2 (см. индексы в простейшей формуле). Именно в этом отношении атомы железа и серы вступают в реакцию, что и учитывается при составлении электронного баланса:
4
2S –I – 10e – = 2S +IV
11
Встречаются и более сложные случаи ОВР, с некоторыми из них вы познакомитесь, выполняя домашнее задание.


2.Составьте уравнения ОВР, обнаруженных вами при выполнении задания к § 1 этой главы. На этот раз для расстановки коэффициентов используйте метод электронного баланса. 3.Используя метод электронного баланса, составьте уравнения реакций, соответствующие следующим схемам: а) Na + I2 NaI;
б) Na + O2 Na2O2;
в) Na2O2 + Na Na2O;
г) Al + Br2 AlBr3;
д) Fe + O2 Fe3O4 (t);
е) Fe3O4 + H2 FeO + H2O (t);
ж) FeO + O2 Fe2O3 (t);
и) Fe2O3 + CO Fe + CO2 (t);
к) Cr + O2 Cr2O3 (t);
л) CrO3 + NH3 Cr2O3 + H2O + N2 (t);
м) Mn2O7 + NH3 MnO2 + N2 + H2O;
н) MnO2 + H2 Mn + H2O (t);
п) MnS + O2 MnO2 + SO2 (t)
р) PbO2 + CO Pb + CO2 (t);
с) Cu2O + Cu2S Cu + SO2 (t);
т) CuS + O2 Cu2O +SO2 (t);
у) Pb3O4 + H2 Pb + H2O (t).
Почему происходят химические реакции?
Для ответа на этот вопрос вспомним, почему отдельные атомы объединяются в молекулы, почему из изолированных ионов образуется ионный кристалл, почему при образовании электронной оболочки атома действует принцип наименьшей энергии. Ответ на все эти вопросы один и тот же: потому, что это энергетически выгодно. Это значит, что при протекании таких процессов выделяется энергия. Казалось бы, что и химические реакции должны протекать по этой же причине. Действительно, можно провести множество реакций, при протекании которых выделяется энергия. Энергия выделяется, как правило, в виде теплоты.
| Экзотермическая реакция – химическая реакция, при которой происходит выделение теплоты. |
Если при экзотермической реакции теплота не успевает отводиться, то реакционная система нагревается.
Например, в реакции горения метана
выделяется столько теплоты, что метан используется как топливо.
Тот факт, что в этой реакции выделяется теплота, можно отразить в уравнении реакции:
Это так называемое термохимическое уравнение. Здесь символ «+Q» означает, что при сжигании метана выделяется теплота. Эта теплота называется тепловым эффектом реакции.
Откуда же берется выделяющаяся теплота?
Вы знаете, что при химических реакциях рвутся и образуются химические связи. В данном случае рвутся связи между атомами углерода и водорода в молекулах СН4, а также между атомами кислорода в молекулах О2. При этом образуются новые связи: между атомами углерода и кислорода в молекулах СО2 и между атомами кислорода и водорода в молекулах Н2О. Для разрыва связей нужно затратить энергию (см. «энергия связи» , «энергия атомизации» ), а при образовании связей энергия выделяется. Очевидно, что, если «новые» связи более прочные, чем «старые» , то энергии выделится больше, чем поглотится. Разность между выделившейся и поглощенной энергией и составляет тепловой эффект реакции.
Тепловой эффект (количество теплоты) измеряется в килоджоулях, например:
Такая запись означает, что 484 килоджоуля теплоты выделится, если два моля водорода прореагируют с одним молем кислорода и при этом образуется два моля газообразной воды (водяного пара).
Таким образом, в термохимических уравнениях коэффициенты численно равны количествам вещества реагентов и продуктов реакции.
| Термохимическое уравнение реакции – уравнение реакции, включающее тепловой эффект реакции, рассчитанный на количества вещества, задаваемые коэффициентами этого уравнения. |
От чего зависит тепловой эффект каждой конкретной реакции?
Тепловой эффект реакции зависит
а) от агрегатных состояний исходных веществ и продуктов реакции,
б) от температуры и
в) от того, происходит ли химическое превращение при постоянном объеме или при постоянном давлении.
Зависимость теплового эффекта реакции от агрегатного состояния веществ связана с тем, что процессы перехода из одного агрегатного состояния в другое (как и некоторые другие физические процессы) сопровождаются выделением или поглощением теплоты. Это также может быть выражено термохимическим уравнением. Пример – термохимическое уравнение конденсации водяного пара:
В термохимических уравнениях, а при необходимости и в обычных химических уравнениях, агрегатные состояния веществ указываются с помощью буквенных индексов:
(г) – газ,
(ж) – жидкость,
(т) или (кр) – твердое или кристаллическое вещество.
Зависимость теплового эффекта от температуры связана с различиями в теплоемкостях исходных веществ и продуктов реакции.
Так как в результате экзотермической реакции при постоянном давлении всегда увеличивается объем системы, то часть энергии уходит на совершение работы по увеличению объема, и выделяющаяся теплота будет меньше, чем в случае протекания той же реакции при постоянном объеме.
Тепловые эффекты реакций обычно рассчитывают для реакций, протекающих при постоянном объеме при 25 ° С и обозначают символом Qo.
Если энергия выделяется только в виде теплоты, а химическая реакция протекает при постоянном объеме, то тепловой эффект реакции (QV) равен изменению внутренней энергии (D U) веществ-участников реакции, но с противоположным знаком:
QV = – U.
Под внутренней энергией тела понимают суммарную энергию межмолекулярных взаимодействий, химических связей, энергию ионизации всех электронов, энергию связей нуклонов в ядрах и все прочие известные и неизвестные виды энергии, » запасенные» этим телом. Знак » – » обусловлен тем, что при выделении теплоты внутренняя энергия уменьшается. То есть
U = – QV .
Если же реакция протекает при постоянном давлении, то объем системы может изменяться. На совершение работы по увеличению объема также уходит часть внутренней энергии. В этом случае
U = – (QP + A) = –(QP + P V),
где Qp – тепловой эффект реакции, протекающей при постоянном давлении. Отсюда
QP = – U – P V .
Величина, равная U + P V получила название изменение энтальпии и обозначается D H.
H = U + P V.
QP = – H.
Таким образом, при выделении теплоты энтальпия системы уменьшается. Отсюда старое название этой величины: » теплосодержание» .
В отличие от теплового эффекта, изменение энтальпии характеризует реакцию независимо от того, протекает она при постоянном объеме или постоянном давлении. Термохимические уравнения, записанные с использованием изменения энтальпии, называются термохимическими уравнениями в термодинамической форме. При этом приводится значение изменения энтальпии в стандартных условиях (25 °С, 101,3 кПа), обозначаемое Hо. Например:
2Н2(г) + О2(г) = 2Н2О(г) Hо = – 484 кДж;
CaO(кр) + H2O(ж) = Сa(OH)2(кр) Hо = – 65 кДж.
Зависимость количества теплоты, выделяющейся в реакции (Q) от теплового эффекта реакции (Qo) и количества вещества (nБ) одного из участников реакции (вещества Б – исходного вещества или продукта реакции) выражается уравнением:
Здесь Б – количество вещества Б, задаваемое коэффициентом перед формулой вещества Б в термохимическом уравнении.
Задача
Определите количество вещества водорода, сгоревшего в кислороде, если при этом выделилось 1694 кДж теплоты.
Решение
2Н2(г) + О2(г) = 2Н2О(г) + 484 кДж.
(Н2) = 2 моль,
Qo = 484 кДж.
= 2 мольЧ (1694 кДж/484 кДж) = 7 моль.


2.Как вы думаете, может ли реакционная система при протекании экзотермической реакции охлаждаться?
3.Какое количество теплоты выделится при сгорании 320 г серы в кислороде по реакции:
4.Какое количество теплоты выделится при сгорании 405 г алюминия в кислороде по реакции:
5.Определите объем водорода, прореагировавшего с кислородом (объему газов измерены при н. у.), если при этом выделилось 114,4 кДж теплоты.
6.Тепловой эффект реакции взаимодействия кристаллического алюминия с газообразным хлором равен 1408 кДж. Запишите термохимическое уравнение этой реакции и определите массу алюминия, необходимого для получения 2816 кДж теплоты с использованием этой реакции.
7.Определите количество теплоты, выделяющейся при сгорании на воздухе 1 кг угля, содержащего 90 % графита, если тепловой эффект реакции горения графита в кислороде равна 394 кДж.
Кроме экзотермических реакций возможны реакции, при протекании которых теплота поглощается, и, если ее не подводить, то реакционная система охлаждается. Такие реакции называют эндотермическими.
| Эндотермическая реакция – химическая реакция, при которой происходит поглощение теплоты. |
Таким образом, энергия, выделяющаяся при образовании связей в продуктах этих и им подобных реакций, меньше, чем энергия, необходимая для разрыва связей в исходных веществах.
Что же является причиной протекания таких реакций, ведь энергетически они невыгодны?
Раз такие реакции возможны, значит существует какой-то неизвестный нам фактор, являющийся причиной их протекания. Попробуем его обнаружить.
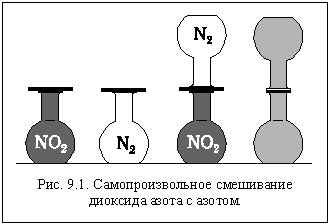
Возьмем две колбы и заполним одну из них азотом (бесцветный газ), а другую – диоксидом азота (бурый газ) так, чтобы и давление, и температура в колбах были одинаковыми. Известно, что эти вещества между собой не вступают в химическую реакцию. Герметично соединим колбы горлышками и установим их вертикально, так, чтобы колба с более тяжелым диоксидом азота была внизу (рис. 9.1). Через некоторое время мы увидим, что бурый диоксид азота постепенно распространяется в верхнюю колбу, а бесцветный азот проникает в нижнюю. В результате газы смешиваются, и окраска содержимого колб становится одинаковой.
Что же заставляет газы смешиваться?
Хаотическое тепловое движение молекул.
Приведенный опыт показывает, что самопроизвольно, без какого бы то ни было нашего (внешнего) воздействия может протекать процесс, тепловой эффект которого равен нулю. А он действительно равен нулю, потому что химического взаимодействия в данном случае нет (химические связи не рвутся и не образуются), а межмолекулярное взаимодействие в газах ничтожно и практически одинаково.
Наблюдаемое явление представляет собой частный случай проявления всеобщего закона Природы, в соответствии с которым системы, состоящие из большого числа частиц, всегда стремятся к наибольшей неупорядоченности.
Мерой такой неупорядоченности служит физическая величина, называемая энтропией.
| Энтропия – физическая величина, характеризующая степень неупорядоченности систем, состоящих из большого числа частиц, находящихся в тепловом движении. |
чем БОЛЬШЕ ПОРЯДКА – тем МЕНЬШЕ ЭНТРОПИЯ,
чем МЕНЬШЕ ПОРЯДКА – тем БОЛЬШЕ ЭНТРОПИЯ.
Уравнения связи между энтропией (S) и другими величинами изучаются в курсах физики и физической химии. Единица измерений энтропии [S] = 1 Дж/К.
Энтропия возрастает при нагревании вещества и уменьшается при его охлаждении. Особенно сильно она возрастает при переходе вещества из твердого в жидкое и из жидкого в газообразное состояние.
Что же произошло в нашем опыте?
При смешении двух разных газов степень неупорядоченности возросла. Следовательно, возросла энтропия системы. При нулевом тепловом эффекте это и послужило причиной самопроизвольного протекания процесса.
Если теперь мы захотим разделить смешавшиеся газы, то нам придется совершить работу, то есть затратить для этого энергию. Самопроизвольно (за счет теплового движения) смешавшиеся газы никогда не разделятся!
Итак, мы с вами обнаружили два фактора, определяющих возможность протекания многих процессов, в том числе и химических реакций:
1) стремление системы к минимуму энергии (энергетический фактор) и
2) стремление системы к максимуму энтропии (энтропийный фактор).
Посмотрим теперь, как влияют на возможность протекания химических реакций различные комбинации этих двух факторов.
1. Если в результате предполагаемой реакции энергия продуктов реакции оказывается меньше, чем энергия исходных веществ, а энтропия больше (» под гору к большему беспорядку» ), то такая реакция может протекать и будет экзотермической.
2. Если в результате предполагаемой реакции энергия продуктов реакции оказывается больше, чем энергия исходных веществ, а энтропия меньше (» в гору к большему порядку» ), то такая реакция не идет.
3. Если в предполагаемой реакции энергетический и энтропийный факторы действуют в разные стороны (» под гору, но к большему порядку» или » в гору, но к большему беспорядку» ), то без специальных расчетов сказать что-либо о возможности протекания такой реакции нельзя (» кто перетянет» ). Подумайте, к какому из этих случаев относятся эндотермические реакции.
Возможность протекания химической реакции можно оценить, рассчитав изменение в ходе реакции физической величины, зависящей как от изменения энтальпии, так и от изменения энтропии в этой реакции. Такая физическая величина называется энергией Гиббса (в честь американского физикохимика XIX в. Джозайя Уилларда Гиббса).
G = H – T S
Условие самопроизвольного протекания реакции:
G
| [предыдущий раздел] | [содержание] | [следующий раздел] |


Сервер создается при поддержке Российского фонда фундаментальных исследований
Не разрешается копирование материалов и размещение на других Web-сайтах
Вебдизайн: Copyright (C) И. Миняйлова и В. Миняйлов
Copyright (C) Химический факультет МГУ
Написать письмо редактору
Формулы веществ и уравнения химических реакций
Содержание:
Химическим уравнением (уравнением химической реакции) называют условную запись химической реакции с помощью химических формул, числовых коэффициентов и математических символов. Уравнение химической реакции даёт качественную и количественную информацию о химической реакции.
На странице -> решение задач по химии собраны решения задач и заданий с решёнными примерами по всем темам химии.
Формулы веществ и уравнения химических реакций
Химическая реакция — это превращение одних веществ в другие. Впрочем, такое определение нуждается в одном существенном дополнении. В ядерном реакторе или в ускорителе тоже одни вещества превращаются в другие, но такие превращения химическими не называют. В чем же здесь дело? В ядерном реакторе происходят ядерные реакции. Они заключаются в том, что ядра элементов при столкновении с частицами высокой энергии (ими могут быть нейтроны, протоны и ядра иных элементов) — разбиваются на осколки, представляющие собой ядра других элементов. Возможно и слияние ядер между собой. Эти новые ядра затем получают электроны из окружающей среды и, таким образом, завершается образование двух или нескольких новых веществ. Все эти вещества являются какими-либо элементами Периодической системы.
В отличие от ядерных реакций, в химических реакциях не затрагиваются ядра атомов. Все изменения происходят только во внешних электронных оболочках. Разрываются одни химические связи и образуются другие.
Химическими реакциями называются явления, при которых одни вещества, обладающие определенным составом и свойствами, превращаются в другие вещества — с другим составом и другими свойствами. При этом в составе атомных ядер изменений не происходит.
Расчёты по химическим формулам
По химическим формулам веществ можно производить различные расчеты:
1. Определение численного соотношения атомов.
Для молекулы SO3 численное соотношение атомов составляет 1 : 3, а для

2. Определение относительной молекулярной массы вещества.
3. Расчет массы одной молекулы вещества.
Для молекулы
4. Определение массовых отношений химических элементов в сложном
веществе.
Для молекулы 
5. Расчет массы элемента по известной массе вещества и обратная задача.
а) Сколько граммов меди содержится в 320 г оксида меди (II)?

б) В какой массе карбоната кальция 
6. Расчет массовой доли химического элемента в сложном веществе.
По формуле вещества можно рассчитать массовую долю каждого химического элемента, который входит в состав вещества.
Массовая доля 


n – число атомов элемента (Э) в молекуле вещества;

Массовые доли обычно выражаются в процентах:
Пример: Рассчитать массовые доли водорода и кислорода в воде

Если вещество состоит из трех элементов, для определения массовой доли третьего элемента можно определить массовые доли двух элементов, затем их сумму отнять от 100%.
6. Составление формул по соотношению масс и массовых долей элементов в молекуле.
а) Выведите формулу вещества, если соотношение масс элементов
m (S) : m (O) = 2 : 3.


x (S) = 2 : 32 = 0,0625
y (О) = 3 : 16 = 0,1875


Поскольку в молекулах не может быть дробных чисел атомов, то делением на наименьшее значение или умножением на какое-то число превращаем дробные числа в целое число:


б) Составьте формулу вещества, если массовые доли элементов в соединении таковы:





Массовая доля элементов в веществе, массовые соотношения атомов, соотношения чисел атомов.
Составление уравнений химических реакций
Химические формулы, индексы, химические реакции
Используя различные слова, мы составляем предложения. Используя формулы веществ, составляем уравнения реакций. Химическое уравнение –условная запись химической реакции с помощью химических формул и знаков. По уравнениям реакций можно определить, в каких количественных отношениях реагируют вещества и сколько продуктов при этом образуется. Вещества, вступающие в реакцию, называются реагентами. Образующиеся при этом вещества называются продуктами.
Алгоритм составления уравнений реакций
1. Записываем схему уравнения реакции: формулы вступающих в реакцию веществ – слева, а образовавшихся – справа.
2. Уравнения реакций отличаются от схем этих же реакций. Например, горение железа в кислороде записывается в виде схемы:
3. В уравнениях реакций число атомов реагирующих веществ должно быть равно числу атомов продуктов реакций. Поэтому в схемах реакций перед формулами веществ ставятся коэффициенты. Подбираем коэффициенты, чтобы число атомов каждого элемента в левой и правой частях равенства было одинаковым. Коэффициент 1 не ставится. Вначале уравниваем число атомов кислорода. Для этого находим наименьшее кратное число для атомов кислорода до и после реакции: 2 · 3 = 6. Делением этого числа на число атомов кислорода находим коэффициенты в левой части – 6 : 2 = 3; затем в правой части – 6 : 3 = 2.
4. Теперь уравниваем число атомов железа и, наконец, заменяем стрелку на знак равенства:
Коэффициенты перед формулами веществ в химических уравнениях называются стехиометрическими коэффициентами.
В полученном уравнении число атомов каждого элемента в левой части равно числу тех же атомов в правой части. Уравнение читается так: 4 атома железа плюс 3 молекулы кислорода равны 2 молекулам оксида железа (III).
При записи химического уравнения подбираются только коэффициенты, а индексы в формулах менять нельзя, так как нельзя произвольно менять состав вещества.
По уравнениям реакций можно получить следующие сведения:
1) качественный состав реагирующих и образовавшихся веществ 
2) соотношения коэффициентов перед формулами: 
3) соотношения масс веществ:
Уравнения реакции, реагенты, продукты, коэффициенты.
Закон сохранения массы веществ
При химических реакциях происходит распад молекул реагирующих
веществ, осуществляется перегруппировка атомов и групп атомов, образуются молекулы продуктов реакции. В результате реакций число атомов не изменяется, поэтому не должны изменяться и массы этих атомов.
Рассмотрим реакцию горения магния:
Масса веществ, вступивших в реакцию, равна массе веществ, образовавшихся в результате реакции.
В этом и состоит закон сохранения массы. Закон был открыт опытным путем в 1748 г. русским ученым М. В. Ломоносовым. Позднее, в 1789 г., французский ученый А. Лавуазье пришел к такому же выводу независимо от М. В. Ломоносова. Закон сохранения массы веществ имеет огромное значение для естественных наук.
Значение закона сохранения массы веществ
- 1. Открытие закона способствовало дальнейшему развитию химии.
- 2. Все расчетные задачи в химии решаются на его основе. Все химические уравнения составляются на основании этого закона.
- 3. Этот закон является одним из проявлений общего закона природы: вещество не исчезает бесследно и не образуется из ничего.
Закон сохранения массы веществ.
Демонстрация №1
Опыт, доказывающий закон сохранения массы веществ
Цель: Знать закон сохранения массы веществ и доказать это опытным путём.
Проведите реакцию карбоната кальция с соляной кислотой. Для этого предварительно взвесьте колбу с кислотой, а также шарик на весах (рис. 9). Насыпьте 1 г карбоната
кальция в шарик. Затем наденьте его на колбу. Закрепите скотчем. Поднимите надувной шарик, чтобы весь карбонат высыпался в колбу. После проведения реакции взвесьте.
Сделайте выводы.
Соотношение масс реагирующих веществ. Закон постоянства состава
Состав вещества можно выразить числом атомов или массовым отношением атомов в молекуле. Например, для молекулы 
= 1 : 2, а массовые отношения элементов m (C) : m (O) = 12 : 32 = 3 : 8. Или можно взять отношения массовых долей элементов:
Углекислый газ выделяется при горении топлива, при разложении некоторых сложных веществ или в результате дыхания.
Как вы видите, в молекуле 

Состав химически чистого, имеющего молекулярное строение вещества, независимо от способа получения, остается постоянным. Химически чистое вещество имеет постоянный качественный и количественный состав.
В настоящее время известны вещества с переменным составом, с ними вы познакомитесь позднее.
В формулах веществ молекулярного строения индекс указывает на количество химического элемента в молекуле вещества.
На основе закона постоянства состава вещества можно производить различные расчеты. Рассмотрим следующий пример:
При взаимодействии меди с серой образуется 1 моль сульфида меди (II):
m (Cu) : m (S) = 64 : 32 = 2 : 1
Значит, из 2 г Cu и 1 г S образуется сульфид меди (ІІ).
Проведем два опыта.
1. Возьмем смесь, состоящую из 5 г меди и 2 г серы. После нагревания получим смесь сульфида меди с медью, так как 1 г меди находится в избытке. В смеси содержится 6 г CuS и 1 г Сu.
2. Теперь возьмем по 4 г меди и серы. В этом случае после нагревания образуется смесь сульфида меди и серы, так как 2 г серы остаются неизрасходованными и образуется 6 г сульфида меди.
Проверим результаты опытов математическим путем.
Для первого опыта:


m(Cu) + m(S) = 4 + 2 = 6 г.

Для второго опыта:

По условию задачи было взято 4 г серы, значит, масса оставшейся
серы:
4 – 2 = 2 г S в избытке.

По закону сохранения массы веществ 4 г Cu взаимодействует с 2 г S с образованием 6 г CuS.

Соотношение масс реагирующих веществ, закон постоянства состава.
Лабораторный опыт №2
І вариант.
Цель: определить опытным путем соотношение масс реагирующих веществ, доказать правильность закона постоянства состава и закона сохранения масс.
Ход работы
1. Налейте во все пробирки, закрепленные в штативах, по 5 мл раствора
гидроксида натрия.
2. С помощью бюретки налейте определенные объемы раствора сульфата
меди в таком порядке: 1 мл, 1,5 мл, 2 мл, 2,5 мл, 3 мл, 3,5 мл, 4 мл.
3. Через некоторое время в некоторых пробирках образуется осадок, и
надо дать ему отстояться.
4. Заполните таблицу. Высота осадка будет измеряться линейкой.
Вопросы и задания:
1. Напишите уравнение реакции.
2. Какое объемное отношение растворов достаточно для образования осадка?
3. Определите массовые отношения исходных веществ.
4. Сделайте выводы: выполняется ли закон постоянства состава и закон сохранения масс.
ІІ вариант.
Цель: определять опытным путем соотношение масс реагирующих веществ.
Ход работы
1. Напишите уравнение реакции взаимодействия железа с серой:
2. Определить соотношение масс реагирующих веществ:
m (Fe) : m (S) = 56 : 32 = 7 : 4
3. Для удобства и экономии реагентов можно брать исходные вещества в соотношении 3,5 : 2, т. е. на технических весах взвесить 3,5 г железа и 2 г серы.
4. Закрепить тигель на кольце штатива, нагреть, перемешивая стеклянной палочкой взвешенные железо и серу до образования однородной темной массы сульфида железа (ІІ) (рис. 10).
Типы химических реакций
По числу и составу реагентов, вступивших в реакцию, и продуктов реакций различают четыре типа химических реакций.
1. Реакции соединения – это реакции, в результате которых из нескольких
простых или сложных веществ образуется одно сложное вещество (рис. 10).
2. Реакции разложения – это реакции, в результате которых из одного сложного вещества образуются два и более веществ – простых или сложных.
3. Реакции замещения – это реакции между простым и сложным веществами, в которых атомы простого вещества замещают атомы одного из элементов в сложном соединении. В результате образуются новые простое и сложное вещества (рис. 11а).
4. Реакции обмена – это реакции, в результате которых два сложных вещества обмениваются своими составными частями и образуются два новых сложных вещества (рис. 11б).
С классификацией химических реакций по другим признакам вы познакомитесь позднее.
Химические реакции в природе и жизнедеятельности живых организмов и человека
Вам известно, что в результате химических явлений одни вещества превращаются в другие, отличающиеся от исходных веществ по составу. Это вы можете наблюдать в окружающей среде каждодневно. Например: ржавление железного гвоздя, потускнение серебряных украшений и предметов кухонной утвари, позеленение тазика из латуни, горение дров и газа на плите. Что общего между ними? Все эти процессы происходят под действием кислорода
воздуха, т. е. идет окисление.
Химия в природе. В природе непрерывно идут реакции образования органических веществ из простых неорганических соединений, т. е. идут реакции синтеза (рис. 12):
Такой процесс идет в зеленых растениях и водорослях. Хлорофилл находится в хлоропластах зеленых листьев, поэтому они окрашены в зеленый цвет.
Во время грозы в летний период воздух становится свежее и чище в результате следующих реакций:
При разложении кислорода получаем атомарный кислород. Атомарный кислород, соединяясь с молекулой кислорода, образует озон.
Озон – это газ синего цвета с характерным запахом свежести. Накапливается в верхних слоях атмосферы и образует озоновый слой, который выполняет роль щита нашей планеты. Озон защищает Землю от солнечной радиации из космоса и не допускает остывание Земли, поглощая инфракрасное излучение.
Гниение также относится к реакциям окисления. В отличие от горения, гниение – это медленно протекающие процессы. В результате гниения сложные азотсодержащие вещества взаимодействуют с кислородом при участии микроорганизмов. Для того чтобы шел процесс гниения, кроме микроорганизмов, необходимо наличие влаги. Это уникальный, сложный многоступенчатый процесс, позволяющий перерабатывать белки погибших животных и
растений в соединения, пригодные к усвоению растениями.
На реакциях, лежащих в основе брожения сахаристых веществ, основаны многие производства, например, хлебобулочных изделий и напитков.
В результате реакции окисления глюкозы образуется углекислый газ, вода и большое количество тепла:
Это является источником энергии, необходимой для физической и умственной деятельности в повседневной жизни человека.
Использование пищевой соды способствует поднятию теста, так как при взаимодействии с органическими кислотами выделяется углекислый газ.
Выделяющийся углекислый газ 
Химия в живых организмах
С точки зрения химика, дыхание – также процесс окисления органических веществ: углеводов, жиров, белков.
Часть энергии, выделенной в результате этой реакции, организм использует
для совершения умственной, физической работы.
А вторая часть запасается в организме для того, чтобы можно было использовать ее при синтезе характерных для данного организма белков, углеводов и жиров. Таким образом, энергия, необходимая для жизнедеятельности, получается из питательных веществ, поступающих в организм из окружающей среды.
Антацидные вещества – лекарственные средства для лечения желудочно-кишечных заболеваний. Они нейтрализуют соляную кислоту, которая входит в состав желудочного сока.
Химия в быту
Работа двигателей внутреннего сгорания основана на реакции горения углеводородов (топлива).
Вы, наверное, заметили, что на стенках чайника через некоторое время образуется накипь. При этом идет реакция разложения солей магния и кальция, обусловливающих временную жесткость воды. В результате этих реакций образуются нерастворимые соли кальция и магния.
Из-за накипи выходят из строя нагревательные элементы в стиральных и посудомоечных машинах, утюгах, а также промышленные котлы.
Для очистки чайника от накипи достаточно прокипятить воду, в которую добавлена уксусная кислота.
Для этой цели можно использовать и лимонную кислоту.
«Гашение» соды уксусом – часто наблюдаемая на кухне реакция:
сода 4- уксусная кислота -> соль 4- вода 4- углекислый газ
Хозяйственное мыло не мылится в жесткой воде, т. к. идет реакция обмена с солями кальция и магния и образуется нерастворимая соль, которая «всплывает». Это объясняется тем, что натриевые соли органических кислот растворимые, а кальциевые, магниевые соли – нерастворимые в воде.
Санатории для больных туберкулезом обычно расположены в сосновых борах. Почему? Потому что в хвойных растениях содержится соединение, которое при окислении озоном (после грозы) выделяет атомарный кислород, который обладает дезинфицирующим и отбеливающим свойствами.
Еще одно интересное природное явление – образование в пещерах сталактитов и сталагмитов – это осадок карбоната кальция СаСО3. Сталактиты растут сверху вниз как сосульки, а сталагмиты – снизу вверх (рис. 13).
Химия дает человечеству огромные возможности и силы, но только она требует грамотного и ответственного отношения к ней. За день в мире происходят тысячи различных (опасных для человечества, в то же время интересных) химических реакций. Не зря говорится в изречении М. В. Ломоносова: «Широко распространяет химия руки свои в дела человеческие».
- 1. Обозначения качественного и количественного состава простых и сложных веществ с помощью символов элементов и индексов называются химическими формулами.
- 2. Химическое уравнение — условная запись химической реакции с помощью химических формул и знаков.
- 3. По числу и составу реагентов, вступивших в реакцию, и продуктов реакций различают четыре типа химических реакций: реакция соединения, реакция разложения, реакция замещения, реакция обмена.
- 4. Масса веществ, вступивших в реакцию, равна массе веществ, образовавшихся в результате реакции. Эта формулировка называется законом сохранения масс веществ.
- 5. Состав химически чистого, имеющего молекулярное строение вещества, независимо от способа получения, остается постоянным. Химически чистое вещество имеет постоянный качественный и количественный состав.
Услуги по химии:
Лекции по химии:
Лекции по неорганической химии:
Лекции по органической химии:
Присылайте задания в любое время дня и ночи в ➔
Официальный сайт Брильёновой Натальи Валерьевны преподавателя кафедры информатики и электроники Екатеринбургского государственного института.
Все авторские права на размещённые материалы сохранены за правообладателями этих материалов. Любое коммерческое и/или иное использование кроме предварительного ознакомления материалов сайта natalibrilenova.ru запрещено. Публикация и распространение размещённых материалов не преследует за собой коммерческой и/или любой другой выгоды.
Сайт предназначен для облегчения образовательного путешествия студентам очникам и заочникам по вопросам обучения . Наталья Брильёнова не предлагает и не оказывает товары и услуги.
http://www.chem.msu.su/rus/school/zhukov1/09.html
http://natalibrilenova.ru/formulyi-veschestv-i-uravneniya-himicheskih-reaktsij/