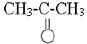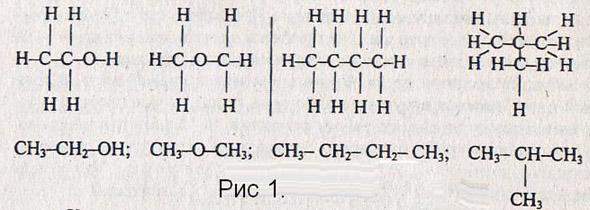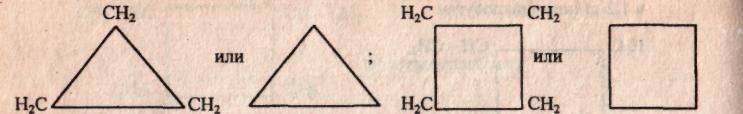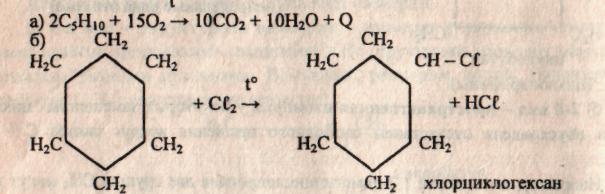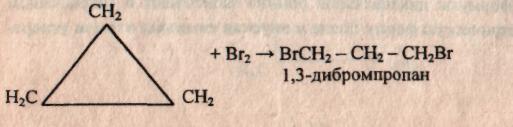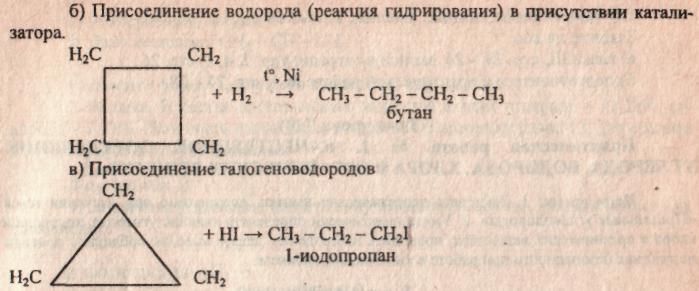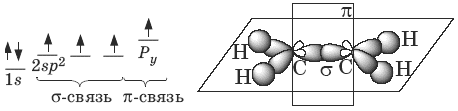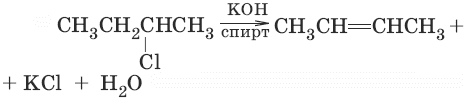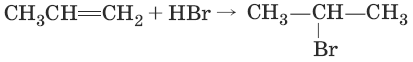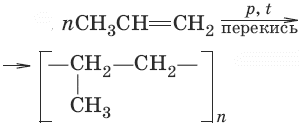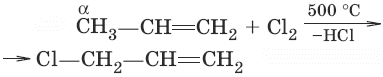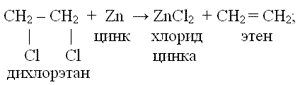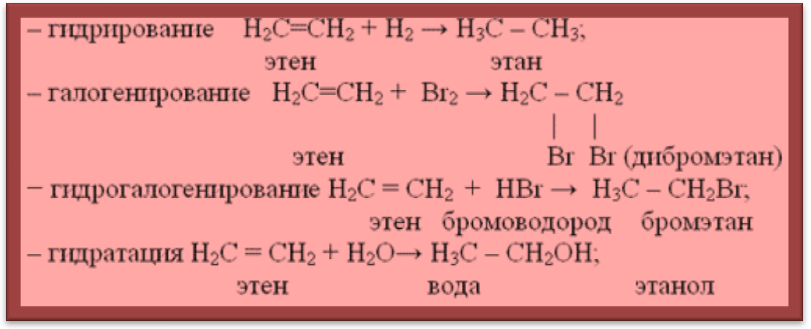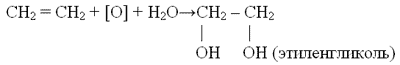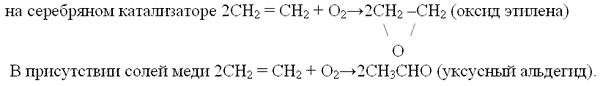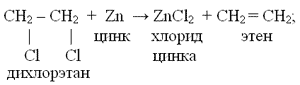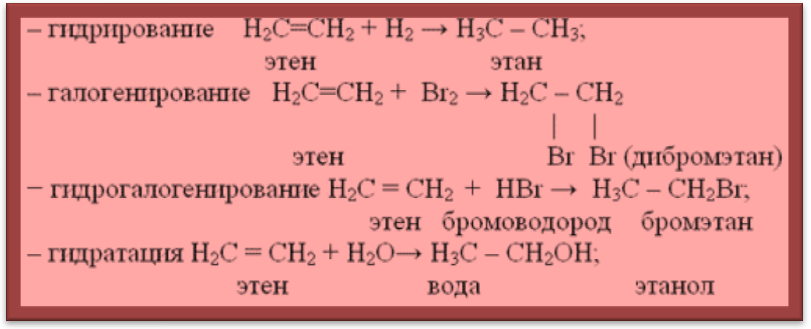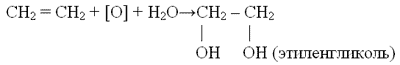Конспекты всех уроков по химии 10 класс
Представлены конспекты уроков по всему курсу химии за 10 класс.
Просмотр содержимого документа
«1 урок»
Урок на тему: Вводный инструктаж по Т/Б.Предмет органической химии. Формирование органической химии как науки.
1.Сформировать представление о составе и строении органических соединений, их отличительных признаках.
2. Выявить причины многообразия органических веществ.
3. Продолжить формирование умения составлять структурные формулы на примере органических веществ.
4. Сформировать представление об изомерии и изомерах.
Оборудование урока: образцы органических соединений, спички, фарфоровая чашка, щипцы, шаростержневые модели представителей алканов, алкенов, циклоалканов.
Что же такое “органическая химия” и как произошел термин “органические вещества”?
Органическая химия – наука об органических соединениях и их превращениях. Первоначально органическим считались вещества, найденные в живых организмах и животных. Такие, встречающиеся в живой природе вещества, обязательно содержат углерод. Долгое время считалось, что для получения сложных соединений углерода используется некая “движущая сила”, действующая только в живой материи. В лабораториях удавалось синтезировать лишь самые простые углеродосодержащие соединения, такие, как диоксид углерода CO2, карбид кальция CaC2, цианид калия KCN. Началом синтеза органических веществ по праву считается синтез мочевины из неорганической соли – цианата аммония NH4CNO, произведенный Вёлером в 1828 году. Это и повлекло за собой необходимость определения органических веществ. Сегодня к ним относятся более миллиона углеродосодержащих соединений. Некоторые из них выделены из растительных и животных источников, однако гораздо большее их число синтезировано в лабораториях химиками-органиками.
На каком основании органические вещества выделяют в отдельную группу? Каковы их отличительные признаки?
Так как углерод непременно присутствует во всех органических веществах, органическую химию с середины XIX века часто называют химией соединений углерода.
Термин “органическая химия” был введен шведским ученым Й. Берцелиусом в начале XIX века. До этого вещества классифицировали по источнику их получения. Поэтому в XVIII веке различали три химии: “растительную”, “животную” и “минеральную”. Еще в XVI веке ученые не делали различий между органическими и неорганическими соединениями. Вот, например, классификация веществ на основании знаний того времени:
Масла: купоросное (серная кислота), оливковое;
Спирты: винный, нашатырный, соляный (соляная кислота), селитряной (азотная кислота);
Соли: поваренная, сахар и т.д.
Несмотря на то, что эта классификация, мягко говоря, не соответствует нынешней, многие современные названия пришли к нам из того времени. Например, название “спирт” (от латинского “спиритус” – дух) присваивалось всем легколетучим жидкостям. Уже в XIX века химики не только вели интенсивный поиск новых веществ и способов их получения, но и уделяли особое внимание определению состава веществ. Список важнейших открытий органической химии того времени можно было бы представить следующим образом:
1845 год. Кольбе синтезирует в несколько стадий уксусную кислоту, используя в качестве исходных неорганические вещества: древесный уголь, водород, кислород, серу и хлор.
1854 год. Бертло синтезирует жироподобное вещество.
1861 год. Бутлеров, действуя известковой водой на параформальдегид (полимер муравьиного альдегида), осуществил синтез “метиленитана” — вещества, относящегося к классу сахаров.
1862 год. Бертло, пропуская водород между угольными электродами, получает ацетилен.
Эти эксперименты подтверждали, что органические вещества имеют ту же природу, что и все простые вещества, и никакой жизненной силы для их образования не требуется.
Органические и неорганические вещества состоят из одних и тех же химических элементов и могут быть превращены друг в друга.
Учитель приводит примеры органических веществ, называет их молекулярную формулу (формулы записаны заранее на доске и закрыты): уксусная кислота CH3-COOH, этиловый спирт CH3CH2OH, сахароза C12H22O11, глюкоза C6H12O6, ацетилен HC = CH, ацетон
Вопрос: Что общего вы заметили в составе этих веществ? Какое химическое свойство вы можете предположить для этих веществ?
Учащиеся отвечают, что во все перечисленные соединения входят углерод и водород. Предполагают, что они горят. Учитель демонстрирует горение спиртовки ( C2H5OH ), обращает внимание на характер пламени, вносит последовательно в пламя спиртовки, уротропина и свечи фарфоровую чашку, показывает, что от пламени свечи образуется копоть. Далее обсуждается вопрос о том, какие вещества образуются в ходе горения органических веществ. Учащиеся приходят к выводу, что образоваться может углекислый или угарный газ, чистый углерод ( сажа, копоть ). Учитель сообщает, что не все органические вещества способны гореть, но все они разлагаются при нагревании без доступа кислорода, обугливаются. Учитель демонстрирует обугливание сахара при нагревании. Учитель просит определить вид химической связи в органических веществах, исходя из их состава.
Далее ученики в тетрадях записывают признаки органических веществ:
1. Содержат углерод.
2. Горят и (или) разлагаются с образованием углеродсодержащих продуктов.
3. Связи в молекулах органических веществ ковалентные.
Вопрос: Как вы думаете, сколько органических соединений сейчас известно? (Учащиеся называют предполагаемое количество известных органических веществ. Обычно эти числа занижены по сравнению с фактической численностью органических веществ). В 1999 году зарегистрировано 18-миллионное органическое вещество.
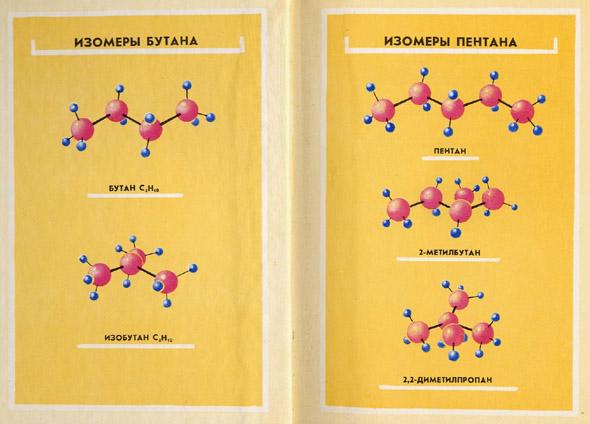
Вопрос: В чем же причины многообразия органических веществ? Учащимся предлагается попытаться найти их в том, что уже известно о строении органических веществ. Ученики называют такие причины, как: соединение углерода в цепи разной длины; соединение атомов углерода простыми, двойными и тройными связями с другими атомами и между собой; множество элементов, входящих в состав органических веществ. Учитель приводит еще одну причину – разный характер углеродных цепей: линейные, разветвленные и циклические, демонстрирует модели бутана, изобутана и циклогексана.
Учащиеся в тетради записывают: Причины многообразия органических соединений.
1. Соединиение атомов углерода в цепи разной длины.
2. Образование атомами углерода простых, двойных и тройных связей с другими атомами и между собой.
3. Разный характер углеродных цепочек: линейные, разветвленные, циклические.
4. Множество элементов, входящих в состав органических веществ.
5. Явление изомерии органических соединений.
Вопрос: Что же такое изомерия?
Это было известно с 1823 года. Берцелиус (1830 год) предложил назвать изомерами вещества, имеющие качественный и количественный состав, но обладающие различными свойствами. К примеру, было известно около 80 разнообразных веществ, отвечающих составу C6H12O2. В 1861 году загадка изомерии была разгадана.
На съезде немецких естествоиспытателей и врачей был прочитан доклад, называвшийся “Нечто в химическом строении тел”. Автором доклада был профессор Казанского университета Александр Михайлович Бутлеров.
Именно это самое “нечто” и составило теорию химического строения, которая легла в основу наших современных представлений о химических соединениях.
Теперь органическая химия получила прочную научную основу, обеспечившую ее стремительное развитие в последующее столетие вплоть до наших дней. Предпосылками для ее создания послужили успехи в разработке атомно-молекулярного учения, представлений о валентности и химической связи в 50-е годы XIX века. Эта теория позволила предсказывать существование новых соединений и их свойства.
Понятие о химическом строении или, в конечном итоге, о порядке связи атомов в молекуле позволило объяснить такое загадочное явление, как изомерия.
Определения понятий “химическое строение”, “изомеры” и “изомерия” записываются в тетрадь.
Умение строить структурные формулы изомеров отрабатываются на примерах:
C2H6O (этанол и диметиловый эфир), C4H10 (бутан и изобутан). Учитель показывает, как можно записать краткую структурную формулу
На доске – плакат с изображением изомеров бутана и пентана.
Учитель предлагает построить изомеры состава C6H14, если известно, что их существует пять. После вынесения всех изомеров на доску, учитель обращает внимание учащихся на методику построения изомеров: уменьшение с каждым разом главной цепи и увеличение числа радикалов.
Домашнее задание: выучить записи в тетради, построить все возможные изомеры состава C7H16.
Просмотр содержимого документа
«10 урок»
Тема: «ЦИКЛОПАРАФИНЫ: СТРОЕНИЕ, СВОЙСТВА, ПРИМЕНЕНИЕ». Нахождение молекулярной формулы газообразного углеводорода по его относительной плотности и массовым долям элементов
Цели урока: 1. Дать учащимся понятие о циклических углеводородах. 2. Знать физические и химические свойства циклопарафинов в сравнении с предельными углеводородами, уметь записывать уравнения реакций, доказывающие химические свойства циклопарафинов. 3. Знать практическое применение циклопарафинов, исходя из свойств данных веществ, способы получения.
I . Подготовка к восприятию нового материала
1. Проверка домашнего задания.
У доски 1-й учащийся — задача № 1, стр. 50. 2-й учащийся — задача 7, стр. 23.
2. Работа классу.
Решить задачу:
При сжигании 2,1 г вещества образуется 6,6 г оксида углерода ( IV ) и 2,7 г воды. Плотность паров этого вещества по воздуху равна 2,91. Определите молекулярную формулу данного вещества.
3. Фронтальная беседа по вопросам:
а) Какие вещества называют гомологами? изомерами?
б) Почему углеводороды называют предельными?
в) Почему углеводородная цепь (у предельных углеводородов) имеет зигзагообразное строение? Почему эта цепь может принимать в пространстве разные формы?
г) Почему атомы углерода соединяются в цепи?
д) В чем причина многообразия органических соединений? И другие вопросы.
II . Изучение нового материала (лекция)
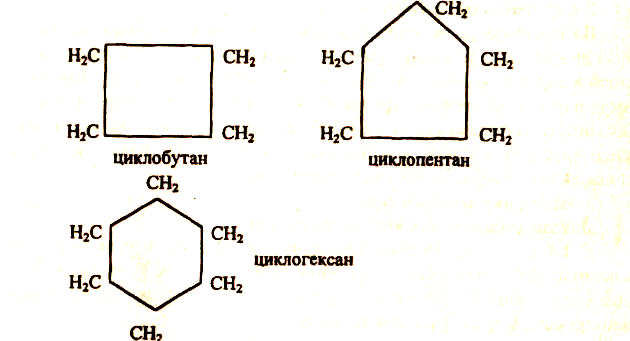
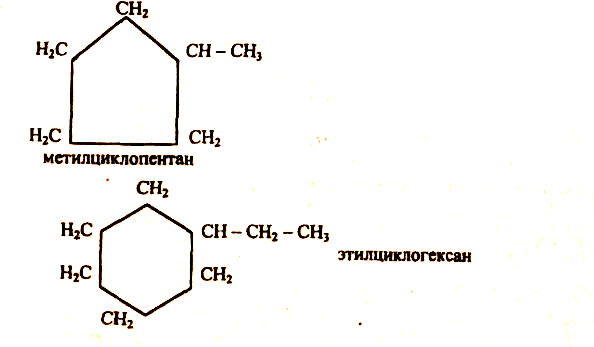
Кроме рассмотренных предельных углеводородов с открытой цепью атомов — парафинов, существуют углеводороды замкнутого, циклического строения. Их называют циклопарафинами, например:
Общая формула циклопарафинов: СпН2п.
Они имеют на два атома водорода меньше, чем у предельных. Почему?
Циклопарафины называют также циклоалканами. Пяти- и шестичленные циклопарафины были впервые открыты в нефти профессором Московского университета В. В. Марковниковым. Отсюда их другое название — нафтены.
Молекулы циклопарафинов часто содержат боковые углеродные цепи:
2. Строение циклопарафинов.
По строению молекул циклопарафины сходны с предельными углеводородами. Каждый атом углерода в циклоалканах находится в состоянии sp 3 -гибридизации и образует четыре δ-связи С — С и С — Н. Углы между связями зависят от размера цикла. В простейших циклах С3 и С4 углы между связями С — С сильно отличаются от тетраэдрического угла 109°28 что создает в молекулах напряжение и обеспечивает их высокую реакционную способность.
Свободное вращение вокруг связей С-С, образующих цикл, невозможно.
3. Изомерия и номенклатура.
Для циклоалканов характерны два вида изомерии.
а) 1-й вид — структурная изомерия — изомерия углеродного скелета (как для всех классов органических соединений). Но структурная изомерия может быть обусловлена разными причинами.
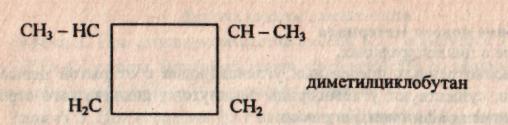
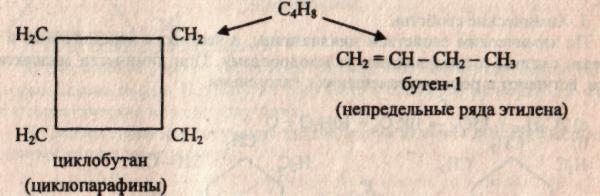
Во-первых, размером цикла. Например, для циклоалкана С4Н8 существует два вещества:
Также к структурной изомерии относится межклассовая. Например, для вещества С4Н8 можно записать структурные формулы веществ, относящихся к разным классам углеводородов.
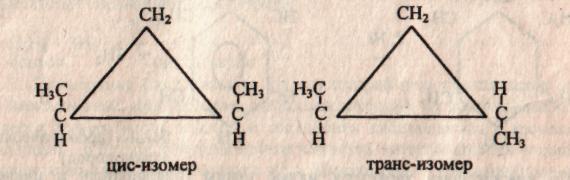
б) 2-й вид — пространственная изомерия у некоторых замещенных циклоалканов обусловлена отсутствием свободного вращения вокруг связей С — С в цикле.
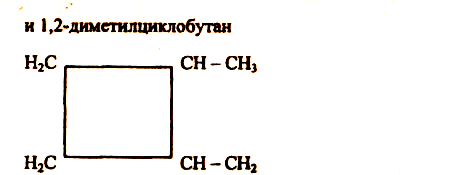
Например, в молекуле 1,2-диметилциклопропанадве группы СН3 могут находиться по одну сторону от плоскости цикла (цис-изомер) или по разные стороны (транс-изомер).
Названия циклоалканов образуются путем добавления приставки цикло- к названию алкана с соответствующим числом атомов углерода. Нумерацию в цикле производят таким образом, чтобы заместители получили наименьшие номера.
Структурные формулы циклоалканов обычно записывают в сокращенном виде, используя геометрическую форму цикла и опуская символы атомов углерода и водорода.
4. Физические свойства циклопарафинов.
При обычных условиях первые два члена ряда (С3 и С4) — газы, C 5 – С10 — жидкости, высшие — твердые вещества. Температуры кипения и плавления циклоалканов, как и их плотности, несколько выше, чем у парафинов с равным числом атомов углерода. Как и парафины, циклоалканы практически нерастворимы в воде.
5. Химические свойства.
По химическим свойствам циклоалканы, в частности циклопентан и циклогексан, сходны с предельными углеводородами. Они химически малоактивны, горючи, вступают в реакцию замещения с галогенами.
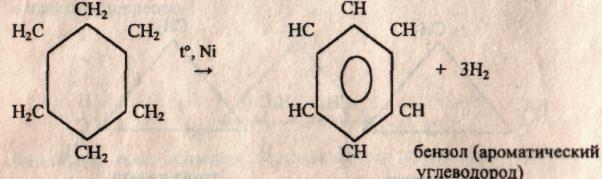
в) Также они вступают в реакцию дегидрирования (отщепления водорода) в присутствии никелевого катализатора.
По химическому характеру малые циклы (циклопропан и циклобутан) склонны к реакциям присоединения, в результате которых происходит разрыв цикла и образуются парафины и их производные, чем они напоминают ненасыщенные соединения.
а) Присоединение брома
6. Получение циклопарафинов.
а) Циклопентан, циклогексан и их производные составляют основную часть некоторых сортов нефти. Поэтому их получают в основном из нефти. Но существуют и синтетические методы получения.
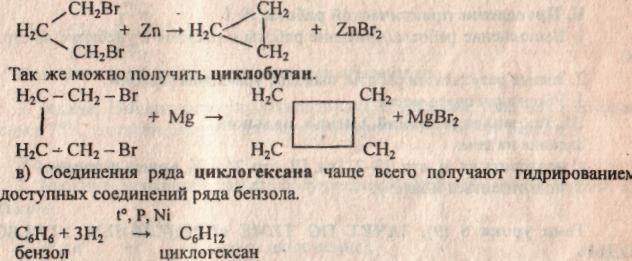
б) Общим способом получения циклоалканов является действие металлов на дигалогенопроизводные алканов.
7. Применение циклоалканов. Из циклопарафинов практическое значение имеют циклопентан, циклогексан, метил циклогексан, их производные и другие. В процессе ароматизации нефти эти соединения превращаются в ароматические углеводороды — в бензол, толуол и другие вещества, которые широко используются для синтеза красителей, медикаментов и т.д. Циклопропан применяют для наркоза. Циклопентан используется как добавка к моторному топливу для повышения качества последнего и в разных синтезах.
В нефти содержатся также карбоксильные производные циклопентана -циклопенткарбоновая кислота и ее гомологи, называемые нафтеновыми кислотами. При очистке нефтяных продуктов щелочью образуются натриевые соли этих кислот, обладающие моющей способностью (мылонафт). Циклогексан используют главным образом для синтеза адипиновой кислоты и капролактама — полупродуктов для производства синтетических волокон найлон и капрон.
III . Закрепление знаний и умений.
Задача 2. При сгорании вещества массой 4,2 г образуется 13,2 г оксида углерода ( IV ) и 5,4 г воды. Плотность паров этого вещества по воздуху равна 2,9. Определите молекулярную формулу данного вещества.
Задача 3. При сгорании 7,5 г вещества образуется 11 г оксида углерода ( IV ) и 4,5 г воды. Плотность паров этого вещества по водороду равна 14 Определите молекулярную формулу данного вещества.
Просмотр содержимого документа
«10.1»
Цели. Научиться экспериментально доказывать качественный состав углеводородов и их галогенопроизводных, обосновывать данные эксперимента.
Оборудование и реактивы . Шпатели (2 шт.), кусочек ваты, U- и Г-образные газоотводные трубки, газоотводная трубка-капилляр, спиртовка, спички, штатив железный с лотком, широкогорлая пробирка, пипетка, промывочная склянка, штатив с пробирками, щипцы тигельные, фильтровальная бумага, фарфоровая чашка, синее стекло (Со), санитарная склянка, стакан на 50 мл; лакмусовая бумага (фиолет.), С2Н5ОН (3–4 мл), известковая вода Са(ОН)2 или баритовая вода Ba(OH)2, парафин (измельченный), сахароза С12Н22О11, CuO (порошок), CuSO4 (безвод.), HNO3 (конц.), хлороформ СНСl3 или четыреххлористый углерод CCl4, Na металлический (2–3 горошины, свежеочищенный), AgNO3 (р-р, 

Реакция Степанова . Наличие галогена определяют путем восстановления соединения галогена водородом (атомарным, в момент выделения). Галоген отщепляется в виде галогеноводорода, обнаруживаемого реакцией с нитратом серебра(I) по белому творожистому осадку AgCl, нерастворимому в кислотах. Водород получают действием металлического Na на спирт.
Наблюдения и выводы
1. В пробирке смешать (1:3) немного сахара С12Н22О11 с оксидом меди(II), засыпав оксидом смесь и сверху.
2. В верхнюю часть пробирки (под пробку) поместить комок ваты, на которую насыпать немного безводной сернокислой меди(II).
Доказать опытным путем, что в составе выданного органического вещества имеются углерод и водород. Назвать признаки наблюдаемых химических реакций.
3. Пробирку закрыть пробкой с газоотводной трубкой, конец которой должен быть в сборнике над уровнем известковой воды. Нагревать сначала всю пробирку, затем смесь. Наблюдать
Написать уравнения протекающих реакций. Дополнительно написать уравнения реакций сжигания с CuO веществ
а) CCl4;
б) глюкозы С6Н12О6;
в) глицерина С3Н8О3
Медную проволоку, взятую щипцами, прокалить в пламени горелки для образования на ее поверхности слоя оксида меди(II). Если пламя окрашивается в сине-зеленый цвет, то нагрев вести до исчезновения этой окраски. После охлаждения смочить кончик проволоки в испытываемом веществе CCl4 и ввести в несветящееся пламя
Доказать опытным путем наличие в составе четыреххлористого углерода атомов галогена. Доказательство провести двумя способами. Объяснить результаты эксперимента, записать уравнения реакций распознавания
Демонстрационный опыт. В 2–3 мл С2Н5ОН (обезвоженного безводным CuSO4) растворить несколько капель (крупинок) испытываемого вещества и добавить кусочек металлического Na (горошину). По окончании выделения водорода, убедившись в полном растворении натрия, смесь разбавить равным объемом воды, подкислить концентрированным раствором HNO3 и прилить 1%-й раствор нитрата серебра(I)
Просмотр содержимого документа
«10kachreakzii»
Качественные реакции в органической химии» (10 класс)
Цель урока: обобщить знания учащихся по распознаванию органических веществ с помощью качественных реакций, уметь решать экспериментальные задачи.
Оборудование: учебное электронное издание «Органическая химия», (лаборатория систем мультимедиа ), карточки с индивидуальными заданиями по распознаванию органических веществ.
Тип урока: обобщение и проверка знаний учащихся по данной теме.
Форма проведения урока: урок проводится два академических часа по 45 минут: на первом уроке просматривается диск и записываются уравнения реакций, с помощью которых можно распознать органические вещества, на втором уроке решаются экспериментальные задачи, в течении последних 15 минут урока учащиеся выполняют
Учитель: Сегодня на уроке мы вспомним все качественные реакции, которые изучали в этом учебном году, научимся решать экспериментальные задачи. Поможет нам вспомнить и закрепить знания учебное электронное пособие «Органическая химия». Вы должны будете посмотреть и записать уравнения реакций, чтобы затем решать задачи.
I . Просмотр диска и запись уравнений реакций. (Первый урок)
1. Непредельные углеводороды.
1. Обесцвечивание бромной воды при пропускании через неё этилена. ( Тема «Алкены», раздел «Химические свойства», слайд 4.)
2.Обесцвечивание перманганата калия в водной и кислой среде при пропускании через неё алкена. (Тема «Алкены», раздел «Химические свойства», слайды 11, 12, 13.)
3.Окисление алкинов и получение ацетилена. ( Тема «Алкины», раздел «Окисление алкинов», слайды 1 и 8.)
2. Кислородосодержащие органические вещества.
1.Взаимодействие одноатомных предельных спиртов с натрием и окисление спиртов. ( Уравнения записывают ученики самостоятельно.)
2. Внутримолекулярная дегидратация одноатомных спиртов — получение алкенов. ( Тема «Спирты», раздел «Химические свойства спиртов», слайд 17.)
3. Многоатомные спирты. ( Тема «Полиолы», слайды 2 и 4.)
4. Качественные реакции на фенол — взаимодействие с бромной водой и хлоридом железа ( III ). ( Тема «Фенол», слайды 2 и 4 .)
5. Окисление альдегидов. Реакции «серебряного и медного зеркала». ( Тема «Альдегиды», раздел «Химические свойства альдегидов», слайды 12, 13, 14, 15.)
6. Распознавания предельных одноосновных карбоновых кислот. Реакции на индикаторы, взаимодействие с карбонатами и хлоридом железа ( III ). ( Тема «Карбоновые кислоты», раздел «Химические свойства», слайды 2, 3, 4.)
7. Качественные реакции на муравьиную кислоту. Обесцвечивание перманганата калия в кислой среде и реакция «серебряного зеркала». ( Раздел «Муравьиная кислота», слайд 2.)
8. Распознавание высших непредельных карбоновых кислот и раствора мыла (стеарата натрия) — обесцвечивание бромной воды олеиновой кислотой и выпадение в осадок стеариновой кислоты при действии на мыло минеральной кислоты. ( Уравнения ученики записывают самостоятельно.)
9. Распознавание глюкозы. Реакции с гидроксидом меди ( II ), реакции «серебряного и медного зеркала». ( Уравнения записываются самостоятельно.)
10. Действие раствора йода на крахмал. ( Тема «Углеводы», раздел «Крахмал», слайд 6.)
3. Азотосодержащие органические соединения.
1. Распознавание первичных и вторичных аминов. ( Тема «Амины», раздел «Химические свойства», слайд 7.)
2. Обесцвечивание бромной воды анилином. ( Тема «Амины», раздел «Получение и свойства аминов», слайд 9.)
3. Качественные реакции на аминокислоты. ( Тема «Аминокислоты», раздел «Физические и химические свойства», слайд 6.)
4. Цветные реакции белков. ( Тема «Белки», раздел «Свойства белков», слайды 21 и 22 .)
II . Решение экспериментальных задач. (30 минут второго урока)
Для решения задач используется материал учебника О. С. Габриеляна «Органическая химия» 10 класс, с.293-294. (Практическая работа № 8.) Для решения задач мало знать качественные реакции, необходимо определить ход распознавания.
III . Проверочная работа учащихся. (15 минут второго урока)
Работа поводиться по карточкам, содержащих 4 варианта заданий. Необходимо написать ход определения веществ и уравнения качественных реакций.
1 вариант. Распознать растворы крахмала, формальдегида, мыла и глюкозы.
2 вариант. Распознать растворы глицерина, гексена, уксусной кислоты и белка.
3 вариант. Распознать растворы ацетальдегида, этанола, фенола и этиленгликоля.
4 вариант. Распознать растворы муравьиной кислоты, уксусной кислоты, крахмала и анилина.
Учитель: Качественный анализ веществ — важная тема при изучении органической химии. Знание её помогает в работе не только химикам, но и медикам, экологам, биологам, эпидемиологам, фармацевтам, работникам пищевой промышленности. Надеюсь, что эти знания помогут вам и в повседневной жизни.
Просмотр содержимого документа
«11-12 урок»
Урок 11-12 10 класс
Тема. «Алкены: строение, изомерия и номенклатура».
Цель: продолжить формирование понятий об углеводородах с целью выяснения влияния электронного строения алкенов на появление большого числа изомеров у данного класса веществ.
Задачи: образовательные: способствовать формированию у учащихся понятий о химическом и электронном строении, о гомологическом ряде, изомерии и номенклатуре алкенов; развивающие: продолжить развивать понятие о строении вещества, об изомерии и ее видах; продолжить развивать умения давать названия органическим соединениям по номенклатуре ИЮПАК и строить формулы веществ по названию; работать с тестами; продолжить развивать умения сравнивать строение и виды изомерии алканов и алкенов; воспитательные: продолжить воспитание познавательного интереса к науке.
Методы: словесные (объяснение, рассказ, беседа);
наглядные (демонстрация таблиц, шоростержневых моделей молекул).
Тип урока: изучение нового материала.
Оборудование: таблицы «Строение молекулы этилена», «Строение атома углерода», «Номенклатура алкенов»; ключи к тестам и графическому диктанту; шаростержневые модели молекул гексана, этена, бутена-2 (цис- и транс).
Вступительное слово учителя
— Урок начинается поэтическими строками.
Нам каждый день природа дарит
Прикосновенье к алтарю.
За жизнь – космический подарок –
Тебя, Земля, благодарю.
Все – север, юг, зима и лето,
Дорога, труд, любовь, стихи,
Сплетение души и мысли,
Провалы, взлеты вверх и вниз…
Какой же смысл – в исканье смысла?
Процесс познанья – в этом смысл.
И вот сегодня, как и на других уроках мы будем познавать новое. А познаем мы для того, чтобы уметь применять свои знания в жизни.
По теории Бутлерова, свойства веществ зависят от их строения.
Тема сегодняшнего урока – «Алкены: строение, изомерия и номенклатура».
А на последующих уроках мы изучим их свойства и применение.
Сообщение задач урока.
Проверка пройденного материала.
1. Двое учащихся работают у доски: 1-й учащийся – осуществляет цепочку превращений; 2-й ученик – записывает условия протекания реакций в данной цепочке. Остальные учащиеся выполняют задание в тетради.
Осуществить цепочку превращений по следующей схеме:
Этан → Бромэтан → н-Бутан → Изобутан → Оксид углерода (IV).
При необходимости укажите условия протекания реакций.
2. Разноуровневый тестовый контроль.
Учащиеся самостоятельно выбирают уровень сложности задания.
Уровень А (задание на «4»)
Вещества с общей формулой СnН2n+2 относятся к классу:
А. Алканов. Б. Алкенов.
А. Метан и хлорметан. Б. Этан и пропан.
Пи – связь отсутствует в молекуле:
А. Этана. Б. Этена.
Для алканов характерны реакции:
А. Замещения. Б. Присоединения.
Определите тип реакции:

А. Гидрогалагенирование. Б. Гидрирование.
Перегонка нефти производится с целью получения:
А. Только бензина и метана. Б. Различных нефтепродуктов.
Уровень Б (задания на «5»)
Гомологами пентана являются:
Промышленным процессом переработки каменного угля является:
А. Ректификация. В. Коксование.
Б. Электролиз. Г. Крекинг.
2,3-диметилбутан имеет молекулярную формулу:
Все атомы углерода находятся в sp 3 — гибридном состоянии в:
А. Аренах. Б. Алканах. В. Алкенах. Г. Алкинах.
Допишите уравнение реакции и определите ее тип:
А. Гидратация. В. Гидрирование.
Б. Гидролиз. Г. Окисление.
Молекулярная формула органического вещества, содержащего 52,17% углерода, 13, 04% водорода, 34,78% кислорода, имеющего плотность паров по водороду 23, — это:
Ключ. Уровень А: 1.А. 2. Б. 3. А. 4.А. 5. Б. 6. Б.
6 баллов – «4», 5 баллов – «3».
Уровень Б: 1. А. 2. В. 3. В. 4. Б 5. Б. 6. Б.
7 баллов – «5», 6 баллов — «4», 5 баллов – «3»
Учащиеся проверяют тестовые задания по ключу и самостоятельно выставляют себе оценки.
3. Актуализация знаний.
Почему алканы относятся к предельным углеводородам?
Какие связи образуются между атомами в молекулах алканов?
Какие типы гибридизации характерны для атомов углерода в алканах?
Какие еще типы гибридизации атомов углерода существуют?
Изучение нового материала.
Понятие о непредельных углеводородах.
Электронное и пространственное строение этилена.
Гомологический ряд алкенов.
? -Чем отличаются предельные углеводороды от непредельных?
Какие непредельные углеводороды вам известны?
1. Понятие о непредельных углеводородах.
— Самостоятельная работа по учебнику с. (2 мин)
? 1- какие углеводороды можно отнести к непредельным?
2 – что означает термин непредельные углеводороды?
3 – назовите простейший представитель непредельных углеводородов класса алкены.
«Впервые этилен был получен в 1669 году немецким химиком Иоганом Иохимом Бехером нагреванием этилового спирта с концентрированной серной кислотой. Современники не смогли по достоинству оценить открытие ученого. Ведь Бехер не только синтезировал новый углеводород, но и впервые применил химический катализатор (серная кислота) в процессе реакции. До этого в научной практике и повседневной жизни применялись только биологические катализаторы природного происхождения – ферменты.
Этилен более 100 лет после его открытия не имел собственного названия. В конце 18 века выяснилось, что при взаимодействии с хлором «газ Бехера» превращается в маслянистую жидкость, после чего его назвали олефином, что значит рождающий масло. Затем это название распространилось на все углеводороды, которые имели подобное этилену строение».
? Дайте определение классу алкены.
Алкены (олефины) – ациклические углеводороды, содержащие в молекуле, помимо одинарных связей, одну двойную связь между атомами углерода и соответствующие общей формуле СnН2n .
2. Электронное и пространственное строение этилена.
Демонстрация шаростержневых моделей молекул гексана и этилена
— Объяснение по таблице.
В молекуле этилена СН2 = СН2 оба атома углерода, связанные двойной связью, находятся в состоянии sp 2 – гибридизации. То есть в гибридизации участвует 1 s -облако и 2 p -облака (в отличие от этана у которого в гибридизации участвуют 1 s -облако и 3 p -облака), и по одному p -облаку у каждого атома углерода остаются негибридизованными.
Оси sp 2 — орбиталей лежат в одной плоскости (в отличие от алканов, в которых атом углерода имеет объемную форму — тетраэдр).
Угол между ними составляет 120 0 (в алканах 109 0 28 / ).
Длина двойной связи меньше одинарной и составляет 0,133 нм (у алканов l =0,154 нм).
Из-за наличия двойной связи свободное вращение относительно связи С=С невозможно (тогда как у алканов возможно свободное вращение вокруг одинарной связи).
3. Гомологический ряд алкенов.
? — Какие вещества называются гомологами?
— Запишите структурные формулы гомологов этилена и дайте им название.
этен пропен бутен-1
4. Изомерия алкенов.
? – Какие виды изомерии характерны для алканов?
— Как вы думаете, а какие виды изомерии возможны у алкенов?
И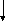


Углеродного Положения Межклассовая Геометрическая
скелета двойной (с циклоалканами) (цис- и транс-)
С

С

2-метилпропен циклобутан цис-бутен -2 транс-бутен –2
Схема вычерчивается на доске в ходе объяснения, учащиеся записывают в тетрадь.
! Физкультминутка: выполняются упражнения для мышц глаз, головы, плеча, кистей.
5. Номенклатура алкенов.
Объяснение по таблице «Номенклатура алкенов».
Номенклатура алкенов, разработанная ИЮПАК, схожа с номенклатурой алканов.
Правила составления названий алкенов.
1. Выбор главной цепи. В случае алкенов самая длинная цепочка атомов углерода должна содержать двойную связь.
Просмотр содержимого документа
«12 урок»
Тема. Электронное и пространственное строение алкенов, гомологический ряд алкенов. Алкены: строение, изомерия и номенклатура».
Цель: продолжить формирование понятий об углеводородах с целью выяснения влияния электронного строения алкенов на появление большого числа изомеров у данного класса веществ.
Задачи: образовательные: способствовать формированию у учащихся понятий о химическом и электронном строении, о гомологическом ряде, изомерии и номенклатуре алкенов;
развивающие: продолжить развивать понятие о строении вещества, об изомерии и ее видах; продолжить развивать умения давать названия органическим соединениям по номенклатуре ИЮПАК и строить формулы веществ по названию; работать с тестами; продолжить развивать умения сравнивать строение и виды изомерии алканов и алкенов;
воспитательные: продолжить воспитание познавательного интереса к науке.
Методы: словесные (объяснение, рассказ, беседа);наглядные (демонстрация таблиц, шоростержневых моделей молекул).
Тип урока: изучение нового материала.
Оборудование: таблицы «Строение молекулы этилена», «Строение атома углерода», «Номенклатура алкенов»; ключи к тестам и графическому диктанту; шаростержневые модели молекул гексана, этена, бутена-2 (цис- и транс).
Сообщение задач урока.
Проверка пройденного материала.
1. Двое учащихся работают у доски: 1-й учащийся – осуществляет цепочку превращений; 2-й ученик – записывает условия протекания реакций в данной цепочке. Остальные учащиеся выполняют задание в тетради.
Осуществить цепочку превращений по следующей схеме:
Этан → Бромэтан → н-Бутан → Изобутан → Оксид углерода (IV).
При необходимости укажите условия протекания реакций.
2. Разноуровневый тестовый контроль.
Учащиеся самостоятельно выбирают уровень сложности задания.
Уровень А (задание на «4»)
Вещества с общей формулой СnН2n+2 относятся к классу:
А. Алканов. Б. Алкенов.
А. Метан и хлорметан. Б. Этан и пропан.
Пи – связь отсутствует в молекуле:
А. Этана. Б. Этена.
Для алканов характерны реакции:
А. Замещения. Б. Присоединения.
Определите тип реакции:

А. Гидрогалагенирование. Б. Гидрирование.
Перегонка нефти производится с целью получения:
А. Только бензина и метана. Б. Различных нефтепродуктов.
Изучение нового материала.
Понятие о непредельных углеводородах.
Электронное и пространственное строение этилена.
Гомологический ряд алкенов.
? -Чем отличаются предельные углеводороды от непредельных?
Какие непредельные углеводороды вам известны?
1. Понятие о непредельных углеводородах.
Алкены
Алкены (непредельные углеводороды, этиленовые углеводороды, олефины) – непредельные алифатические углеводороды, молекулы которых содержат двойную связь. Общая формула ряда алкенов СnН2n.
По систематической номенклатуре названия алкенов производят от названий соответствующих алканов (с тем же числом атомов углерода) путем замены суффикса – ан на – ен: этан (CH3—CH3) – этен (CH2=CH2) и т. д. Главная цепь выбирается таким образом, чтобы она обязательно включала в себя двойную связь. Нумерацию углеродных атомов начинают с ближнего к двойной связи конца цепи.
В молекуле алкена ненасыщенные атомы углерода находятся в sp 2 -гибридизации, а двойная связь между ними образована σ– и π-связью. sp 2 -Гибридные орбитали направлены друг к другу под углом 120°, и одна негибридизованная 2р-орбиталь, расположена под углом 90° к плоскости гибридных атомных орбиталей.
Пространственное строение этилена:
Длина связи С=С 0,134 нм, энергия связи С=С Ес=с = 611 кДж/моль, энергия π-связи Еπ = 260 кДж/моль.
Виды изомерии: а) изомерия цепи; б) изомерия положения двойной связи; в) Z, Е (cis, trans) – изомерия, вид пространственной изомерии.
Способы получения алкенов
3. (дегидрогалогенирование алкилгалогенидов по правилу Зайцева)
4. CH2Cl—CH2Cl + Zn → ZnCl2 + CH2=CH2 (дегалогенирование дигалогенопроизводных)
Химические свойства алкенов
Для алкенов наиболее характерны реакции присоединения, они легко окисляются и полимеризуются.
(присоединение галогенов, качественная реакция)
2. (присоединение галогеноводородов по правилу Марковникова)
5. ЗCH2=CH2 + 2КMnO4 + 4Н2O → ЗCH2OH—CH2OH + 2MnO2↓ + 2KOH (мягкое окисление, качественная реакция)
10. CH3—CH=CH2 + HBr →перекись→ CH3—CH2—CH2Br (присоединение бро-моводорода против правила Марковникова)
11. (реакция замещения в α-положение)
Просмотр содержимого документа
«12.1 урок»
12 урок 10 класс
Цель: продолжить формирование понятий об углеводородах с целью выяснения влияния электронного строения алкенов на появление большого числа изомеров у данного класса веществ.
образовательные: способствовать формированию у учащихся понятий о химическом и электронном строении, о гомологическом ряде, изомерии и номенклатуре алкенов;
развивающие: продолжить развивать понятие о строении вещества, об изомерии и ее видах;
продолжить развивать умения давать названия органическим соединениям по номенклатуре ИЮПАК и строить формулы веществ по названию; работать с тестами; продолжить развивать умения сравнивать строение и виды изомерии алканов и алкенов;
воспитательные: продолжить воспитание познавательного интереса к науке.
Методы: словесные (объяснение, рассказ, беседа); наглядные (демонстрация таблиц, шоростержневых моделей молекул).
Тип урока: изучение нового материала.
Оборудование: таблицы «Строение молекулы этилена», «Строение атома углерода», «Номенклатура алкенов»; ключи к тестам и графическому диктанту; шаростержневые модели молекул гексана, этена, бутена-2 (цис- и транс).
Вступительное слово учителя — Урок начинается поэтическими строками.
Нам каждый день природа дарит
Прикосновенье к алтарю.
За жизнь – космический подарок –
Тебя, Земля, благодарю.
Все – север, юг, зима и лето,
Дорога, труд, любовь, стихи,
Сплетение души и мысли,
Провалы, взлеты вверх и вниз…
Какой же смысл – в исканье смысла?
Процесс познанья – в этом смысл.
И вот сегодня, как и на других уроках мы будем познавать новое. А познаем мы для того, чтобы уметь применять свои знания в жизни. По теории Бутлерова, свойства веществ зависят от их строения.
Тема сегодняшнего урока – «Алкены: строение, изомерия и номенклатура».
А на последующих уроках мы изучим их свойства и применение.
Сообщение задач урока.
Проверка пройденного материала.
1. Двое учащихся работают у доски: 1-й учащийся – осуществляет цепочку превращений; 2-й ученик записывает условия протекания реакций в данной цепочке. Остальные учащиеся выполняют задание в тетради.
Задание. Осуществить цепочку превращений по следующей схеме:
Этан → Бромэтан → н-Бутан → Изобутан → Оксид углерода (IV).
Изучение нового материала.
Гомологический ряд алкенов.
1 . Гомологический ряд алкенов.
? — Какие вещества называются гомологами?
— Запишите структурные формулы гомологов этилена и дайте им название.
этен пропен бутен-1
? – Какие виды изомерии характерны для алканов?
— Как вы думаете, а какие виды изомерии возможны у алкенов?
И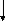


Углеродного Положения Межклассовая Геометрическая
скелета двойной (с циклоалканами) (цис- и транс-)
С

С

2-метилпропен циклобутан цис-бутен -2 транс-бутен –2
Схема вычерчивается на доске в ходе объяснения, учащиеся записывают в тетрадь.
! Физкультминутка: выполняются упражнения для мышц глаз, головы, плеча, кистей.
3 . Номенклатура алкенов.
Объяснение по таблице «Номенклатура алкенов».
Номенклатура алкенов, разработанная ИЮПАК, схожа с номенклатурой алканов.
Правила составления названий алкенов.
Выбор главной цепи. В случае алкенов самая длинная цепочка атомов углерода должна содержать двойную связь.
Просмотр содержимого документа
«13 урок»
«___»_____________2011г. Урок 13
Тема урока: Алкены. Получение, химические свойства и применение алкенов.
Цели и задачи урока:
рассмотреть конкретные химические свойства этилена и общие свойства алкенов;
углубить и конкретизировать понятия о пи-связи, о механизмах химических реакций;
дать первоначальные представления о реакциях полимеризации и строении полимеров;
разобрать лабораторные и общие промышленные способы получения алкенов;
продолжить формирование умения работать с учебником.
Оборудование: прибор для получения газов, раствор КМnO4, этиловый спирт, концентрированная серная кислота, спички, спиртовка, песок, таблицы «Строение молекулы этилена», «Основные химические свойства алкенов», демонстрационные образцы «Полимеры».
I. Организационный момент
Мы продолжаем изучение гомологического ряда алкенов. Сегодня нам предстоит рассмотреть способы получения, химические свойства и применение алкенов. Мы должны охарактеризовать химические свойства, обусловленные двойной связью, получить первоначальные представления о реакциях полимеризации, рассмотреть лабораторные и промышленные способы получения алкенов.
II. Активизация знаний учащихся
Какие углеводороды называются алкенами?
Каковы особенности их строения?
В каком гибридном состоянии находятся атомы углерода, образующие двойную связь в молекуле алкена?
Итог: алкены отличаются от алканов наличием в молекулах одной двойной связи, которая обуславливает особенности химических свойств алкенов, способов их получения и применения.
III. Изучение нового материала
1. Способы получения алкенов
Составить уравнения реакций, подтверждающих способы получения алкенов
– крекинг алканов C8H18 –– C4H8 + C4H10; (термический крекинг при 400-700 o С)
октан бутен бутан
– дегидрирование алканов C4H10 –– C4H8 + H2; (t, Ni)
бутан бутен водород
– дегидрогалогенирование галогеналканов C4H9Cl + KOH –– C4H8 + KCl + H2O;
хлорбутан гидроксид бутен хлорид вода
калия калия
– дегидрогалогенирование дигалогеналканов
– дегидратация спиртов С2Н5ОН –– С2Н4 + Н2О (при нагревании в присутствии концентрированной серной кислоты)
Запомните! При реакиях дегидрирования, дегидратации, дегидрогалогенирования и дегалогенирования нужно помнить, что водород преимущественно отрывается от менее гидрогенизированных атомов углерода (правило Зайцева, 1875 г.)
2. Химические свойства алкенов
Характер углерод – углеродной связи определяет тип химических реакций, в которые вступают органические вещества. Наличие в молекулах этиленовых углеводородов двойной углерод – углеродной связи обуславливает следующие особенности этих соединений:
– наличие двойной связи позволяет отнести алкены к ненасыщенным соединениям. Превращение их в насыщенные возможно только в результате реакций присоединения, что является основной чертой химического поведения олефинов;
– двойная связь представляет собой значительную концентрацию электронной плотности, поэтому реакции присоединения носят электрофильный характер;
– двойная связь состоит из одной 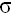
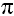
Уравнения реакций, характеризующих химические свойства алкенов
а) Реакции присоединения
Запомните! Реакции замещения свойственны алканам и высшим циклоалканам, имеющим только одинарные связи, реакции присоединения – алкенам, диенам и алкинам, имеющим двойные и тройные связи.
Запомни! Возможны следующие механизмы разрыва 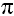
а) если алкены и реагент – неполярные соединения, то 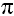
б) если алкен и реагент – полярные соединения, то разрыв 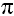
в) при соединении по месту разрыва 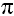
– реакция полимеризации nCH2 = CH2 –– n – CH2 – CH2 –– (– CH2 – CH2 –)n
этен полиэтилен
б) реакция окисления
Лабораторный опыт. Получить этилен и изучить его свойства ( инструкция на столах учащихся)
Инструкция по получению этилена и опытов с ним
1. Поместите в пробирку 2 мл концентрированной серной кислоты, 1 мл спирта и небольшое количество песка.
2. Закройте пробирку пробкой с газоотводной трубкой и нагрейте в пламени спиртовки.
3. Выделяющийся газ пропустите через раствор с перманганатом калия. Обратите внимание на изменение цвета раствора.
4. Подожгите газ у конца газоотводной трубки. Обратите внимание на цвет пламени.
– алкены горят светящимся пламенем. (Почему?)
C2H4 + 3O2 –– 2CO2 + 2H2O (при полном окислении продуктами реакции являются углекислый газ и вода)
Качественная реакция: «мягкое окисление (в водном растворе)»
– алкены обесцвечивают раствор перманганата калия (реакция Вагнера)
При более жёстких условиях в кислой среде продуктами реакции могут быть карбоновые кислоты, например (в присутствии кислот):
CH 3 – CH = CH 2 + 4 [O] –– CH 3 COOH + HCOOH
1. Непредельные углеводороды активно вступают в реакции присоединения.
2. Реакционная активность алкенов связана с тем, что 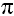
3. В результате присоединения происходит переход атомов углерода из sp 2 – в sp 3 — гибридное состояние. Продукт реакции имеет предельный характер.
4. При нагревании этилена, пропилена и других алкенов под давление или в присутствии катализатора их отдельные молекулы соединяются в длинные цепочки – полимеры. Полимеры (полиэтилен, полипропилен) имеют большое практическое значение.
3. Применение алкенов (сообщение учащегося по следующему плану).
1 – получение горючего с высоким октановым числом;
2 – пластмасс;
3 – взрывчатых веществ;
4 – антифризов;
5 – растворителей;
6 – для ускорения созревания плодов;
7 – получение ацетальдегида;
8 – синтетического каучука.
III. Закрепление изученного материала
Домашнее задание: §§ 15, 16, упр. 1, 2, 3 стр. 90, упр. 4, 5 стр. 95.
Просмотр содержимого документа
«14 урок»
«___»_____________2011г. Урок 1 4
Тема урока: Получение алкенов и их применение Алкены. Получение, химические свойства и применение алкенов.
Цели и задачи урока:
рассмотреть конкретные химические свойства этилена и общие свойства алкенов;
углубить и конкретизировать понятия о пи-связи, о механизмах химических реакций;
дать первоначальные представления о реакциях полимеризации и строении полимеров;
разобрать лабораторные и общие промышленные способы получения алкенов;
продолжить формирование умения работать с учебником.
Оборудование: прибор для получения газов, раствор КМnO4, этиловый спирт, концентрированная серная кислота, спички, спиртовка, песок, таблицы «Строение молекулы этилена», «Основные химические свойства алкенов», демонстрационные образцы «Полимеры».
I. Организационный момент
Мы продолжаем изучение гомологического ряда алкенов. Сегодня нам предстоит рассмотреть способы получения, химические свойства и применение алкенов. Мы должны охарактеризовать химические свойства, обусловленные двойной связью, получить первоначальные представления о реакциях полимеризации, рассмотреть лабораторные и промышленные способы получения алкенов.
II. Активизация знаний учащихся
Какие углеводороды называются алкенами?
Каковы особенности их строения?
В каком гибридном состоянии находятся атомы углерода, образующие двойную связь в молекуле алкена?
Итог: алкены отличаются от алканов наличием в молекулах одной двойной связи, которая обуславливает особенности химических свойств алкенов, способов их получения и применения.
III. Изучение нового материала
1. Способы получения алкенов
Составить уравнения реакций, подтверждающих способы получения алкенов
– крекинг алканов C8H18 –– C4H8 + C4H10; (термический крекинг при 400-700 o С)
октан бутен бутан
– дегидрирование алканов C4H10 –– C4H8 + H2; (t, Ni)
бутан бутен водород
– дегидрогалогенирование галогеналканов C4H9Cl + KOH –– C4H8 + KCl + H2O;
хлорбутан гидроксид бутен хлорид вода
калия калия
– дегидрогалогенирование дигалогеналканов
– дегидратация спиртов С2Н5ОН –– С2Н4 + Н2О (при нагревании в присутствии концентрированной серной кислоты)
Запомните! При реакиях дегидрирования, дегидратации, дегидрогалогенирования и дегалогенирования нужно помнить, что водород преимущественно отрывается от менее гидрогенизированных атомов углерода (правило Зайцева, 1875 г.)
2. Химические свойства алкенов
Характер углерод – углеродной связи определяет тип химических реакций, в которые вступают органические вещества. Наличие в молекулах этиленовых углеводородов двойной углерод – углеродной связи обуславливает следующие особенности этих соединений:
– наличие двойной связи позволяет отнести алкены к ненасыщенным соединениям. Превращение их в насыщенные возможно только в результате реакций присоединения, что является основной чертой химического поведения олефинов;
– двойная связь представляет собой значительную концентрацию электронной плотности, поэтому реакции присоединения носят электрофильный характер;
– двойная связь состоит из одной 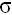
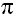
Уравнения реакций, характеризующих химические свойства алкенов
а) Реакции присоединения
Запомните! Реакции замещения свойственны алканам и высшим циклоалканам, имеющим только одинарные связи, реакции присоединения – алкенам, диенам и алкинам, имеющим двойные и тройные связи.
Запомни! Возможны следующие механизмы разрыва 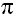
а) если алкены и реагент – неполярные соединения, то 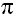
б) если алкен и реагент – полярные соединения, то разрыв 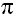
в) при соединении по месту разрыва 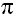
– реакция полимеризации nCH2 = CH2 –– n – CH2 – CH2 –– (– CH2 – CH2 –)n
этен полиэтилен
б) реакция окисления
Лабораторный опыт. Получить этилен и изучить его свойства ( инструкция на столах учащихся)
Инструкция по получению этилена и опытов с ним
1. Поместите в пробирку 2 мл концентрированной серной кислоты, 1 мл спирта и небольшое количество песка.
2. Закройте пробирку пробкой с газоотводной трубкой и нагрейте в пламени спиртовки.
3. Выделяющийся газ пропустите через раствор с перманганатом калия. Обратите внимание на изменение цвета раствора.
4. Подожгите газ у конца газоотводной трубки. Обратите внимание на цвет пламени.
– алкены горят светящимся пламенем. (Почему?)
C2H4 + 3O2 –– 2CO2 + 2H2O (при полном окислении продуктами реакции являются углекислый газ и вода)
Качественная реакция: «мягкое окисление (в водном растворе)»
– алкены обесцвечивают раствор перманганата калия (реакция Вагнера)
При более жёстких условиях в кислой среде продуктами реакции могут быть карбоновые кислоты, например (в присутствии кислот):
CH 3 – CH = CH 2 + 4 [O] –– CH 3 COOH + HCOOH
1. Непредельные углеводороды активно вступают в реакции присоединения.
2. Реакционная активность алкенов связана с тем, что 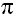
3. В результате присоединения происходит переход атомов углерода из sp 2 – в sp 3 — гибридное состояние. Продукт реакции имеет предельный характер.
4. При нагревании этилена, пропилена и других алкенов под давление или в присутствии катализатора их отдельные молекулы соединяются в длинные цепочки – полимеры. Полимеры (полиэтилен, полипропилен) имеют большое практическое значение.
3. Применение алкенов (сообщение учащегося по следующему плану).
1 – получение горючего с высоким октановым числом;
2 – пластмасс;
3 – взрывчатых веществ;
4 – антифризов;
5 – растворителей;
6 – для ускорения созревания плодов;
7 – получение ацетальдегида;
8 – синтетического каучука.
III. Закрепление изученного материала
Домашнее задание: §§ 15, 16, упр. 1, 2, 3 стр. 90, упр. 4, 5 стр. 95.
Просмотр содержимого документа
«15 урок»
23.10.2011г. Урок 15 10 класс
Урок на тему: Расчёты по химическим уравнениям, характеризующим свойства и способы получения алкенов, при условии, что одно из реагирующих веществ дано в избытке.
Цели: Научить учащихся составлять и решать химические задачи.
Тип урока: Комбинированный.
Ход урока
I. Организация класса
II. Актуализация знаний, умений и навыков
III. Изучение нового материала:
Металлический натрий массой 5,6 г добавили к 96% водному раствору этанола объемом 112,5 мл (0,8г/мл). Определите массовые доли веществ в растворе по окончании реакций.
Решение: т.к. условие задачи объемное, разбираем его на рисунке-схеме.
n ( Na )= m / M =5,6:23=0,24(моль).
по условию 0,24моль 0,2моль
2 Na + 2 H 2 O 2 NaOH + H 2
Как решать химические уравнения — схемы и примеры решения для разных реакций
Основные термины и понятия
Составление уравнений химических реакций невозможно без знания определённых обозначений, показывающих, как проходит реакция. Объединение атомов, имеющих одинаковый ядерный заряд, называют химическим элементом. Ядро атома состоит из протонов и нейтронов. Первые совпадают с числом атомного номера элемента, а значение вторых может варьироваться. Простейшими веществами называют элементы, состоящие из однотипных атомов.
Любой химический элемент описывается с помощью символов, условно обозначающих структуру веществ. Формулы являются неотъемлемой частью языка науки. Именно на их основе составляют уравнения и схемы. По своей сути они отражают количественный и качественный состав элементов. Например, запись HNO3 сообщает, что в соединении содержится одна молекула азотной кислоты, а оно само состоит из водорода, азота и кислорода. При этом в состав одного моля азотной кислоты входит по одному атому водорода и азота и 3 кислорода.
Символика элементов, условное обозначение, представляет собой химический язык. В значке содержится информация о названии, массовом числе и порядковом номере. Международное обозначение принято, согласно периодической таблице Менделеева, разработанной в начале 1870 года.
Взаимодействующие между собой вещества называются реагентами, а образующиеся в процессе реакции — продуктами. Составление и решение химических уравнений фактически сводится к определению результатов реакций, поэтому просто знать формулы веществ мало, нужно ещё уметь подбирать коэффициенты. Располагаются они перед формулой и указывают на количество молекул или атомов, принимающих участие в процессе. С правой стороны от химического вещества ставится индекс, указывающий место элемента в системе.
Записывают уравнения в виде цепочки, в которой указываются все стадии превращения вещества начиная с левой части. Вначале пишут формулы элементов в исходном состоянии, а затем последовательно их преобразование.
Виды химических реакций
Химические явления характеризуются тем, что из двух и более элементов образуются новые вещества. Уравнения описывают эти процессы. Впервые с объяснениями протекания реакций знакомят в восьмом классе средней образовательной школы на уроках неорганической химии. Ученикам демонстрируют опыты, в которых явно наблюдаются различия в протекании реакций.
Всего существует 4 типа химического взаимодействия веществ:
- Соединение. В реакцию могут вступать 2 простых вещества: металл и неметалл или неметалл и неметалл. Например, алюминий с серой образуют сульфид алюминия. Кислород, взаимодействуя с водородом, превращается в воду. Объединятся могут 2 оксида с растворимым основанием, как оксид кальция с водой: CaO + H2O = Ca (OH)2 или основной оксид с кислотным: CaO + SO3 = CaSO4.
- Разложение. Это процесс обратный реакции соединения: было одно вещество, а стало несколько. Например, при пропускании электрического тока через воду получается водород и кислород, а при нагревании известняка 2 оксида: CaCO3 = CaO + CO2.
- Замещение. В реакцию вступают 2 элемента. Один из них простой, а второй сложный. В итоге образуются 2 новых соединения, при котором атом простого вещества заменяет сложный, как бы вытесняя его. Условие протекания процесса: простое вещество должно быть более активным, чем сложное. Например, Zn + 2HCl = ZnCl2 + H2. Величину активности можно узнать из таблицы ряда электрохимических напряжений.
- Обмен. В этом случае между собой реагируют 2 сложных элемента, обменивающиеся своими составными частями. Условием осуществления такого типа реакции является обязательное образование воды, газа или осадка. Например, CuO + 2HCl = CuCl2 + H2O. Чтобы узнать, смогут ли вещества прореагировать, используют таблицу растворимости.
Основными признаками химических реакций является изменение цвета, выделение газа или образование осадка. Различают их по числу веществ, вступивших в реакцию и образовавшихся продуктов. Правильное определение типа реакции особо важно при составлении химических уравнений, а также определения свойств и возможностей веществ.
Окислительно-восстановительный процесс
Составление большинства реакций сводится к подбору коэффициентов. Но при этом могут возникнуть трудности с установлением равновесия, согласно закону сохранения массы веществ. Чаще всего такая ситуация возникает при решении заданий, связанных с расстановкой количества атомов в уравнениях окислительно-восстановительных процессов.
Под ними принято понимать превращения, протекающие с изменением степени окисления элементов. При окислении происходит процесс передачи атомом электронов, сопровождающийся приобретением им положительного заряда или ионом, после чего он становится нейтральным. При этом также происходит процесс восстановления, связанный с присоединением элементарных частиц атомом.
Для составления уравнений необходимо определить восстановитель, окислитель и число участвующих в реакции электронов. Коэффициенты же подбирают с помощью метода электронно-ионного баланса (полуреакций). Его суть состоит в установлении равенства путём уравнивания количества электронов, отдаваемых одним элементом и принимаемым другим.
Классический алгоритм
В основе решения задач этим методом — закон сохранения массы. Согласно ему, совокупная масса элементов до реакции и после остаётся неизменной. Другими словами, происходит перегруппировка частиц. Если рассматривать решение химического уравнения поэтапно, оно будет состоять из трёх шагов:
- Написания формул элементов, вступающих в реакцию с левой стороны.
- Указания справа формулы образующихся веществ.
- Уравнивания числа атомов с добавлением коэффициентов.
Перед тем как переходить к сложным соединениям, лучше всего потренироваться на простых. Например, нужно составить уравнение, описывающее взаимодействие двух сложных веществ: гидроксида натрия и серной кислоты. При таком соединении образуется сульфат натрия и вода.
Согласно алгоритму, в левой части уравнения необходимо записать реагенты, а в правой продукты реакции: NaOH + H2SO 4 → Na 2SO4 + H2O. Теперь следует уравнять коэффициенты. Начинают с первого элемента. В примере это натрий. В правой части содержится 2 его атома, а в левой один, поэтому необходимо возле реагента поставить цифру 2. Затем нужно уровнять водород. В результате получится выражение: 2 NaOH + H2SO 4 → Na2 SO4 +2H2O.
Ещё одним наглядным примером является процесс реакции тринитротолуола с кислородом. При их взаимодействии образуется: C7H5N3O6 + O2 → CO2 + H2O + N2. Исходя из того, что слева находится нечётное число атомов H и N, а справа чётное, нужно их уравнять: 2C7H5N3O6 + O2 → CO2 + H2O + N2.
Теперь становится понятным, что 14 и 10 атомов углерода и водорода должны образовать 14 долей диоксида и 5 молекул воды. При этом 6 атомов азота превратятся в 3. Итоговое уравнение будет выглядеть как 2C7H5N3O6 + 10,5O2 → 14CO2 + 5H2O + 3N2.
Перед тем как начинать тренировку по составлению уравнений, следует научиться расставлять валентность. Это параметр, равный числу соединившихся атомов каждого элемента. Фактически это способность к соединению. Например, в формуле NH3 валентность атома азота равна 3, а водорода 1.
Решение методом полуреакций
Алгоритм для решения примеров химических уравнений проще рассмотреть на конкретном задании. Пускай необходимо описать процесс окисления пирита азотной кислоты с малой концентрацией: FeS2 + HNO3. Решать этот пример необходимо в следующей последовательности:
- Определить продукты реакции. Так как кислота является сильным окислителем, сера получит максимальную степень оксидации S6+, а железо Fe3+. HNO3 может восстановиться до одного из двух состояний NO2 или NO.
- Исходя из состава ионов и правила, что вещества, переходящие в газовую форму или плохо растворимые, записываются в молекулярном виде, верным будет записать: FeS2 — Fe3+ + 2SO2−4. Гидролизом можно пренебречь.
- В записи уравнивают кислород. Для этого в левую часть добавляют 8 молекул воды, а в правую 16 ионов водорода: FeS2 + 8H20 — Fe3+ + 2SO2−4 + 16H+. Так как заряда в левой части нет, а в правой он равный +15, то серное железо должно будет отдать 15 электронов. Значит, уравнение примет вид: FeS2 + 8H20 — 15e → Fe3+ + 2SO2−4 + 16H+.
- Теперь переходят к реакции восстановления нитрата иона: NO-3 →NO. Для её составления нужно отнять у оксида азота 2 атома кислорода. Делают это путём прибавления к левой части 4 ионов водорода, а правой — 2 молекул воды. В итоге получится: NO-3 + 4H+ → NO + 2H2O.
- Полученную формулу уравнивают добавлением к левой части 3 электронов: NO-3 + 4H+ 3e → NO + 2H2O.
- Объединяют найденные выражения и записывают результат: FeS2 + 8H20 + 5NO-3 + 20H+ → Fe3+ + 2SO2−4 + 16H+ + 5NO + 10H2O.
Уравнение можно сократить на 16H + и 8H2O. В итоге получится сокращённое выражение окислительно-восстановительной реакции: FeS2 + 5NO — 3 + 4 H + = Fe3 + + 2SO 2- 4 + 5NO + 2H2O.
Такой алгоритм считается классическим, но для упрощения понимания лучше использовать способ электронного баланса. Процесс восстановления переписывают как N5+ + 3e → N2+. Степень же окисления составить сложнее. Сере нужно приписать степень 2+ и учесть, что на 1 атом железа приходится 2 атома серы: FeS2 → Fe3++ 2S6+. Запись общего баланса будет выглядеть: FeS2 + 5N5+ = Fe3+ + 2S6+ + 5N2+.
Пять молекул потратятся на окисление серного железа, а ещё 3 на образование Fe (NO3)3. После уравнения двух сторон запись реакции примет вид, аналогичный полученному с использованием предыдущего метода.
Использование онлайн-расчёта
Простые уравнения решать самостоятельно довольно просто. Но состоящие из сложных веществ могут вызвать трудности даже у опытных химиков. Чтобы получить точную формулу и не подбирать вручную коэффициенты, можно воспользоваться онлайн-калькуляторами. При этом их использовать сможет даже пользователь, не особо разбирающийся в науке.
Чтобы расстановка коэффициентов в химических уравнениях онлайн происходила автоматически, нужно лишь подключение к интернету и исходные данные. Система самостоятельно вычислит продукты реакции и уравняет обе стороны формулы. Интересной особенностью таких сайтов является не только быстрый и правильный расчёт, но и описание правил с алгоритмами, по которому выполняются действия.
После загрузки калькулятора в веб-обозревателе единственное, что требуется от пользователя — правильно ввести реагенты в специальные формы латинскими буквами и нажать кнопку «Уравнять». Иногда возникает ситуация, когда запись сделана верно, но коэффициенты не расставляются. Это происходит, если суммы в уравнении могут быть подсчитаны разными способами. Характерно это для реакций окисления. В таком случае нужно заменить фрагменты молекул на любой произвольный символ. Таким способом можно не только рассчитать непонятное уравнение, но и выполнить проверку своих вычислений.
Химические уравнения.
Химическое уравнение – это условное изображение химической реакции с помощью химических формул веществ, числовых коэффициентов и математических символов.
При записи химических уравнений должен строго соблюдаться закон сохранения массы: массы вступивших в реакцию веществ, равны массе продуктов реакции.
Химическая реакция – процесс, при котором вещества, обладающие определенным составом и свойствами, превращаются в другие вещества – с другим составом и свойствами. При этом в составе атомных ядер изменений не происходит.
Химические реакции всегда сопровождаются физическими эффектами – поглощением или выделением теплоты, изменениями агрегатного состояния и окраски веществ.
Пример составления химического уравнения:
слева 2 атома Fe – справа 1 атом Fe (множитель 2)
слева 3 атома O – справа 1 атом O (множитель 3)
Затем подбирается коэффициент для H2O:
слева 2 атома H – справа 2 атома H (множитель 1), но т.к. справа 3 атома O, то множитель для H2O получаем 3. Н в правой части уравнения имеет множитель 6, для равновесия Н, в левой части используем множитель 3.
Итоговое химическое уравнение:
Выпадение осадка в результате химической реакции обозначается в химическом уравнении стрелкой вниз ↓. Это означает, что соединение нерастворимо:
Выделение газа в результате химической реакции обозначается в химическом уравнении стрелкой вверх ↑.
Виды химических реакций.
Реакции соединения: хотя бы два элемента образуют один продукт:
Реакции разложения: вещество распадается на два или более простых элемента (соединения):
Реакция замещения: обязательно участвуют атомы какого-нибудь простого вещества, которые замещают атомы одного из элементов в сложном веществе:
Цинк заместил водород в его соединении с хлором (HCl). Водород при этом выделяется в виде газа.
Реакция обмена: реагенты и продукты реакции являются сложными веществами:
http://nauka.club/khimiya/khimicheskie-uravneniya.html
http://www.calc.ru/Khimicheskiye-Uravneniya.html