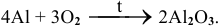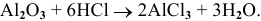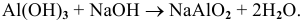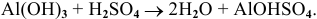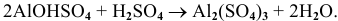Все уравнения по неорганической химии
1. Основные классы неорганических соединений
Оксиды – сложные вещества, состоящие из атомов кислорода в степени окисления -2 и атомов другого элемента.
Номенклатура: Fe2O3 – оксид железа(III), Cl2O – оксид хлора(I).
Несолеобразующие (безразличные) оксиды: CO, SiO, NO, N2O.
основные – оксиды металлов в степени окисления +1, +2,
амфотерные – оксиды металлов в степени окисления +2, +3, +4,
кислотные – оксиды металлов в степени окисления +5, +6, +7 и
оксиды неметаллов в степени окисления +1 – +7.
Горение простых веществ:
Горение (обжиг) сложных веществ:
Разложение сложных веществ:
Химические свойства оксидов
Основным оксидам (Na2O, CaO, CuO, FeO) соответствуют основания.
СаО + Н2O = Са(OH)2 (растворимы оксиды металлов IA– и IIА-групп, кроме Be, Mg)
CuO + Н2O ? (оксиды остальных металлов нерастворимы)
SO2 + Н2O = H2SO3 (кислотные оксиды, кроме SiO2, растворимы в воде)
Амфотерным оксидам (ZnO, Al2O3, Cr2O3, ВеО, РЬО) соответствуют амфотерные гидроксиды.
ZnO + H2O ? (амфотерные оксиды нерастворимы в воде)
ZnO + 2NaOH >t> Na2ZnO2 + Н2O (при нагревании или сплавлении)
ZnO + 2NaOH + H2O = Na2[Zn(OH)4] (в разбавленном растворе)
Основания – сложные вещества, состоящие из атомов металла и гидроксиль-ных групп; основания – электролиты, образующие при диссоциации в качестве анионов только анионы гидроксила.
Номенклатура: Fe(OH)3 – гидроксид железа(III).
– растворимые (щелочи) NaOH, KOH;
– однокислотные NaOH, KOH;
Получение нерастворимых и амфотер-ных оснований:
NaOH > Na + + OH? (? = 1, фенолфталеин – красный)
NaOH + HCl = NaCl + H2O (реакция нейтрализации)
Свойства нерастворимых оснований:
Fe(OH)2 — FeOH + + OH? (? + — Fe 2+ + OH? (? t> FeO + H2O
Свойства амфотерных оснований:
Кислоты – сложные вещества, состоящие из атомов водорода и кислотного остатка; кислоты – электролиты, образующие при диссоциации в качестве катионов только катионы водорода.
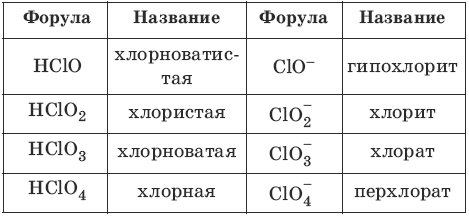
Номенклатура кислот и кислотных остатков:
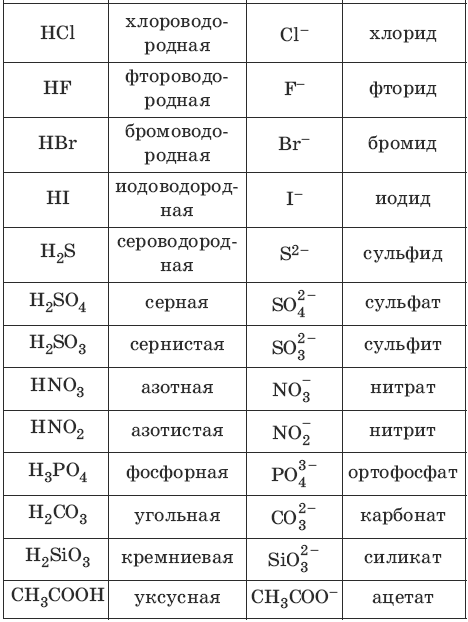
Химические свойства кислот
HCl > H + + CI? (? =1) (лакмус – красный)
HCO3? — H + + CO3 2- (? MgOH + + CI? (? = 1)
MgOH + — Mg 2+ + OH? (? Na + + Н + + SO4? (? = 1)
CuSO4 + Fe = Cu + FeSO4 (Fe до Cu в ряду напряжений)
Pb + ZnCl2 ? (Pb после Zn в ряду напряжений)
Разложение некоторых солей при нагревании
CaCO3 >t> CaO + CO2 (роме устойчивых карбонатов щелочных металлов)
2NaNO3 >t> 2NaNO2 + O2 (металл до Mg в ряду напряжений)
2Pb(NO3)2 >t> 2РbO + 4NO2 + O2 (металл от Mg до Cu в ряду напряжений)
2AgNO3 >t> 2Ag + 2NO2 + O2 (металл после Cu в ряду напряжений)
NH4Cl >t> NH3 + HCl (при охлаждении идет в противоположном направлении)
4KClO3 >400 °C> KCl + 3KClO4
Связь между классами соединений
Металл — основный оксид — основание — соль
Неметалл — кислотный оксид — кислота — соль
Атомы этих элементов имеют электронную формулу ns 1 . Они являются сильными восстановителями. Их активность растет от лития к цезию. Для них характерна степень окисления +1. В природе щелочные металлы находятся в виде хлоридов, сульфатов, карбонатов, силикатов и т. д.
Щелочные металлы мягкие, легко режутся ножом, на свежем срезе имеют серебристую окраску. Все они легкие и легкоплавкие металлы с хорошей электропроводностью. В парообразном состоянии атомы щелочных металлов образуют молекулы Э2, например Na2.
2.1. Получение и химические свойства щелочных металлов
2NaCl >электролиз расплава> 2Na + Cl2
KCl + Na >800?С> К + NaCl
Горение в кислороде
Реакции с другими неметаллами
Реакции с водой и разбавленными кислотами
2Na + 2HCl = 2NaCl + H2^
2.2. Получение и химические свойства соединений щелочных металлов
Оксиды. Оксиды щелочных металлов являются активными основными оксидами.
Гидроксиды. Гидроксиды щелочных металлов – растворимые основания, щелочи. Их степень диссоциации увеличивается от LiOH к CsOH.
NaOH > Na + + OH? (? ? 1)
Гидриды. Гидриды щелочных металлов – восстановители.
NaH + HCl = NaCl + H2
Пероксиды и надпероксиды. Являются окислителями.
Соли. Хорошо растворяются в воде. Соли лития окрашивают пламя горелки в карминово-красный цвет, соли натрия – в желтый цвет, соли калия – в светло-фиолетовый цвет. Соли щелочных металлов со слабыми кислотами гидролизуются, создавая щелочную среду.
Элементы IIА-группы имеют электронную формулу ns 2 . Все они являются металлами, сильными восстановителями, несколько менее активными, чем щелочные металлы. Для них характерна степень окисления +2 и валентность II. Щелочноземельные металлы: Са, Sr, Ba, Ra. В природе элементы IIА-группы находятся в виде солей: сульфатов, карбонатов, фосфатов, силикатов. Элементы IIА-группы представляют собой легкие серебристые металлы, более твердые, чем щелочные металлы.
3.1. Получение и химические свойства простых веществ
Элементы IIА-группы – менее активные восстановители, чем щелочные металлы. Их восстановительные свойства увеличиваются от бериллия к радию. Кислород воздуха окисляет Са, Sr, Ba, Ra при обычной температуре. Mg и Be покрыты оксидными пленками и окисляются кислородом только при нагревании:
3.2. Получение и химические свойства соединений
Оксид бериллия – амфотерный оксид. Оксид магния – нерастворимый основный оксид. Оксид кальция – растворимый основный оксид.
Гидроксид бериллия – амфотерное основание. Гидроксид магния – нерастворимое основание. Гидроксиды щелочноземельных металлов – щелочи.
Имеют восстановительные свойства.
Содержание ионов Са 2+ и Mg 2+ обуславливает жесткость воды: временную, если есть гидрокарбонаты Са и Mg, и постоянную, если в воде есть хлориды или сульфаты Са и Mg.
Элементы IIIА-группы имеют электронную формулу ns 2 np 1 . Они являются значительно менее активными восстановителями, чем щелочноземельные металлы. Для них характерна степень окисления +3 и валентность III. В группе сверху вниз возрастают металлические свойства элементов, увеличиваются восстановительные свойства их атомов. Увеличиваются основные свойства гидроксидов и уменьшаются их кислотные свойства.
Соединения Тl 3+ являются сильными окислителями и восстанавливаются до соединений Тl + .
4.1. Химические свойства бора и его соединений
4.2. Химические свойства алюминия и его соединений
4Al + 3O2 = 2Al2O3 (металл покрыт оксидной пленкой)
2Al + 6Н2O = 2Al(OH)3 + ЗН2 (без оксидной пленки)
Оксид алюминия – амфотерный оксид
Гидроксид алюминия – амфотерный гидроксид.
Соли алюминия гидролизуются. Некоторые из них (Al2S3, Al2(CO3)3) полностью разлагаются водой.
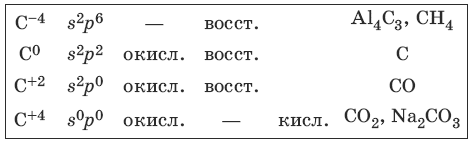
Элементы IVA-группы имеют электронную формулу ns 2 np 2 . Углерод и кремний являются неметаллами, германий, олово, свинец – металлами. Для элементов характерны степени окисления +4, +2, 0, -4 и валентность IV. В возбужденном состоянии атомы имеют конфигурацию ns 1 np s , в этом состоянии для них характерна sp 3 -гибридизация.
5.1. Свойства углерода и его соединений
Характерные степени окисления углерода, электронные формулы соответствующих ионов, химические свойства и примеры соединений приведены в таблице.
С + CuO >t> Cu + CO
Свойства оксида углерода (II) – угарного газа
CO + NaOH >t, p> HCOONa
Свойства оксида углерода(IV) – углекислого газа
Свойства карбонатов и гидрокарбонатов
5.2. Получение и свойства кремния и его соединений
SiH4 + 2O2 = SiO2 + 2Н2O (самовоспламенение на воздухе)
Кремниевая кислота и силикаты. Кремниевая кислота имеет полимерное строение и состав xSiO2 • yH2O. H2SiO3 – условная формула, такого соединения не выделено.
5.3. Получение и свойства соединений олова и свинца
Гидроксиды олова и свинца имеют амфо-терные свойства. При этом в степени окисления элемента +2 в гидроксидах преобладают основные свойства, а в степени окисления +4 – кислотные. Соединения Sn 2+ имеют восстановительные свойства, а соединения РЬ 4+ – окислительные:
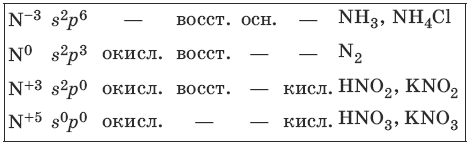
Элементы VA-группы имеют электронную формулу ns 2 np s . Азот, фосфор и мышьяк являются неметаллами, висмут и сурьма имеют металлические свойства. Наиболее характерные степени окисления: +5, +3, 0, -3. Оксиды Э2O5 имеют кислотные свойства, свойства оксидов Э2O3: кислотные – для N и Р, амфотерные – для As и Sb, основные – для Bi.
6.1. Получение и свойства азота и его соединений
Характерные степени окисления азота, соответствующие им электронные формулы, химические свойства и примеры соединений приведены в таблице.
HNO3(конц.) пассивирует на холоду Al, Fe, Cr.
2KNO3 >t> 2KNO2 + O2 (металлы до Mg в ряду напряжений)
2AgNO3 >t> 2Ag + 2NO2 + O2 (металлы после Cu в ряду напряжений)
6.2. Получение и свойства фосфора и его соединений
Простое вещество (Р4 – белый фосфор, Р – красный фосфор)
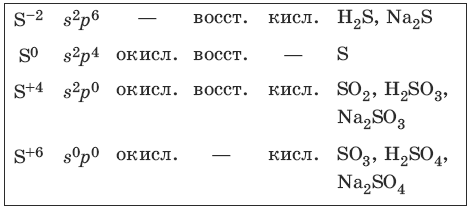
VIA-группу образуют четыре неметалла: кислород, сера, селен, теллур, называемые халькогенами, и радиоактивный металл полоний. Атомы элементов VIA-группы имеют электронную формулу ns 2 np 4 . Для них характерны степени окисления -2, 0, +4, +6. У атома кислорода отсутствуют 2d-орбитали, поэтому его валентность равна двум. Наличие d-орбиталей у атомов других элементов позволяет им иметь валентности два, четыре или шесть.
7.1. Кислород и его соединения
Кислород – самый распространенный элемент земной коры. Кислород представляет собой газ без цвета, без вкуса, без запаха. Возможные степени окисления кислорода, электронные формулы соответствующих ионов, химические свойства и примеры соединений приведены в таблице.
Получение и свойства кислорода
Кислород может быть получен при сжижении и разделении воздуха.
Получение и свойства озона O3
Свойства пероксида водорода
7.2. Сера и ее соединения
Характерные степени окисления серы, соответствующие им электронные формулы, химические свойства и примеры соединений приведены в таблице.
Чистая сера – хрупкое кристаллическое вещество желтого цвета. Сера имеет несколько модификаций: ромбоэдрическую и призматическую, также пластическую (аморфную). Аллотропия серы обусловлена различной структурой кристаллов, построенных из восьмиатомных молекул S8. В расплаве серы существуют молекулы S8, S6, в парах серы – молекулы S6, S4, S2.
Получение и свойства серы
Получение и свойства соединений серы (-2)
H2S — H + + HS? — 2H + + S 2-
Получение и свойства соединений серы (+4)
Получение и свойства соединений серы (+6)
Концентрированная серная кислота пассивирует на холоду Al, Fe, Cr.
Атомы галогенов, образующих VIIA-группу, имеют электронную конфигурацию ns 2 np 5 . Все галогены являются активными неметаллами, окислителями. Их активность уменьшается в ряду F > Cl > Br > I > At. Характерные степени окисления галогенов: -1, 0, +1, +3, +5, +7. Однако у фтора, наиболее активного неметалла, есть лишь степени окисления -1 и 0. F2 и Cl2 – газы, Br2 – жидкость, I2 – твердое вещество. С увеличением радиуса атомов галогенов растет объем их атомов и молекул, а также их поляризуемость. Это приводит к увеличению сил межмолекулярного взаимодействия (сил Ван дер Ваальса) и повышению температур плавления и кипения простых веществ.
HF, HCl, HBr, HI при растворении в воде образуют кислоты (HF – слабую, HCl, HBr и HI – сильные). В HF имеются сильные водородные связи. В ряду HCl – HBr – HI сила кислот несколько увеличивается в связи с увеличением поляризуемости молекул, пропорциональной их объему.
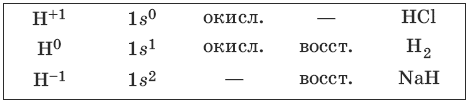
Электронная формула атома водорода 1s 1 . С галогенами его объединяет способность принимать один электрон и образовывать стабильную электронную оболочку 1s 2 . Поэтому часто водород располагают вместе с галогенами в VIIA-группе.
8.1. Водород и его соединения
Водород – наиболее распространенный элемент во Вселенной. Водород – легкий газ без цвета, без запаха. Возможные степени окисления водорода, электронные формулы соответствующих ионов, химические свойства и примеры соединений приведены в таблице.
Молекулы воды связаны водородными связями: nH2O = (Н2O)n, поэтому вода жидкая в отличии от ее газообразных аналогов H2S, H2Se и Н2Те.
Кислород в молекуле воды находится в состоянии sp 3 -гибридизации, две связи О—Н и две неподеленные пары кислорода располагаются тетраэдрически, угол между связями О—Н равен 104,5°, поэтому молекула воды полярная. Вода является хорошим растворителем для веществ с ионными или полярными связями.
8.3. Фтор и его соединения
Фтор является наиболее активным неметаллом, сильным окислителем.
8.4. Хлор и его соединения
Хлор – тяжелый газ желто-зеленого цвета, с резким запахом.
2NaCl + 2Н2O >электролиз раствора> Н2 + Cl2 + 2NaOH
Cl2 + Н2O = HCl + HClO (реакция диспропорционирования)
HClO = HCl + О (атомарный кислород – окислитель)
Смесь CaCl2 и Са(ClO)2 – хлорная, или белильная, известь.
KClO3 – хлорат калия, или бертолетова соль.
Сила кислот растет в ряду:
8.5. Бром, иод и их соединения
Бром – темно-бурая жидкость с резким запахом, а иод – кристаллическое вещество темного цвета. Изменение фазового состояния галогенов обусловлено увеличением межмолекулярного – дисперсионного взаимодействия, связанного с увеличением размеров и поляризуемости молекул галогенов в ряду хлор > бром > иод.
В атомах d-элементов (переходных элементов) заполняется электронами d-под-уровень предвнешнего уровня. На внешнем уровне атомы d-элеметов имеют, как правило, два s-электрона. Близость строения валентных уровней атомов переходных элементов определяет их общие свойства. Все они являются металлами, имеют высокую прочность, твердость, высокую электро– и теплопроводность. Многие из них электроположительны и растворяются в минеральных кислотах, однако среди них есть металлы, не взаимодействующие обычным способом с кислотами. Большинство переходных металлов имеют переменную валентность. Максимальная валентность, как и максимальная степень окисления, как правило, равно номеру группы, в которой находится данный элемент.
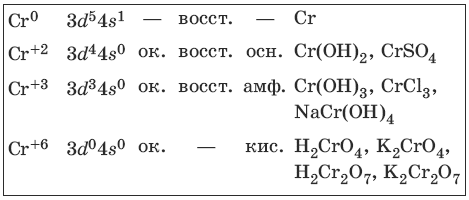
9.1. Хром и его соединения
Хром представляет собой ковкий тягучий металл серо-стального цвета. Электронная формула атома хрома 1s 2 2s 2 2p 6 3s 2 3p 6 3d 5 4s 1 .
Характерные степени окисления хрома, электронные формулы соответствующих ионов, химические свойства и примеры соединений приведены в таблице.
Получение и свойства хрома
FeO • Cr2O3 + 4CO >t> Fe + 2Cr + 4CO2 (Fe + 2Cr) – феррохром
Хром пассивируется на холоду концентрированными азотной и серной кислотами.
Свойства соединений хрома (+2) и хрома (+3)
Гидроксид хрома(II) сразу окисляется кислородом воздуха.
Свойства соединений хрома (+6)
Желтый раствор хромата калия устойчив в щелочной среде, оранжевый раствор дихромата калия – в кислой среде.
Дихромат калия – окислитель в кислой среде.
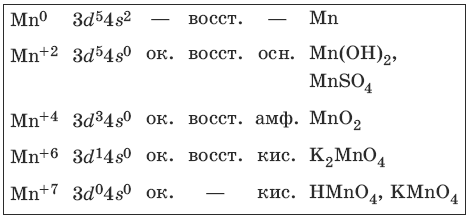
9.2. Марганец и его соединения
Марганец – серебристо-белый твердый и хрупкий металл. Характерные степени окисления марганца, электронные формулы соответствующих ионов, химические свойства и примеры соединений приведены в таблице.
Получение и свойства марганца
FeO • Mn2O3 + 4CO >t> Fe + 2Mn + 4CO2 (Fe + 2Mn) – ферромарганец
Свойства соединений марганца (+2)
Свойства соединений марганца (+4)
MnO2 – устойчивый амфотерный оксид, сильный окислитель.
Свойства соединений марганца (+6)
Соединения устойчивы лишь в сильнощелочной среде.
Свойства соединений марганца (+7)
Сильные окислители в кислой среде.
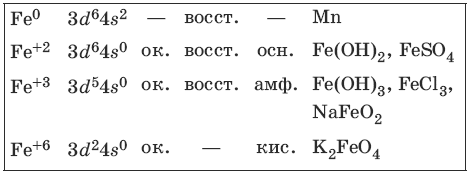
9.3. Железо и его соединения
Железо является вторым после алюминия металлом по распространенности в природе. Характерные степени окисления железа, электронные формулы соответствующих ионов, химические свойства и примеры соединений приведены в таблице.
Соединения железа (+8) малохарактерны.
Получение и свойства железа
4Fe + 3O2 + 2Н2O = 4FeO(OH)v (коррозия на воздухе)
Концентрированные серная и азотная кислоты пассивируют железо на холоду. При нагревании реакция идет.
Свойства соединений железа (+2)
Гидроксид железа(II) сразу окисляется кислородом воздуха.
Свойства соединений железа (+3)
Fe(OH)3v + NaOH ? не идет в разбавленном растворе
Свойства соединений железа (+6)
Феррат калия – окислитель.
9.4. Медь и ее соединения
Медь – мягкий красный металл, хорошо проводит теплоту и электрический ток.
Получение и свойства меди
Свойства соединений меди(I)
Свойства соединений меди(II)
Cu(OH)2v + NaOH ? не идет в растворе
Неорганическая химия — задачи с решением и примерами
Прежде чем изучать примеры решения задач, нужно знать теорию, поэтому для вас я подготовила очень краткую теорию и примеры решения задач.
Если что-то непонятно — вы всегда можете написать мне в WhatsApp и я вам помогу!
Неорганическая химия
Неорганическая химия — раздел химии, связанный с изучением строения, реакционной способности и свойств всех химических элементов и их неорганических соединений. Эта область охватывает все химические соединения, за исключением органических веществ (класса соединений, в которые входит углерод, за исключением нескольких простейших соединений, обычно относящихся к неорганическим). Различия между органическими и неорганическими соединениями, содержащими углерод, являются по некоторым представлениям произвольными. wikipedia.org/wiki/Неорганическая_химия
Неорганическая химия изучает химические элементы и образуемые ими простые и сложные вещества (кроме органических соединений). Обеспечивает создание материалов новейшей техники. Число известных на 2013 г. неорганических веществ приближается к 500 тысячам. Теоретическим фундаментом неорганической химии является периодический закон и основанная на нём периодическая система Д. И. Менделеева. Важнейшая задача неорганической химии состоит в разработке и научном обосновании способов создания новых материалов с нужными для современной техники свойствами.
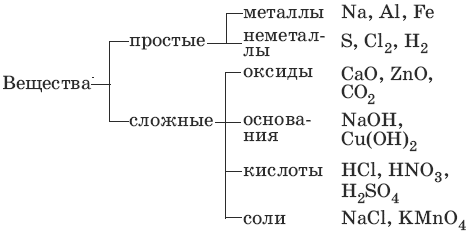
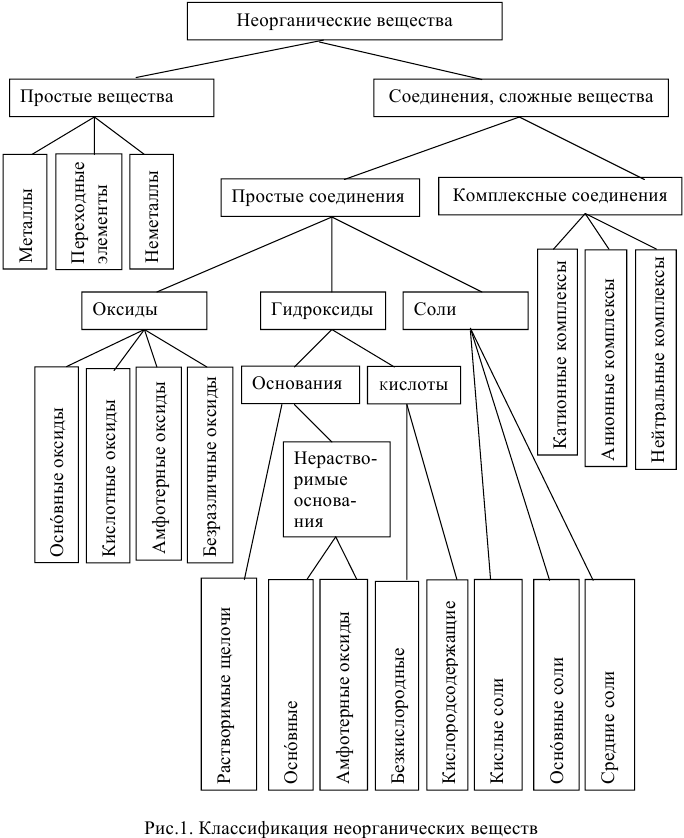
Основные классы неорганических соединений
Классификация неорганических веществ (рис.1)
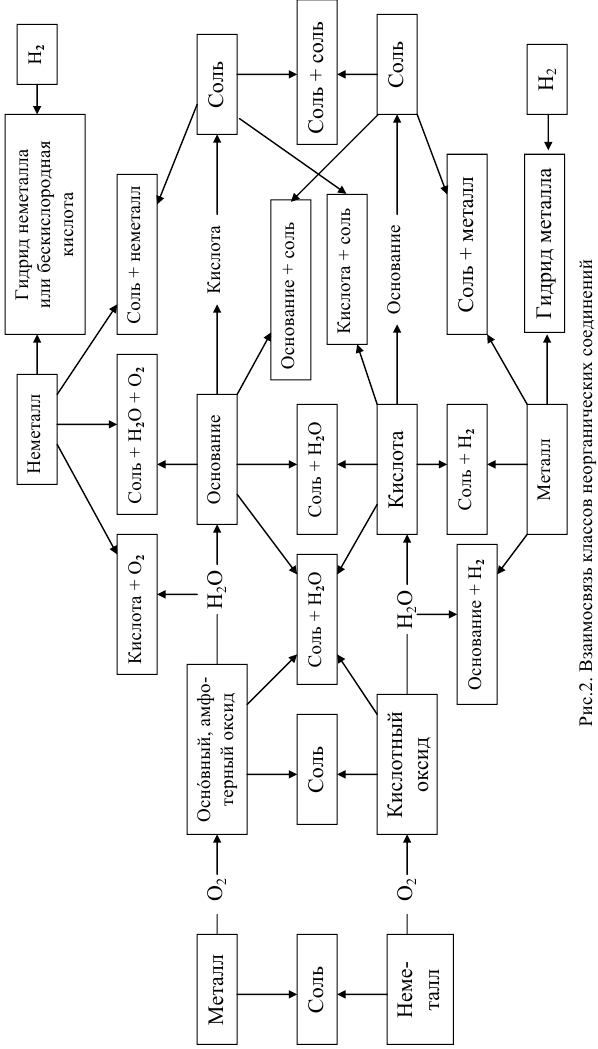
Связь между классами неорганических веществ
Связь между классами неорганических веществ, т.е. способы превращения одного вещества в другое вещество, даны в подразд. 1.2-1.7. Все эти взаимосвязи между классами соединений обобщены на рис.2.
Зная взаимосвязь классов неорганических соединений, можно осуществлять цепочки превращений, например:
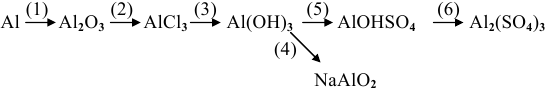
1. Известно, что металлы окисляются кислородом воздуха, для алюминия эта реакция протекает при нагревании:
2. Амфотерные оксиды взаимодействуют с кислотами:
3. При действии щелочи на соль образуется нерастворимое основание, в данном случае оно амфотерное:
4. Амфотерные основания реагируют со щелочами, образуя соль:
5. Многокислотные основания, взаимодействуя с недостатком кислоты, образуют основные соли:
6. Основные соли при действии на них избытка кислоты переходят в нормальные соли:
Дополнительная теория:
Задачи с решениями
Возможно эти страницы вам будут полезны:




















































Образовательный сайт для студентов и школьников
Копирование материалов сайта возможно только с указанием активной ссылки «www.lfirmal.com» в качестве источника.
© Фирмаль Людмила Анатольевна — официальный сайт преподавателя математического факультета Дальневосточного государственного физико-технического института
Как решать химические уравнения — схемы и примеры решения для разных реакций
Основные термины и понятия
Составление уравнений химических реакций невозможно без знания определённых обозначений, показывающих, как проходит реакция. Объединение атомов, имеющих одинаковый ядерный заряд, называют химическим элементом. Ядро атома состоит из протонов и нейтронов. Первые совпадают с числом атомного номера элемента, а значение вторых может варьироваться. Простейшими веществами называют элементы, состоящие из однотипных атомов.
Любой химический элемент описывается с помощью символов, условно обозначающих структуру веществ. Формулы являются неотъемлемой частью языка науки. Именно на их основе составляют уравнения и схемы. По своей сути они отражают количественный и качественный состав элементов. Например, запись HNO3 сообщает, что в соединении содержится одна молекула азотной кислоты, а оно само состоит из водорода, азота и кислорода. При этом в состав одного моля азотной кислоты входит по одному атому водорода и азота и 3 кислорода.
Символика элементов, условное обозначение, представляет собой химический язык. В значке содержится информация о названии, массовом числе и порядковом номере. Международное обозначение принято, согласно периодической таблице Менделеева, разработанной в начале 1870 года.
Взаимодействующие между собой вещества называются реагентами, а образующиеся в процессе реакции — продуктами. Составление и решение химических уравнений фактически сводится к определению результатов реакций, поэтому просто знать формулы веществ мало, нужно ещё уметь подбирать коэффициенты. Располагаются они перед формулой и указывают на количество молекул или атомов, принимающих участие в процессе. С правой стороны от химического вещества ставится индекс, указывающий место элемента в системе.
Записывают уравнения в виде цепочки, в которой указываются все стадии превращения вещества начиная с левой части. Вначале пишут формулы элементов в исходном состоянии, а затем последовательно их преобразование.
Виды химических реакций
Химические явления характеризуются тем, что из двух и более элементов образуются новые вещества. Уравнения описывают эти процессы. Впервые с объяснениями протекания реакций знакомят в восьмом классе средней образовательной школы на уроках неорганической химии. Ученикам демонстрируют опыты, в которых явно наблюдаются различия в протекании реакций.
Всего существует 4 типа химического взаимодействия веществ:
- Соединение. В реакцию могут вступать 2 простых вещества: металл и неметалл или неметалл и неметалл. Например, алюминий с серой образуют сульфид алюминия. Кислород, взаимодействуя с водородом, превращается в воду. Объединятся могут 2 оксида с растворимым основанием, как оксид кальция с водой: CaO + H2O = Ca (OH)2 или основной оксид с кислотным: CaO + SO3 = CaSO4.
- Разложение. Это процесс обратный реакции соединения: было одно вещество, а стало несколько. Например, при пропускании электрического тока через воду получается водород и кислород, а при нагревании известняка 2 оксида: CaCO3 = CaO + CO2.
- Замещение. В реакцию вступают 2 элемента. Один из них простой, а второй сложный. В итоге образуются 2 новых соединения, при котором атом простого вещества заменяет сложный, как бы вытесняя его. Условие протекания процесса: простое вещество должно быть более активным, чем сложное. Например, Zn + 2HCl = ZnCl2 + H2. Величину активности можно узнать из таблицы ряда электрохимических напряжений.
- Обмен. В этом случае между собой реагируют 2 сложных элемента, обменивающиеся своими составными частями. Условием осуществления такого типа реакции является обязательное образование воды, газа или осадка. Например, CuO + 2HCl = CuCl2 + H2O. Чтобы узнать, смогут ли вещества прореагировать, используют таблицу растворимости.
Основными признаками химических реакций является изменение цвета, выделение газа или образование осадка. Различают их по числу веществ, вступивших в реакцию и образовавшихся продуктов. Правильное определение типа реакции особо важно при составлении химических уравнений, а также определения свойств и возможностей веществ.
Окислительно-восстановительный процесс
Составление большинства реакций сводится к подбору коэффициентов. Но при этом могут возникнуть трудности с установлением равновесия, согласно закону сохранения массы веществ. Чаще всего такая ситуация возникает при решении заданий, связанных с расстановкой количества атомов в уравнениях окислительно-восстановительных процессов.
Под ними принято понимать превращения, протекающие с изменением степени окисления элементов. При окислении происходит процесс передачи атомом электронов, сопровождающийся приобретением им положительного заряда или ионом, после чего он становится нейтральным. При этом также происходит процесс восстановления, связанный с присоединением элементарных частиц атомом.
Для составления уравнений необходимо определить восстановитель, окислитель и число участвующих в реакции электронов. Коэффициенты же подбирают с помощью метода электронно-ионного баланса (полуреакций). Его суть состоит в установлении равенства путём уравнивания количества электронов, отдаваемых одним элементом и принимаемым другим.
Классический алгоритм
В основе решения задач этим методом — закон сохранения массы. Согласно ему, совокупная масса элементов до реакции и после остаётся неизменной. Другими словами, происходит перегруппировка частиц. Если рассматривать решение химического уравнения поэтапно, оно будет состоять из трёх шагов:
- Написания формул элементов, вступающих в реакцию с левой стороны.
- Указания справа формулы образующихся веществ.
- Уравнивания числа атомов с добавлением коэффициентов.
Перед тем как переходить к сложным соединениям, лучше всего потренироваться на простых. Например, нужно составить уравнение, описывающее взаимодействие двух сложных веществ: гидроксида натрия и серной кислоты. При таком соединении образуется сульфат натрия и вода.
Согласно алгоритму, в левой части уравнения необходимо записать реагенты, а в правой продукты реакции: NaOH + H2SO 4 → Na 2SO4 + H2O. Теперь следует уравнять коэффициенты. Начинают с первого элемента. В примере это натрий. В правой части содержится 2 его атома, а в левой один, поэтому необходимо возле реагента поставить цифру 2. Затем нужно уровнять водород. В результате получится выражение: 2 NaOH + H2SO 4 → Na2 SO4 +2H2O.
Ещё одним наглядным примером является процесс реакции тринитротолуола с кислородом. При их взаимодействии образуется: C7H5N3O6 + O2 → CO2 + H2O + N2. Исходя из того, что слева находится нечётное число атомов H и N, а справа чётное, нужно их уравнять: 2C7H5N3O6 + O2 → CO2 + H2O + N2.
Теперь становится понятным, что 14 и 10 атомов углерода и водорода должны образовать 14 долей диоксида и 5 молекул воды. При этом 6 атомов азота превратятся в 3. Итоговое уравнение будет выглядеть как 2C7H5N3O6 + 10,5O2 → 14CO2 + 5H2O + 3N2.
Перед тем как начинать тренировку по составлению уравнений, следует научиться расставлять валентность. Это параметр, равный числу соединившихся атомов каждого элемента. Фактически это способность к соединению. Например, в формуле NH3 валентность атома азота равна 3, а водорода 1.
Решение методом полуреакций
Алгоритм для решения примеров химических уравнений проще рассмотреть на конкретном задании. Пускай необходимо описать процесс окисления пирита азотной кислоты с малой концентрацией: FeS2 + HNO3. Решать этот пример необходимо в следующей последовательности:
- Определить продукты реакции. Так как кислота является сильным окислителем, сера получит максимальную степень оксидации S6+, а железо Fe3+. HNO3 может восстановиться до одного из двух состояний NO2 или NO.
- Исходя из состава ионов и правила, что вещества, переходящие в газовую форму или плохо растворимые, записываются в молекулярном виде, верным будет записать: FeS2 — Fe3+ + 2SO2−4. Гидролизом можно пренебречь.
- В записи уравнивают кислород. Для этого в левую часть добавляют 8 молекул воды, а в правую 16 ионов водорода: FeS2 + 8H20 — Fe3+ + 2SO2−4 + 16H+. Так как заряда в левой части нет, а в правой он равный +15, то серное железо должно будет отдать 15 электронов. Значит, уравнение примет вид: FeS2 + 8H20 — 15e → Fe3+ + 2SO2−4 + 16H+.
- Теперь переходят к реакции восстановления нитрата иона: NO-3 →NO. Для её составления нужно отнять у оксида азота 2 атома кислорода. Делают это путём прибавления к левой части 4 ионов водорода, а правой — 2 молекул воды. В итоге получится: NO-3 + 4H+ → NO + 2H2O.
- Полученную формулу уравнивают добавлением к левой части 3 электронов: NO-3 + 4H+ 3e → NO + 2H2O.
- Объединяют найденные выражения и записывают результат: FeS2 + 8H20 + 5NO-3 + 20H+ → Fe3+ + 2SO2−4 + 16H+ + 5NO + 10H2O.
Уравнение можно сократить на 16H + и 8H2O. В итоге получится сокращённое выражение окислительно-восстановительной реакции: FeS2 + 5NO — 3 + 4 H + = Fe3 + + 2SO 2- 4 + 5NO + 2H2O.
Такой алгоритм считается классическим, но для упрощения понимания лучше использовать способ электронного баланса. Процесс восстановления переписывают как N5+ + 3e → N2+. Степень же окисления составить сложнее. Сере нужно приписать степень 2+ и учесть, что на 1 атом железа приходится 2 атома серы: FeS2 → Fe3++ 2S6+. Запись общего баланса будет выглядеть: FeS2 + 5N5+ = Fe3+ + 2S6+ + 5N2+.
Пять молекул потратятся на окисление серного железа, а ещё 3 на образование Fe (NO3)3. После уравнения двух сторон запись реакции примет вид, аналогичный полученному с использованием предыдущего метода.
Использование онлайн-расчёта
Простые уравнения решать самостоятельно довольно просто. Но состоящие из сложных веществ могут вызвать трудности даже у опытных химиков. Чтобы получить точную формулу и не подбирать вручную коэффициенты, можно воспользоваться онлайн-калькуляторами. При этом их использовать сможет даже пользователь, не особо разбирающийся в науке.
Чтобы расстановка коэффициентов в химических уравнениях онлайн происходила автоматически, нужно лишь подключение к интернету и исходные данные. Система самостоятельно вычислит продукты реакции и уравняет обе стороны формулы. Интересной особенностью таких сайтов является не только быстрый и правильный расчёт, но и описание правил с алгоритмами, по которому выполняются действия.
После загрузки калькулятора в веб-обозревателе единственное, что требуется от пользователя — правильно ввести реагенты в специальные формы латинскими буквами и нажать кнопку «Уравнять». Иногда возникает ситуация, когда запись сделана верно, но коэффициенты не расставляются. Это происходит, если суммы в уравнении могут быть подсчитаны разными способами. Характерно это для реакций окисления. В таком случае нужно заменить фрагменты молекул на любой произвольный символ. Таким способом можно не только рассчитать непонятное уравнение, но и выполнить проверку своих вычислений.
http://lfirmal.com/reshenie-zadach-po-neorganicheskoy-himii/
http://nauka.club/khimiya/khimicheskie-uravneniya.html